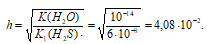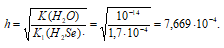Как сделать сульфит натрия дома
Сульфит натрия (Е221)

Характеристики вещества
Е221 – консервант, который выступает в роли антиоксиданта и часто помогает стабилизировать окраску продуктов питания. Несмотря на то, что сульфит натрия способен сильно навредить здоровью человека, вещество не является запрещенным в списке использования в пищевых продуктах ни в странах Евросоюза, ни в Украине, ни в России.
С виду сульфит натрия можно выявить по характерному порошкообразному состоянию розоватого либо белого цвета, со слабо выраженным запахом и сильным соленым холодящим привкусом. Консервант Е221 очень сильно окисляется на открытом воздухе, он отлично растворим в воде. В спирте растворить данное химическое соединение получится значительно сложнее, а в жирных маслах это сделать вообще не получится.
Сульфит натрия является результатом химического взаимодействия диоксида серы и раствора карбоната натрия. Он представляет собой побочный продукт производства фенола из бензолсульфокислоты. В полученном консерванте Е221 есть ряд примесей, например, тиосульфаты натрия, сульфаты и карбонаты.
Химической формулой вещества (Na2SO3) чаще всего пользуются в пищевой промышленности, где сульфит натрия применяется как консервант. Это свойство вещества позволяет качественно предотвращать брожение, распад и гниение пищевых продуктов, препятствует возникновению грибка, размножению микроорганизмов в еде.
Подобные антибактериальные свойства заставляют производителей широко использовать Е221 в производстве многих продуктов. К тому же, как уже упоминалось, вещество отлично стабилизирует окраску продуктов и обладает отбеливающим свойством.
Области применения
Консервант Е221 применяют совместно с химической добавкой Е220 или диоксидом серы в пищевой отрасли для обработки свежих фруктов или овощей.

Многие кондитерские изделия с низким процентным содержанием сахара, такие как мармелад или повидло, пиво, соки, желатин, жидкий пектин, грибные продукты и продукты из картофеля, колбаса и соленая рыба также лучше сохраняются, благодаря наличию в их составе сульфита натрия. Часто данное химическое вещество используется в качестве консерванта и в тех сладостях, где уровень сахара слишком высокий. Консервант Е221 применяется для приготовления приправ на основе сока лимона, консервированных морепродуктов.
Отлично работает Е221 и в винодельческом секторе. Если в виноматериал при изготовлении вина добавить сульфит натрия, произойдет связывание ацетальдегида. Итогом таких процессов станет вино с хорошей окраской, прекрасным окислительно-восстановительным потенциалом и устойчивостью на микробиологическом уровне. Также вина с Е221 в составе являются стабильными по отношению к возникновению в них любых бактериальных изменений.
В других отраслях промышленного производства сульфит натрия используется в качестве отбеливателя для холстов, проявителя для фотографий, составной части пестицидов, применяемых в сельском хозяйстве, средства для получения цветных металлов в металлургической отрасли.
Химическое вещество можно применять для получения моющих средств, осаждения хрома в канализационных проходах, изготовления фармакологических препаратов в медицинском секторе и производства кожевенных, химических товаров в других отраслях промышленности.
Отрицательное влияние на организм человека
Если применять сульфит натрия в допустимых (малых) дозах, вещество не окажет вреда человеческому организму. Однако даже в таких пропорциях вещество в редких случаях способно вызывать расстройство желудка, приступы бронхиальной астмы. Если же использовать консервант Е221 регулярно и в больших количествах, то он начнет разрушать запасы жизненно необходимых организму витаминов Е и В1, а также под влиянием поступающих кислот будет превращаться в диоксид серы, который воздействует на человека, как канцероген.
Специалисты не рекомендуют употреблять сульфит натрия в детском возрасте. Это объясняется тем, что существует некая вероятность спровоцировать возникновение болезней желудочно-кишечного тракта, аллергии, почечной недостаточности и других сбоев в работе систем неокрепшего организма.
Сульфит натрия
| Сульфит натрия | |
|---|---|
 | |
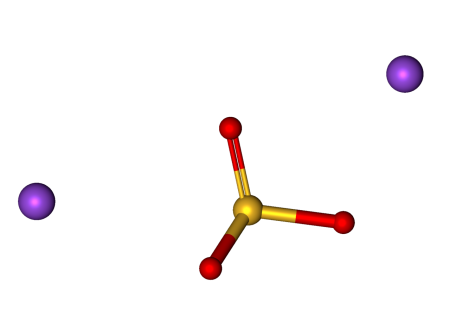 | |
| Хим. формула | Na2SO3 |
| Молярная масса | 126,037 г/моль |
| Плотность | 2,633 г/см³ |
| Т. плав. | 500 °C |
| Т. разл. | 600 °C |
| Растворимость в воде | 14,29 г/100 мл (0 °С) 26,10 г/100 мл (20 °С) 36,99 г/100 мл (40 °С) 29,20 г/100 мл (80 °С) |
| ГОСТ | ГОСТ 195-77 ГОСТ 5644-75 ГОСТ 903-76 |
| Рег. номер CAS | 7757-83-7 |
| PubChem | 24437 |
| Рег. номер EINECS | 231-821-4 |
| SMILES | |
| Кодекс Алиментариус | E221 |
| RTECS | WE2150000 |
| ChEBI | 86477 |
| ChemSpider | 22845 |
| Токсичность | умеренная |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Сульфит натрия (сернистокислый натрий) — неорганическое соединение, соль натрия и сернистой кислоты с формулой Na2SO3. Применяют в фотографии, при изготовлении тканей и вискозного волокна, при обработке руд цветных металлов и для обезвреживания сточных вод.
Содержание
История
В фотографии впервые было использовано в 1882 году Х. Б. Беркли для пирогаллоловых проявителей с целью уменьшить пятна, возникающие на фотоматериале в процессе обработки. С 1882 года многие составы включали в себя сульфитные ионы, как правило с целями защиты проявителя от окисления, но в целом роль этих ионов была малопонятна и только спустя годы исследований удалось выявить значительный ряд функций этого соединения в составе проявляющих растворов.
Физические свойства
Химические свойства
Сульфит натрия устойчив на воздухе при комнатной температуре, но при нагревании разлагается с образованием сульфата натрия и сульфида натрия, при этом при температуре выше 800 °C разложение идет до образования оксида натрия и диоксида серы.
Гептагидрат сульфита натрия во влажном воздухе легко окисляется до сульфата натрия, для замедления окисления используют ингибиторы — гидрохинон, пирогаллол, 1,4-фенилендиамин. В сухом воздухе гептагидрат не окисляется, но частично теряет кристаллизационную воду, полностью обезвоживаясь при температуре 150—160 °C.
Водные растворы сульфита натрия имеют щелочную реакцию, при их подкислении происходит выделение диоксида серы.
Сульфит натрия является сильным восстановителем. В водных растворах находится в частично гидролизованном состоянии, легко окисляется кислородом воздуха, перманганатом калия, бихроматом калия, бромом, иодом и другими окислителями до сульфата натрия. Растворы сульфита натрия поглощают диоксид серы, образуя гидросульфит натрия, а при кипячении присоединяют серу с образованием тиосульфата натрия. В кислых растворах хлорида титана (III), двуххлористого олова и хлорида железа (II) восстанавливается до дитионита натрия или до сульфида натрия.
Фотографические свойства
Многочисленные исследования свойств сульфита натрия в составе проявляющих растворов показали, что действие этого соединения не ограничивается узкой областью снижения количества пятен на эмульсии, образующихся в процессе обработки в некоторых окрашивающих проявителях, для чего это соединение было предложено изначально. Практически сразу сульфит натрия стал использоваться в своей роли основного универсального сохраняющего вещества, что было вызвано его многоаспектным действием на фотографические составы при всех этапах проявления и хранения растворов.
Антиоксидант
Основная роль сульфита натрия в составе фотографических проявляющих растворов заключается в защите органических проявляющих веществ от окисления кислородом воздуха. При высоком значении pH раствора проявляющее вещество в отсутствии сульфита быстро окисляется, становясь фотографически неактивным. Например, гидрохинон сначала превращается в хинон, вследствие чего раствор приобретает жёлтую окраску, а затем в фотографически неактивный оксихинон, окрашивающий раствор в тёмно-коричневый цвет. Небольшое количество сульфита натрия резко замедляет этот процесс за счет того, что вместо гидрохинона с кислородом в первую очередь будет реагировать сам сульфит с образованием сульфата натрия. Присутствие же органического проявляющего вещества, в свою очередь, является ингибитором процесса окисления сульфита кислородом.
Точный механизм ингибирования окисления органических проявляющих веществ неизвестен, но предполагается, что он обусловлен связыванием сульфитом натрия окрашенных окисленных форм проявляющих веществ, которые в несвязанном состоянии катализируют дальнейшее окисление своей неокисленной формы.
Окисление гидрохинона кислородом воздуха в растворах, содержащих сульфит натрия, будет происходить уже не с образованием хинона и оксихинона, а с образованием бесцветного добезилата натрия, который также является проявляющим веществом:
Разрыв цепи полимеризации
При проявлении гидрохиноном и его производными в растворе образуются семихиноны — высокоактивные и нестабильные соединения. Они имеют тенденцию к полимеризации в гуминовые кислоты, цепи которых в типичных условиях для фотографического проявления образуются из порядка 10 молекул окисленных остатков гидрохинона и имеют тёмную окраску. Так как на стадии образования семихинона сульфит реагирует с ним, то полимеризации, как правило, не происходит, а следовательно, не будет и каталитического воздействия данных полимерных соединений на неокисленную форму проявляющего вещества. Тем не менее, для пирогаллола сульфит не способен взаимодействовать с нерастворимыми окрашенными продуктами окисления, аналогично и для слабоокрашенных продуктов окисления фенидона и L-аскорбиновой кислоты.
Обесцвечивающий агент
Сульфит натрия в описанном выше процессе связывания окрашенных форм образует бесцветные соединения, вместо сильноокрашенных, тем самым снижая нежелательные пятна и окраску результирующего изображения.
Поддержание активности проявления
Окисленные остатки проявляющего вещества в растворе, хотя и непосредственно не реагируют с галогенидом серебра в эмульсии, но изменяют pH среды и другие её показатели, что может вести либо к нарастанию скорости проявления, либо к её спаду. Лишь немногие проявляющие вещества не дают подобного эффекта. Рост активности наблюдается в проработавших растворах проявляющих веществ, имеющих активные гидроксогруппы, например у глицина-фото. Если же проявляющее вещество имеет только аминогруппы, то скорость проявления будет падать. Превращение окисленных форм в сульфонаты при реакции с сульфитом стабилизирует и поддерживает активность, тем самым позволяя избегнуть нежелательного пере- или недопроявления.
Получение
Сульфит натрия получают:
Применение
Применяют для удаления следов хлора после отбеливания тканей, для удаления серы из вискозного волокна после формования, как флотореагент для руд цветных металлов, в производстве пестицидов, для обезвреживания сточных вод, содержащих хром.
В фотографии используют как основное сохраняющее вещество в проявителях, входит в состав фиксажей и других растворов.
Безопасность
Сульфит натрия
Раствор сульфита натрия применяется в пищевой промышленности сразу в четырех качествах:
На этикетке это химическое вещество можно встретить под названием Е221. Как и большинство ингредиентов с кодом «Е», сульфит натрия не несет в себе никакой пользы для здоровья, более того, его можно назвать вредным. Тем не менее, применение сульфита натрия не запрещено ни в Российской федерации, ни в странах Европейского союза.
Физико-химические свойства и производство сульфита натрия
Раствор сульфита натрия получают из розовато-белого порошка с почти неуловимым запахом и солоноватым холодящим язык вкусом. Этот порошок хранят в полностью герметичной полимерной таре, поскольку он окисляется при контакте с воздухом и металлами. Сульфит натрия достаточно хорошо растворяется в воде, намного хуже – в спирте, и совсем не растворяется в жирах.
Сульфит натрия, по сути, является побочным продуктом производства бензолсульфокислоты и фенола. Его получают также при химическом взаимодействии раствора карбоната натрия с диоксидом серы – другим известным пищевым консервантом. Технологический процесс совсем не сложен и не требует больших финансовых затрат. Вот почему сульфит натрия пользуется популярностью у производителей продуктов питания.
Применение сульфита натрия
Основным потребителем сульфита натрия является пищевая промышленность. Очень многие готовые продукты и напитки производятся с применением сульфита натрия, вот лишь основные примеры:
Применение сульфита натрия позволяет не переживать о том, что продукт испортится под действием повышенной температуры, начнет гнить и плесневеть, потеряет товарный вид или изменит окраску. Но особенно активно раствор сульфита натрия используется в виноделии. Он связывает молекулы ацетальдегида, а это препятствует окислению и потемнению вина. Кроме того, сульфит натрия препятствует размножению патогенной микрофлоры, что очень важно для недорогих вин, расфасованных в так называемые тетра-паки.
Воздействие сульфита натрия на организм человека
Сульфит натрия очень давно и широко применяется в пищевой промышленности, поэтому его воздействие на здоровье хорошо изучено. В минимальных дозах это вещество не представляет никакой угрозы для человека, однако передозировка может быть весьма опасной. Отравление сульфитом натрия сопровождается болями в желудке, тошнотой, рвотой, диареей, спутанностью сознания и удушьем. Однако чтобы такие неблагоприятные последствия возникли, требуется очень большая доза сульфита натрия, получить которую из продуктов питания практически невозможно.
Все-таки длительное употребление консервов и вин с содержанием этого консерванта может спровоцировать нежелательные изменения в состоянии здоровья. Сульфит натрия разрушает многие полезные витамины, прежде всего, B1 и E. Поэтому крайне не рекомендуется давать продукты с этим консервантом маленьким детям, чей организм остро нуждается в витаминах.
Под действием некоторых кислот, например, аскорбиновой, сульфит натрия может превращаться в диоксид серы. А это вещество, кстати, тоже не запрещенное в нашей стране, официально причислено к третьему классу опасности для человека. Тем не менее, диоксид серы применяется в качестве консерванта, в том же виноделии. Очевидно, что любые консерванты неполезны для здоровья, но при этом сульфит натрия – один из самых безопасных.
Характеристика свойств сульфитов, сульфидов и тиосульфатов
Транспортировка олеума
Задача 870.
Олеум перевозят в железных цистернах. Можно ли заменить их свинцовыми? Почему олеум не растворяет железо?
Решение:
Олеум – это насыщенный раствор SO 3 в 96 – 98% H 2 SO 4. Олеум перевозят в железных цистернах, потому что в присутствии серной кислоты, концентрация которой близка к 100%, железо становится пассивным, и взаимодействия его с кислотой практически нет. Олеум нельзя перевозить в свинцовых цистернах, потому что свинец интенсивно растворяется в концентрированной серной кислоте с образованием растворимой кислой соли:
Разбавленная серная кислота практически не действует на свинец. Это связано с тем, что образуется малорастворимый сульфат свинца, который, откладываясь на поверхности свинца пассивирует его по отношению к кислоте:
Железо же в разбавленной серной кислоте растворяется с образованием хорошо растворимого сульфата железа:
Fe + H 2 SO 4(разб.) ↔ FeSO4 + Н 2 ↑
Таким образом, концентрированную серную кислоту и олеум можно перевозить и хранить в железных ёмкостях, а разбавленную серную кислоту можно хранить в свинцовых емкостях.
Сульфит натрия. Тиосульфат натрия
Задача 871.
По каким свойствам можно отличить сульфит натрия от тиосульфата натрия? Привести уравнения реакций.
Решение:
а) Сульфит натрия является средней солью сернистой кислоты. Атомы серы в сульфите натрия находятся в своей промежуточной степени окисления +4, поэтому он в реакциях окисления-восстановления может быть как восстановителем, так и окислителем. Например, свободные галогены могут восстанавливаться им до галогеноводородов:
Как окислитель сульфит натрия может реагировать с сильными восстановителями, например, с сероводородом:
Сульфит натрия при прокаливании может разлагаться до сульфата натрия и сульфида натрия:
4 Na 2 S O 3 
При этом протекает реакция самоокисления-восстановления.
б) Тиосульфат натрия Na 2 S 2 O 3 содержит один атом серы в степени окисления 0, а другой – в степени окисления +4. Поэтому тиосульфат натрия в реакциях окисления-восстановления может быть как восстановителем, так и окислителем. Например, свободные галогены хлор или бром, как сильные окислители, окисляют его до серной кислоты или до её соли:
Окисление тиосульфата натрия слабыми окислителями протекает иначе, например, под действием свободного йода тиосульфат натрия окисляется до соли тетратионовой кислоты H2S4O6:
Эта реакция служит основой йодометрического метода определения некоторых окислителей и восстановителей.
Как окислитель тиосульфат натрия может реагировать с сильными восстановителями, например, с сероводородом:
При нагревании свыше 200 0 С тиосульфат натрия распадается по схеме:
4 Na 2 S 2 O 3 
При этом протекает реакция самоокисления-восстановления при которой в осадок выпадает свободная сера.
Задача 872.
Указать вещества, содержание значительных количеств которых в воздухе несовместимо с присутствием озона: а) SO2; б) НF; в) Н2S; г) СО2 д) N2.
Решение:
Озон не реагирует ни с НF, ни с СО2, ни с N2.
Озон может окислят сероводород в атмосфере:
В свою очередь сернистый газ может далее окисляться озоном:
Образовавшийся оксид серы (VI) реагирует с атмосферной влагой:
Уравнение в общем виде:
Значит, вещества, содержание значительных количеств которых в воздухе несовместимо с присутствием озона это SO2 и Н2S.
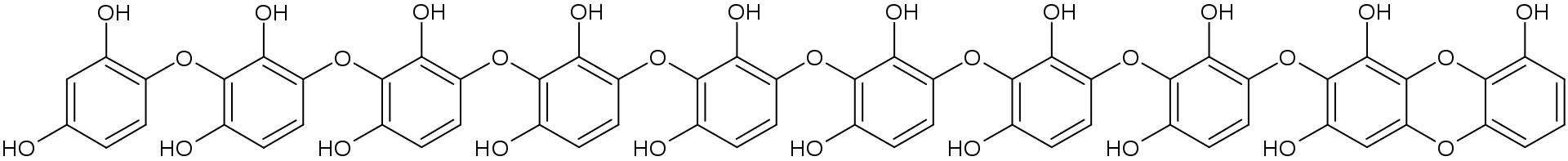
б) для NaSе, получим:
Определяем степень гидролиза соли:
в) для NaТе, получим:
Определяем степень гидролиза соли:
Значит концентрация образовавшихся ионов ОН — :
Так как 12,6 > 10,9 > 9,5, то рН1 > рН2 > рН3.