Как вылечить болезнь паркинсона навсегда
Как вылечить болезнь паркинсона навсегда
Болезнь Паркинсона: как с ней справляться
Рисунок 1. Применение антихолинергических препаратов, известных с прошлого века, для снятия тремора и ригидности ограничено из-за их побочных эффектов Каковы основные диагностические критерии болезни Паркинсона? Когда пациента необходимо
 |
| Рисунок 1. Применение антихолинергических препаратов, известных с прошлого века, для снятия тремора и ригидности ограничено из-за их побочных эффектов |
Каковы основные диагностические критерии болезни Паркинсона?
Когда пациента необходимо отправить к специалисту?
С каких препаратов начать лекарственную терапию?
Каким образом устранить побочное действие специфической терапии?
Причины паркинсонизма до сих пор неизвестны, а лечение остается симптоматическим, несмотря на то, что прошло уже четверть века с тех пор, как леводопа прочно внедрилась в жизнь больных паркинсонизмом.
Но не будем слишком пессимистичны — современные методы лечения продлевают жизнь таким больным и делают ее более или менее нормальной [1]. Один человек из тысячи страдает болезнью Паркинсона. Диагноз ставится на основании клинического синдрома, включающего гипокинезию, ригидность, тремор и нарушенные рефлексы позы. Уровень допамина снижается почти на 80% к моменту появления клинических признаков, поэтому неудивительно, что невозможно точно указать время появления первых симптомов.
Далеко не всегда просто отличить идиопатическую болезнь Паркинсона от других состояний, включая такое часто встречающееся, как эссенциальный тремор, и менее распространенные заболевания, которым присущи иные неврологические симптомы — супрануклеарный паралич, автономные нарушения или мозжечковые симптомы [2].
Патолого-анатомические исследования показывают, что каждый пятый диагноз в данной группе заболеваний ошибочен. Перед тем как поставить диагноз, важно убедиться в наличии по крайней мере двух из четырех основных клинических признаков, помня при этом, что у большинства пациентов симптоматика асимметрична. В сомнительных случаях помогает пробное лечение леводопой или допаминовыми агонистами [3].
 |
| Рисунок 2. Задержка мочи часто сопровождает болезнь Паркинсона |
Основной проблемой в контролировании болезни Паркинсона на сегодняшний день остается поздняя недостаточность допаминергической терапии, проявляющаяся в исчезновении или колебаниях реакции на препарат или в развитии дискинезий и прочих побочных эффектов у 75% пациентов после пяти лет лечения [4].
Расширение спектра препаратов и вновь возросший интерес к хирургическому лечению объясняется стремлением избежать или уменьшить проблемы длительного лечения.
Врач общей практики, подозревающий у пациента болезнь Паркинсона, должен решить, к кому его направить — к невропатологу, гериатру или другим специалистам. Особенно это важно в хронических прогрессирующих случаях у молодых людей, нуждающихся в длительном лечении.
Пациенту крайне необходимо рассказать о его болезни, прогнозе и сути применяемого лечения. Как и при астме, диабете и другом хроническом заболевании, врач и пациент должны действовать сообща, при активном участии последнего в принятии решений, касающихся лечения.
Как правило, с такими пациентами легко договориться, но по мере прогрессирования заболевания их приходится уговаривать принимать различные препараты несколько раз в день.
Контроль за заболеванием не сводится лишь к лекарственной терапии, напротив, психотерапия, трудотерапия, обучение навыкам речи и психологические методы существенно улучшают состояние пациентов [5]. Регулярная физиотерапия, назначаемая до допаминергических препаратов, замедляет прогрессирование заболевания [6], поэтому сразу после установления диагноза нужно советовать пациентам физические упражнения, соблюдение диеты, трудотерапию.
Весьма часто такие методы используются на более поздних стадиях заболевания, когда ничто другое уже не помогает, в то время как их нужно использовать для предупреждения развития болезни. Общество больных болезнью Паркинсона выпускает информационные сборники для персонала больниц и специальный обучающий материал для пациентов.
В ряде центров специально обученные сиделки помогают больным и тем, кто за ними ухаживает. Несмотря на отсутствие конкретных научных данных, многие пациенты признают эффект музыкотерапии, обучения, йоги и прочих дополнительных методов лечения.
Количество доступных препаратов и их новых форм в последние десять лет значительно увеличилось и обещает еще большее увеличение в ближайшем будущем. В табл. 1 приведены основные группы препаратов.
Таблица 1. Лекарственные препараты, применяемые для лечения паркинсонизма
антихолинергические препараты
Антихолинергические средства применялись еще в прошлом веке. Они до сих пор помогают справиться с тремором и, в меньшей степени, с ригидностью, практически не влияя на гипокинезию. Выбор среди них невелик. Все они имеют побочные эффекты: сухость во рту, нарушение аккомодации, запор и задержка мочи. У пожилых пациентов они склонны вызывать спутанность сознания и прочие психиатрические нарушения.
Следует отметить, что все антипаркинсонические средства способны вызывать подобные проблемы и любое нарушение ментальной функции требует пересмотра целесообразности применения и адекватности доз препарата. Леводопа, в настоящее время назначаемая вместе с ингибитором периферической декарбоксилазы (ИНД), остается пока самым эффективным лекарственным средством. В начале курса лечения могут возникать тошнота, рвота, поэтому пациенты предпочитают принимать их вместе с пищей или с противорвотными лекарствами — домперидоном и метоклопрамидом.
Необходимо учитывать, что большое потребление белка может мешать всасыванию леводопы.
Кроме психологических расстройств необходимо отметить и другие побочные эффекты — дискинезии или непроизвольные движения. Они бывают различными: движения языка и губ, гримасы, болезненные напряжения мышц, хореоатетоз, двигательное беспокойство. Снижение дозы препарата, как правило, уменьшает и дискинезию, однако пациенты часто предпочитают последнюю невозможности передвигаться вообще.
Другой элемент нарушений, возникающих при длительном лечении, — колебания реакции на препарат. Вначале это проявляется феноменом «выключения» — продолжительность действия леводопы-ИПД все время уменьшается. В тяжелых случаях человек внезапно переключается от движения, обычно с дискинезиями, к полной неподвижности.
 |
| Рисунок 3. Нарушение постуральных рефлексов — одна из составляющих клинического синдрома |
Для преодоления подобных проблем были разработаны формы с дозированным высвобождением препарата, позволяющие избежать колебаний концентраций лекарства в крови, и порошковые формы, обеспечивающие быстрое нарастание уровня лекарства в крови.
Агонисты допамина действуют на различные участки дофаминового рецептора. Соответственно разнится и их действие. Применяемые в одиночку, агонисты допамина менее эффективны, чем леводопа, но и реже приводят к колебаниям и дискинезиям [4]. Желудочно-кишечные побочные эффекты и воздействие на психику у них такие же. Апоморфин отличается от прочих упомянутых средств тем, что вводится путем инъекции.
По данным исследования, проведенного в Соединенных Штатах, селигин отсрочивает необходимость назначения леводопы, имеет нейропротекторные свойства и способен замедлять развитие болезни [7]. С тех пор, однако, было доказано, что селегилин сам по себе обладает умеренным допаминергическим эффектом, а также амфетаминоподобным и антидепрессантным воздействием; его защитные свойства в настоящее время находятся под сомнением [8].
Механизм действие селегилина — блокада моноаминоксидазы В, одного из основных ферментов допаминового метаболизма. Бытует мнение, что он потенциирует действие леводопы.
Ингибиторы катехол-о-метилтрансферазы (КОМТ) просто замедляют метаболизм допамина. По крайней мере два таких препарата уже готовятся к массовому производству [9, 10].
 |
| Рисунок 4. Инъекции апоморфина применяют в трудно поддающихся лечению случаях |
Допаминергический эффект антивирусного препарата амантадина замечен еще много лет назад, но он менее эффективен, чем леводопы. Точный механизм его действия неизвестен, но все же его пытаются применять в случаях, резистентных к терапии леводопой; кроме того, его назначение совместно с леводопой позволяет уменьшить дозу последней.
Бесспорно, при назначении лекарственных препаратов следует учитывать возраст пациента, степень нарушений и индивидуальные особенности, однако невропатологи, как и другие специалисты, единого подхода к последовательности применения препаратов пока не разработали. Некоторые считают, что откладывать применение леводопы не имеет смысла, и начинают со стандартных схем ее использования.
Еще один подход заключается в использовании сначала пролонгированных форм, применении только дофаминового агониста или в сочетании с низкими дозами леводопы; или же назначают на какое-то время один селегилин, а затем присоединяют леводопу.
Какой бы схеме вы ни следовали, целесообразно начинать с низких доз, осторожно и постепенно подбирая необходимую дневную дозу. По возможности нужно избегать резких изменений в схеме приема или быстрого увеличения дозы.
При развитии феномена «выключения» нередко, хотя и на непродолжительное время, может оказаться полезным разделение дневной дозы препарата на несколько более мелких приемов. Можно попробовать присоединить к леводопе селегилин и/или агонист допамина, а также использовать вместо леводопы (или чаще дополнительно к ней) лекарственные формы пролонгированного действия. Биодоступность подобных форм меньше, чем у обычных препаратов, и их доза обычно несколько больше. У отдельных пациентов хороший результат дает прием препарата до, а не после еды или сокращение потребления белка.
В случаях с ярко выраженным феноменом включения-выключения используют те же приемы, в сочетании с индивидуальным подбором наиболее эффективной схемы лечения.
| Не рекомендуется устраивать длительные перерывы между приемами препаратов |
При отсутствии успеха от перорального приема препарата можно использовать такие новые методы, как подкожное введение апоморфина. Правда, для этого требуется обученный персонал, лучше всего — специальная сиделка для больных паркинсонизмом.
Другой подход — нейрохирургия. Проводят стереотоксическую паллидотомию или стимуляцию таламуса при феномене включения-выключения, а также при упорном треморе [11]. Имеющиеся на сегодняшний день данные обнадеживают. Они свидетельствуют об уменьшении дискинезии и удлинении периода включения. Однако, как и трансплантацию фетальных тканей, подобные хирургические методы пока следует считать экспериментальными, требующими дальнейшего изучения и оценки.
Кроме дискинезий и тремора, у многих пациентов при прогрессировании заболевания развиваются когнитивные и психические расстройства. При этом необходимо снижать дозу препарата.
Небольшие перерывы в приеме лекарств, отмена допаминергических препаратов на короткое время — такие «каникулы» (один-два дня каждую неделю) позволяют снизить психотоксичность [10]. Отмена препаратов на длительный срок не рекомендуется, поскольку может повлечь серьезные или даже необратимые нарушения способности двигаться.
Болезнь Паркинсона сопровождается нарушениями сна, депрессией, задержкой мочи, запорами, болями, расстройствами автономной нервной системы и сексуальными отклонениями. Все это поддается лекарственной коррекции. Просто надо дать возможность пациенту подробно описать все, что его беспокоит. Ограниченное время консультации вместе с тяжелыми проблемами общения, от которых страдают многие пациенты, могут быть преодолены посредством заранее подготовленного самим пациентом или сиделкой описания его состояния.
1. Clarke C. E. Mortality from Parkinson’s disease in England and Wales 1921-89. J. Neurol. Neurosurg Psychiatry 1993; 56:690-3.
2. Quinn N. Parkinsonism — recognition and differential diagnosis. BMJ 1995; 310:447-52.
3. Hughes A. J., Lees A. J., Stern G. M. Challenge test to predict the dopaminergic response in untreated Parkinson’s disease. Neurology 1991; 41:1723-5.
4. Marsden C. D. Parkinson’s disease. J. Neurol. Neurosurg Psychiat 1994; 57:672-81.
5. Patti F., Reggio A., Nicoletti F. et al. Effects of rehabilitation therapy on Parkinsonians’ disability and functional independence. J. Neurol. Rehab 1996; 10:223-231.
6. Doshay L. J. Method and value of physiotherapy in Parkinson’s disease. N. Eng. J. Med. 1962; 266:878-80.
7. Parkinson Study Group. Effects of tocopherol and deprenyl on the progression of disability in early Parkinson’s disease. N. Eng. J. Med. 1993; 328:176-83.
8. Jankovic J., Shoulson I., Weiner W. J. Early-stage Parkinson’s disease: to treat or not to treat. Neurology 1994; 44(suppl1):S4-S7.
9. Pouttinen H. M., Rinne U. K. A double-blind pharmocokinetic and clinical dose-response study of entacapone as an adjuvant to levadopa therapy in advanced Parkinson’s disease. Clin. Neuropharmac 1996; 19:283-96.
10. Stocchi F., Nordera G., Marsden C. D. Strategies for treating patients with advanced Parkinson’s disease with disastrous fluctuations and dyskinesias. Clin. Neuropharmac 1997; 20:95-115.
11. Obeso J. A., Guridi J., Delong M. Surgery for Parkinson’s disease. J. Neurol. Neurosurg. Psychiat 1997; 62:2-8.
Болезнь Паркинсона и астроциты: новый взгляд на лечение нейродегенеративных заболеваний
15 февраля 2021
Болезнь Паркинсона и астроциты: новый взгляд на лечение нейродегенеративных заболеваний
Ученые из Калифорнийского университета в Сан-Диего показали успешную трансформацию астроцитов в нейроны in situ для лечения болезни Паркинсона. Поможет ли эта работа приблизиться к созданию успешной терапии?
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Болезнь Паркинсона до сих пор остается неизлечимой. Однако в июне 2020 года в журнале Nature вышла статья, способная произвести революцию в терапии этого недуга. В этой работе мы рассмотрим, какие предыдущие исследования привели к такому результату и как это может повлиять на будущее всей нейробиологии.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Дисклеймер
Обычно «Биомолекула» не публикует статьи по одинаковым инфоповодам, но в этом году мы приняли две работы, базирующиеся на одной и той же публикации в Nature 2020 года. Статья, которую вы читаете, — обзорная, а вот и ее парная новостная [16].
Болезнь Паркинсона является вторым по распространенности нейродегенеративным расстройством. Она характеризуется отмиранием нейронов в черной субстанции мозга. Существующая терапия направлена на ограниченное сдерживание заболевания. Эффективного лекарства до сих пор не существует. Недавнее исследование может в корне изменить плачевную ситуацию. Хао Цянь из Калифорнийского университета в Сан-Диего (США) вместе с коллегами из Пекинского университета (Китай) продемонстрировал успешное превращение астроцитов в нейроны in situ на мышиной модели болезни Паркинсона. Однако начнем с общей характеристики этого заболевания.
Болезнь Паркинсона: история и молекулярный патогенез
В 1817 году английский врач Джеймс Паркинсон [1] опубликовал работу «Эссе о дрожательном параличе», в которой дал описание неврологического недуга, а также провел анализ и выявил общие закономерности. В названии отражено необычное сочетание основных симптомов — тремор, скованность мышц и неспособность удерживать равновесие [2].
Кстати, одним из ученых, который помог разгадать тайны патогенеза болезни Паркинсона, стал русский невропатолог Константин Николаевич Третьяков, занимавший в 1916–1923 годах должность заведующего лабораторией мозга имени Шарко кафедры нервных болезней Парижского университета (Франция). Он предложил нигральную теорию патогенеза болезни Паркинсона, согласно которой, проявления заболевания были связаны с утратой черной субстанции головного мозга.
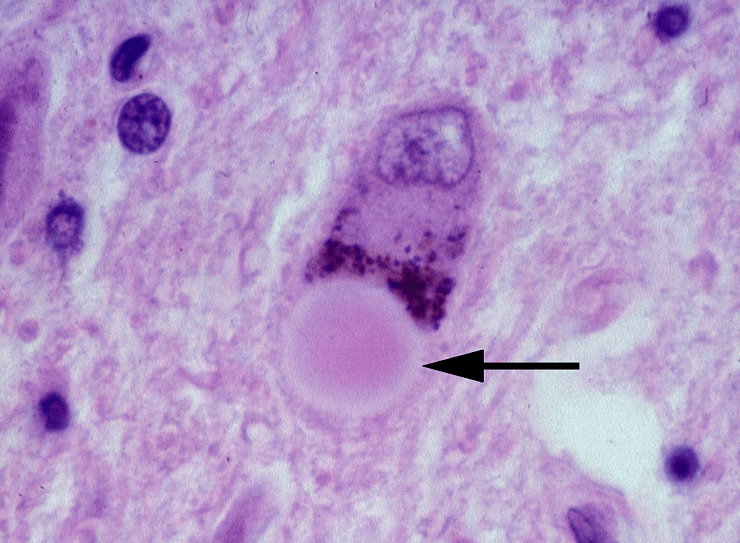
Сегодня известно, что болезнь Паркинсона развивается вследствие дегенерации дофаминергических нейронов в черной субстанции, что приводит к снижению уровня вырабатываемого дофамина — нейромедиатора, ответственного за чувство удовлетворения и привязанности. Клинические проявления связаны с нейротоксическим эффектом: по мере прогрессирования заболевания в клетках накапливается белок альфа-синуклеин [3]. Альфа-синуклеин в норме задействован в механизме транспорта и высвобождения везикул с нейротрансмиттерами. Однако у пациентов с болезнью Паркинсона наблюдается фосфорилирование и аномальное свертывание этого белка с образованием агрегатов — телец Леви (рис. 1). В 2018 году группа ученых из научно-исследовательского института Скриппса (США) обнаружила, что фосфорилированная форма альфа-синуклеина локализуется в митохондриях, вызывая их фрагментацию [4].
Рисунок 1. Тельце Леви в нейроне черной субстанции головного мозга
Возможности сегодняшней терапии
Сейчас существует только симптоматическое лечение, направленное на облегчение имеющихся проявлений заболевания. Одним из наиболее эффективных и широко применяемых лекарств является леводопа, или 3-гидрокси-L-тирозин [5]. Леводопа — биологический предшественник дофамина. Помимо леводопы, иногда используется ряд других лекарственных средств. Агонисты дофаминовых рецепторов имеют химическую структуру, похожую на дофамин, и за счет этого могут стимулировать его рецепторы [6]. Ингибиторы моноаминоксидазы B способны блокировать высвободившийся дофамин и продлевать время его действия. Ингибиторы катехол-О-метилтрансферазы подавляют распад принятой леводопы и удлиняют время ее действия в организме.
Также для терапии болезни Паркинсона применяют так называемые нейротрофические факторы — регуляторные белки, которые поддерживают жизнеспособность и функционирование нейронов. Хотя было проведено множество исследований по использованию нейротрофических факторов в клинической практике, у них есть ряд недостатков. Во-первых, они нуждаются в точной доставке к месту назначения. Для этого используют специальные катетеры. Во-вторых, нейротрофические факторы целесообразно использовать только в том случае, если у пациента еще не повреждены аксоны дофаминергических нейронов. Если же транспортная система в черной субстанции нарушена или уничтожена, то такое лечение не даст никаких положительных эффектов [7].
Часть из вышеперечисленных способов борьбы с болезнью широко используется, однако ничего из этого не поможет вернуть человеку его утраченные нейроны. Поэтому были попытки разработать терапию, направленную на восстановление популяции дофаминергических нейронов. В 2018 году группа ученых из японского Университета Киото [8] пересадила в мозг пациента индуцированные плюрипотентные стволовые клетки (ИПСК) [9], способные превращаться в любую клетку организма. Перед тем как применять ИПСК для лечения болезни Паркинсона у человека, были проведены исследования эффективности и безопасности этой терапии на приматах [10]. У семи людей изъяли ИПСК для их последующего превращения в клетки нейронного ряда. Для трансформации использовали двойное подавление сигнального пути SMAD, участвующего в процессах клеточного роста, дифференциации и смерти. За специализацию дофаминергических нейронов в черной субстанции отвечает сигнальный путь Sonic hedgehog (Shh). Подавление SMAD и активация Shh привели к дифференцировке ИПСК в клетки-предшественники дофаминергических нейронов, которые начали синтезировать нейронные маркеры [11]. Однако трансплантация стволовых клеток для лечения болезни Паркинсона у человека не применяется из-за сложности и недостаточных данных об эффективности.
Астроциты — возможное лекарство?
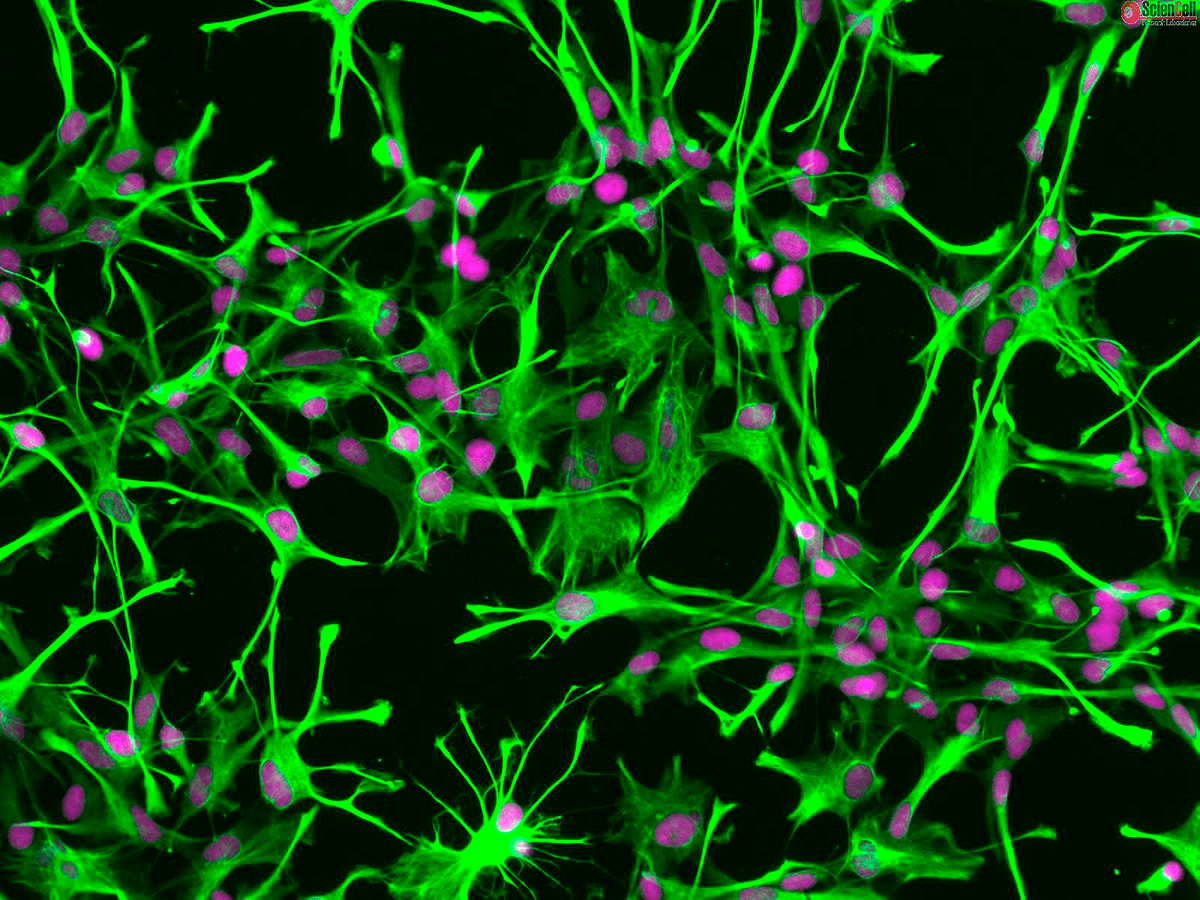
В последнее время было опубликовано несколько научных работ по превращению различных клеток в дофаминергические нейроны. В основном, исследователи останавливали свой выбор на астроцитах — клетках, поддерживающих жизнедеятельность нейронов. Свое название они получили за характерную звездчатую форму (рис. 2). В обязанности этих клеток входит обеспечение метаболических потребностей нейронов, участие в своевременном высвобождении нейротрансмиттеров из нервных окончаний, запас питательных веществ и регуляция активности нейронов.
Рисунок 2. Вспомогательные клетки нервной системы — астроциты. В норме они обеспечивают жизнедеятельность нейронов, но воздействуя на молекулярные процессы, протекающие в астроцитах, можно добиться их «превращения» в нейроны любого типа.
Но больше всего ученых интересует их репаративная функция. В 2014 году группа ученых из Лундского университета и Каролинского института обнаружила, что при повреждении нервной ткани после инсульта астроциты способны замещать погибшие нейроны [12]. При этом у них «выключается» сигнальный путь Notch1, имеющий ключевое значение в процессах пролиферации и дифференцировки клеток. В здоровом головном мозге этот путь активен и блокирует превращение астроцитов в нейроны. Однако после инсульта этот механизм подавляется, и астроциты могут начать трансформироваться в нейроны.
Идея для исследования, проведенного группой из Калифорнийского университета, не нова. Еще в 2017 году группа шведских ученых с помощью вирусных векторов превратила человеческие астроциты в нейроны in vitro. После этого трансформировали и мышиные астроциты, но уже in vivo. Для репрограммирования они использовали три транскрипционных фактора (NEUROD1, ASCL1 и LMX1A) и микроРНК miR218 [13]. Трансформация астроцитов in vitro была улучшена с помощью молекул, способных провоцировать перестройку хроматина и активировать несколько сигнальных путей.
Однако в исследовании 2020 года предлагается куда более простой метод перепрограммирования астроцитов: достаточно просто заблокировать производство одного-единственного белка.
Механизм трансформации астроцитов
В качестве мишени для репрограммирования астроцитов Цянь и коллеги выбрали РНК-связывающий белок PTB1 [14]. Этот белок синтезируется в астроцитах и ингибирует дифференцировку в нейроны. Снижение производства PTB1 вызывает продукцию его нейронного варианта nPTB1.
Сначала ученые провели трансформацию астроцитов in vitro. Астроциты выделили из среднего мозга и коры мыши и из коры человека. Исследователи использовали РНК-шпильку к гену Ptbp1, который кодирует белок PTB1. РНК-шпильки работают по принципу РНК-интерференции: они взаимодействуют с информационной РНК конкретного гена и вызывают ее деградацию, что приводит к неспособности клетки произвести белок. Уровень PTB1 в астроцитах упал, что привело к трансформации астроцитов в нейроны.
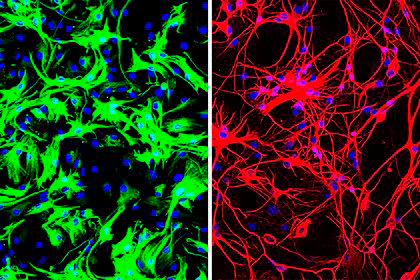
Затем исследователи перешли к экспериментам in vivo: они истощали запасы белка PTB1 в мозге мыши. Симптомы болезни Паркинсона у мышей были вызваны с помощью токсичного аналога дофамина, 6-OHDA, вызывающего гибель дофаминергических нейронов. Цянь и коллеги использовали трансгенных мышей, продуцирующих cre-рекомбиназу. Это позволяло нацелить вирусный вектор непосредственно на астроциты. Чтобы убедиться, что вирус достиг своей цели, в него встроили ген красного флуоресцентного белка. В составе вирусного вектора была маленькая РНК-шпилька (shPTB), которая блокировала ген Ptbp1. Такая стратегия также привела к преобразованию астроцитов в нейронные клетки и восстановлению двигательной активности (рис. 3).
Рисунок 3. Слева: астроциты мыши. Справа: нейроны, полученные в ходе репрограммирования астроцитов.
Результаты
Цянь и коллеги обнаружили, что истощение запасов PTB1 в астроцитах стимулирует их трансформацию в нейроны. Результат такой трансформации зависит от области мозга, в которой находятся целевые астроциты. Обнаружено, что астроциты в среднем мозге синтезируют низкие уровни факторов транскрипции Lmx1a и Foxa2. Эти факторы являются маркерами предшественников дофаминергических нейронов во время развития среднего мозга. Однако истощение белка PTB1 усиливало продукцию этих факторов транскрипции в астроцитах среднего мозга. С другой стороны, воздействие на корковые астроциты приводило к увеличению синтеза факторов транскрипции, характерных для корковых нейронов.
Спустя 4 недели после воздействия на астроциты in vitro 50–80% клеток стали морфологически похожи на нейроны и дали положительный результат на нейронные маркеры TUJ1 и MAP2.
При экспериментах in vivo спустя 3 недели после введения shPTB около 20% клеток, получивших красный флуоресцентный белок, синтезировали маркер нейронов NeuN. После 10 недель было уже около 80% клеток с NeuN. При этом клетки переставали продуцировать GFAP — белок, присутствующий в астроцитах.
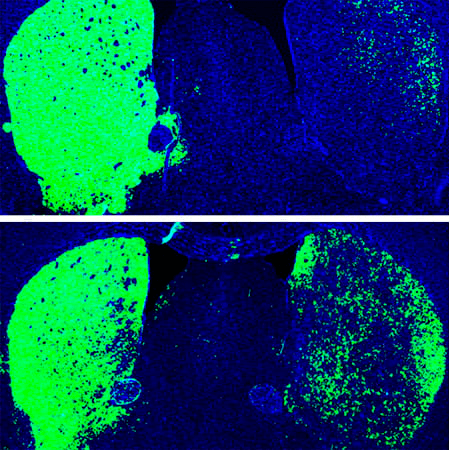
Спустя 12 недель 30–35% этих клеток трансформировались в дофаминергические нейроны. Другими словами, перепрограммирование астроцитов помогло восстановить более 600 погибших дофаминергических нейронов (рис. 4).
Рисунок 4. Мозг мыши с «односторонней» болезнью Паркинсона. Сверху — до репрограммирования с помощью shPTB. Снизу — после. Зеленым показаны дофаминергические нейроны.
Более того, новоиспеченные нейроны стали активно производить дофамин. Воздействие 6-OHDA привело к снижению уровня нейромедиатора до 25% от нормальных показателей. После терапии концентрация дофамина поднялась до 65% нормального уровня.
Будет ли создана новая терапия болезни Паркинсона?
Пока что слишком рано говорить о перспективах использования метода репрограммирования астроцитов для лечения болезни Паркинсона у реальных пациентов. Однако уже сейчас можно сказать, что это исследование помогло понять, как лучше подступиться к созданию новых направлений терапии этого недуга. Хотя эта многообещающая терапевтическая стратегия в будущем может быть применима и для лечения других нейродегенеративных заболеваний, сами авторы указывают, что «применение нашего подхода к людям потребует преодоления многих препятствий, включая возрастные ограничения перепрограммирования и потенциальные побочные эффекты». Вдобавок, в дальнейших экспериментах необходимо определить, сохранят ли перепрограммированные клетки свою функциональную активность в течение длительных промежутков времени.
Болезнь Паркинсона
Болезнь Паркинсона – нейродегенеративное заболевание, распространенное среди взрослых людей, первые признаки и симптомы которого могут возникнуть у взрослых, в юности, при наличии причин, а лечение помогает замедлить прогрессирование синдрома, но не избавиться от него.
Синдром паркинсонизма развивается вследствие дегенеративных изменений в черной субстанции головного мозга. По причине того, что начинают гибнуть дофамин-продуцирующие нейроны.
Дебют болезни Паркинсона обычно происходит после 50 лет, хотя в последние десятилетия нередки случаи, когда первые симптомы наблюдаются у молодых (с 16 лет) людей. Это объясняется ухудшением экологии, генетическими врожденными проблемами и нездоровым образом жизни.
Причины возникновения
Рассказать все о болезни Паркинсона, симптомах и лечении простыми словами достаточно сложно, однако причины возникновения и развития паркинсонизма, врачам понятны в достаточной мере.
Болезнь Паркинсона или дрожательный паралич (почему она так называется, понятно из основных проявлений даже на начальной стадии) – одно из распространенных дегенеративных заболеваний мозга, ежегодно поражающее тысячи человек.
Но жить с такой патологией можно на протяжении десятилетий.
Ученые до сих пор не способны точно установить, что конкретно провоцирует развитие заболевания. Однако факторы, ускоряющие деградацию установлены точно:
Также на прогрессирование патологии влияет применение некоторых медицинских препаратов, наркотических веществ.
Ученые считают, что сигналом к развитию болезни является воздействие нескольких неблагоприятных факторов одновременно.
Симптомы заболевания Паркинсона
Симптомы болезни Паркинсона достаточно разнообразны, иногда сложно понять, когда начинается, как именно впервые проявляется это заболевание. Но возникновение одного или нескольких из них, даже в юном возрасте, служит сигналом для беспокойства.
Главные признаки связаны с утерей контроля над движениями:
Болезнь можно определить не только по симптоматике, связанной с нарушениями подвижности тела, но и по другим характерным признакам:
Алгоритм лечения ранних стадий болезни Паркинсона
Профессор В.Л.Голубев,
зав. кафедрой неврологии ФУВ ММА им. И.М.Сеченова
В медицинской практике нередко встречаются ситуации, когда безуспешное лечение становится следствием неточной или ошибочной диагностики. Распознавание начальных стадий болезни Паркинсона часто осуществляется с большим трудом. Дебют этого заболевания всегда развивается субклинически и проходит немало времени (иногда – не один год), прежде чем ухудшающееся самочувствие заставит больного обраться к врачу. В настоящее время разработаны достаточно чёткие клинические критерии диагностики болезни Паркинсона. Они эффективно «работают» на развёрнутых стадиях заболевания и несомненно полезны для ранней диагностики, хотя в последнем случае их «разрешающая способность» не столь высока. Согласно этим диагностическим критериям, чтобы поставить диагноз болезни Паркинсона, нужно сделать три «шага»: распознать синдром паркинсонизма, исключить другие заболевания и найти симптомы, подтверждающие болезнь Паркинсона.
В целом современная концепция лечения болезни Паркинсона предполагает два стратегических подхода: поиск средств, способных замедлить, задержать или остановить её прогрессирование и создание новых более эффективных способов симптоматической терапии. Последний подход считается в настоящее время основным.
На ранних фазах заболевания врач ещё не видит у пациента тех серьёзных проблем, которые столь характерны для поздних стадий заболевания. Тем не менее уже на первых этапах болезни Паркинсона перед врачом неизбежно встаёт ряд задач, иногда весьма непростых и требующих корректного разрешения.
Поставив диагноз болезни Паркинсона, врач, прежде чем начинать лечение, обычно решает следующий круг вопросов:
Впервые поставленный диагноз болезни Паркинсона не обязательно требует немедленного начала лекарственной терапии.
Первое обращение пациента за врачебной помощью чаще всего обусловлено непонятным для него ухудшением самочувствия, смутной тревогой за своё состояние здоровья и (или) ухудшением адаптации больного в повседневной бытовой и (или) профессиональной деятельности. Таким образом, пытаясь найти ответ на первый вопрос («когда следует начинать лечение?»), врач должен проанализировать целый ряд обстоятельств, от которых может зависеть ответ на этот вопрос.
К числу таких обстоятельств на всех стадиях заболевания, в том числе и при первом обращении пациента к врачу, относятся следующие факторы, каждый из которых может оказаться значимым для того или иного больного.
Совокупность перечисленных выше факторов (их можно сгруппировать в объективные и субъективные) позволяет максимально точно ответить на главный вопрос, важный для определения времени начала лечения: «Какова степень функциональных нарушений у данного больного?» или, иными словами, влияет ли она на его социальную адаптацию (профессиональную и повседневную активность). Эти субъективные и объективные факторы в своей совокупности и дают врачу основание для того, чтобы предложить больному лечебную помощь и приступить к лечению, предварительно обсудив её с пациентом.
Основные факторы, влияющие на оценку степени функциональных нарушений:
Планируя стратегию лечения, врач имеет в своём арсенале потенциально разные варианты медикаментозной терапии, оперативное лечение, нелекарственные терапевтические подходы, социальную поддержку.
Принципы медикаментозной терапии болезни Паркинсона в значительной степени основаны на современных представлениях о функционировании дофаминергического синапса и патогенезе нейродегенеративных заболеваний. Эти принципы нацелены на использование средств, позволяющих: 1)увеличить синтез дофамина (ДА) в мозге; 2)стимулировать выброс ДА из пресинаптической терминали и блокировать его обратное поглощение пресинаптическими структурами; 3) задержать распад (катаболизм) ДА; 4) стимулировать постсинаптические ДА-рецепторы; 5) препятствовать прогрессирующей гибели нейронов и замедлить течение заболевания.
Начальная стадия заболевания сопровождается обычно слабо- или умеренно выраженными клиническими проявлениями, которые вполне можно успешно контролировать не леводопой, а менее сильнодействующими дофаминергическими средствами, не содержащими леводопу. В условиях России на выбор пациентом конкретных препаратов оказывает существенное влияние, помимо их наличия в аптечной сети, его социо-экономический статус (финансовые возможности больного). Достаточно высокая стоимость некоторых из них заставляет иногда учитывать и этот фактор.
К числу таких препаратов относятся: аматантадины (мидантан и ПК-Мерц), селективные ингибиторы МАО (юмекс, селегилин) и, конечно, агонисты дофаминовых (ДА) рецепторов, список которых продолжает пополняться всё новыми и новыми формами. Лечение начальных стадий заболевания указанными средствами возможно как в виде монотерапии (чаще), так и в виде различных комбинаций перечисленных препаратов (реже). Именно этот комплекс фармакологических средств рекомендуется для лечения начальных (I-II) стадий болезни Паркинсона. Целью терапии является восстановление нарушенных функций при минимальных эффективных дозах.
Лечение начальных (I-II по Hoehn и Yarh) стадий заболевания:
Что касается ингибиторов КОМТ (комтан, тасмар), то их эффективность на ранних стадиях болезни Паркинсона также показана в специальных исследованиях, но их применение на ранних этапах заболевания ещё не превратилось в традицию и нуждается в дальнейшем накоплении наблюдений.
Все перечисленные лекарственные средства несомненно уступают в своей эффективности дофасодержащим препаратам, но вполне подходят для лечения первых этапов заболевания. Если же их терапевтическую эффективность сравнивать не с леводопой, а между собой, то обнаруживается не столь разительная разница в их антипаркинсоническом действии. Тем не менее, большинство агонистов ДА-рецепторов пусть незначительно, но всё-таки эффективнее амантадинов и ингибиторов МАО, сохраняют дольше способность проявлять антипаркинсоническую активность по сравнению с леводопой и, что ещё важнее, обеспечивают несколько лучшие отдалённые перспективы для пациента. Изучение свойств ДА-агонистов теоретически позволяет предполагать наличие у них и некоторых других преимуществ. Поэтому они пользуются предпочтением у большинства исследователей. Однако практическому врачу не стоит слишком преувеличивать эти преимущества. Они действительно имеют место, но не столь выражены, как того хотелось бы, и, более того, клинически они не всегда заметны.
Некоторые преимущества ДА-агонистов по сравнению с другимиантипаркинсоническими препаратами:
Таким образом, если при первом визите больного врач видит очень слабо выраженные симптомы с минимальным снижением функциональных возможностей, то ДА-агонисты могут и не назначаться. Мидантан (или юмекс) будет вполне адекватным антипаркинсоническим препаратом, обладающим к тому же и нейропротективным действием. Если же клинические проявления таковы, что требуется более эффективный дофаминергический препарат, то более показанным будет ДА-агонист.
При ухудшении состояния (переход в III стадию), которое рано или поздно, но обязательно наступает независимо от характера лечения, рекомендуется увеличение дозы этих же препаратов, что обычно приводит к улучшению самочувствия, повышает адаптацию и качество жизни больного. И лишь при последующем ухудшении, которое, к сожалению, миновать никому не удаётся и которое характеризуется появлением постуральных расстройств (III-стадия), ставится вопрос о назначении дофасодержащего препарата.
Жёстких критериев, указывающих на оптимальное время начала лечения леводопой или дофасодержащими препаратами, не существует. Известен лишь принцип, согласно которому не следует торопиться с ранним назначением леводопы, как и не следует быстро форсировать её дозу, добиваясь по возможности отсрочки её применения. Полезно ориентироваться при этом и на возраст пациента. Если позволяет состояние больного, лучше не начинать лечение леводопой у лиц моложе 60-70 лет. У пожилых же пациентов с болезнью Паркинсона средством выбора при лечении даже начальных стадий заболевания являются дофасодержащие препараты (обычно мадопар или наком), к которым, в случае такой необходимости, добавляются ДА-агонисты, ингибиторы МАО, ингибиторы КОМТ и другие средства.
Лечение последующих этапов болезни:
Основные ориентиры в выборе дозы дофасодержащего препароата:
Как видно из таблицы, основным ориентиром в выборе дозы дофасодержащего препарата служит откликаемость больного на предложенную минимальную дозу мадопара (накома, дуэллина, сталево и т. д.), а также её переносимость. При выраженной клинической картине слишком низкая доза (например, четверть таблетки мадопара-250) может оказаться настолько недостаточной для данного пациента, что её эффект может остаться просто незамеченным как пациентом, так и врачом. Как правило, первая (стартовая) доза мадопара составляет 125 мг в день (одна капсула или половина таблетки мадопара-250). Иногда этой дозы вполне достаточно, чтобы удовлетворительно компенсировать больного или вернуть ему состояние более или менее приемлемой адаптации. Главный и вполне достаточный повод для любого увеличения дозы дофасодержащего препарата всегда заключается только в ухудшении адаптированности больного на работе и в быту.
Таким образом по мере прогрессирования заболевания арсенал используемых антипаркинсонических средств, как правило, расширяется и большинство больных получает комплексное лечение, которое заключается в той или иной комбинации вышеупомянутых препаратов. Все они не только хорошо сочетаются, но и потенцируют эффект друг друга. Правда при этом повышается стоимость такого лечения.
На ранних и, особенно на последующих этапах течения заболевания полезно учитывать также, какой из кардинальных симптомов паркинсонизма (акинезия, ригидность или тремор) является ведущим в клинической картине. Если составить таблицу, в которой напротив каждого из перечисленных симптомов расположить ряд антипаркинсонических препаратов, начиная с самого эффективного и кончая наименее действенным по отношению к нему, то такие ряды примут весьма характерный вид.
Основные симптомы паркинсонизма и сравнительная эффективность антипаркинсонических препаратов:
Акинезия: леводопа > ДА-агонисты > амантадины > холинолитики > юмекс
Ригидность: леводопа > ДА-агонисты > холинолитики > амантадины > юмекс
Тремор*: леводопа > холинолитики > ДА-агонисты > амантадины > юмекс
* Имеется в виду тремор покоя. По отношению к тремору действия (постуральному и кинетическому) более эффективным препаратом является обзидан. Последний обычно сочетается с другими вышеупомянутыми антипаркинсоническими средствами. В целом все антипаркинсонические препараты менее эффективны по отношению к тремору, чем к акинетико-ригидному синдрому. Тремор – особая проблема, требующая специального обсуждения.
Холинолитики (антихолинергические препараты) становятся менее популярными в лечении Болезни Паркинсона. Их побочные эффекты, ограниченная эффективность и целый ряд серьёзных противопоказаний, в том числе ятрогенное снижение когнитивных функций, делает их применение при болезни Паркинсона весьма ограниченным. Не рекомендуется их назначение у лиц старше 50-60 лет. Лишь у пациентов молодого возраста на ранних этапах заболевания при хорошей откликаемости и переносимости становится оправданным их применение.
Таким образом решение вопроса о сроках начала лечения, стартовой дозе препарата и последующего её титрования, включения в схему лечения других антипаркинсонических средств решается, как уже говорилось выше, строго индивидуально с учётом синдромальных особенностей паркинсонизма, возраста больного, характера его профессиональной деятельности и, что иногда очень важно, отношения самого пациента к своей физической несостоятельности, его психологической реакции на заболевание и действия врача. Описанная выше стратегия лечения ранних стадий болезни Паркинсона допускает, следовательно, возможность выбора в решении обсуждаемых вопросов, что и определяет принципиальную возможность индивидуального подхода к каждому конкретному пациенту, без чего невозможно эффективное лечение и сотрудничество с ним.
Что касается нефармакологического подхода к лечению (социальная поддержка и психотерапия; советы по режиму двигательной активности и профессиональной деятельности; характеру питания и т.д.), то оно уместно на всех стадиях этого заболевания, а некоторые из нефармакологических подходов могут применяться и на самых ранних его этапах. Важно разъяснить больному, что ему одинаково нежелательны как избыточная физическая активность, так и чрезмерное избегание её. Оптимальным будет для него сохранение на прежнем уровне того режима двигательной активности (впрочем как и психической), к которой он привык. Сохранение привычного темпа жизни и тех стереотипов, которые были ему свойственны до болезни, и стремление удержать свою активность на прежнем уровне – вот та стратегия, которой должен придерживаться пациент.
Нефармакологическое лечение:
Здесь особенно важное значение придаётся рекомендациям по физической активности. На ранних стадиях заболевания применяются физические нагрузки, уровень которых может быть достаточно высоким и «предполагает преодоление внешних препятствий»:
На последующих этапах заболевания физическая нагрузка должна быть дозированной; здесь она уже «не предусматривает преодоления внешних препятствий и значительных усилий»:
Основные двигательные симптомы, на которые нацелен тренинг, включают: ригидность, гипокинезию, нарушения походки, нарушения устойчивости и позы, подвижность в постели. Превентивно применяются также дыхательные упражнения (на поздних этапах болезни им свойственна гиповентиляция и пневмония становится опасной для них).
Используется и такие программы физической активности, которые требуют участия специально подготовленного методиста:
Функциональный тренинг, включающий манипуляции с окружающими предметами, ритмическая физическая нагрузка и т.д. уменьшают не только гипокинезию, ригидность и походку, но и достоверно снижают такие показатели как баллы в шкале UPRDS, улучшают когнитивные функции и настроение.
Широко используются различные приспособления, улучшающие качество жизни. Эти мероприятия в англоязычной литературе получили даже специальное название «модификации окружающей среды в целях безопасности и комфорта»
В некоторых случаях для больного становится особо актуальной симптоматическая терапия других (в том числе недвигательных) симптомов и синдромов. Имеются в виду депрессия, дизартрия, сиалорея, боли, запоры, нарушения поведения во время ночного сна и при пробуждениях, пароксизмы профузного гипергидроза и др. Некоторые из этих симптомов иногда выходят на передний план в клинической картине и становятся главными дезадаптирующими проявлениями, снижающими качество жизни.
Перечень отдельных симптомов и синдромов, которые могут потребовать дополнительного симптоматического лечения:
* Симптомы, которые чаще встречаются на последующих этапах болезни.
Наконец, дополнительная фармакотерапия недофаминергическими средствами, включая препараты с нейропротекторными свойствами; антиглютаматные (NMDA-антагонисты) и антиапоптозные средства; антиоксиданты; средства, улучшающие метаболизм в мозге; нейротрофические факторы; иммуномодуляторы, проводится обычно регулярными повторными курсами как вспомогательная, но стратегически важная лекарственная терапия. И хотя многие представители этих фармакологических групп препаратов по своей эффективности оставляют желать лучшего, именно с ними связывают перспективы более успешной терапии болезни Паркинсона в будущем.
При лечении сопутствующих, в том числе соматических, заболеваний больному нежелательно назначение препаратов с нейролептическими свойствами и блокаторов кальциевых каналов.
Основные направления в выборе недофаминергических препаратов:
Нейропротекторная (помимо мидантана, юмекса и ДА-агонистов), общеукрепляющая (и симптоматическая) терапия:
Ранние побочные эффекты дофаминергических средств (тошнота, рвота, анорексия, ортостатическая гипотензия, реже – другие симптомы) преодолеваются изменением (снижением) рекомендованной дозы, советами по диете, реже – сменой препарата или назначением дополнительных лекарственных препаратов. Как правило ранние побочные эффекты не столь трудны для коррекции, как поздние побочные эффекты, и в большинстве случаев удаётся адаптировать к ним пациента, не прибегая к отмене антипаркинсонического средства.
Наиболее часто встречающиеся побочные эффекты дофаминергических препаратов на ранних этапах лечения:
Вопросы хирургического лечения болезни Паркинсона с применением конструктивных и деструктивных методов редко становятся актуальными на ранних её стадиях и чаще всего обсуждаются на более поздних этапах, когда фармакотерапия перестаёт справляться с возложенными на неё задачами и теряет свою эффективность.
Оценивая новые терапевтические подходы, всегда полезно помнить о незримом присутствии плацебо-эффекта, который реализуется, как недавно было показано, при участии тех же дофаминергических систем мозга и имеет место при всех заболеваниях, в том числе и при болезни Паркинсона. Эти больные нуждаются в адекватной психотерапии и социальной поддержке, организации специальных обществ и интернет-сайтов, которых уже достаточно много и где они могут получить ответы на свои вопросы.
Современные подходы к лечению болезни Паркинсона
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Статья посвящена одному из наиболее распространенных во всем мире заболеваний – болезни Паркинсона (БП), распространенность которой в России достигает 10% в популяции. Количество больных паркинсонизмом увеличивается, причем за счет лиц трудоспособного возраста.
В статье подробно рассматриваются фармакокинетика, фармакодинамика, эффекты, данные о клинических исследованиях, нежелательных явлениях (НЯ) и взаимодействии противопаркинсонических препаратов: дофаминсодержащих, агонистов дофамина, ингибиторов МАО-Б, антихолинергических средств, а также комбинированных препаратов.
Также в статье уделено внимание немедикаментозным методам лечения больных паркинсонизмом: хирургическому лечению (стереотаксической деструкции вентролатерального ядра зрительного бугра), физическим упражнениям, которые призваны помочь больным лучше передвигаться и выполнять повседневную работу, несмотря на двигательные затруднения, связанные с болезнью.
Эффективность терапии пациентов с БП должна быть основана на индивидуальном подходе в зависимости от стадии заболевания, выраженности клинических проявлений и наличии или отсутствии осложнений. В статье приведен алгоритм анализа «затраты/полезность» терапии больных паркинсонизмом. Информационная система многокритериального анализа может рассматриваться как частный вариант системы поддержки принятия решений при выборе пожизненной терапии пациентам с паркинсонизмом.
Ключевые слова: болезнь Паркинсона, дофамин, ингибиторы МАО-Б, пирибедил, амантадин, QALM.
Для цитирования: Страчунская Е.Я., Грибова Н.П. Современные подходы к лечению болезни Паркинсона. РМЖ. 2017;13:957-962.
Modern approaches to treatment of Parkinson’s disease
Strachunskaya E.Ya., Gribova N.P.
Smolensk Medical University
The article is devoted to one of the commonest ubiquitous ailments – Parkinson’s disease (PD). Its prevalence in Russia reaches 10% of the polulation. The number of patients with parkinsonism is growing, mainly due to spread in working age group. The article provides a thorough review of pharmacokinetics, pharmacodynamics, effects, data on clinical investigations, untoward reactions, and interactions of antiparkinson drugs: dopamine-containing, agonists of dopamine, MAO-B inhibitors, anticholinergic and combined drugs. The article also focuses on the non-pharmacological methods of treatment of patients with parkinsonism: surgery (stereotactic destruction of ventrolateral nucleus of the optic thalamus), physical exercises for improvement of motility and of daily activities, in spite of movement limitations linked with the disease.
The effectiveness of therapy for PD should be based on individual approach depending on the stage of the disorder, severity of clinical signs and on lack or absence of the complications. The article presents a tool “Expenses-Usefulness” for assessing treatment of patients with parkinsonism. The information system of multi-criteria analysis can be viewed as a option for support of decision-making when choosing a life-long therapy for patients with parkinsonism.
Key words: Parkinson’s disease, dopamine, MAO-B inhibitors, Piribedil, Amantadine, QALM.
For citation: Strachunskaya E.Ya., Gribova N.P. Modern approaches to treatment of Parkinson’s disease // RMJ. 2017. № 13. P. 957–962.
Представлены современные подходы к лечению болезни Паркинсона
Актуальность
Лечение
Дофаминсодержащие препараты
Агонисты дофамина
Ингибиторы МАО-Б
Антихолинергические средства
Амантадины
Комбинированные препараты
Хирургическое лечение
Применяется в мире с 1958 г. Оно заключается в стереотаксической деструкции вентролатерального ядра зрительного бугра. В нашей стране эта методика впервые была внедрена Э. Канделем в 1965 г. По литературным данным, положительный эффект после этой операции наблюдается в 80–90% случаев. Постепенно снижаясь с течением времени, через 10–20 лет он уже приближается к 50%. Серьезным осложнением этой операции является травма зрительного нерва (14% случаев), приводящая к гемианопсии. Послеоперационная летальность составляет около 2% [1, 23].
В последние годы параллельно с вышеуказанным методом развивается нейротрансплантация. В качестве трансплантатов используют мозговую ткань надпочечников и нейроны черной субстанции эмбрионов 6–9-недельного возраста. Однако накопленного в этой области опыта еще недостаточно, чтобы делать определенные выводы.
С учетом пожилого возраста большинства пациентов и наличия у них сопутствующих заболеваний (например, сердечно-сосудистых) понятно, что многие из них не в состоянии перенести такие серьезные оперативные вмешательства. Кроме того, хирургические методы чаще всего не могут полностью ликвидировать симптомы паркинсонизма, а только снижают их выраженность в той или иной степени. Поэтому они нисколько не умаляют значение фармакотерапии.
БП и симптоматический паркинсонизм – это тяжелые поражения ЦНС, с которыми, однако, в настоящее время неврологи и нейрохирурги уже пытаются бороться. С этой целью разработано много направлений и методов терапии. Для каждого из них существует ряд показаний и противопоказаний, что лишний раз подчеркивает необходимость индивидуализации выбора терапии для каждого пациента с этой патологией [4, 17]. Однако достижения в области индивидуального подхода к лечению еще недостаточны и несовершенны. На практике врач сталкивается со сложностями в подборе схем терапии, определении и смене суточных дозировок отдельных препаратов и кратности их приема. Это во многом определяет дальнейшую скорость прогрессирования болезни, появление осложнений и НЯ.
Опыт современной противопаркинсонической терапии и наличие стандартных рекомендаций по диагностике и лечению различных вариантов паркинсонизма далеко не всегда могут гарантировать их оптимальную реализацию на практике без проведения клинико-экономического анализа, позволяющего объективно оценить эффективность лечения в динамике.
Одним из наиболее распространенных методов клинико-экономического исследования является анализ «затраты/полезность (утилитарность)», который можно рассматривать как вариант анализа «стоимость/эффективность», при котором результаты вмешательства оцениваются в единицах «полезности» с точки зрения потребителя медицинской помощи, т. е. больного. К таким единицам можно, например, отнести показатель «качество жизни» или «сохраненные месяцы качественной жизни» (QALM) [17, 18].
Когда речь идет о хроническом прогрессирующем процессе, крайне сложно четко выделить и правильно оценить показатель QALM как в связи с постоянным ухудшением здоровья вследствие основного заболевания, так и в зависимости от наличия сопутствующей патологии, для которой характерны периодическая изменчивость и специфическое лечение. Однако в данных условиях очевидно отсутствие стандартных критериев для расчета этого показателя при хроническом патологическом процессе, т. е. наличие той же проблемы, которая касается и решения вопроса определения клинической эффективности.
Для устранения указанного недостатка нами была разработана методика, которая включает использование таких расчетных единиц, как коэффициенты эффективности (КЭ) с такими показателями, как: индивидуальные КЭ (ИКЭ) – для каждого пациента при конкретной хронической патологии; средние КЭ (СКЭ) – единые для групп пациентов с одинаковым течением заболевания на исследуемый период времени (ухудшение, стабилизация, улучшение) и зависимые от среднесуточных доз принимаемых препаратов ИКЭ – ИКЭ (DDD).
Введение величин ИКЭ (DDD) и СКЭ позволяет рассчитать коэффициент «стоимость/эффективность» и инкрементальную стоимость, опираясь на объективные, рассчитанные математически показатели клинической эффективности, определенные Патентной службой РФ в рамках информационно-аналитического комплекса программ расчета фармакоэкономических показателей как стандартные единицы. Это позволяет исключить имеющие место при всех клинико-экономических исследованиях недостатки субъективного подхода к оценке результатов лечения.
Введение величин ИКЭ (DDD) и СКЭ также позволяет объективизировать входную информацию, опираясь не только на субъективные суждения, но и на данные клинических осмотров. В результате можно рассчитать коэффициент «затраты/полезность» (З/П), используя новую, более совершенную методику.
Алгоритм оптимизированного нами анализа «затраты/полезность» выглядит следующим образом:
1. Набирается группа пациентов, у которых применяется одна схема терапии.
2. Вычисляется стоимость лечения одного пациента за год и за весь период наблюдения.
3. Проводится расчет КП для отбора схожих течений с использованием информационно-аналитического комплекса компьютерных программ.
4. Выбирается кластер стереотипных течений в группе «улучшение», т. е. пациентов, имеющих наилучшие (учитывая заболевание) показатели здоровья.
5. Прослеживается количество месяцев, в течение которых будут наблюдаться сохранение данной совокупности траекторий и справедливость равенства ИКЭ (DDD) ≤ СКЭ. Эти месяцы составят показатель «качественно прожитых» месяцев жизни. Оставшиеся месяцы, когда кластер будет «рассыпаться» и равенство исчезнет, отойдут к разряду «потерянных».
6. Среди «потерянных» месяцев, рассматриваемых отдельно, также выявляются схожие течения и их количество, но уже для пациентов с «прогрессированием» заболевания, которые тем не менее часть времени также могут жить «качественно». Это будет учитываться в расчетах как показатель «штрафных месяцев».
7. Проводится вычисление стоимости одного «качественно прожитого» и одного «штрафного» месяцев жизни. Для этого стоимость лечения за период наблюдения делится на соответствующее количество месяцев.
8. При помощи программного обеспечения рассчитывается стоимость «качественно прожитого» и «штрафного» времени в целом за исследуемый период с учетом количественного соотношения пациентов, попавших в группы «улучшение» и «прогрессирование».
9. Коэффициент З/П будет равен значению стоимости одного «месяца качественной жизни», вычисленного от средней стоимости «качественно прожитого» и «штрафного» времени.
10. Аналогичные расчеты могут быть произведены для пациентов, получающих другое лечение. Для корректности вычислений все приводятся к одному общему показателю, например, числу учтенных месяцев с кластерным течением заболевания в группе.
11. Проводится сравнительный анализ эффективности различных терапевтических схем по показателям «штрафных», «качественных» месяцев и коэффициенту З/П.
Использование в вышеприведенных расчетах стандартных коэффициентов (КП, СКЭ, ИКЭ (DDD)) для отбора эффективных случаев позволило объективизировать данный метод фармакоэкономического анализа, устранив по возможности субъективную клиническую оценку со стороны и врача, и больного. Принимая во внимание, что решение данного вопроса является ключевым при выполнении всех дальнейших вычислений, следует использовать приведенную методику для расчета коэффициента З/П в рамках стандартного клинико-экономического анализа.
Все вышеизложенное составляет в совокупности интеллектуальную информационную систему многокритериального анализа ФЭ- и ФЭК-показателей, которая может рассматриваться как частный вариант системы поддержки принятия решений при выборе пожизненной терапии пациентам с паркинсонизмом (свидетельство об официальной регистрации № 2007611811 на информационно-аналитический комплекс программ расчета фармакоэкономических показателей AP_EconEval_Pharm от 28.04.2007).
Таким образом, внедрение стандартных коэффициентов при проведении фармакоэкономического анализа позволяет в определенной степени оптимизировать лечение пациентов. Это создает условия для реализации максимально эффективных терапевтических схем на различных этапах развития хронически прогрессирующих заболеваний при рациональном распределении материальных ресурсов в рамках реального объема финансирования здравоохранения.
Только для зарегистрированных пользователей
Болезнь Паркинсона
Болезнь Паркинсона – это хроническое дегенеративное заболевание нервной системы, сопровождающееся дрожанием рук и ног, обеднением движений и постепенным замедлением мыслительных процессов, и депрессией. Правильно подобранное и своевременно назначенное лечение способно затормозить патологический процесс и продлить жизнь пациента.
Общая информация
Болезнь Паркинсона вдвое чаще поражает мужчин, чем женщин. В большинстве случаев она развивается после 60 лет, но регистрируются случаи раннего начала заболевания (в 30-40 лет), а также ювенильные формы, развивающиеся у двадцатилетних людей.
Существует несколько гипотез формирования патологии. В настоящее время точно доказано, что одним из механизмов ее развития является постепенная дегенерация нейронов и снижение выработки дофамина. Это важный нейромедиатор, участвующий в передаче нервных импульсов. В результате формируется специфический комплекс нарушений, который позволяет легко поставить диагноз.
Причины
Точные причины возникновения болезни Паркинсона не выявлены. Ученые смогли определить лишь ряд факторов, повышающих риск развития нейродегенеративных процессов:
Симптомы
Болезнь Паркинсона проявляется специфическими признаками, которые в комплексе составляют четкую картину заболевания:
Экспертное мнение врача
Заместитель главного врача, врач-невролог, иглорефлексотерапевт
Формы болезни
В зависимости от преобладающей симптоматики, выделяют три формы болезни Паркинсона:
Стадии развития
В настоящее время врачи выделяют 5 стадий болезни Паркинсона, проявляющиеся определенным комплексом симптомов:
Диагностика
Диагноз болезни Паркинсона ставится на основании характерной клинической картины. Пациента осматривает невролог, который отмечает типичные признаки. В обязательном порядке уточняются жалобы, собирается анамнез заболевания (история появления признаков) и жизни (сведения о перенесенных травмах, хронических заболеваниях, хирургических вмешательствах). Лабораторная и инструментальная диагностика используется для уточнения сопутствующей патологии и исключения других причин неврологических нарушений.
Лечение болезни Паркинсона
В настоящий момент успешно подобранное лечение болезни Паркинсона может приостановить процесс деградации и снизить выраженность патологической симптоматики. Болезнь начинает прогрессировать медленнее, что позволяет пациентам дольше оставаться в хорошей форме.
Медикаментозное лечение
Медикаментозное лечение направлено на восстановление баланса дофамина в центральной нервной системе. Используются следующие препараты:
Существуют комбинированные средства, сочетающие несколько действующих веществ для максимально быстрого эффекта.
Немедикаментозное лечение
Медикаментозное лечение дополняется физиотерапией, ЛФК и массажем. Физиотерапия используется для активации процессов метаболизма и усиления кровотока в головном мозге. В зависимости от состояния пациента и сопутствующих заболеваний могут быть назначены:
Массаж направлен на улучшение двигательной активности. Интенсивное разминание мускулатуры и пассивная гимнастика снижает ригидность мышц и обладает общеукрепляющим действием.
Упражнения лечебной физкультуры позволяют:
Большинство упражнений направлены на тренировку чувства равновесия. Комплекс подбирается индивидуально в зависимости от состояния пациента, его возраста и сопутствующих заболеваний.
Хирургическое лечение
Помощь хирургов актуальна на последних стадиях развития заболевания. Наиболее эффективной и безопасной операцией является установка стимулятора головного мозга. Вмешательство не требует вскрытия черепной коробки. В мозг вводятся тонкие электроды, а под кожу ключицы помещается небольшой стимулятор. Прибор программируется на определенную частоту импульсов, кроме того, больной и его родственники могут менять настройки в зависимости от состояния. Использование стимулятора позволяет сократить дозировку препаратов и длительное время держать симптоматику под контролем.
Другие варианты хирургического лечения требуют работы на открытом мозге:
Осложнения
Ограничение работы мускулатуры при болезни Паркинсона неизбежно приводит к уменьшению интенсивности кровотока и снижению уровня обмена веществ. Уже на средних стадиях развития заболевания значительно повышается риск образования тромбов и развития опасных состояний:
Прикованные к постели пациенты нередко сталкиваются с тяжелыми осложнениями, связанные с лежачим положением:
Правильно подобранное лечение значительно снижает риск развития осложнений, вот почему важно своевременно обратиться к врачу.
Профилактика
Профилактика болезни Паркинсона включает:
Лечение в клинике «Энергия здоровья»
Неврологи клиники «Энергия здоровья» придут на помощь при любой стадии болезни Паркинсона. Мы предлагаем комплексное лечение в соответствии с современными стандартами:
Преимущества клиники
Болезнь Паркинсона начинается очень медленно, но остановить этот процесс практически невозможно. Если у Вас или Ваших родных появились подозрительные признаки, не затягивайте с обращением к врачу. Запишитесь на диагностику в клинику «Энергия здоровья».
Болезнь Паркинсона
С годами у человека накапливается все больше болезней. К старости многие приходят с целым «букетом» недугов, некоторые из которых нельзя ни излечить, ни даже предугадать. К таким относится и болезнь Паркинсона.
Ее развитие не зависит от интеллектуальных способностей человека. Паркинсонизмом болели даже такие одаренные личности, как Сальвадор Дали. Медики до сих пор затрудняются ответить, почему он возникает. И все же методы борьбы с этим серьезным заболеванием имеются.
Симптомы болезни
Паркинсонизм относится к хроническим заболеваниям ЦНС. Детально описал и заложил основы его диагностики британец Джеймс Паркинсон. Он установил, что болезнь является результатом нехватки в организме дофамина — нейромедиатора, продуцируемого корой головного мозга.
Первые признаки проблемы обычно проявляются после 50 лет. Паркинсонизм — нейродегенеративноезаболевание, прогрессирующее с возрастом. Чем старше становится человек, тем сильнее проявляется симптоматика.
Распознать заболевание у пожилого человека можно по таким симптомам:
Существует несколько форм заболевания. В 40% случаев врачи диагностируют дрожательно-ригидную форму, самым ярким признаком которой является тремор. 30% пациентов страдают замедленностью движений. Дрожание конечностей при этом встречается редко.
У 20% диагностируется ригидно-дрожательная форма недуга. При ней пациенты испытывают сложности с координацией. В остальных случаях наблюдается дрожательная или акинетическая форма. При первой у больных страдает тонус мышц, мимика, присутствует сильный тремор. При второй симптомы практически незаметны.
Причины заболевания
Существует 3 главных провоцирующих фактора:
1. Изменения в клетках.
Двигательная деятельность человека полностью подчинена работе мозга. В первую очередь на нее влияет нейромедиатор дофамин. Чем его меньше в организме — а с возрастом производство дофамина снижается, — тем хуже тело координирует свои действия.
Уменьшение физической активности наблюдается практически у всех пожилых людей. Однако у не подверженных болезни Паркинсона граждан оно начинается гораздо позднее. У больных же людей симптомы проявляются рано и с каждым годом все усиливаются.
Количество дофамин содержащих клеток у них резко уменьшается. Этот процесс развивается стремительно, постепенно приводя человека к полной беспомощности и инвалидности.
Болезнь Паркинсона — «подарок» от предков. Если родители ею болели, то у потомства вдвое больше шансов столкнуться с теми же проблемами в старости. Склонность к дегенеративным процессам ЦНС заложена в генах.
3. Влияние негативных факторов.
Развитие недуга у пожилых людей обусловлено еще и тем, что вырабатывающие дофамин участки мозга очень чувствительны к негативным факторам. Болезнь Паркинсона могут спровоцировать:
Если болезнь развилась на фоне этих факторов, то говорят о вторичном паркинсонизме. Какими бы ни были причины, недуг всегда сильно осложняет жизнь престарелых. Из-за того что человек не может свободно перемещаться, он становится менее социально активным. Отчужденность и одиночество плохо сказываются и на психическом здоровье.
Депрессия и ограниченность перемещений делают человека незащищенным перед разными недугами. Пациенты с Паркинсоном предрасположены к инфекционным и вирусным заболеваниям, а из-за плохой координации еще и регулярно получают травмы. Естественно, человеку с таким списком проблем нужна постоянная помощь.
Проявления болезни Паркинсона
Существует 2 вида признаков. К первому относятся все те симптомы, которые были описаны ранее: гипокинезия, тремор и пр. Уменьшение двигательной активности — один из наиболее тяжелых «спутников» болезни.
У здорового человека побуждение что-либо сделать сразу же подкрепляется готовностью мышц. Абсолютное большинство движений — ходьба, бег и пр. — выполняется непроизвольно, сразу же, без какой-либо предварительной подготовки. Здоровый человек шагает, не задумываясь о том, что надо поднять ногу, перенести ее на новое место и опустить.
Мышцы больного слабо воспринимают нервные импульсы, поэтому между побуждением и самим действием проходит довольно ощутимый промежуток времени. Болезнь Паркинсона сказывается на ходьбе, движениях головы и рук, даже мимике человека. Лицевые мышцы, утратив тонус, почти не отражают истинных эмоций пациента. Со стороны кажется, что ему все безразлично.
Снижение двигательной активности проявляет себя по-разному. Иногда пациенты просто замирают, причем, в довольно неудобных позах. Меняется и почерк. Пожилой человек начинает медленнее писать и делает это с заметным усилием.
Сгибающие и разгибающие конечности мышцы у больного работают одновременно, поэтому тело постоянно находится в тонусе. Это состояние сам больной явственно ощущает. Людям с развившейся болезнью свойственна определенная поза: склоненная голова, прижатые к телу, чуть согнутые руки.
Еще один характерный признак — так называемый «тремор покоя». Когда больной не двигается, его голова и руки совершают мелкие ритмичные колебания. Если человек волнуется, дрожь усиливается.
По мере развития недуга тремор поражает все тело. Могут подергиваться глаза, ноги, нижняя губа. При самой тяжелой форме паркинсонизма тремор почти прекращается из-за полной ригидности мышц.
Эти признаки тесно переплетены с неспособностью сохранять равновесие. Поскольку мышцы слабо реагируют на сигналы головного мозга, человек не может скоординировать движения ног с положением тела. Его походка становится шаркающей. Любой толчок может привести к падению.
Описанные симптомы редко встречаются в единичном варианте. Обычно они группируются, и картина болезни Паркинсона проявляется в полной мере. У пациентов также могут встречаться сложности с мочеиспусканием/дефекацией, чрезмерная активность сальных желез, слюнотечение и психические изменения. Больные паркинсонизмом чувствуют себя лишними, раздражаются по пустякам, часто бывают ворчливы и скупы.
Врачи у пациентов с таким диагнозом нередко диагностируют депрессию. Те замыкаются в себе, стараются избегать контактов с окружающими, иногда зацикливаются на одной идее. Появляются проблемы с ночным сном. Больные часто встают по ночам, ходят по дому, никак не могут заснуть.
Самое печальное, что из-за недуга страдают и умственные способности. На последних стадиях престарелые теряют память и впадают в старческую деменцию.
Стадии болезни
Различают 5 стадий заболевания, характеризующихся следующими признаками:
Болезнь может развиваться медленно или стремительно. В одних случаях пожилые люди остаются на определенной стадии более 5 лет, в других — за 2 года переходят к полной недееспособности и беспомощности. Если заболевание не лечится, продолжительность жизни сокращается до 10 лет.
Деменция
Самое тяжелое проявление болезни Паркинсона — слабоумие, или деменция. Она встречается у 25% пациентов. Пожилые люди с таким симптомом апатичны, замкнуты, озлоблены. Очень часто они погружаются в глубокую депрессию.
Поскольку полностью излечить паркинсонизм нельзя, главной задачей медиков является минимизация негативной симптоматики и отдаление V стадии недуга, которая заканчивается смертью.
Диагностика
Первая задача врача — выявление причин заболевания. Важно определить, является ли оно собственно болезнью Паркинсона или характерная симптоматика — следствие других недугов. Вторичный паркинсонизм способны вызывать:
Диагностику начинают с обследования у невролога. Назначив терапию, врач постоянно контролирует реакцию организма на медпрепараты. Если пациент положительно реагирует на лекарства, предназначенные именно для излечения болезни Паркинсона, то диагноз подтверждается. Вторичный паркинсонизм частично устраняется другими средствами.
В ряде случаев проводится аппаратная диагностика с помощью МРТ и компьютерной томографии.
Положена ли инвалидность
Поскольку заболевание серьезно сказывается как на физических, так и на умственных способностях пациентов, при нем назначается инвалидность. В I группу попадают больные, неспособные обслуживать себя и имеющие серьезные проблемы с работой мышц и координацией.
Если пенсионер может себя обслуживать и выполнять простейшие действия в быту, ему присваивается II группа. В третью попадают достаточно сохранные больные, у которых нарушения двигательной активности минимальны.
Лечение болезни Паркинсона
Сложность недуга заключается в его хроническом течении. Излечиться от болезни Паркинсона полностью невозможно. Однако уже сейчас есть медицинские препараты, помогающие пациенту сохранять физическую и интеллектуальную активность достаточно долгий срок.
Терапия при этом комплексная. Она включает прием специальных лекарств и витаминов, гимнастику, сеансы психотерапии и массажа. Пациенту нельзя уменьшать двигательную нагрузку. Чем дольше мышцы будут активны, тем позднее начнут проявляться заторможенность, потеря координации и другие симптомы.
В числе препаратов, использующихся для лечения Паркинсона, — «Мирапекс», «ПК-Мерц» и пр. Они содержат вещества, приостанавливающие гибель дофамин содержащих нейронов. В комплексе с такими медпрепаратами пациенту назначают купирующие конкретные симптомы лекарства. Например, «Леводоп» хорошо снимает тремор и другие двигательные нарушения.
Хирургические методы
Если пациент слабо реагирует на прием медикаментов, применяются современные методы хирургического лечения. В мозг больного внедряют электроды, стимулирующие активность нейромедиаторов, или сами дофаминсодержащие клетки.
Новое в лечении паркинсонизма
В последние десятилетия болезнь очень активно исследуется. Сейчас проводятся опыты по лечению стволовыми клетками. Ученые высказали предположение, что эта методика способна продлевать активную фазу жизни пациентов до 15 лет. Сейчас технология испытывается, и пока не известно, когда она получит широкое распространение.
Другое направление исследований связано с изучением генов. Поскольку паркинсонизм генетически обусловлен, есть надежда на выявление хромосом, ответственных за его развитие. Калифорнийские ученые уже выяснили, что болезнь вызывает генная наследственная мутация.
Израильские специалисты тестируют ультразвуковую методику лечения. Ее суть заключается в том, что с помощью ультразвука разрушаются пораженные клетки, вследствие чего наиболее серьезные симптомы недуга исчезают. Этот метод во многом схож с хирургией, но является более щадящим для пациента.
Режим и правила питания
Существенно повысить результативность медикаментозной терапии помогает соблюдение режима и норм питания. Прежде всего, лекарства нужно принимать за полчаса до еды; тогда они будут лучше усваиваться. Питание больных Паркинсоном должно быть витаминизированным и разнообразным. Важно пить много воды (не менее 1,5 л в день).
Полезна пища, содержащая жирные омега-кислоты: орехи, морская рыба, растительные масла. Белковые продукты можно употреблять не чаще 3 раз в неделю. На растительную и молочную пищу ограничений практически нет. Если пациенту сложно глотать, блюда нужно готовить в перетертом или жидком виде. В день должно быть 4—5 приемов пищи (небольшими порциями).
Громадное значение имеет посильная физическая активность:
Уход за больными паркинсонизмом
Крайне важна не только физическая помощь, но и психологическая поддержка. Больному нужно помогать во всех начинаниях, но там, где это возможно, — позволять действовать самому. С ним также нужно много общаться, чтобы не угасали умственные способности.
Важно контролировать, чтобы пенсионер не забывал пить лекарства. От этого зависит течение болезни и общее состояние престарелого. Нехватка нужных веществ проявляется в:
Обращайте на это внимание и сообщайте обо всех подозрительных изменениях лечащему врачу! Возможно, больной нуждается в коррекции дозы препарата.
Когда заболевание перешло с первой стадии на вторую и последующие, не обойтись без инвалидной коляски и других приспособлений, облегчающих передвижения. Из комнаты больного следует убрать все вещи, которые могут его ранить или нанести другой вред. В ванной стоит оборудовать специальные поручни. Это поможет избежать падений и травм.
Профилактика заболевания
Предугадать развитие болезни Паркинсона очень сложно. Даже если у ближних родственников ее не было, нельзя гарантировать, что и дальние ею тоже не болели. Людям, стоящим на пороге старости, рекомендуется:
Соблюдая эти правила и внимательно относясь к своему здоровью, можно долго оставаться активным и полным сил. Но если тревожные симптомы все же дали о себе знать, нужно срочно обратиться за медицинской помощью. Чем раньше будет предпринято соответствующее лечение, тем дольше человек сможет оставаться в хорошей физической и умственной кондиции.
Как вылечить болезнь паркинсона навсегда
Приведен обзор нелекарственных методов лечения пациентов с болезнью Паркинсона (БП). Особое внимание уделяется плохо поддающимся медикаментозной коррекции моторным проявлениям заболевания, в частности нарушениям ходьбы. Приводится информация о методиках объективизации нарушений функции ходьбы. Анализируются результаты собственного исследования, подтверждающие эффект разработанного авторами метода темпоритмовой коррекции ходьбы при БП и сосудистом паркинсонизме, а также авторского устройства для оценки параметров ходьбы. Анализируется эффективность других методов коррекции ходьбы с использованием внешних стимулов, оцениваются дизайн исследований и уровень их доказательности. Представлена информация о возможностях лечебной физкультуры и эрготерапии для коррекции различных симптомов БП. Проанализированы положительные и отрицательные результаты транскраниальной магнитной стимуляции, светотерапии, транскраниальной микрополяризации при БП. Кратко изложены основные нелекарственные методы лечения пациентов с БП, на настоящий момент не имеющие достаточной доказательной базы (ментальные методики релаксации и аутотренига, методики общей вибрации (вибромассаж), лазертерапия (фотоакустическая терапия), акупунктура). Подчеркивается перспективность метода восстановления ходьбы при БП с применением методов темпо-ритмовой коррекции.
Кафедра нервных болезней Красноярского государственного медицинского университета;
Сибирский клинический центр Федерального медико-биологического агентства России, Красноярск
ГОУ ВПО «Красноярский государственный медицинский университет им. профессора В.Ф. Войно-Ясенецкого», Красноярск
ГБОУ ВПО «Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого»;
ГБУЗ «Сибирский научно-клинический центр» ФМБА, Красноярск, Россия
Нарушения походки у пациентов с БП в начале заболевания зависят от гипокинезии и ригидности. В результате наблюдается замедленная инициация ходьбы, снижение ее скорости и уменьшение величины шага (микробазия). Походка становится шаркающей, при этом больной почти не отрывает ног от пола, возникает «семенящий» шаг. Нарушение позы при БП возникает в результате постоянной флексии шейного отдела позвоночника и формирования «согбенной» установки туловища с кифозом. При ходьбе туловище может еще больше наклоняться вперед. Чтобы сохранить равновесие и избежать падения, больные, пытаясь «догнать» центр тяжести тела, вынуждены постепенно ускоряться (пропульсия). У части больных наблюдаются ретро- и латеропульсии. Довольно часто при БП встречается феномен застывания при ходьбе (англ.: freezing). По мере прогрессирования БП застывания могут встречаться чаще и становиться более продолжительными, что значительно нарушает ходьбу.
Роль постуральной неустойчивости особенно значительна на поздней стадии заболевания, когда смещение центра тяжести больного не вызывает компенсаторных движений туловища и конечностей, что ведет к падениям [3, 6, 7].
Снижение общей активности в сочетании с кифотической установкой позвоночника и общей гипокинезией, как правило, приводит к дыхательным расстройствам.
Проблемы диагностики нарушений ходьбы при БП. Механизмы развития нарушений ходьбы при различных заболеваниях и возможности их компенсации, а также динамика изменений нарушений походки и оценка результатов терапии предполагают развитие инструментальных методов анализа ходьбы [11]. Для регистрации пространственных характеристик шага используются различные ихнометрические методики. В настоящее время наиболее распространен достаточно трудоемкий импрегнационный метод ихнометрии, заключающийся в ручном измерении расстояния между отпечатками стоп на бумажной полосе [12, 13]. Неудобны и механические методы ихнометрии с использованием чернильных самописцев, прикрепляемых к обуви. Оптоэлектронные методы сложны в использовании и дорогостоящи. Более доступны электрические методы ихнографии, однако большинство из них требует использования специальной обуви либо соединения при помощи кабеля закрепленных на обуви пациента электродов и считывающего устройства, что изменяет стереотип ходьбы и отражается на конечных результатах исследования 14. В связи с этим чрезвычайно актуальны задачи создания простого, но достаточно информативного метода регистрации ходьбы, выбора критериев оценки походки с целью более полного понимания ее механизмов в норме и патологии.
Типичные графики результатов обследования здоровых молодых, здоровых пожилых пациентов с ПБ представлены на рис. 1. Из представленных графиков видно, что для здоровых молодых характерна значительная стандартность походки (соответственно малая вариабельность длины шага) с небольшими колебаниями относительно среднего показателя. В результате график имеет форму пирамиды с узким основанием. У здоровых пожилых основание данной пирамиды расширяется ввиду большего разброса длины шагов (большая вариабельность длины шага). У пациента с БП объективизируется термин «семенящая походка», с топтанием на месте и явлениями моторных флюктуаций в виде застываний, что проявляется большим количеством шагов минимальной длины.
Другим подходом диагностических оценок является формализация и стандартизация обследования без использования специальных устройств. Например, исследуется время прохождения определенного расстояния или, наоборот, определяется расстояние, пройденное за единицу времени.
Методы темпоритмовой коррекции ходьбы (ТРКХ)
Уже с XIX века известен феномен парадоксальных кинезий, который заключается в уменьшении олигобрадикинезии под влиянием периодизации времени (звучание марша, ритмические команды и т. д.) либо пространства (ступеньки, пол с контрастными половицами и т. д.) [9, 18, 19]. Проводились попытки улучшить ходьбу больного при помощи данных методов. Так, описывался положительный эффект ходьбы больных под музыку, заключающийся в увеличении длины шага [20, 21]. Методика динамической зрительной афферентации [7] также показала существенную эффективность, однако ее внелабораторное применение в настоящее время затруднено. Проведенные метаанализы показали, что звуковая стимуляция более эффективна в сравнении со зрительной в отношении восстановления ходьбы, поскольку влияет не только на длину шага (как зрительная), но и ее скорость и ритм 22. Кроме того, аудиостимуляция более доступна для последующего применения с целью поддержания положительного эффекта [25, 26].
M. Thaut и соавт. [21] предлагали использовать единую частоту подаваемых звуковых сигналов (звук метронома, записанный поверх музыки в базовом режиме и ускоренный на 10%) для коррекции нарушений ходьбы у пациентов с БП, что не учитывало индивидуальные особенности пациентов и степень нарушения походки. В исследовании участвовал всего 21 пациент с II-IV стадиями заболевания по Хену-Яру. Это, очевидно, несколько размывает результаты исследования, не позволяя полноценно изучить эффективность терапии на разных стадиях заболевания. Авторы оценивали результаты коррекции в периоды как включения, так и выключения. Существенным отличием от большинства других работ является объективизация ходьбы с размещением меток на четырех точках каждой стопы при помощи компьютеризированной установки, что значительно повышает достоверность данных. В целом была продемонстрирована относительно небольшая эффективность использованного метода лечения. Также авторы констатировали, что простое изменение длины шага недостаточно для существенного улучшения ходьбы.
По нашему мнению, особое внимание при восстановительном лечении нарушений ходьбы при паркинсонизме должно быть обращено на индивидуальные возможности больного поддерживать различные темпы ходьбы, их динамическую корректировку в зависимости от стадии заболевания и схем приема лекарственных препаратов, опирающихся на количественную регистрацию параметров шага в процессе лечения 26.
Занятия по корректировке ходьбы с синхронизацией шага под ОЧ проводили ежедневно по 5-20 мин от 3 до 6 раз в день в зависимости от состояния больного. Таким образом, во время синхронизированной с темпом звуковой стимуляции ходьбы изменялся двигательный стереотип патологической походки, который, однако, быстро угасал при самостоятельной ходьбе в произвольном темпе без подкрепления экзогенной стимуляцией. С целью закрепления достигнутого эффекта пациентам выдавалась аудиокассета с записанной на ней ОЧ, которую они применяли при ходьбе с использованием аудиоплеера и наушников. ОЧ записывали также на флеш-плейере больных или выдавали разработанное нами устройство для тренировок ходьбы, которое пациенты использовали в повседневной жизни (при ходьбе по квартире, прогулках на улице и т. д.).
По нашим наблюдениям, у некоторых пациентов с БП эффект от использования звуковой стимуляции с ОЧ в отношении резкого увеличения длины шага оказался сопоставим с эффектом действия препаратов леводопы. Приводим графики результатов оценки ходьбы больного БП III стадии в свободном темпе и синхронизированной с ОЧ подаваемых звуковых сигналов (рис. 2). Результаты также представлены в табл. 1 и 2.

Было установлено, что метод ТРКХ, использованный в схемах лечения пациентов с БП II стадии по Хену-Яру, показал более высокую эффективность в восстановлении походки, чем в группе сравнения. Положительная динамика показателей ходьбы (СДШ, КВШ) превзошла таковые у больных с БП со II стадией по Хену-Яру, в лечении которых применялись только антипаркинсонические препараты. Нарушения ходьбы у пациентов с БП с III стадией по Хену-Яру оказались более выраженными по сравнению с больными со II стадией. В связи с этим потребность в восстановлении ходьбы у этих пациентов была значительно выше. Положительный эффект от применения ТРКХ у больных с БП III стадии также оказался значительно выше по сравнению с получавшими антипаркинсонические препараты.
Подбор стимулов проводился и в других исследованиях, в частности была предпринята попытка улучшить качество ходьбы у пациентов с ранними стадиями БП, используя ТРКХ с аудиосигналом, который подбирался индивидуально [28]. Для этого пациент проходил с комфортной для него скоростью расстояние в 9 м 15 раз, среднее значение ритма вычислялось (авторы не указывают, какие методы объективного контроля использовались), и в дальнейшем пациенту предлагалось ходить с использованием заданных ритмов. Ценность работы снижает малое количество (11 человек) обследованных и невозможность экстраполяции полученных данных на пациентов с поздними стадиями Б.П. Это связано с тем, что в моменты выраженной гипокинезии ритм пациента может быть очень низким, и его увеличение навряд ли существенно изменит ходьбу. На наш взгляд, недостатком работы является недооценка других параметров ходьбы.
Данная методика стимуляции использовалась у относительно небольшого числа пациентов с БП, однако в одном из моноцентровых исследований у пациентов с сосудистым паркинсонизмом (СП) с наличием активного (звуковая стимуляция) и пассивного (отсутствие воздействия) контроля было установлено значительное увеличение СДШ и уменьшение КВШ. Более подробно результаты представлены в табл. 3.
Эффективность обеих методик, на наш взгляд, следует связать с мобилизацией дополнительных компенсаторных механизмов в виде коркового контроля над ходьбой, реализуемого через премоторную кору, а также, возможно, дополнительного влияния мозжечковых путей, компенсирующего дисфункцию базальных ганглиев и связанной с ним дополнительной моторной коры. Одним из аргументов в пользу этой концепции является работа M. Mak и соавт. [29], показавших существенное ухудшение ходьбы по сравнению со здоровыми у пациентов с БП при отвлечении их внимания на вычисления, и, напротив, больший уровень положительных изменений (длина, скорость и ритм ходьбы) у пациентов с БП по сравнению со здоровыми при предъявлении аудиовизуальных стимулов. Ходьба существенно улучшалась при использовании как слуховых, так и зрительных стимулов, однако их сочетание не давало значительного увеличения эффекта ТРКХ [30]. Это может объясняться индивидуальным доминированием восприятия у пациента сигналов одного из типов либо элементами отвлечения внимания при использовании двух сигналов разного типа, что не позволяло суммировать положительный эффект.
Методы ЛФК и эрготерапии в лечении БП
Тезис о пользе дыхательной гимнастики для пациентов с БП подтверждается данными работы R. Inzelberg и соавт. [33]. Пациенты были распределены в группу сравнения (ложная дыхательная гимнастика) и основную (дыхательная гимнастика). Достоверно лучшие результаты были в основной группе.
Рассматривая программы, направленные на упражнения для скелетной мускулатуры с позиций доказательной медицины, можно констатировать, что любые систематические занятия, включая самостоятельные домашние, оказывают положительное влияние на моторные функции [34]. Проведенный Cochrane Movement Disorders Group метаанализ (33 исследования, 1518 пациентов) полностью подтверждает значение занятий ЛФК по сравнению с их имитацией (или отсутствие вмешательства) в отношении скорости и длины шага, равновесия и моторных функций [35]. Систематические занятия под контролем специалистов ЛФК достоверно эффективнее, чем самостоятельные домашние, и оказывают положительное влияние на моторные функции (включая показатели шкалы UPDRS, оценка при помощи PDQ-39) и дневную активность (оценка по шкале NEADL) [36]. Применение специализированной программы занятий (ParkFit) у 540 пациентов с БП со сниженной двигательной активностью в рандомизированном контролируемом исследовании не показало существенного воздействия на активность по шкале LAPAQ, однако остальные вторичные точки оценки эффективности (включая дневник активности и 6-минутный тест ходьбы) продемонстрировали достоверное улучшение [37]. Подчеркнем, что исследование касается не просто пациентов с БП, но больных с пониженной моторной активностью. В отношении частоты падений существенного эффекта ЛФК не оказывает [35, 38]. Эрготерапия оказывает положительное влияние на качество жизни (оценка по PDQ-39), дневную активность (оценка по NEADL) [15].
Транскраниальная магнитная стимуляция (ТКМС)
После первых оптимистических единичных сообщений об использовании ТКМС для пациентов с БП появились работы, указывающие на низкую эффективность данного метода [39]. Видимо, проблема связана с подбором оптимального режима стимуляции, в первую очередь частоты воздействия и ее области: так, в указанном исследовании использовалась частота 50 Гц. В другом рандомизированном исследовании [40] имелись группа сравнения (имитация ТКМС) и две группы воздействия с частотой 10 и 1 Гц. Полученные данные свидетельствуют о достоверном улучшении (около 6,8 балла по шкале UPDRS) в группе, получавшей стимуляцию с частотой воздействия 1 Гц, тогда как стимуляция с частотой 10 Гц обладала гораздо меньшим и нестойким эффектом. В открытом неконтролируемом исследовании [25] была отмечена эффективность ТКМС с частотой 9 Гц в сочетании с фармакотерапией (галантамин) у пациентов с БП и деменцией. Интересно, что наблюдалась положительная динамика (повышение метаболизма соответствующих структур нервной системы) по данным позитронно-эмиссионной томографии.
Светотерапия (фототерапия)
Сеансы воздействия белого искусственного света 3300 люкс были эффективными в отношении моторных проявлений БП и эмоционального состояния больных [41]. Использование источника света в 5000 люкс сопровождалось достоверным уменьшением дневной сонливости и слабости у пациентов с БП по сравнению с группой плацебо (источник света в 300 люкс) [42]. Авторы связывают данные эффекты с оптимизацией циркадных циклов выработки мелатонина.
Транскраниальная микрополяризация (ТКМП)
Отечественные работы, касающиеся транскраниальной электрополяризации при БП, представляют интерес, ее применение сопровождается уменьшением гипокинезии [43]. Однако в этих работах нет четкого описания критериев включения пациентов, а также отсутствует элемент заслепления. ТКМП привлекает все большее внимание и зарубежных исследователей. Так, в рандомизированном исследовании с плацебо-контролем были показаны положительные эффекты в отношении улучшения ходьбы и уменьшения брадикинезии, хотя по шкале UPDRS четкого улучшения отмечено не было [39]. В другом пилотном исследовании отмечено существенное улучшение ходьбы при использовании ТКМП [44].
Изучение применения ментальных методик релаксации и аутотренинга не показало эффективности при БП [34]. Также не продемонстрирована эффективность применения общей вибрации (вибромассаж) [45]. В настоящее время обсуждают потенциальные возможности для дезагрегации патологического α-синуклеина для терапии БП с использованием лазеротерапии (фотоакустическая терапия), однако на настоящий момент не имеется данных, касающихся ее эффективности и безопасности.
В отдельных исследованиях показан положительный эффект акупунктуры (иглорефлексо-, апитерапия), однако метаанализы не подтверждают эти данные, в первую очередь вследствие малочисленности участников. Значительным недостатком данных исследований является сложность воспроизведения технологии, которая может значительно различаться у двух разных специалистов. В настоящее время имеется ряд моноцентровых простых рандомизированных и заслепленных исследований в известных центрах акупунктуры (преимущественно в Южной Корее и КНР), которые на малых группах пациентов продемонстрировали положительный эффект. Следует указать, что подавляющее большинство исследований проводилось при использовании акупунктуры в качестве дополнительного лечения к терапии препаратами леводопы. Имеются интересные результаты работ с оценкой не столько клинических конечных точек, сколько изменений в ходе инструментальных исследований. Так, по данным однофотонной эмиссионной компьютерной томографии, на фоне акупунктуры (в сочетании с терапией препаратами леводопы) по сравнению с пациентами на фоне только лекарственной терапии имелось достоверно большее регионарное изменение кровотока при одинаковой активности дофаминтранспортирующих систем [46]. Аналогичные результаты, касающиеся метаболизма мозга, получены при использовании позитронно-эмиссионной томографии [47]. По нашему мнению, окончательного ответа в отношении эффективности акупунктуры при БП не существует. Он может появиться только при должной стандартизации методик акупунктуры и проведении мультицентровых исследований по стандартным методикам.
Таким образом, поиски оптимальных методов нелекарственного воздействия при БП в настоящее время продолжаются с разной степенью успешности. Постепенно повышается уровень доказательной базы. Продолжение изысканий и выработка единых подходов к нелекарственной терапии БП имеет большое значение, принимая во внимание малую эффективность лекарственных средств для лечения немоторных симптомов и нарушений ходьбы. В плане восстановления ходьбы имеются обоснованные надежды в отношении методов ТРКХ.
Конфликт интересов отсутствует.
1 Патент на изобретение № 2321345, зарегистрирован в Государственном реестре изобретений РФ 10 апреля 2008 г.
2 Патент на изобретение № 2281695, зарегистрирован в Государственном реестре изобретений РФ 20 августа 2006 г.
3 Патент на изобретение № 2304997, зарегистрирован в Государственном реестре изобретений РФ 27 августа 2007 г.
4 Патент на изобретение № 2527170 «Способ лечения больных паркинсонизмом».