какая форма углерода используется для изготовления драгоценных камней
Творческие проекты и работы учащихся
В индивидуальной исследовательской работе по химии «Углерод и его аллотропные модификации» автор изучает литературу по теме исследования и подробно рассказывает об аллотропных модификациях углерода, о химических и физических свойствах, а также знакомится с её видами.
Подробнее о проекте:
Учащаяся института профессионального образования в рамках своего проекта на тему «Углерод и его аллотропные модификации» изучила такие аллотропные модификации углерода, как алмаз, графит и фуллерен, описала историю их открытия и структуру каждого рассматриваемого вещества. Также изучены и представлены физические и химические свойства алмаза, графита и фуллерена.
Оглавление
Введение
1. Понятие аллотропии.
2. Аллотропные модификации углерода.
3. Алмаз.
4. Графит.
5. Фуллерен.
6. Физические свойства.
7. Химические свойства.
8. Практическая часть.
Заключение
Список использованной литературы
Введение
Углерод и его аллотропные модификации имеют большое практическое значение в жизни человека и промышленности.
Цель исследования: Подробно рассказать об аллотропных модификациях углерода, о химических и физических свойствах, а также ознакомиться с её видами.
Понятие аллотропии
Понятия «Аллотропия» имеет древнегреческие корни: αλλος — другой, τροπος — свойство. Аллотропия — существование двух и более простых веществ одного и того же химического элемента. Понятие аллотропии введено в науку Й. Берцелиусом в 1841 году для обозначения разных форм существования элементов.
Явление аллотропии подразумевает возможность создания из одного и того же элемента определенного количества различных веществ. Например, кислород и озон в своем составе содержат только лишь оксиген. Вопрос о том, как это вообще возможно, на протяжении длительного периода времени интересовал многих людей. На сегодняшний момент ученые легко могут объяснить все особенности этого процесса.
Далеко не все элементы способны образовывать несколько разных простых веществ. Такая способность напрямую зависит от структуры молекул. Чаще всего подобное явление наблюдается у элементов, которые имеют переменные окислительные степени.
Это касается таких групп, как:
Причины аллотропии могут быть нескольких типов. К наиболее вероятным из них ученые относят такие факторы, как:
Для того чтобы наглядно понять, каким образом может существовать явление аллотропии, необходимо рассмотреть несколько наиболее примечательных примеров, широко встречающихся в природе.
При нагревании металлов в процессе превращения поглощается тепло, при этом изменение решеточной конструкции происходит при одной и той же температуре. Аллотропным модификациям подвергаются многие металлы, например, титан, железо, олово и др. Железо при нагревании до +1390 ºС характеризуется гранецентрированной решеткой. Повышение температуры до +1540 ºС ведет к перестройке до центрировано-кубической структуры.
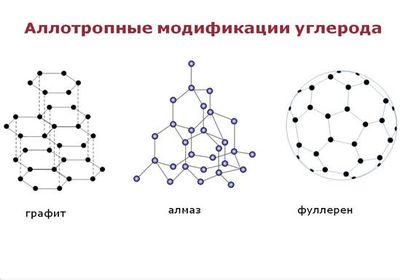
Аллотропные модификации углерода
Углерод в виде угля, копоти и сажи известен человеку с незапамятных времен; около 100 тыс. лет назад, когда наши предки овладели огнём. Вероятно, очень рано люди познакомились и с аллотропными изменениями углерода – алмазом и графитом, а также с ископаемым углем. Не удивительно, что горение углеродсодержащих веществ было одними из первых химических процессов, заинтересовавших человека.
Элементом был огонь-явление, сопровождающее горение; в учениях об элементах древности огонь обычно фигурирует в качестве одного из элементов. На рубеже XVII-XVIII вв. возникла теория флогистона, выдвинутая Бехером и Шталем. Эта теория признавала наличие в каждом горючем теле особого элементарного вещества – невесомого флюида-флогистона, улетучивающегося в процессе горения.
В книге Гитона де Морво, Лавуазье и Фуркруа «Метод химической номенклатуры» (1787) появилось название «углерода» вместо французского «чистый уголь». Под этим же названием углерод фигурирует в «Таблице простых тел» в «Элементарном учебнике химии» Лавуазье. В 1791 году английский химик Теннант первым получил свободный углерод; он пропускал пары фосфора над прокаленным мелом, в результате чего образовывался фосфат кальция и углерод. То, что алмаз при сильном нагревании сгорает без остатка, было известно давно.
Еще в 1751 году французский король Франц I согласился дать алмаз и рубин для опытов по сжиганию. Оказалось, что сгорает лишь алмаз, а рубин (окись алюминия с примесью хрома) выдерживает без повреждения длительное нагревание в фокусе зажигательной линзы. Лавуазье поставил новый опыт по сжиганию алмаза с помощью большой зажигательной машины, пришел к выводу, что алмаз представляет собой кристаллический углерод.
Второй аллотроп углерода – графит в алхимическом периоде считался видоизмененным свинцовым блеском и назывался plumbago; только в 1740 году Потт обнаружил отсутствие в графите какой – либо примеси свинца. Шееле исследовал графит (1779) и будучи флогистиком счел его сернистым телом особого рода, особым минеральным углем, содержащим связанную «воздушную кислоту» (СО2) и большое количество флогистона. Двадцать лет спустя Гитон де Морво путем осторожного нагревания превратил алмаз в графит, а затем в угольную кислоту.
Международное название Carboneum происходит от латинского carbo (уголь). Слово это очень древнего происхождения. Его сопоставляют с cremare – гореть; корень car, cal, русское гар, гал и гол, санскритское cra означает кипятить, варить. Со словом «carbo» связаны названия углерода и на других европейских языках (carbon, charbone и др.). Немецкое Kohlenstoff происходит от Kohle – уголь.
Древнерусское угорати, или угарати (обжигать, опалять) имеет корень гар, или гор, с возможным переходом в гол; уголь по-древнерусски югъль, или угъль, того же происхождения. Слово алмаз происходит от древнегреческого – несокрушимый, непреклонный, твердый, а графит от греческого – пишу. В начале XIX в. Старое слово уголь в русской химической литературе иногда заменялось словом «углетвор» (шере, 1807; Севергин, 1815); с 1824 г. Соловьев ввел название углерод.
Алмаз
Согласно современным теоретическим представлениям, тверже алмаза ничего в мире быть не может — такова у него кристаллическая решетка. Можно сказать, что алмаз — самый крепкий минерал в мире. Плавится алмаз при высоких температурах, от 3700 до 4 тыс. градусов. Но еще раньше, при 850 градусах, он начинает гореть, а без доступа воздуха при достижении половины от температуры плавления превращается в графит.
Алмазы не всегда были драгоценными камнями, имевшими ценность и шкалу стоимости. В природе этот камушек непривлекателен — простая шершавая стекляшка. Ценность ему придает огранка. Все изменилось в XIX веке, когда в Южной Африке около современного города Кимберли на ферме братьев де Бирс обосновались искатели алмазов. Камней на этих землях было много. Настоящая промышленная их добыча стала связана с именем Сесиля Родса.
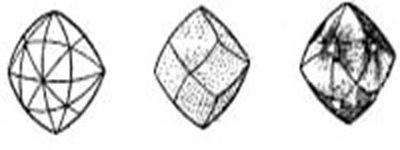
Сесиль Родс стал монополистом на рынке алмазов, чему поспособствовали Ротшильды, а бриллианты стали потребительским товаром, доступным не только королям. Монопольное положение де Бирс пошатнулось только в середине XX века благодаря антимонопольному законодательству в США и началу массовой добычи в странах, где возможностей захвата рынка в принципе не было — например, в СССР. Существует несколько способов огранки алмазов, при которой они лучше всего проявляют такое свое свойство, как игру цвета. Играет свою роль и исходная форма камня, поскольку огранщик старается свести его потери к минимуму.
Наиболее распространенными формами бриллианта являются:
Графит
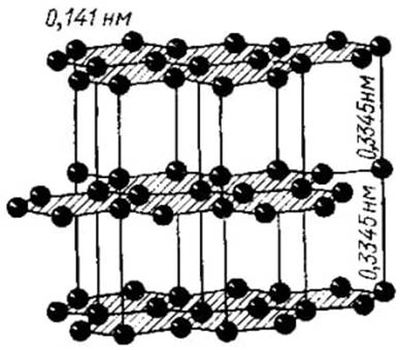
Графи́т — минерал из класса самородных элементов, одна из аллотропных модификаций углерода. Структура слоистая. Слои кристаллической решётки могут по-разному располагаться относительно друг друга, образуя целый ряд политипов, с симметрией от гексагональной сингонии (дигексагонально-дипирамидальный), до тригональной (дитригонально-скаленоэдрический).
Слои слабоволнистые, почти плоские, состоят из шестиугольных слоёв атомов углерода.
Физические свойства в графите сильно различаются по направлениям – перпендикулярному и параллельному слоям атомов углерода.
При нагревании без доступа воздуха графит не претерпевает никаких изменений до 3700°С. При указанной температуре он возгоняется, не плавясь.
Искусственный графит получают из лучших сортов каменного угля при 3000°С в электрических печах без доступа воздуха.
Графит термодинамически устойчив в широком интервале температур и давлений, поэтому он принимается в качестве стандартного состояния углерода. Плотность графита составляет 2,265 г/см3.
Известны две формы графита: альфа-графит (имеет гексагональную структуру и кристаллическую решетку) и бета-графит (имеет ромбоэдрическую структуру и кристаллическую решетку). У α-графита половина атомов каждого слоя располагается над и под центрами шестиугольника, а у β-графита каждый четвёртый слой повторяет первый.
Альфа-графит может быть преобразован в бета-форму с помощью механической обработки. Бета-форма переходит в альфа-форму при нагревании графита свыше 1300 °C.
Фуллерен
Открытие фуллерена произошло в результате экспериментов Смолли и Крото с инструментом, который Смолли изобрел для изучения молекул и атомных кластеров. Крото заинтересовала предложенная Смолли методика лазерного испарения. С ее помощью он намеревался проверить свою теорию о поведении углерода в межзвездном пространстве. Крото считал, что богатые углеродом красные гиганты способны испускать сложные углеродные соединения, которые можно обнаруживать с помощью радиотелескопов.
Атом связь Фуллерен является новой аллотропной формой углерода. Молекулы фуллерена состоят из 60,70 атомов, образующих сферу. Кристаллические фуллерены представляют собой полупроводники. Разнообразие физико-химических и структурных свойств соединений на основе фуллеренов позволяет говорить о химии фуллеренов как о новом перспективном направлении органической химии.
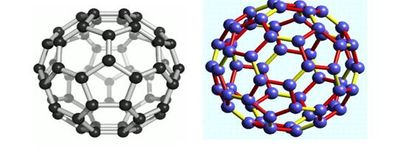
Атомы углерода расположены в вершинах правильных шести- и пятиугольников, из которых составлена поверхность сферы или эллипсоида. Самый симметричный и наиболее полно изученный представитель семейства фуллеренов фуллерен (C60), в котором углеродные атомы образуют усечённый икосаэдр, состоящий из 20 шестиугольников и 12 пятиугольников и напоминающий футбольный мяч.
Следующим по распространённости является фуллерен C70, отличающийся от фуллерена C60 вставкой пояса из 10 атомов углерода в экваториальную область C60, в результате чего молекула C70 оказывается вытянутой и напоминает своей формой мяч для игры в регби. Так называемые высшие фуллерены, содержащие большее число атомов углерода (до 400), образуются в значительно меньших количествах и часто имеют довольно сложный изомерный состав. Среди наиболее изученных высших фуллеренов можно выделить Cn, n=74, 76, 78, 80, 82 и 84.
Физические свойства
Физические свойства. Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.
Поэтому разные модификации проявляют очень разные физические свойства это и очень твердое вещество, и мягкое вещество проводящее электрический ток и многие другие.
Алмаз:
Физ. свойства. Алмаз и графит резко отличаются по физ. Свойствам. Алмаз – прозрачные кристаллы, очень твердые. Твердость объясняется строением его кристаллической решетки. Графит – мягкое темно-серое вещ-во с Ме блеском.
Графит:
Фуллерен:
Физические свойства фуллерена Конденсированные системы, состоящие из молекул фуллеренов, называются фуллеритами. Наиболее изученная система такого рода — кристалл С60, менее — система кристаллического С70. Исследования кристаллов высших фуллеренов затруднены сложностью их получения.
Химические свойства
Алмаз:
При обычной температуре углерод малоактивен. Он может быть, как восстановителем, так и окислителем. Как восстановитель: Горит на воздухе.
Графит:
Химические свойства. Со многими веществами (щелочными металлами, солями) образует соединения включения. Реагирует при высокой температуре с воздухом, сгорая до углекислого газа.
Фуллерен:
Восстановление, нуклеофильное присоединение, цикло присоединение, региохимическое множественное присоединение, галогенирование, модифицирование фуллеренов, кластерами гидрирование, присоединение радикалов, образование комплексов, переходных металлов окисление и реакции с электрофильными реагентами.
Практическая часть
Новая аллотропная модификация:
C18 был получен путём удаления монооксида углерода из молекулы C24O6 принципом атомно-силовой микроскопии на двухслойной поверхности хлорида натрия при температуре 5°K (-268,15°С). По мнению учёных, циклоуглероды могут оказаться полезными в компьютерных технологиях в качестве чрезвычайно энергоэффективного компьютерного логического устройства. Кроме того, создание С18 открывает путь для синтеза других углеродных аллотропов, но пока что предстоит глубокое изучение свойств новой молекулы.
Заключение
Углерод — вещество с самым большим числом аллотропических модификаций. В проекте рассмотрены аллотропные модификации алмаза, графита, фуллерена. Углерод и его аллотропные модификации имеют большое практическое значение в жизни человека и промышленности.
Большинство вещей в нашей жизни мы получили благодаря аллотропным модификациям, например, сверло, чёрные графитовые карандаши и батарейки.
Благодаря этому проекту мы узнала, как и кто помог нам в улучшении нашей жизни.
Исходя из всей проделанной работы, мы можем сделать следующие выводы:
225 лет назад английский химик Смитсон Теннант дотла сжег алмаз и получил один углекислый газ
Доброго времени суток, дорогие друзья. Продолжая череду статей об алмазах, мы никак не можем не упомянуть о таком интересном аспекте, как химические свойства алмаза. Ведь они действительно необыкновенны и разнообразны.
Начнем с того, что у углерода существует несколько кристаллических модификаций, к каковым относится и алмаз. Также сюда включаем чаоит, графит и лонсдейлит. Как и все свои собратья, алмаз является чистым углеродом, но со своими специфическими особенностями.
Что такое алмаз
Имеющий особое строение алмаз невероятно прочен. Кристаллическая решётка минерала имеет форму куба, внутри и на вершинах которого расположены атомы углерода. Наличие между этими атомами прочной связи и предопределяет строение драгоценного камня: его твёрдость.
Химическая формула алмаза предельно проста. Он практически полностью состоит из углерода. Поэтому формула алмаза – С (углерод). Доля остальных элементов в составе минерала незначительна (поэтому эти элементы не учитываются в формуле). В целом в природе углерода достаточно мало (около 0,15% от общего числа элементов).
Разнообразие сфер применения натурального сырья обусловлено уникальными характеристиками минерала. Использование драгоценных камней распространено:
Состав и физические свойства алмаза обуславливают и применение минерала в сфере телекоммуникаций. Подобное сырье высоко ценится за способность выдерживать резкие перепады температур и напряжения.
Обратите внимание! Химический состав алмаза предопределяет и использование природного сырья в горнодобывающей промышленности: для повышения эффективности бурового долота.
Только 15 % камней, добываемых в мире, в последующем используется для получения бриллиантов из природного сырья. 45 % минералов «условно пригодны» к тому, чтобы подвергать минералы огранке. Оставшееся сырье используется для производственных и промышленных нужд.
Химические свойства и структура вещества
Аллотропные модификации возможны, потому что существуют разные способы гибридизации электронов атома. Углерод состоит из 6 электронов, которые находятся на 2 энергетических уровнях: на первом — 2 S-электрона, на втором — 2 S-электрона и 2 P-электрона. При возбуждении атома происходит перемещение 1 электрона на другой подуровень. Таким образом строение атомов меняется и они приобретают форму тетраэдра.
Если говорить о связях между атомами, то они бывают разными, в зависимости от формы гибридизации. Между собой атомы углерода образуют либо сигма-связи (ковалентные) или пи-связи. Оба варианта связей являются ковалентными, но сигма-связи прочнее.
Алмазы, найденные в природе, могут иметь разную форму и внешний вид, но кристаллическая решетка и химические свойства всегда будут одинаковыми. Кристаллическая решетка выглядит, как тетраэдр, на вершинах которого находятся атомы углерода. Связи между атомами — по типу сигма. Именно этим фактом и обусловлена колоссальная твердость вещества. Атомы в вершинах тетраэдров образуют центры новых тетраэдров. Решетка минерала имеет кубическую симметрию.
А вот графит имеет другое химическое строение решетки. В ней прочные только плоскостные связи, а пространственные соединения между атомами не такие надежные. Это объясняется свободными электронами в атомах. Зато у графита хорошая электропроводность из-за свободных электронов.
Если говорить о решетках, то стоит отметить, что по отношению к алмазам не используется молекулярный тип строения, поскольку в основе вещества лежат именно атомы. Молекула углерода практически не встречается в природе. Она обнаруживается только в фуллеренах, где располагается в виде многогранников. По своей структуре молекула фуллерена напоминает футбольный мяч, сложенный из шестиугольников. На сегодня молекула фуллерена представлена формулами от С60 до С540, где число обозначает количество атомов углерода в молекуле.
Физико-химические свойства
Драгоценный камень отличается:
Ещё одно заслуживающее внимания свойство – большая твердость алмаза (10 единиц по шкале Мооса). Для минерала характерен показатель преломления от 2,417 до 2,421.
Основные химические свойства алмаза приведены ниже:
Стоит пояснить и то, какого цвета бывают алмазы. Цветовая гамма минерала разнообразна. Существуют как бесцветные, так и голубые, зелёные, красные, розовые экземпляры. Распределение окраски может быть пятнистым, неравномерным или зональным. То, какого цвета бывают камни, предопределено и воздействием ультрафиолетовых, катодных и рентгеновских лучей. Под влиянием такого излучения большинство минералов люминесцируют (светятся) розовым, зелёным или голубым оттенками.
Строение вещества
Вся загвоздка и сложность производства заключалась в уникальной структуре алмаза. Между атомами в химии может сформироваться четыре типа связи:
Самая прочная из них — ковалентная связь. Она также имеет свои подвиды: сигма-связи и пи-связи. Второй подвид менее прочный. В алмазе есть несколько миллионов атомов углерода, которые соединены между собой с помощью ковалентных связей.
Пространственное расположение атомов и их соединения называются кристаллической решеткой. Именно ее строение и обусловливает такую характеристику, как твердость вещества. Элементарная ячейка структуры алмаза выглядит как куб. То есть алмаз кристаллизуется в кубической сингонии, если пользоваться научной терминологией.
На вершинах этого куба находится по атому углерода. По одному атому располагается в каждой грани, а еще четыре — внутри куба. Центральные атомы в гранях являются общими для двух ячеек, а те, что находятся в вершинах куба, — общие для восьми ячеек. Между собой атомы соединены ковалентными сигма-связями.
Такая структура и упаковка считается наиболее плотной. Каждый атом углерода располагается в центре тетраэдра и связан по всем сторонам. Поскольку валентность углерода равняется четырем, то все связи оказываются перекрытыми, и взаимодействие с веществом со стороны невозможно.
Расстояние между атомами одинаковое, свободных электронов нет, поэтому минерал является хорошим диэлектриком. Твердость алмаза достигается именно благодаря такому строению. Эти характеристики, в свою очередь, и стали причиной широкого использования камней. Они применяются не только в ювелирном деле, но и в качестве абразива, а также покрытия для инструментов.
Но не все в природе идеально. Даже в алмазах часто встречаются примеси. Такая структура позволяет минералу выглядеть абсолютно прозрачным, без включений. Но добываемые камни не всегда обладают ювелирными свойствами из-за большого количества дефектов и примесей.
Кристалл алмаза может содержать такие вещества:
Иногда в составе встречается вода, углекислота или другие газы. Примеси в кристалле располагаются неравномерно и несколько нарушают кристаллическую структуру. Если дефекты располагаются на периферии, что происходит чаще, тогда с ними можно бороться с помощью огранки.
Основные разновидности
Выделяют перечисленные ниже виды алмазов:
Красные минералы встречаются редко. На тендере, который проводится алмазодобывающей компанией Rio Tinto, выставляется всего несколько таких экземпляров в год. Самые ценные из цветных камней – фиолетовые. Стоимость таких драгоценностей зачастую превышает 1 миллиона долларов за карат.
Чёрные камни заслуживают отдельного внимания. Фактически они являются отходами, образующимися при добыче классических бесцветных минералов. Тем не менее в настоящее время украшения с чёрными бриллиантами охотно приобретают люди, желающие выделиться из толпы, не придерживающиеся общепринятых правил и канонов.
Синтезированные алмазы
Обиходный термин «синтетические
» алмазы не вполне корректен, так как искусственно выращенные алмазы по составу и структуре аналогичны природным (атомы углерода, собранные в кристаллическую решетку), то есть не состоят из синтетических материалов.
Предпосылки и первые попытки
В 1694 году итальянские учёные Джон Аверани и К.-А. Тарджони при попытке сплавить несколько мелких алмазов в один крупный обнаружили, что при сильном нагревании алмаз сгорает, как уголь. В 1772 году Антуан Лавуазье установил, что при сгорании алмаза образуется диоксид углерода[25]. В 1814 году Гемфри Дэви и Майкл Фарадей окончательно доказали, что алмаз является химическим родственником угля и графита.
Открытие натолкнуло учёных на мысль о возможности искусственного создания алмаза. Первая попытка синтеза алмаза была предпринята в 1823 году основателем Харьковского университета Василием Каразиным, который при сухой перегонке древесины при сильном нагреве получил твёрдые кристаллы неизвестного вещества. В 1893 году профессор К. Д. Хрущов при быстром охлаждении расплавленного серебра, насыщенного углеродом, также получил кристаллы, царапавшие стекло и корунд. Его опыт был успешно повторён Анри Муассаном, заменившим серебро на железо. Позже было установлено, что в этих опытах синтезировался не алмаз, а карбид кремния (муассанит), который имеет очень близкие к алмазу свойства[26].
В 1879 году шотландский химик Джеймс Хэнней обнаружил, что при взаимодействии щелочных металлов с органическими соединениями происходит выделение углерода в виде чешуек графита и предположил, что при проведении подобных реакций в условиях высокого давления углерод может кристаллизоваться в форме алмаза. После ряда экспериментов, в которых смесь парафина, костяного масла и лития длительное время выдерживалась в запаянной нагретой до красного каления стальной трубе, ему удалось получить несколько кристаллов, которые после независимого исследования были признаны алмазами. В научном мире его открытие не было признано, так как считалось, что алмаз не может образовываться при столь низких давлениях и температурах[27]. Повторное исследование образцов Хэннея, проведённое в 1943 году с применением рентгеновского анализа, подтвердило, что полученные кристаллы являются алмазами, однако профессор К. Лонсдейл, проводившая анализ, вновь заявила, что эксперименты Хэннея являются мистификацией[28].
Синтез

Изображение синтетических алмазов, полученное на растровом электронном микроскопе
Первым в 1939 году выполнил термодинамический расчёт линии равновесия графит-алмаз Овсей Ильич Лейпунский
[29] — советский физик, что послужило основой синтеза алмаза из графито-металлической смеси в аппаратах высокого давления (АВД). Данный метод искусственного получения алмазов впервые в 1953 году был осуществлён в лаборатории фирмы АСЕА (Швеция), затем в 1954 году в лаборатории американской и в 1960 году — в Институте физики высоких давлений АН СССР (ИФВД) группой исследователей под руководством Леонида Фёдоровича Верещагина. Этот метод применяется во всём мире до сих пор.
В 1961 году, основываясь на научных результатах в синтезе алмазов, полученных в ИФВД, Валентин Николаевич Бакуль в Киеве в ЦКТБ твердосплавного и алмазного инструмента организовал выпуск первых 2000 карат искусственных алмазов; с 1963 года налажен их серийный выпуск[30].
Прямой фазовый переход графит → алмаз зафиксирован при ударно-волновом
нагружении по характерному излому
ударной адиабаты
графита[31]. В 1961 году появились первые публикации о получении алмаза (размер до 100 мкм) методом
ударно-волнового
нагружения с использованием энергии взрыва (в СССР этот метод был реализован в 1975 году в Институте сверхтвёрдых материалов АН Украины[32][33][34]). Известна также технология получения алмазов методом
детонационного
нагружения при взрыве некоторых взрывчаток, например, троти́л, с отрицательным кислородным балансом[35], при котором алмазы образуются непосредственно из продуктов взрыва. Это наиболее дешёвый способ получения алмазов, однако, «детонационные алмазы» очень мелкие (менее 1 мкм) и пригодны лишь для абразивов и напылений[36].
В настоящее время существует крупное промышленное производство синтетических алмазов, которое обеспечивает потребности в абразивных материалах. Для синтеза используется несколько способов. Один из них состоит в использовании системы металл(растворитель) — углерод (графит) при воздействии высоких давлений и температур, создаваемых с помощью прессового оборудования в твёрдосплавных АВД. Алмазы выкристализовываются при охлаждении под давлением из расплава, представляющего собой образующийся при плавлении металло-графитовой шихты перенасыщенный раствор углерода в металле. Синтезируемые таким образом алмазы отделяют от спёка шихты растворением металлической матрицы в смеси кислот. По этой технологии получают алмазные порошки различной зернистости для технических целей, а также монокристаллы ювелирного качества.
Современные способы получения алмазов из газовой фазы и плазмы, в основе которых лежат пионерские работы коллектива научных сотрудников Института физической химии АН СССР (Дерягин Б. В., Федосеев Д. В., Спицын Б. В.)[37], используют[38] газовую среду, состоящую из 95 % водорода и 5 % углеродсодержащего газа (пропана, ацетилена), а также высокочастотную плазму, сконцентрированную на подложке, где образуется сам алмаз (см. CVD-процесс). Температура газа от +700…850 °C при давлении в тридцать раз меньше атмосферного. В зависимости от технологии синтеза, скорость роста алмазов от 7 до 180 мкм/ч на подложке. При этом алмаз осаждается на подложке из металла или керамики при условиях, которые в общем стабилизируют не алмазную (sp3), а графитную (sp2) форму углерода. Стабилизация алмаза объясняется в первую очередь кинетикой процессов на поверхности подложки. Принципиальным условием для осаждения алмаза является возможности подложки образовывать стабильные карбиды (в том числе и при температурах осаждения алмаза: между +700 °C и +900 °C). Так, например, осаждение алмаза возможно на подложках из Si, W, Cr и невозможно (напрямую, либо только с промежуточными слоями) на подложках из Fe, Co, Ni.
Как выглядят камни
Существует классификация минералов, согласно которой выделяют:
Стоит рассказать, наличие каких ещё минералов предусмотрено в природе. Карбонадо представляет собой разноцветные кристаллы, окрашенные в серый или чёрный оттенок. У такого природного сырья крупнозернистое или плотное строение.
Выделяют и якутит. По своим характеристикам камень является тёмным минералом с небольшими включениями и серебристым отблеском на поверхности.
Ссылки
Лечебные свойства камня
По мнению лиготерапевтов, минерал способствует активному обновлению клеток организма. Во многих учениях его применяется как омолаживающее средство.
При помощи минерала лечат:
В прежние времена горные воины носили перстни, декорированные бриллиантом. Считалось, что такие украшения придают силу духа, делают человека мужественным и непобедимым. Драгоценный камень оберегает от скверных поступков. Такой талисман приносит искреннее счастье владельцу.
Тонкости ухода
Несмотря на особую структуру алмаза, украшения с бриллиантами стоит оберегать от ударов и механического воздействия. В домашних условиях украшения регулярно моют в тёплом мыльном растворе. Украшения с бриллиантами оставляют в таком средстве на 20 минут. По истечении указанного времени изделия чистят мягкой тряпочкой. После этого украшения промывают в прохладной чистой воде.
Бриллианты хранят в плотно закрывающихся шкатулках, бархатных мешочками. При этом драгоценные камни не должны царапаться друг об друга.
Есть различные способы получения драгоценных камней. Набор украшений с дорогими бриллиантами указывает на богатство женщины, высокий статус в обществе. Представительницам женского пола стоит узнать всё про алмаз в плане его магических свойств. К примеру, кольцо с бриллиантом способствует активному раскрытию творческого потенциала.