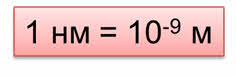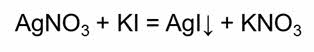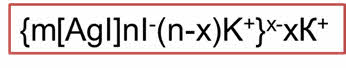какие бывают формы дисперсной системы
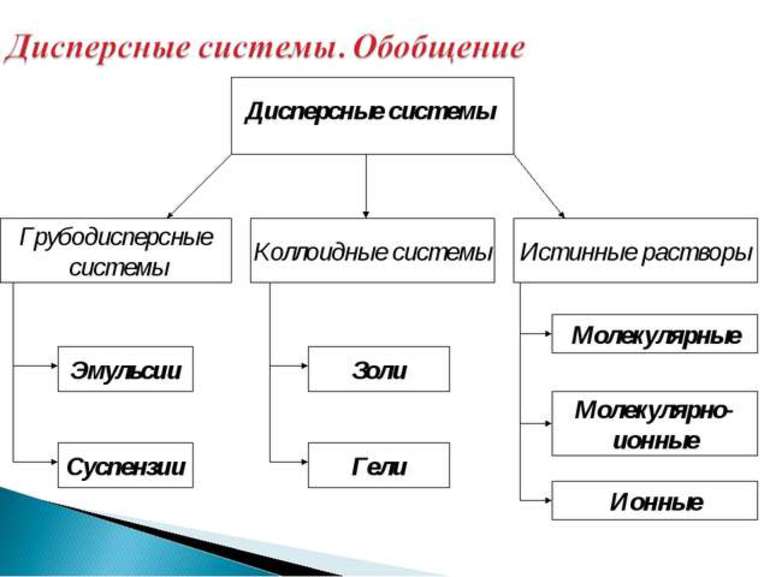
Классификация дисперсных систем
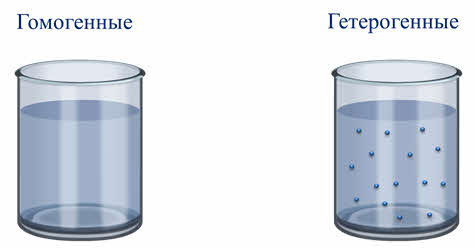
Дисперсные системы — это гетерогенные смеси двух и более составных частей, с высокоразвитой поверхностью раздела между ними.
Отличительная особенность дисперсных систем заключена в малом размере частиц при наличии значительной межфазной поверхности. Поэтому, наибольшее значение имеют свойства поверхности и происходящие на ней процессы, а не свойства частиц в целом.
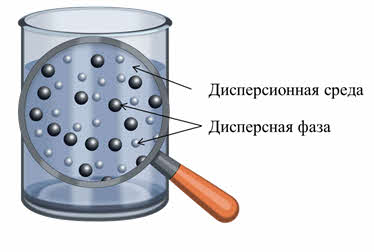
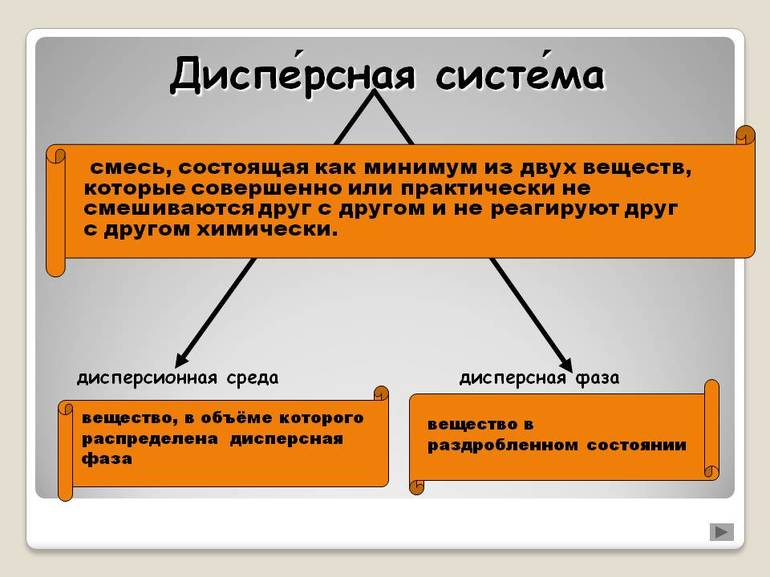
Итак, такие системы состоят из двух и более фаз, одна из которых находится в мелкораздробленном состоянии (дисперсная фаза) в среде другой фазы (дисперсионная среда).
Классификация дисперсных систем разнообразна:
По агрегатному состоянию дисперсной фазы и дисперсионной среды
Для удобства, дисперсные системы принято условно обозначать через дробь, где в числителе указывают агрегатное состояние дисперсной фазы, а в числителе – дисперсионной среды:
| Дисперсная фаза | Дисперсионная среда | Условное обозначение | Название |
| Газ | Газ | Г/Г | Дисперсные системы не образуются |
| Газ | Жидкость | Г/Ж | Газовые эмульсии |
| Газ | Твердое вещество | Г/Т | Пористые тела |
| Жидкость | Газ | Ж/Г | Аэрозоли |
| Жидкость | Жидкость | Ж/Ж | Эмульсии |
| Жидкость | Твердое вещество | Ж/Т | Капиллярные системы |
| Твердое вещество | Газ | Т/Г | Порошки, пыли |
| Твердое вещество | Жидкость | Т/Ж | Суспензии и золи |
| Твердое вещество | Твердое вещество | Т/Т | Твердые гетерогенные системы |
По кинетическим свойствам дисперсной фазы
По наличию взаимодействия частиц дисперсной фазы с молекулами дисперсионной среды
— лиофильные – значительное взаимодействие частиц дисперсной фазы с молекулами дисперсионной среды. К ним могут относиться как природные, так и синтетические высокомолекулярные вещества.
— лиофобные – слабое взаимодействие частиц дисперсной фазы с молекулами дисперсионной среды. Это коллоидные растворы металлов, их оксидов, гидроксидов и солей.
По размеру частиц дисперсной фазы
-Грубодисперсные – размер частиц > 10 мкм;
-Среднедисперсные – размер частиц от 0,1 до 10 мкм;
-Высокодисперсные – размер частиц от 1 до 100 нм;
-Наноразмерные – размер частиц от 1 до 10 нм.
Предметом изучения коллоидной химии являются высокодисперсные или коллоидные системы (10-9-10-7 м).
Коллоидные системы
Коллоидные системы — это гетерогенные системы, в которых дисперсная фаза отделена от дисперсионной среды поверхностью раздела. При условии, что дисперсионная среда является жидкостью, а дисперсная фаза – твёрдым веществом, коллоидную систему называют золем; если дисперсная фаза является жидкостью, то коллоидную систему называют эмульсией.
Наиболее значимы коллоидные системы, в которых в качестве дисперсионной среды выступает вода. Они делятся на гидрофильные и гидрофобные коллоиды.
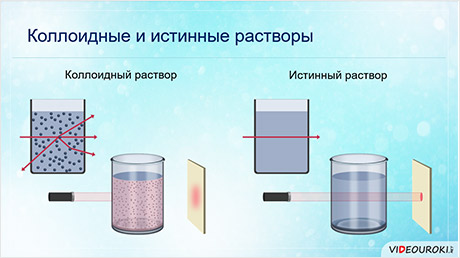
Гидрофильные коллоиды похожи на истинные растворы, которые являются однородными, гомогенными.
Гидрофобные коллоиды можно получить, если только они каким-то образом стабилизируются. Гидрофобные коллоиды можно стабилизировать при помощи адсорбции ионов на их поверхности. Адсорбированные ионы стабилизируют коллоид, взаимодействуя с водой. Укрупнение частиц и их слипание не происходит вследствие отталкивания частиц с адсорбированными на них ионов с одинаковым зарядом.
Гидрофобные коллоиды могут также стабилизироваться в присутствии других гидрофильных групп. Например, масло гидрофобно, и капельки масла, при смешивании с водой, отделяются от нее. При этом на поверхности воды образуется масляное пятно. Но такую систему можно стабилизировать, добавив в нее, например, стеарат натрия или другие поверхностно-активные вещества (ПАВ):
Молекула стеарата натрия состоит из двух частей: одна часть полярная или заряженая (гидрофильная), другая часть — неполярная (гидрофобная). При добавлении его к маслу, гидрофильные концы взаимодействуют с водой, а гидрофобные – с маслом.
Дисперсные системы
Урок 18. Химия 11 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Дисперсные системы»
Холодный утренний туман, столб дыма над костром, взвешенные частицы в воде рек и озёр – это дисперсные системы. Они состоят из вещества в мелкораздробленном состоянии – дисперсной фазы и среды, в которой эта фаза распределена и называется дисперсионной средой.
Дисперсные системы бывают газовыми, жидкими и твёрдыми.
При смешивании одних веществ с водой образуются однородные, или гомогенные системы, а при смешивании других – неоднородные, или гетэрогенные.
По степени дисперсности, то есть по величине частиц, распределённых в дисперсионной среде, различают грубодисперсные системы, как суспензии и эмульсии и тонкодисперсные системы.
Измеряется размер частиц в нанометрах. Один нанометр равен десять в минус девятой степени метру.
Так частицы в грубодисперсных системах хорошо видны в микроскоп, их средний размер более десяти в шестой степени метра. Например, грубодисперсной системой является молоко.
Оно представляет собой эмульсию капелек жира в жидкости. Грубодисперсные системы неустойчивы и со временем дисперсная фаза отделяется от дисперсионной среды.
В тонко или высокодисперсных системах, которые ещё называют коллоидными системами размер частиц от одного микрометра до одного нанометра.
Классификация дисперсных систем.
Суспензии или взвеси представляют собой находящиеся в жидкой среде мелкие частицы твёрдого вещества. Примером может служить смесь глины с водой. Мутные частицы здесь видны невооружённым глазом. Они легко осаждаются, задерживаются любыми фильтрами, размер этих твёрдых частиц около ста нанометров. То есть в суспензиях дисперсной фазой являются твёрдые вещества.
Какао – также пример суспензии, эта смесь кажется гомогенной, но в конце концов она разделяется. То есть в суспензиях частицы находятся во взвешенном состоянии, и со временем распределяются вниз или вверх, в зависимости от самих частиц. Примером суспензий являются также цементный раствор, бетон и другие.
Эмульсии – это смесь в жидкой среде мелких капелек другой жидкости. Например, смесь масла с водой. В эмульсии мутные отдельные частицы видны невооружённым глазом, они также легко осаждаются, задерживаются обычными фильтрами, размер частиц также около ста нанометров.
Таким образом, эмульсии – это системы, состоящие из двух несмешивающихся жидкостей. Они широко распространены в природе: сырая нефть, млечный сок растений.
Облака, туманы и дым представляют собой аэрозоли. Аэрозоли нашли широкое применение – это топливо в двигателях внутреннего сгорания.
Туман образуется при выпускании в воздух содержимого аэрозольных баллончиков. Дым образуется не только при горении топлива, но и при химических реакциях. Например, при взаимодействии хлороводорода с аммиаком.
Если дисперсионная среда – жидкость, а дисперсная фаза – газ, то образуется система, называемая пеной. Устойчивость пен зависит от прочности плёнок, разделённых пузырьками газа.
Жидкие пены – это мыльная, пивная, квасная пены. При затвердевании плёнок образуются устойчивые твёрдые пены – пемза, вулканический туф. К твёрдым пенам относится также пенопласт, поролон, микропористая резина. Банная губка является дисперсной системой с двумя взаимопроникающими дисперсионными средами. В виде дисперсных систем с жидкой дисперсной фазой и твёрдой дисперсионной средой выпускают некоторые лекарственные средства. Устойчивость пены применяется и при тушении пожаров.
По размерам частиц промежуточное положение между взвесями и истинными растворами занимают коллоидные растворы – золи.
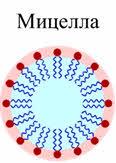
Коллоидные частицы очень малы, но могут состоять из сотен и тысяч молекул. Коллоидные частицы называются мицэллами.
Так, коллоидный раствор йодида серебра можно получить при взаимодействии разбавленных растворов нитрата серебра и йодида калия.
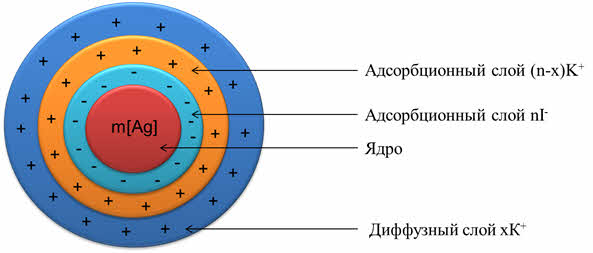
Нерастворимые молекулы йодида серебра образуют ядро коллоидной частицы.
Само вещество ядра нерастворимо в дисперсионной среде и состоит из нейтральных молекул или атомов. В нашем примере ядро коллоидной системы – микрокристаллик йодида серебра, который состоит из множества молекул. Это ядро адсорбирует на своей поверхности ионы, которые находятся в растворе (это ионы серебра и ионы йода). Ядро с таким адсорбционным слоем называется гранулой. Оставшаяся часть ионов образует диффузный слой ионов. Ядро с адсорбционным и диффузным слоями представляет собой мицэллу.
Коллоидные растворы – это смеси, в которых прозрачные отдельные частицы обнаруживаются только при помощи ультрамикроскопа. Эти частицы с трудом осаждаются в течение продолжительного времени и задерживаются только ультрафильтрами. Размер этих частиц приблизительно от одного до ста нанометров.
То есть, коллоиды – разновидность гомогенных систем. В этих смесях частицы настолько малы, что находятся во взвешенном состоянии. Примерами коллоидов является яичный белок, плазма крови.
Укрупнение коллоидных частиц называется коагуляцией. Некоторые коллоидные растворы при коагуляции образуют гели, или студни. Примерами студней являются желе, мармелад, мясной студень, простокваша.
Истинные растворы – это смеси, где прозрачные отдельные частицы нельзя обнаружить даже при помощи ультрамикроскопа, они не осаждаются и фильтрами не задерживаются. Размер этих частиц меньше одного нанометра.
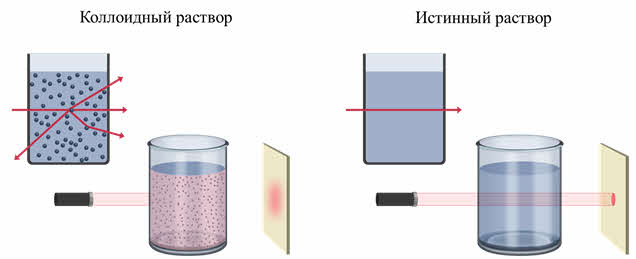
Сходство коллоидов и истинных растворов заключается в их прозрачности. При этом, пропущенный луч света через коллоид даёт светящийся конус, а истинный раствор не даёт. То есть, если на осветлённый коллоидный раствор посмотреть сбоку, то путь луча будет виден, как светлая дорожка, которая образуется в результате рассеивания света частицами. А в истинном растворе луч света не виден, так как молекулы слишком малы и не рассеивают свет.
Вещества в коллоидном состоянии являются основой жизни на земле. Это протоплазма любой живой клетки, представляющая собой сложную коллоидную систему. Мышечная ткань, хрящи, клетки тканей растений, эритроциты – разновидности студней. Коллоиды почвы играют значительную роль в корневом питании растений.
Вещества в коллоидном состоянии принимают участие в образовании многих минералов: агата, малахита, мрамора.
Некоторые драгоценные камни – жемчуг – представляют собой коллоидную систему, где дисперсионной средой является твёрдый карбонат кальция, а дисперсной фазой – капельки воды. Окраска драгоценных камней: рубина, изумруда, сапфира зависит от содержания в них небольших золей металлов.
Ещё в глубокой древности человек использовал коллоидные процессы: египтяне забивали в щели скал деревянные клинья, поливали их водой, древесина набухала, создавалось огромное давление, которое приводило к разрушению твёрдой породы.
Процессы коагуляции коллоидов применяют для очистки природной воды. Так, в бассейн-отстойник добавляют электролит, и коллоиды осаждаются в виде хлопьев, а они задерживаются песчаными фильтрами.
Мели и наносы в устьях образуются под действием воды, которая приводит к коагуляции частиц, находящихся в реке.
С коллоидными процессами связаны важнейшие отрасли промышленности: производство искусственных волокон, различных клеящих веществ, синтетического каучука. Коллоидные растворы используются в мыловарении, бумажной промышленности, в фармацевтическом производстве.
Адсорбционные свойства коллоидных частиц положены в основу процесса обогащения руд. Важнейшие пищевые продукты: простокваша, кефир, творог, желе, джем – это коллоидные системы – студни. Студни обладают некоторыми свойствами твёрдого тела: они легко режутся, сохраняют первоначальную форму.
Бумага, сплавы металлов, цветные стёкла, пластмассы, натуральные и искусственные ткани содержат вещества в коллоидном состоянии.
Дисперсная система – таблица с примерами, названиями и видами
Чистое вещество в природе встречается довольно редко. Большинство из них не являются гомогенными, а состоят из смеси различных атомов и молекул. В статье мы поговорим о том, как вещества могут быть распределены в другом веществе и, при этом не смешиваться, дадим определение этому явлению.
Что это такое дисперсная система?
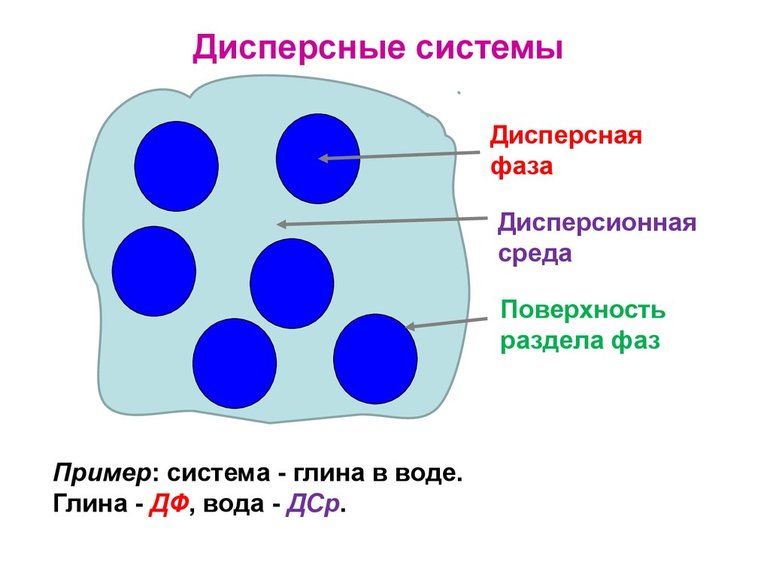
Дисперсная система – это гетерогенная структура, где мельчайшие частицы одного вещества равномерно распределены в другом веществе, при этом они не смешиваются и не контактируют химически. Компонент, который занимает больший объем, имеет название «среда». Компонент, имеющий меньший объем обозначается термином «дисперсная фаза». Частицы фазы и среда имеют между собой поверхность раздела. Именно поэтому дисперсные системы являются неоднородными, то есть гетерогенными.
Рис. 1. Структура системы: дисперсная фаза, дисперсионная среда.
Дисперсными называются частицы размером от 1 нм до 10 мкм.
Дисперсные системы (фазы и дисперсные частицы) могут иметь любое агрегатное состояние: жидкое, твердое, газообразное. Окружающий нас мир состоит из множества дисперсных систем. Примером может служить почва, морская вода, продукты и многое другое.
В дисперсной системе фаз может быть больше двух. В таком случае отделяют их друг от друга с помощью сепарирования, центрифугирования.
Рис. 2. Центрифугирование.
Классификация дисперсных систем
Как известно, дисперсные системы могут находится в трех агрегатных состояниях. Сочетания этих состояний позволяют выделить 9 видов двухфазных дисперсных систем (3 агрегатных состояния фаз и три агрегатных состояния среды). Рассмотрим таблицу «Дисперсная система»:
| Виды дисперсной системы | Дисперсная фаза | Дисперсионная среда | Название и пример |
| газ в газе | газообразная | газообразная | дисперсные системы не образуются |
| жидкость в газе | жидкая | газообразная | аэрозоли: туманы, облака |
| твердое тело в газе | твердая | газообразная | аэрозоли: пыль, дым |
| газ в жидкости | газообразная | жидкая | газовые эмульсии, пены |
| жидкость в жидкости | жидкая | жидкая | эмульсии: нефть, молоко |
| твердое тело в жидкости | твердая | жидкая | суспензии, золи: ил, взвесь |
| газ в твердом веществе | газообразная | твердая | пористые тела: пемза |
| жидкость в твердом веществе | жидкая | твердая | капилярные системы: грунт, почва |
| твердое вещество в твердом веществе | твердая | твердая | сплавы, бетон, композиционные материалы |
По наличию или отсутствию взаимодействия между частицами дисперсной фазы можно выделить два вида дисперсных систем:
Рис. 3. Определение золи.
Что мы узнали?
Дисперсная система – гетерогенная среда, состоящая из двух или более фаз и дисперсионной среды. Системы могут существовать во всех трех агрегатных состояниях. Благодаря этому формируются 9 видов двухфазных дисперсных систем.
Понятие и определение
Дисперсные системы представляют собой гетерогенные структуры, внутри которых одно или более веществ распределяются в другом. Они никак не контактируют друг с другом, химические или иные реакции полностью отсутствуют. Нет и смешения. Фактически каждый элемент является самостоятельным, и если его извлечь, он сохраняет свое изначальное состояние.
То вещество, которого больше всего в соединении, называется дисперсной средой, второстепенное — фазой. Частицы между собой не взаимодействуют, даже имеется некая прослойка, которая разделяет их. Поэтому системы являются гетерогенными или неоднородными.
Примеры дисперсных систем встречаются в природе постоянно — морская вода, почва, большинство продуктов питания и т. д. Они могут иметь любое агрегатное состояние. Иногда в среде находится сразу несколько фаз. Тогда их выделяют с помощью центрифуги или методом сепарирования.
Классификация по агрегатному состоянию
Классификация дисперсных систем осуществляется в соответствии с агрегатными состояниями вещества. Их имеется три вида: жидкое, твердое и газообразное. Поэтому разделение происходит на 9 основных категорий, примеры и описание которых можно посмотреть в таблице ниже.
| Вид | Среда | Фаза | Пример |
| Газ х 2 | Газ | Газ | Отсутствуют |
| Жидкость+газ | Газ | Жидкость | Туман, облако |
| Твердое тело (далее ТТ)+газ | Газ | ТТ | Дым, пыль |
| Газ+жидкость | Жидкость | Газ | Любая пена |
| Жидкость х 2 | Жидкость | Жидкость | Молоко |
| ТТ+жидкость | Жидкость | ТТ | Известь, ил |
| Газ+ТТ | ТТ | Газ | Пемза |
| Жидкость+твердое тело | ТТ | Жидкость | Грунт |
| ТТ+ТТ | ТТ | ТТ | Любые композиционные материалы, такие как бетон или цемент |
Каждый тип классификации, в свою очередь, имеет свое название. К примеру, газообразные соединения называются преимущественно аэрозолями, за редким исключением. Жидкие вещества — газовые эмульсии или суспензии. Взаимодействия, когда средой является твердое тело, определяются, как сплавы, капиллярные системы или пористые субстанции.
Существующие виды
Фазные частицы могут взаимодействовать между собой. При этом среда остается стабильной, химические реакции с ней отсутствуют. В зависимости от типа интерактивности, формируются виды дисперсных систем:
Некоторые субстанции могут быть одновременно двумя видами. Отдельные золи при нормальной температуре являются достаточно текучими, чтобы определить их, как свободнодисперсные. Однако, если градус уменьшается, молекулы соединяются друг с другом сильнее, приобретая характеристики твердого тела. Поэтому переходят в связнодисперсную форму.
Взвеси и их особенности
Те дисперсные системы, фазы в которых можно легко определить невооруженным глазом, называются взвесями. Их характерная черта — непрозрачность. Если необходимо отделить среду и второстепенное вещество, можно воспользоваться рядовыми фильтрами, или процедурой отстаивания. Категорию разделяют на несколько видов:
Взвеси важны в деятельности человека, равно как природных процессах. Почти все производство построено на применении растворов (удобрения, металлы, бумага и пр.). В окружающем мире естественные соединения с водой тоже встречаются постоянно, например, почвообразование или насыщение грунта полезными веществами. В жизнедеятельности всех живых существ они тоже принимают непосредственное участие.
Коллоидные системы
В отличие от взвесей, коллоидные системы невозможно разделить без использования современной техники или специальных препаратов. Без нужного инструмента и невооруженным глазом они выглядят, как однородная субстанция. Из-за этого определить дисперсность становится сложно. Подразделяются на два типа:
Если взвеси играют большую роль в природных процессах, то коллоидные системы являются неотъемлемой частью химии. Чаще всего они добываются посредством смешивания в специальном оборудовании. Без подобной структуры не удалось бы создать множество лекарственных препаратов, удобрений и других полезных материалов.
Высокомолекулярные вещества
Растворы высокомолекулярных веществ бывают двух видов: истинные и коллоидные. Все зависит от разных качеств, таких как тип фазы, среды, температуры и иных условий. У них есть ряд свойств:
Отдельные полимерные растворы образуются самопроизвольно. Когда процесс набухания образуется неорганическим способом, дисперсная система перестает существовать, поскольку фаза полностью растворяется в среде, образуется химическая реакция. Если же он органический, то появляется студень.
Ключевые свойства
Свойства дисперсных систем определяются по одному основному фактору — при их возникновении образуется четкая межфазная граница. Также появляется некоторое значение поверхностной энергии, которая не комбинируется, рассматривается в отдельном порядке по отношению к среде и фазе.
В природе и продуктах жизнедеятельности человека встречаются грубодисперсные системы. Здесь фазу и среду легко можно отличить под стандартным микроскопом, а то и вовсе невооруженным глазом. Но если рассматривать ее в целом, то она представляет собой сложную совокупность коллоидных веществ.
В свою очередь, тонкодисперсные системы являются настолько мелкими, что рассмотреть их можно только в специальный ультразвуковой микроскоп. В некоторых случаях даже при направленном в жидкость луче не появляется характерной «дорожки». Несмотря на существенные различия, свойства везде одинаковы. Они зависят от таких показателей, как:
В жизни человека рассматриваемые системы встречаются постоянно. Такое явление может быть как природным и естественным, так и выводимым в искусственном виде. Многочисленные лекарственные смеси, различные минеральные или химические удобрения, а также производственные процессы построены на дисперсности.