катализатор ускоряет химическую реакцию за счет
Виды и особенности катализаторов химических реакций
Химическая реакция – это процесс превращения реагентов в продукты реакции. Многие превращения в химии имеют очень долгий срок протекания, что абсолютно недопустимо для промышленности или для организма человека. Колоссальное ускорение превращений как в промышленности, так и в живых организмах, обеспечивают катализаторы химических реакций. Рассмотрим этот вопрос подробнее.
Что такое катализатор реакции?
Речь идет о веществе, которое способно ускорять протекание превращения многократно. Процесс в химии, протекающий в присутствии ускорителей превращений, называется катализом. Катализ характеризуется тем, что вещество, ускоряющее химический процесс, не расходует в ходе протекания последнего, а также не входит в состав конечных продуктов.
Катализ по своему результату может быть двух видов: положительный и отрицательный. Положительный катализ приводит к увеличению скорости превращения. Отрицательный катализ приводит к замедлению или прекращению протекания химического превращения. Вещества, реализующие, отрицательный катализ называются ингибиторами.
Разновидности веществ, ускоряющих химические реакции
Существуют две общепризнанных классификации веществ, которые ускоряют протекания превращений в химии. Первая основывается на агрегатном состоянии катализатора, вторая – на происхождении.
Классификация по агрегатному состоянию
По агрегатному состоянию вещества каталитические соединения можно подразделить на гомогенные и гетерогенные. Гомогенные вещества, ускоряющие химическую реакцию, находятся в одной фазе с реагентами. Гетерогенные вещества, ускоряющие химическое превращение, находятся в разных фаза с реагентами (например, катализатор представлен жидкость, а реагенты – газами).
Свойства гомогенных ускорителей реакции
К данной группе соединений относятся кислоты и основания. Например, серная кислота ускоряет протекание превращение органических субстратов. Основными свойствами гомогенных соединений являются:
Свойства гетерогенных ускорителей реакции
К данной группе соединений относятся оксиды большинства металлов (Al2O3, CaO, BaO, MgO, TiO2), а также алюмосиликаты и цеолиты. Обозначим основные свойства гетерогенных каталитических веществ:
Классификация по происхождению
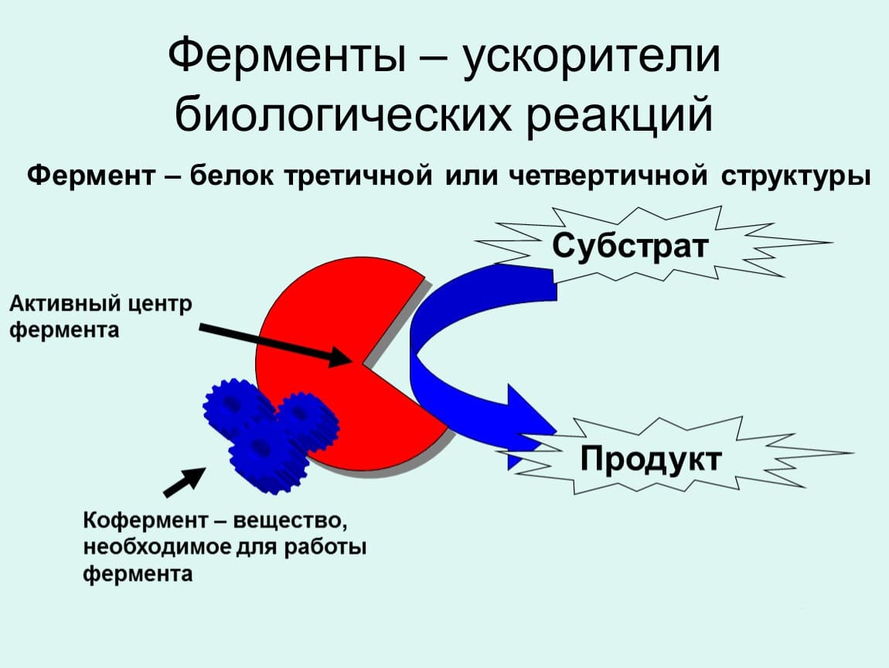
По происхождению вещества, ускоряющие процесс протекания превращений в химии, подразделяются на органические и неорганические. Неорганические соединения в основном представлены тяжелыми металлами (свинец, палладий), спектр органический соединений намного шире. Основными представителями органических ускорителей превращений являются энзимы (соединения биологического происхождения). Энзимы – это катализаторы, увеличивающие скорость химических реакций в живых организмах. Ферменты (энзимы) имеют следующие особенности:
Свойства катализаторов
Каталитические вещества, ускоряющие протекание реакций в химии, имеют определенные свойства. Обозначим их:
Другие свойства каталитические соединений связаны с их строением и физическими параметрами:
Каталитические системы на основе катализаторов
Современные промышленные каталитические смеси состоят из нескольких компонентов:
Промотор
Добавление промоторов к каталитическому соединению улучшает следующие свойства последних: активность, избирательность и стабильность в системе. Сам по себе промотор может являться соединением, которое не участвует в протекающем процессе. По своему назначению активаторы подразделяются на две большие группы:
Также промоторы подразделены на две большие группы структурообразующие (инертные соединения, предотвращающие слипание частиц) и активирующие (изменяют электронную конфигурацию каталитического соединения в активную фазу катализа).
Носитель
Носитель представляет собой материю, на которую различными методами укладывают катализатор. При использовании носителя увеличивается площадь поверхности действия каталитического соединения, повышается его термостойкость. Благодаря использованию носителей возможна экономия в промышленных условиях достаточно дорогих каталитических элементов (палладий, никель, платина, серебро). Однако стоит отметь, что носитель также может положительно влиять на активность каталитического соединения, поэтому нельзя провести четкую границу между этими двумя понятиями. Носителями могут быть оксид алюминия, силикагель, пемза, каолин, асбест, алюмосиликаты и другие вещества.
Катализатор ускоряет химическую реакцию за счет
Каталитические реакции весьма распространены в химии и некоторые из них можно провести даже в домашних условиях. Например, 3%-ный раствор перекиси водорода (именно такой продают в аптеках) вполне устойчив в отсутствие примесей. Но при добавлении очень небольшого количества (нескольких крупинок) твердого диоксида марганца MnO2 начинается реакция разложения Н2О2 с выделением газообразного кислорода:
В качестве катализаторов часто выступают обычные кислоты, основания, оксиды металлов или сами металлы. Но бывают и сложные катализаторы, поиск и приготовление которых требуют большого труда.
Катализаторами называются вещества, способные ускорять химические реакции, сами оставаясь при этом неизменными.
Еще одно важное свойство катализаторов заключается в способности повышать избирательность протекания реакций. Если какие-то реагенты могут реагировать между собой по разным направлениям (то есть давать несколько различных продуктов), то с участием катализаторов во многих случаях образуется только какой-то один продукт реакции. Избирательное протекание реакции называется селективностью. Таким образом, главные полезные свойства катализаторов заключаются в повышении скорости и селективности химических реакций.
Рис. 9-12. В присутствии катализатора Al2O3 реакция разложения этанола протекает по пути с меньшей энергией активации Еа, чем без катализатора. Тепловой эффект реакции при этом не меняется. Подобная закономерность характерна не только для эндотермических, но и для экзотермических реакций.
Как же работают катализаторы? Ответ на этот вопрос известен далеко не всегда. Однако в ряде случаев каталитические превращения изучены хорошо и химикам понятен механизм этих реакций. Термин «механизм реакции» раньше нам не встречался, поэтому необходимо объяснить его значение. Выяснение механизма реакции – это установление строения короткоживущих промежуточных частиц, возникающих на пути от реагентов к продуктам реакции. Такие неустойчивые промежуточные вещества часто невозможно выделить, но они могут быть изучены косвенными методами. Именно от строения и устойчивости (или неустойчивости) промежуточных частиц зависит скорость любой реакции и выбор того или иного её направления.
Например, использование серной кислоты H2SO4 в качестве гомогенного катализатора позволяет получать этилен из этанола уже при 170 о С. Это говорит о еще более значительном снижении энергии активации и ускорении реакции:
Реакцию проводят в растворе. Катализатором здесь является даже не сама серная кислота, а образующиеся при ее диссоциации ионы водорода Н + (первая строчка в приведенной ниже схеме):
Разрыв связи С-О в этаноле происходит с образованием двух частиц, из которых неустойчива только одна (карбокатион), а вторая (Н2О), напротив, очень устойчива. Это приводит к общему снижению энергии активации по сравнению с реакцией без катализатора, где разрыв связи С-О происходит, вероятно, с образованием гораздо более неустойчивых частиц.
Вы можете посмотреть видеозапись этого опыта из Единой коллекции цифровых образовательных ресурсов на school-collection.edu.ru: ПОСМОТРЕТЬ информацию о ресурсе и перейти к видеоопыту (файл 23 Мб).
** Эта реакция называется реакцией дегидрирования (отщепления водорода). Она такая же эндотермическая, как и реакция дегидратации (отщепления воды). Однако при каталитическом дегидрировании, по сравнению с реакцией без катализатора, возникает новый, весьма важный фактор: выделяющийся в реакции водород тут же окисляется на меди кислородом воздуха с выделением большого количества теплоты. Это приводит к тому, что суммарный тепловой эффект всей последовательности реакций оказывается экзотермическим. Избыточной теплоты выделяется так много, что медная спираль (катализатор) в ходе реакции раскаляется.
Вы можете посмотреть видеозапись этого опыта из Единой коллекции цифровых образовательных ресурсов на school-collection.edu.ru: ПОСМОТРЕТЬ информацию о ресурсе и перейти к видеоопыту (файл 16 Мб).
Если механизмы многих гомогенных каталитических реакций с участием кислот (кислотный катализ) или оснований (основной катализ) хорошо изучены, то о гетерогенном катализе этого сказать нельзя. Однако некоторые его закономерности все же известны.
Во-первых, в гетерогенном катализе большую роль играет адсорбция, то есть концентрирование веществ на поверхности раздела между ними. Например, адсорбция молекул газа происходит на поверхности твердого пористого катализатора. Благодаря адсорбции на поверхности катализатора растет концентрация реагирующих частиц, что уже само по себе может приводить к ускорению реакции. Поэтому важным фактором в гетерогенном катализе является площадь поверхности катализатора, его пористость. Чем больше поверхность, тем выше каталитическая активность твердого катализатора. Количество взятого катализатора тоже влияет на скорость реакции.
В этих реакциях образуются цис-алкены. Геометрическое строение продуктов реакции позволяет предположить, что молекула водорода присоединяется к алкину с поверхности катализатора. Если бы это было не так, то образовывался бы более устойчивый транс-алкен:
Еще одна особенность гетерогенного катализа заключается в том, что около поверхности работающего катализатора всегда концентрируются как исходные вещества, так и продукты реакции. Если продукты адсорбируются на катализаторе слишком прочно, то они плохо вытесняются с поверхности и катализатор постепенно теряет активность. В этом случае говорят, что катализатор отравляется продуктами реакции. Однако во многих случаях каталитическими ядами являются даже не продукты реакции, а различные примеси в исходных веществах. Например, для платиновых катализаторов такими каталитическими ядами являются примеси HCN, H2S, соединений As, Se, Te.
Наибольшее применение гетерогенный катализ находит в промышленном производстве органических веществ. Однако не менее необходим он и при получении таких важных неорганических продуктов, как аммиак NH3 и оксид серы SO3 (последний нужен для производства серной кислоты).
В синтезе аммиака применяется не чисто железный катализатор, а с добавками оксидов Al2O3 и K2O. Эти оксиды служат промоторами.
В производстве серной кислоты для получения SO3 раньше в качестве катализатора использовали металлическую платину. На современных сернокислотных заводах работают значительно более дешевые ванадиевые катализаторы (V2O5) с добавками SiO2 и K2О.
В более короткой форме реакцию получения полиэтилена можно выразить уравнением:
Индекс n в формуле полимера называется степенью полимеризации (значение n может достигать десятков тысяч). В результате происходящей сшивки молекул этилена образуются длинные макромолекулы полиэтилена с молекулярной массой от 30000 до 800000 в зависимости от условий реакции. На конце каждой такой гигантской молекулы имеется «пришитый» к ней инициатор, однако его содержание в общей массе полиэтилена ничтожно мало.
В одном параграфе невозможно рассмотреть все многообразие каталитических реакций, известных в неорганической и органической химии, в биохимии (ферментативный катализ), в технике (автомобильные катализаторы дожигания выхлопных газов) и т.д. Здесь мы ставили задачу разобраться лишь в некоторых ключевых вопросах, а именно:
Рекомендуем читателю еще раз вернуться к этим вопросам и ответить на них самостоятельно для закрепления пройденного материала.
Катализаторы
Примерно 90% объема современного химического производства основано на каталитических процессах.
Гидроочистка является наиболее крупнотоннажным каталитическим процессом в нефтепереработке.
В процессе гидроочистки понижается содержание серы в топливе.
Эффективность гидроочистки зависит от активности катализаторов, температурного режима и качества сырья.
И повышение эффективности процесса требует использования новых типов катализаторов.
Требования к катализаторам:
Селективность изменяется из-за изменения электронных свойств и окружения активных центров катализатора (эффект лиганда).
В реакциях сложных органических молекул большое значение имеет преимущественное образование продукта, близкого по своей форме и размерам к размерам микропор катализатора.
В сложных многостадийных реакциях применяют многофазные многокомпонентные катализаторы, селективность которых выше благодаря тому, что каждая стадия сложной реакции ускоряется своим компонентом катализатора. Селективность катализатора зависит также от его пористости, размера зерен и характера их укладки.
Термостойкость катализаторов важна для первых по ходу реагента слоев катализаторов в экзотермических реакциях, когда выделение тепла может вызвать рекристаллизацию и дезактивацию катализаторов.
Для предотвращения рекристаллизации катализаторы наносят на термостойкие носители.
Устойчивость катализатора к действию ядов каталитических определяется спецификой их взаимодействия с катализатором.
Металлические катализаторы отравляются соединениями кислорода (Н2О, СО), серы (H2S, CS2 и др.), N, Р, As и другими веществами, образующими более прочную химическую связь с катализатором, чем реагирующие вещества.
На оксидные катализаторы действуют те же яды, однако оксиды более устойчивы к отравлению.
В процессах крекинга, риформинга и других реакций углеводородов катализаторы отравляются в результате покрытия их слоем кокса.
Кроме того, катализаторы могут дезактивироваться из-за механического покрытия поверхности пылью, которая вносится извне или образуется при катализе.
Приготовление катализаторов
Катализаторы с развитой удельной поверхностью распространение получил метод осаждения из водных растворов солей с последующим прокаливанием образующихся соединений.
Так получают многие оксиды металлов. При этом лучше использовать водный раствор NH3, потому что отпадает необходимость отмывки осадка от щелочных металлов.
Охлажденный катализатор дробят, просеивают и восстанавливают азотно-водородной смесью в колонне синтеза.
Для получения правильной геометрической формы зерен катализатора используют специальные формовочные машины.
Цилиндрические гранулы получают экструзией (выдавливанием) влажной массы с помощью массивного винта (шнека) через отверстия нужного диаметра, после чего разрезают полученный жгут на отдельные цилиндрики, которые
закатываются в сферические гранулы в специальных грануляторах.
Плоские цилиндрические таблетки получают прессованием сухого порошка на таблеточных машинах
Скорость химических реакций. Действие катализаторов.
Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице объема.
Если при постоянных объеме и температуре концентрация одного из реагирующих веществ уменьшилась от с1 до с2 за определенный промежуток времени от t1 до t2, то скорость химической реакции равна:
где k — коэффициент, не зависящий от концентрации, называется константой скорости реакции,
vA и vB – постоянные числа – показатели порядка скорости реакции по реагентам А и В.
Следует отметить, что показатели порядка скорости реакции vA и vB о реагентам никогда не равны стехиометрическим коэффициентам a и b (исключение может быть только в одном случае – если реакция представляет собой элементарный акт).
Для сложных реакций показатели порядка реакции не равны стехиометрическим коэффициентам и определяются только экспериментально.
Такая зависимость справедлива для газов и жидкостей (гомогенные системы). Для гетерогенной реакции (с участием твердых веществ) скорость реакции зависит еще и от величины поверхности соприкосновения между реагирующими веществами. Любое увеличение площади поверхности приводит к увеличению скорости реакции.
Влияние катализаторов на скорость химической реакции.
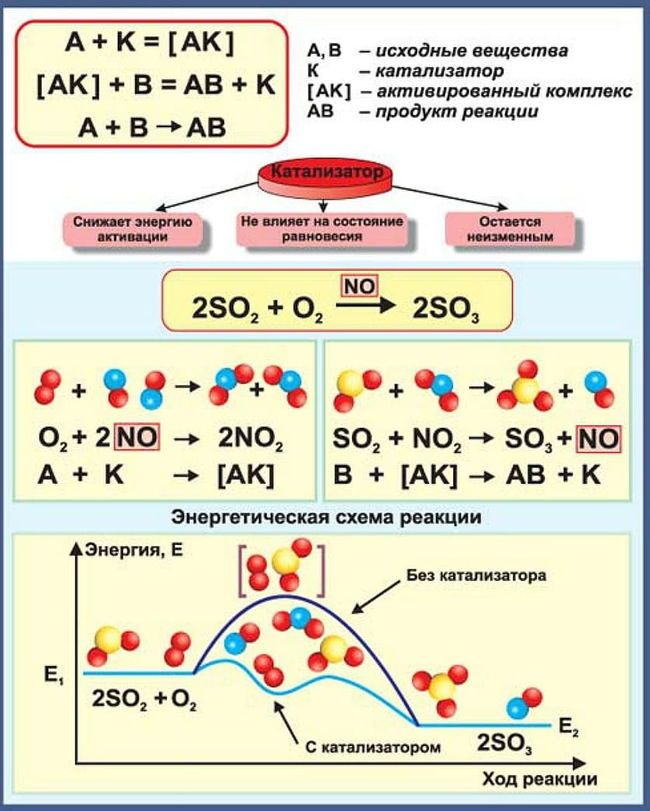
Механизм действия катализаторов (упрощенный).
В ходе катализируемой химической реакции происходит образование промежуточных продуктов (образование связи между катализатором и реагирующим веществом).
Реакция без катализатора идет очень медленно, а при добавлении катализатора К, о реагирует с одним из исходных веществ (например, с А), образуя очень непрочное и реакционноспособное промежуточное соединение АК:
Это промежуточное соединение реагирует с другим исходным веществом В, образуя конечный продукт АВ и катализатор выходит в первоначальном виде:
Катализатор может участвовать в реакции бесконечное число раз. Но следует учесть, что в реакциях могут присутствовать соединения, понижающие активность катализатора. Такие вещества называется каталитическими ядами, а сам процесс – отравлением.
Гомогенный катализ.
Гетерогенный катализ.
При гетерогенном катализе происходит адсорбция реагирующих веществ поверхностью катализатора (она неоднородна, и здесь расположены активные центры, под действием которых связь между атомами реагентов ослабляется, молекула деформируется, а иногда даже распадается).
Для катализатора характерна избирательность действия (определенный катализатор для определенной реакции). Подбор оптимальных катализаторов является насущной проблемой многих производств: переработка газов, крекинг углеводородов, нефтяная промышленность, получение полимеров, каучука и т. д.
В живой природе катализаторы также играют большую роль, только называются они ферментами.
Катализатор ускоряет химическую реакцию за счет
Без универсальных ускорителей мир вокруг нас превратился бы в замедленное кино. Не образуя химических связей с реагирующими веществами, катализаторы искусно управляют динамикой реакций.
Эта статья была опубликована в журнале OYLA №11(39). Оформить подписку на печатную и онлайн-версию можно здесь.
Что мешает веществам реагировать самостоятельно и обходиться без катализаторов? Энергия активации. Молекулам исходных веществ необходимо преодолеть её для запуска взаимодействия. Катализатор же снижает эту энергию. Каталитические реакции могут протекать в жидких и газообразных средах, а также на поверхности твёрдых тел.
Химические ускорители различаются по эффективности, избирательности, а также по масштабам воздействия — от отдельных атомов до гигантских белков-ферментов. Катализатор может выбрать две или более молекул, которым нужна помощь в осуществлении реакции. Он запускает процесс без образования химических связей, после чего отрывается от продукта и прикрепляется к новым молекулам.
Впрочем, есть способ обойтись без катализаторов. В промышленном производстве можно точно настроить температуру, подобрать концентрацию веществ, давление и время контакта реагентов — всё это помогает ускорить процесс, но дорого стоит и очень сложно.
В некоторых ситуациях без катализаторов вообще не обойтись. К примеру, получение аммиака из азота и водорода возможно только при температуре не более 6000°С, а для разрыва тройной связи в молекуле N2 требуются бóльшие температуры. Это термодинамическое противоречие снимается за счёт специального катализатора, снижающего температуру разрушения тройной связи.
Использование химических катализаторов ещё и экологично. Без них реакции пришлось бы ускорять путём повышения температуры и давления. А это означает сжигание миллионов тонн топлива, что неизбежно увеличило бы вредные выбросы в атмосферу.
Катализаторы позволили значительно снизить расход реагентов. Например, раньше эпоксиэтилен С2H4O, важный компонент для синтеза антифриза, получали в три стадии — вместе с вредными побочными продуктами. Катализатор (серебро, активированное хлором) позволил уменьшить количество стадий до одной, а из вредных выбросов осталось лишь немного CO2. Катализаторы применяются в 85–90% промышленных химических процессов: от пищевой индустрии до каталитической переработки нефти.
Транспортировка реактора гидроочистки нефти
Доля тяжёлых остатков нефти (их ещё называют «дно бочки») в добыче жидких углеводородов со временем будет увеличиваться.
Нефтяные ресурсы истощаются: лёгкой нефти становится всё меньше — приходится выкачивать тяжёлую и высоковязкую. Ключевую роль в её переработке играют катализаторы. Увеличение выхода бензина из тяжёлых остатков (мазут) всего на 1% снизит потребность США в импорте нефти на миллионы баррелей в год!
Рециркуляция отработанных газов
EGR (Exhaust Gas Recirculation) — система в двигателях внутреннего сгорания, направляющая отработанные выхлопные газы обратно в цилиндры. Это делается для снижения расхода топлива и количества вредных выбросов.
Дело в том, что при сгорании топлива азот «крадёт» кислород из топливной смеси. А это уменьшает экономичность и мощность мотора. Повторная подача в цилиндры охлаждённых выхлопных газов снижает температуру — кислород перестаёт реагировать с азотом. В итоге падает расход топлива и количество вредных выбросов, а каталитический нейтрализатор работает эффективнее.
AdBlue
Для селективной нейтрализации вредных выхлопов применяют мочевину (NH 2)2CO3. Этот способ получил название AdBlue. Система впрыскивает мочевину порциями в горячий выпускной тракт дизельного двигателя, где она сразу же разлагается:
(NH2)2CO3 = NH3 + HNCO.
Далее аммиак NH3 нейтрализует оксиды азота:
NO + NO2 + 2NH3 = 2N2 + 3H2O.
Преимущество такого метода в возможности использования в дизельных моторах, выхлопные газы которых бедны кислородом, отчего использование трёхкомпонентных каталитических нейтрализаторов становится невозможно.
Помимо экономической выгоды стоит сказать и об экологической: одно только удаление серы и азота снижает токсичность выхлопных газов автомобилей в несколько раз. В воздух перестают попадать серная кислота и ядовитые оксиды, образующиеся в цилиндрах двигателей внутреннего сгорания.
Катализатор гидроочистки
Для удаления атомов N и S и внедрения атомов Н используют катализаторы гидроочистки нефти. Типичным примером такого соединения является дисульфид молибдена MoS 2 с кобальтом или никелем, покрытый оксидом алюминия Al2O3. Самые стойкие к гидрированию молекулы приходится атаковать дорогостоящими катализаторами, в которых молибден заменён на вольфрам.
Дисульфид молибдена
Против термически стабильных серосодержащих молекул в составе нефти применяются вещества на основе палладия и платины. Механика работы таких катализаторов достаточно проста: они приближаются к органической молекуле, содержащей серу, отрывают её, присоединяют к собственному атому металла, а затем отпускают его на свободу в виде сероводорода. При этом химики до сих пор не изучили все тонкости каталитической гидроочистки нефти. А постоянное ужесточение требований к содержанию серы в бензине с каждым днём делает это направление науки всё более актуальным.
Ферменты (Каталитические клубки)
Высокоточными природными катализаторами являются белки-ферменты, или энзимы. Их активность зависит от конфигурации клубка, в который сворачивается молекула. Существует 6 классов ферментов.
Оксиредуктазы отвечают за окисление и восстановление веществ.
Гидролазы участвуют в гидролитическом разрушении химических связей.
Трансферазы транспортируют химические группы от одной молекулы к другой.
Лиазы — агрессивные катализаторы, разрывающие связи без гидролиза.
Лигазы — ферменты-строители, способные формировать химические связи.
Изомеразы отвечают за преобразование структуры молекул и изомеризацию.
Заслуги катализаторов перед экологией не сводятся к перечисленным выше. Существует целая группа химических ускорителей, отвечающих непосредственно за чистоту воздуха (их называют каталитическими нейтрализаторами). Их задача — связывать угарный газ, оксиды азота и серы, а также недогоревшие органические соединения различной природы. Весь этот букет присутствует в выхлопных газах автомобилей и дымах промышленных предприятий. Каталитические нейтрализаторы превращают эти яды в менее токсичные вещества типа H 2, умеренно вредный углекислый газ CO2 и уж совсем нейтральную воду.
Оксид ванадия под микроскопическим увеличением
Трёхкомпонентный каталитический нейтрализатор стал чрезвычайно удачным образцом химического инжиниринга и ставится сейчас практически в каждый автомобиль. На пористом керамическом монолите, покрытом тонким слоем платины и родия, проходят трансформацию три главных загрязнителя: CO, NO и несгоревшие углеводороды. Реакции выглядят так:
СО + О2 = СО2
СxHy + O2 = CO2
NO + CO = N2 + CO2.
Доля кислорода в этих процессах должна регулироваться, потому что его избыток может пойти на полное окисление угарного газа, и, как следствие, оксиды азота останутся в составе выхлопных газов. Уровень кислорода контролируется лямбда-зондом, который подаёт корректирующие сигналы двигателю о составе топливно-воздушной смеси. Оптимальным является соотношение воздуха и топлива в пропорции 14,7:1.
Рабочий диапазон каталитического нейтрализатора лежит в пределах от 3500 до 6500°С, что создаёт трудности при холодном запуске двигателя.
Нейтрализатор
Автомобильные нейтрализаторы впервые внедрили в массовое производство в США в 1975 году. Это стало одной из мер по борьбе с удушающими смогами, которые накрывали мегаполисы с их избытком автомобилей.
Непрогретый катализатор не выполняет защитную функцию, и в воздух попадают все три токсичных отхода: СO, NO и С xHy. Именно поэтому в некоторых странах (к примеру, скандинавских) запрещено прогревать мотор на холостых оборотах — только в движении. Так быстрее.
Промышленные выбросы, содержащие оксид серы SO 2, стали причиной кислотных дождей во второй половине XX века. И тогда химики придумали с помощью расплава V2O5 каталитически окислять оксид серы (IV) до оксида серы (VI), а затем до жидкой серной кислоты.
Экологические последствия кислотных дождей
Многие промышленные предприятия стали попутно серную кислоту производить! Бороться с NО x в дымовых трубах пришлось более сложными методами — добавляя восстановитель-аммиак и катализатор на основе оксидов титана и ванадия. Каталитическая реакция в полном виде:
4NH3 + 4NO + O2 = 4N2 + 6H2O.
Каталитическая химия находится в зените славы — её достижения экономят гигантские ресурсы и помогают бережно относиться к природе. В то же время это одна из самых сложных и малоизученных областей химии, а значит, главные каталитические прорывы ещё впереди.