катализатор в отношениях это
Катализатор в отношениях это
Словосочетание «экономический кризис» прочно вошло в нашу жизнь. Мы обсуждаем цены на нефть, следим за котировкой валют, ловим последние экономические новости.
Для кого-то это просто тема для обсуждения, а для кого-то кризис стал реалией жизни. Сокращения или угроза увольнения, неприятные разговоры и мысли по поводу кризиса так или иначе отражаются на нашем настроении, поведении, которое, в свою очередь, оказывает влияние на отношения с близкими нам людьми.
Каждый реагирует на это по-своему, и очень важно, чтобы экономический кризис не превратился в кризис семейных отношений.
Катализатор отношений
В тех парах, где есть надежные дружеские отношения и система взаимной поддержки, неурядицы могут сплотить семью, как иногда бывает сплоченность народа внутри государства перед угрозой внешнего врага во времена войн и нападений.
Обычно считается, что наиболее устойчивы семьи, созданные по взаимному прагматическому расчету. Сейчас мы можем убедиться в обратном. Браки по расчету в условиях кризиса уязвимы и ненадежны. Все стрессы, разочарование и неудовлетворенность, связанные с проблемами на работе, супруги выплескивают внутри семьи. Вместо поддержки и сочувствия они получают лишь упреки и обвинения в несостоятельности как добытчика. Семьи, в которых муж и жена искренне любят друг друга и столь же самоотверженно заботятся об общем благе, могут выдержать и не такие испытания: любовь не зависит от социально-политической ситуации.
Мужчины в кризисе
Мужчины наиболее уязвимы во время кризиса. Их самооценка в большей степени, чем женская, зависит от успешной карьеры и количества получаемых денег. А кризис ставит под угрозу именно карьеру и деньги. Проблемы на работе могут спровоцировать у мужчины чувство вины: он не в состоянии быть кормильцем семьи и от этого страдает еще сильнее. Мужья теряют уверенность в себе, становятся агрессивными, обидчивыми или замыкаются, впадают в депрессию.
Так как же сохранить статус главы семьи? Как лучше объяснить домочадцам, что жизнь изменилась? Чтобы найти ответ на эти вопросы, был проведен небольшой Интернет-опрос.
Подобные ответы вселяют уверенность, что взаимопонимание и поддержка друг друга свойственны большинству наших семей. Во всяком случае, это относится к семьям участников опроса. А мужчинам такие высказывания могут придать уверенность, что их половинки отнесутся с пониманием к проблемам, если они возникнут.
Но чувства остаются чувствами. Все-таки трудно чувствовать себя полноценным главой семьи, если ты не можешь обеспечить ее материально. В таком случае важно не зацикливаться на проблеме, ведь материальная составляющая понятия «хороший муж» далеко не единственная и, конечно, не главная. Тот, кто может помочь вам в трудную минуту, находится совсем близко. Психологическая поддержка жены позволит ослабить давление ответственности за семью, чувство вины и поможет найти временный выход из положения. Ведь если уж вы решили идти по жизни рядом, то и из ямы следует выбираться вместе. А если семья сплоченная и люди по-настоящему любят друг друга, то, конечно, снижение статуса и уровня жизни будет ими восприниматься хоть и как крайне неприятное, но, тем не менее, переживаемое и временное.
Решаем проблемы вместе
Попробуем теперь сделать вывод о том, как же вести себя грамотно с психологической точки зрения, чтобы сохранить отношения в семье, если вы напрямую столкнулись с последствиями экономического кризиса.
Во-первых, конечно же, будьте честны и откровенны с самого начала. Сообщение о вашем увольнении или «отпуске на неопределенный срок» не должно стать шоком и полной неожиданностью для вашей семьи. Держите близких в курсе событий. Не стоит паниковать, но и умалчивать проблемы тоже не нужно.
Во-вторых, не вините друг друга в проблемах семьи. Не стоит перебрасывать ответственность с одной головы на другую. Ищите выход из создавшегося положения вместе.
В-пятых, если же вам не удалось избежать конфликтов, то значит, в семье уже накопилось множество неразрешенных проблем, скрытых обид и недовольство друг другом. Просто экономический вопрос стал последней каплей. В таком случае нужно не зацикливаться на внешних экономических проблемах, а попытаться найти то, что на самом деле лежит в основе конфликта. Если вы искренне ответите себе на вопрос, что же больше всего раздражает вас в этой ситуации, то, скорее всего, вы получите ту проблему, которую стоит решать в первую очередь.
Вообще, чтобы справиться со стрессом, психологи советуют извлекать из проблем преимущества, позитивно переформулировать их для себя, относится к проблеме спокойно, философски, как если бы эти события происходили не с вами. Например, вы попали под сокращение на работе. Значит, компания, в которой вы работали, была ненадежная и вы сможете найти работу лучше. Перерыв в работе нужно воспринимать как возможность для отдыха, обучения. Если ваш бизнес разорился, значит, не все было хорошо продумано, и в будущем вы учтете эти ошибки и сделаете свой бизнес более приспособленным к условиям российской экономики.
LiveInternetLiveInternet
—Поиск по дневнику
—Подписка по e-mail
—Постоянные читатели
—Статистика

Уильям Сомерсет Моэм
Мне думается, все определяется тем,
чего ты ищешь в жизни, и еще тем,
что ты спрашиваешь с себя и других.
Когда вы станете старше, вы поймете, что в мире можно хоть как-нибудь жить только при одном непременном условии: надо понять, что эгоизм – это естественное свойство человека. Вы требуете бескорыстия от других, но это ведь чудовищная претензия: вы хотите, чтобы они пожертвовали своими желаниями ради ваших. С какой стати? Когда вы примиритесь с мыслью, что каждый живет только для себя, вы будете куда снисходительнее к своим ближним. Они перестанут обманывать ваши надежды, и вы начнете относиться к ним куда милосерднее. Люди стремятся в жизни только к одному – к наслаждению.
Ты мастер в том, что пережил,
ремесленник в том, что переживаешь,
и дилетант в том, что тебе предстоит пережить.

Между раздражителем и нашей реакцией есть
промежуток. В этом промежутке лежит свобода
выбора нашей реакции. От нашей реакции зависит
наше развитие и наше счастье.
Джек Траут “В поисках очевидного”
Системе отношений, составляющих структуру характера,
в одних случаях присуще качество цельности, в других –
противоречивости. Цельный характер у того человека,
у которого отдельные мысли, чувства, взгляды, поступки
согласуются между собой, соответствуют его убеждениям.
Убежденность определяет принципиальность поведения
человека, уверенность в справедливости и важности дела,
которому он отдает все свои силы. Человек с противоречивым
(дисгармоничным) характером отличается наличием
несовместимых друг с другом взглядов и убеждений, целей
и мотивов, стремлений, желаний и поступков.
В известном смысле честность и ум – синонимы.
И то и другое есть способность видеть истину.
Здесь честность есть умственная добросовестность.
Человек копается в себе, своих сомнениях, в добрых
и злых чувствах и мыслях, уясняя мотивы своих действий,
отдавая себе в них отчет – даже и особенно если это ему
неприятно: не нравится он себе такой. Людям ведь
свойственно приукрашивать себя, сообразуясь с моралью.
Подобно многим смертным, менее всего капитан Левассер
интересовался правдой о себе. Давайте честно мыслить –
это и есть высшая нравственность, сказал де Карт.
Истина и мораль есть вещи разные, как номинатив и императив.
Михаил Веллер «Всё о жизни»
Нас никто не сдерживает, нам никто не мешает.
это мы сами держим себя и не можем отпустить в новое.
Наше сознание формирует то, что происходит вокруг.
Если мы сможем быть в полной силе своего «Я»- мир
примет это, он отразит нашу силу! Возьмите свою силу,
проявите её. Будьте в каждый момент времени.
НИКТО НЕ НАВЯЗЫВАЕТ НАМ ЧТО,
ЭТО МЫ САМИ НЕ ДЕЛАЕМ ВЫБОРА.
..Мир делаем мы.
Асимметричный органокатализ в старом и новом свете
Рис. 1. Лауреаты Нобелевской премии по химии 2021 года: Дэвид Макмиллан (David MacMillan, слева) и Беньямин Лист (Benjamin List). Фото с сайта nature.com
Активное исследование асимметричного органокатализа началось на рубеже нового тысячелетия с работ Беньямина Листа (Benjamin List) и Дэвида Макмиллана (David MacMillan). Идея подхода заключается в том, что при помощи тщательно подобранных органических хиральных молекул, выступающих в роли катализатора, можно проводить реакции, в которых будут синтезироваться хиральные молекулы с избытком одного из двух энантиомеров (так называются две зеркально симметричные формы хиральной молекулы). В октябре Лист и Макмиллан были объявлены лауреатами Нобелевской премии по химии за 2021 год с формулировкой «за развитие асимметричного органокатализа». Макмиллан за прошедшее время увлекся другими областями каталитической химии, а вот Лист продолжает активно заниматься органокатализом, и в этом году его научная группа выпустила серию интересных статей, на примере которых хорошо видна логика, лежащая в основе современных исследований по асимметричному органокатализу. В первой статье детально исследуется реакция асимметричного катализа циклоприсоединения двойной связи к индольной группе (важного фрагмента множества биоактивных веществ). Во второй статье описан новый относительно легкий и эффективный метод синтеза катализаторов для широкого круга асимметричных реакций.
Каталитические реакции распространены чрезвычайно широко как в природе, так и в промышленности. Да что далеко ходить: внутри любого живого организма — в том числе и нас с вами — многие биохимические реакции происходят при участии катализаторов, то есть веществ, которые ускоряют реакцию (или вообще делают ее возможной), но сами при этом не расходуются. Впервые идея катализа была описана в конце XVIII века в работе английской ученой Элизабет Фулхейм (Elizabeth Fulhame), а сам термин предложил в 1835 году Йёнс Берцелиус. С тех пор химическая наука ушла далеко вперед и счет различных катализаторов идет на тысячи. Важность этой области исследований подчеркивает и Нобелевский комитет: премии за изучение катализа вручались неоднократно.
Молекулы-катализаторы можно подразделить на три группы: неорганические, органические и биологические. Неорганические соединения содержат в своем составе переходные металлы (палладий, вольфрам, титан и т. д.). Атомы таких металлов могут достаточно легко отдавать и принимать электроны, поэтому с их помощью, как правило, легче производить химические трансформации. За исследования именно неорганического катализа различных реакций Нобелевские премии по химии тоже вручались (например, в 2010 году, когда лауреатами стали Ричард Хек, Эйити Нэгиси и Акира Судзуки «за палладий-катализируемые реакции кросс-сочетания в органическом синтезе»). Проблема в том, что переходные металлы дороги, редки и часто токсичны, а полученные вещества тяжело очищать от них. Поэтому для производства, например лекарств и других биоактивных веществ лучше их не использовать. Органические катализаторы — это небольшие органические молекулы, в которых нет переходных металлов. Биокатализаторы — это большие молекулы биологического происхождения, например ферменты и рибозимы (за открытие рибозимов в 1989 году Нобелевскую премию по химии получили Томас Чек и Сидни Олтмен).
Некоторым молекулам присуща хиральность — способность существовать в двух зеркально симметричных формах, которые невозможно совместить друг с другом движением. Эти формы называются энантиомерами. Макроскопическими примерами хиральных объектов служат руки (от древнегреческого слова χειρ ‘рука’ и происходит название явления) и болты с правой и левой резьбой. Подробнее про хиральность можно прочитать в новости Хирально-индуцированная спиновая селективность может помочь разделять рацемические смеси на энантиомеры («Элементы», 24.05.2018) и в задаче Слабое взаимодействие и хиральность биологических молекул.
Бывает, что из двух возможных энантиомеров только один обладает требуемыми свойствами: даже такая — казалось бы, небольшая — разница, как зеркальная симметрия, между молекулами, которые в остальном идентичны, сильно влияет на биологическую активность. В биохимии, где многое завязано на углероде, который может выступать в роли хирального центра, если к нему присоединены четыре разные группы, такое встречается регулярно. Между тем, если синтезировать такие вещества без участия хиральных молекул, то в продукте реакции оба энантиомера будут присутствовать в соотношении 1:1 (такие смеси называются рацемическими). Чтобы увеличить выход одного из энантиомеров, нужно проводить асимметричную реакцию. В природе такие реакции (а они задействованы едва ли не во всех аспектах жизни) происходят при участии биокатализаторов. Но синтезировать такие большие и сложные молекулы очень долго и дорого. Если химики и работают с биокатализаторами, то берут уже готовые (синтезированные, например, генно-модифицированными бактериями) и приспосабливают под свои нужды, — как правило их используют для тех же реакций, которые они катализируют в природе. Но у эволюции были миллиарды лет, чтобы изготовить хорошие биокатализаторы, а людям нужно делать новые реакции «здесь и сейчас» — и это очень непростая задача.
Разную биоактивность двух энантиомеров одной молекулы хорошо иллюстрирует печальная история с талидомидом. Это вещество в 1950–60-х годах применялось как снотворное и успокаивающее средство. Но довольно быстро выяснилось, что оно обладает и тератогенным действием: у женщин, принимавших талидомид во время беременности, гораздо чаще рождались дети с серьезными врожденными пороками развития. Всего, по разным подсчетам, от талидомида пострадало от нескольких тысяч до нескольких десятков тысяч младенцев. Лишь в 80-е годы стало ясно, что за это ответственен только один из двух энантиомеров талидомида — его S-форма (рис. 2). Если бы в середине XX века уже существовали методы асимметричного синтеза и было понимание опасности потенциально разной биоактивности энантиомеров, то трагедии, возможно, удалось бы избежать. Но талидомид выпускался в виде рацемата, и в организм будущих матерей попадали оба энантиомера.
Рис. 2. Энантиомеры талидомида. Слева — безопасная R-форма, обладающая обезболивающим и седативным действием. Справа — S-форма, являющаяся тератогеном, способным вызвать нарушение эмбрионального развития. Талидомидовая трагедия заставила многие страны пересмотреть существующую практику лицензирования лекарственных средств, ужесточив требования к препаратам и клиническим испытаниям. Жирные линии «выходят» из экрана на нас, пунктирные — «уходят» вглубь экрана. Рисунок с сайта news.tpu.ru
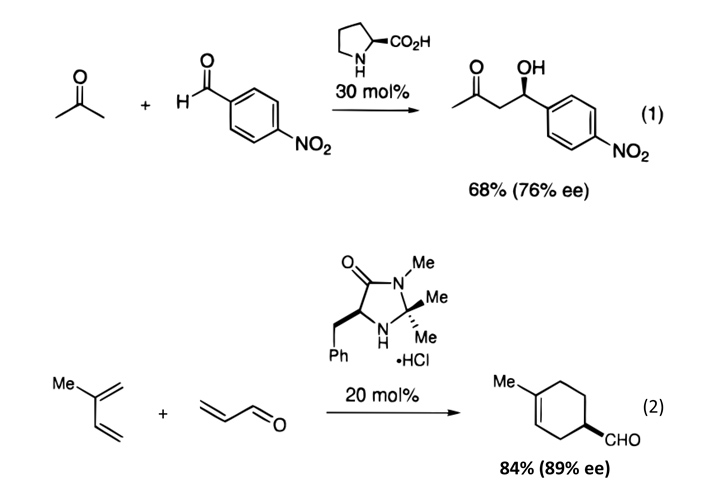
И здесь мы наконец подходим к обсуждению нобелиатов этого года. Как сказано в формулировке Нобелевского комитета, Беньямин Лист (Benjamin List) и Дэвид Макмиллан (David MacMillan) были отмечены «за развитие асимметричного органокатализа». Если формулировать совсем кратко, то они существенно развили методы, позволяющие эффективно использовать в качестве катализаторов сравнительно просто устроенные хиральные органические молекулы. Основополагающие статьи групп Листа (Proline-Catalyzed Direct Asymmetric Aldol Reactions) и Макмиллана (New Strategies for Organic Catalysis: The First Highly Enantioselective Organocatalytic Diels−Alder Reaction) вышли в 2000 году с разницей всего полтора месяца.
В обеих работах проверялось множество реакций (использовались разные заместители, разные функциональные группы, и т. д.) и обе группы в качестве катализаторов использовали циклические азотсодержащие хиральные соединения. Лист работал с аминокислотой пролином, которая является активной группой в реакционном центре многих ферментов. Группа Макмиллана попробовала несколько разных катализаторов. Примеры реакций из этих работ показаны на рис. 3. После того, как химики осознали перспективность нового метода, пошла лавина подобных исследований.
Рис. 3. Примеры реакций из «нобелевских» статей Листа (вверху) и Макмиллана (внизу). Группа Листа исследовала несколько разных реакций, среди которых была показанная здесь асимметричная альдольная конденсация ацетона с пара-нитробензальдегидом. Группа Макмиллана — асимметричное циклоприсоединение Дильса — Альдера 2-метилбутадиена к винилальдегиду. Каждая из этих реакций — лишь одна из множества, проверявшихся в ходе работы обеих групп. mol% — процент молекул катализатора по отношению к реагентам, ее (enantiomeric excess = энантиомерный избыток) — доля (в процентах) изображенного хирального изомера в полученной смеси. Какой именно изомер имеется в виду, можно понять по связям на молекулах: утолщенные линии «выходят» из экрана на нас, а пунктирные — «уходят» вглубь экрана. Схемы из статей B. List et al., 2000. Proline-Catalyzed Direct Asymmetric Aldol Reactions и K. A. Ahrendt et al., 2000. New Strategies for Organic Catalysis: The First Highly Enantioselective Organocatalytic Diels−Alder Reaction
Справедливости ради стоит заметить, что подобные асимметричные реакции были уже известны раньше. И Лист, и Макмиллан в своих статьях приводят изрядное количество ссылок на соответствующие работы, самая ранняя из которых датирована 1971 годом (U. Eder et al., 1971. New Type of Asymmetric Cyclization to Optically Active Steroid CD Partial Structures). Как ни странно, в ней исследовались реакции альдольной конденсации, подобные реакциям из «нобелевской» статьи Листа, — даже с тем же катализатором (пролином). Авторы статьи 1971 года еще живы. Поэтому многие химики, хотя и рады «настоящему химическому Нобелю», все же считают выбор Нобелевского комитета несправедливым.
Почему же выбор пал именно на Листа и Макмиллана? В поддержку решения Нобелевского комитета можно привести пару цитат Д. И. Менделеева.
«Наука начинается с тех пор, как начинают измерять. Точная наука немыслима без меры.»
В 70-х годах методы квантификации хиральной чистоты были менее точны, более дороги, и менее доступны. Энантиомеры никак не отличаются друг от друга ни одним из спектроскопических методов. Наличие избытка одного из них с высокой точностью можно определить только при помощи высокоэффективной жидкостной хроматографии с хиральным наполнителем. Такие аналитические инструменты стали доступны для повсеместного лабораторного использования как раз к 2000-м годам. А в работах 70-х годов энантиомерный избыток измеряли намного менее точными методами. Например, в вышеупомянутой работе 1971 года это делали путем изменения угла вращения плоскости поляризации поперечной волны. Этот классический метод, с помощью которого Луи Пастер открыл хиральность еще аж в 1848 году, основан на разном взаимодействии энантиомеров с поляризованным («закрученным» — фактически хиральным) светом. Также вплоть до XXI века было сложно моделировать процессы (например квантомеханическими расчетами), чтобы понять, как протекают реакции, и доказать механизмы. Поэтому реакции асимметричного органокатализа, хоть и были описаны как частные случаи задолго до Листа с Макмилланом, не изучались массово.
«Справедливо считать творцом научной идеи того, кто не только признал философскую, но и реальную стороны идеи, который сумел осветить вопросы так, что каждый может убедиться в его справедливости, а тем самым сделал идею всеобщим достоянием.»
Можно что-то важное сделать, но рассказать об этом так, что никто и не заинтересуется, и не заметит, и не разовьет. Возможно, Нобелевский комитет посчитал, что именно после высокоцитируемых работ Листа и Макмиллана важность методов асимметричного органокатализа была оценена по заслугам научным сообществом и фармацевтической индустрией и они получили соответствующее распространение. Макмиллан ввел сразу ставший очень популярным термин «органокатализ», а Лист, по-видимому, впервые сформулировал идею использования в органокатализе подходов, которые применяются самой природой в биокатализаторах (подробности — ниже).
Я посчитал, что вместо подробного разбора классических работ Листа и Макмиллана, нагляднее и интереснее будет продемонстрировать, на каком уровне находится нынешний асимметричный органокатализ: какой логикой руководствуются химики, работающие в этой области, и какими проблемами они занимаются сейчас — через 20 лет после тех основополагающих работ.
Дэвид Макмиллан с тех пор от этой темы отошел и занимается еще более модным фотокатализом (ускорением реакций видимым светом). Про недавнюю работу группы Макмиллана можно почитать в провидческом посте Андрея Соловьёва (он предсказал, что Макмиллан получит премию, еще в августе).
Беньямин Лист же по-прежнему развивает именно асимметричный органокатализ и публикует множество блестящих работ. Возможно, в том числе из-за них было решено присудить премию именно ему — ее ведь дали не за открытие (discovery), а за развитие (development) метода. О двух работах группы Листа опубликованных в этом году вкратце расскажу ниже и на их примере попытаюсь раскрыть логику исследований асимметричного органокатализа. Видеорассказ (на английском языке) об этих и еще нескольких недавних работах группы Листа вышел на моем YouTube-канале Chemistry News Selection:
Разные исследовательские группы работают с разными типами органокатализаторов, но подход у всех примерно однаков. В начале ищется реакция, которая может быть полезна для синтеза некоторых типов лекарств или их фрагментов, но которая несовершенна при нынешнем уровне знаний. Что значит несовершенна? Например, реакция идет путем мультистадийного синтеза, хотя из общих химических соображений следует, что она может идти в одну стадию. Или, например, в реакции получается смесь энантиомеров, которые потом надо мучительно разделять на дорогих хиральных хроматографических колонках, а то и вовсе пускать в клинические испытания без разделения (последнее происходит намного чаще). Когда такая несовершенная реакция найдена, ее пытаются усовершенствовать путем добавления хирального катализатора (для начала простого), который теоретически должен взаимодействовать с реагентами, и таким образом передавать свою хиральность продуктам. Если заметна хотя бы незначительная передача хиральности, катализатор можно усложнять и постепенно довести реакцию до совершенства.
Именно такой стратегией пользовалась группа Листа при разработке ассиметричного катализа реакции циклоприсоединения двойной связи к индольной группе. Статья с описанием этого исследования вышла в январе (P. Zhang et al., 2021. Strong and Confined Acids Catalyze Asymmetric Intramolecular Hydroarylations of Unactivated Olefins with Indoles). Индольное ядро входит в состав многих красителей, а также в молекулы многих важных алкалоидов, в аминокислоту триптофан, в ауксины и другие биохимически важные вещества (серотонин, мелатонин, буфотенин и т. д.).
Рис. 4. Сверху: исследуемый асимметричный катализ циклоприсоединения двойной связи к индольной группе. При прохождении реакции один углерод двойной связи присоединяется к углероду около азота на индольном кольце, закрывается шестичленное кольцо, и на другом углероде бывшей двойной связи образуется хиральный центр. Снизу приведены структуры катализаторов 3, 4, 5, 6, и 7а-е. Зелеными и серыми кружочками обозначены боковые группы. Изображения из обсуждаемой статьи P. Zhang et al. в JACS
В качестве модельной была выбрана реакция трансформации, показанная сверху на рис. 4. Официальные названия используемых веществ весьма громоздки, поэтому для простоты будем именовать их по номерам, приведенным на рисунках. Одной из причин такого выбора была возможность получить биоактивное вещество 8, неразделенная смесь энантиомеров которого проходит сейчас клинические испытания как антидепрессант (см. рис. 5). Об этом веществе поговорим ниже — заметим тут только, что смесь энантиомеров проверяли именно потому, что до сих пор не было реакции для эффективного получения одного из энантиомеров в избытке.
Было известно, что подобные реакции присоединения могут ускоряться кислотами, и сначала реакцию провели в присутствии 2% хиральной кислоты 3 (без добавления кислоты реакция не идет, а с нехиральными кислотами получается рацемическая смесь продуктов). Катализатор 3, как и прочие катализаторы о которых пойдет речь ниже, не имеют хирального центра: скорее они сравнимы со спиралью — закручены в одну сторону и из-за пространственных, геометрических ограничений не могут развернуться в другую. Результат этой реакции приведен в первой строке Табл. 1: реакция прошла с выходом 34%, а разница между энантиомерами продукта составила 8%. Такую реакцию успешной считать, конечно, нельзя. Но зато сразу стало ясно, что асимметричный катализ в данном случае возможен и стоит копать дальше.
Таблица 1. Результаты реакций с участием разных катализаторов, показанных на рис. 4. Конверсия — доля прореагировавших реагентов (в процентах); er (enantiomeric ratio) — отношение энантиомеров в продукте реакции (в рацемической смеси er = 50:50). Данные из обсуждаемой статьи P. Zhang et al. в JACS
| № | Катализатор | Температура, °C | Конверсия, % | Выход вещества 2, % | Отношение энантиомеров (er) | 1 | 3 | 80 | 41 | 34 | 54:46 | 2 | 4 | 80 | 47 | 30 | 44:56 | 3 | 5 | 80 | 13 | + ). Впрочем, о механизме реакции подробнее поговорим чуть ниже. |
Так были проведены реакции с большими катализаторами 7b, 7c, 7d и 7e. Катализатор 7e продемонстрировал прекрасный результат с выходом 93% и 90% избытка одного энантиомера (Табл. 1, строка 9). Чтобы еще улучшить результат, температуру реакции понизили до 60°C (увеличив ее селективность), — избыток энантиомера вырос до 95%. Кстати, сравните это с реакциями из статей 2000 года: в них использовалось 20–30 мольных процентов катализатора (это означает, что каждая молекула катализатора расходовалась после 3–5 циклов реакции), а в реакциях в этой работе требовалось всего 2 мольных процентов катализатора (то есть теперь его молекулы выдерживают минимум по 50 циклов).
Что ж, удачный катализатор найден, теперь надо показать его применимость для других похожих реакций и подтвердить, что с его помощью можно получить не одно, а много подобных веществ (рис. 5). Было синтезировано и проверено множество прекурсоров с разными группами. Исследователи удлиняли и укорачивали алкильный хвост при двойной связи (соединения 2b–2h), добавляли группы на индольное кольцо (соединения 2i–2n) — в том числе функциональные группы, с которыми можно производить дальнейшие реакции (соединения 2o–2v). Вещество 2t было кристаллизовано и его структура была определена рентгено-кристаллографией (наиболее прямой и точный метод для определения структур химических веществ, см. новость Новый метод MicroED определяет молекулярную структуру вещества за полчаса, «Элементы», 24.10.2018). С веществами 2t и 2u были проведены химические реакции с полным сохранением хиральной чистоты. Из вещества 2t были получены нафтильное и гидроксильное производные, а из вещества 2u в четыре стадии был получен потенциальный антидепрессант 8 с энантиомерами в отношении 93:7. Это дает возможность проверять каждый из энантиомеров по отдельности, чтобы понять, какой из них более активный.

Рис. 5. Исследование применимости катализатора 7е, пояснения в тексте. Изображения из обсуждаемой статьи P. Zhang et al. в JACS
Самая интересная часть статьи (на скромный вкус автора этой новости) — это исследование механизма реакции (рис. 6). Потому что, конечно, это хорошо — сделать что-то полезное, но понять, как именно оно получилось и доказать, что это именно так, — куда интереснее и важнее для дальнейших исследований. В качестве первой стадии механизма (рис. 6, Е) на основании предыдущих исследований подобных реакций авторы предложили протонирование двойной связи (перенос кислотного протона с катализатора). Чтобы протонирование произошло, молекула реагента должна «соприкоснуться» с молекулой катализатора. Такое «прикосновение» происходит при взаимодействии реагента с двумя группами SO2 на катализаторе: одна группа взаимодействует с азотом индола, а вторая — с протонированной двойной связью. В этом еще одна фундаментальная идея асимметричного катализа — реакция бы произошла и без такого взаимодействия, но фиксация на активном центре хирального катализатора необходима для переноса хиральности на продукт. Протонирование было изучено ранее на обычных (не асимметричных) реакциях в присутствии кислот, однако предложенную геометрию взаимодействия следовало подтвердить, и для этого были проведены реакции, показанные на панелях А, В, и С на рис. 6. Их результаты затем сравнили с результатом реакции вещества 1а (см. рис. 4 и Табл. 1, строка 10).

Рис. 6. Исследование механизма реакции асимметричного катализа циклоприсоединения двойной связи к индольной группе. Пояснения в тексте. Рисунок из обсуждаемой статьи P. Zhang et al. в JACS
Реагент 9 (рис 6, А) отличается от реагента 1а наличием метильной группы на азоте вместо водорода. Если взаимодействие молекулы такое, как показано справа на рис. 6, Е, то метил не будет мешать прохождению реакции, так как двойная связь останется доступной для протонирования, однако хиральная чистота продуктов будет хуже, так как молекула будет хуже заходить в «карман» из объемных групп катализатора и слабее фиксироваться (N–Mе не создает водородную связь с S=O в отличие от N–H). Значительно ухудшившаяся энантиоселективность (отношение энантиомеров 71:29 в продукте 10 в сравнении с 95:5 в продукте 2а) подтвердила эту гипотезу.
Реагенты 11 и 13 отличаются от 1а расстоянием двойной связи от индольной группы. В молекуле 11 она ближе на один атом углерода, а в 13 — дальше на один атом углерода. Реакция с реагентом 11 совсем не идет даже с большим количеством катализатора и при более высокой температуре. С реагентом 13 реакция идет, но с более низким выходом, неполной конверсией и более низкой энантиоселективностью. В случае реагента 11 реакция не может идти через циклизацию, показанную слева на рис. 6, Е (кольцо было бы слишком напряжено), а реагент 13, как и 9, плохо геометрически вписывается в карман катализатора.
Еще более наглядный результат был получен в реакции, показанной на рис. 6, D. Стадия II механизма реакции, показанная слева на рис. 6, Е, предполагает разрыв кольца и перегруппировку (миграцию) до получения менее напряженного продукта. При подобных миграциях, однако, возможен перенос как с одной, так и с другой стороны кольца и получение двух разных продуктов (например, из реагента 15 могут получиться продукты 16а и 16b). Но почему же в таком случае мы до сих пор получали только один продукт во всех остальных реакциях? Дело в том, что, когда алкильная группа мигрирует, она это делает в виде карбокатиона, и чем сильнее карбокатион экранирован сидящими на нем группами, тем он стабильнее. И значит, переноситься в избытке всегда будет группа, на которой сидит больше других групп. Во всех реакциях, которые мы обсуждали до сих пор, перенос был исключительно одного типа, и для того, чтобы увидеть оба типа перегруппировки, реагент 15 «раздели», сделав двойную связь терминальной (сравните соединения 15 и 1а), таким образом сделав менее энергетически выгодную перегруппировку чуть более вероятной. И действительно, в реакции вещества 15 в присутствии катализаторов 7а или 7е был зафиксирован минорный продукт, получающийся путем менее энергетически выгодной перегруппировки и доказывающий существование стадии II (слева на рис. 6, Е).
Возможно, у читателя возник вопрос: а как же эти катализаторы синтезируются? На рисунках они выглядят сложноватыми. На самом деле, получать такие молекулы не так уж и тяжело, а недавно был разработан новый, еще более простой, метод синтеза. Рассмотрим вкратце часть совсем недавней статьи, опубликованной группой Листа в сентябре (S. A. Schwengers et al., 2021. Unified Approach to Imidodiphosphate-Type Brønsted Acids with Tunable Confinement and Acidity). Сравнение старого и нового методов синтеза катализаторов показано на рис. 7.

Рис. 7. Старый и новый методы синтеза хиральных катализаторов. Хиральность катализаторов видна по жирным линиям на схемах молекул, при помощи которых показана трехмерность структуры (жирные связи как бы «выходят» из экрана на нас). Таким образом, молекулы закручены в одну сторону, подобно пружине. Новый метод синтеза одностадийный (относительно хирального диола — молекулы с двумя гидроксильными группами ОН), проходит при более мягких условиях и с гораздо большим выходом (выход указан относительно хирального диола, то есть в случае старого метода 22% — это общий выход после нескольких стадий реакции). Из-за более мягких условий удалось получить катализаторы с более объемными группами (Ar = Aryl, указаны на этом рисунке снизу) и более сильными кислотами (см. рис. 9). Изображения из обсуждаемой статьи S. A. Schwengers et al. в JACS
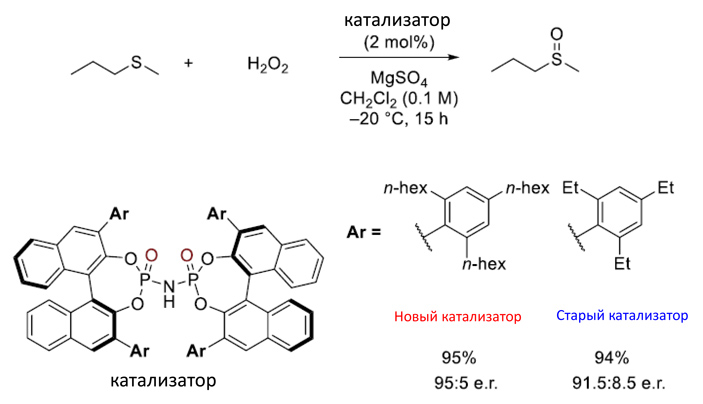
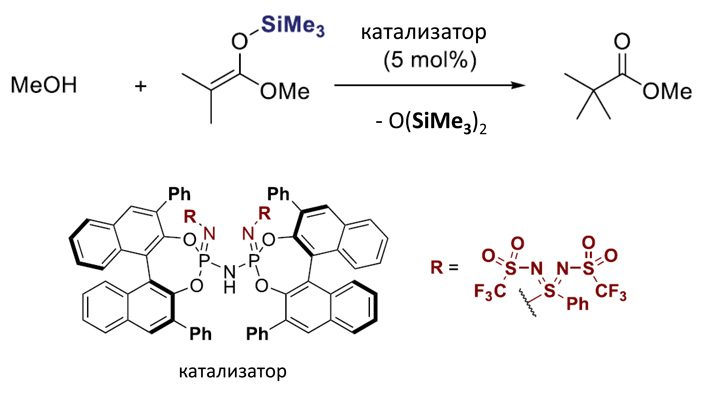
Старым методом катализаторы синтезировались в несколько стадий, на предпоследней из которых два реагента сливались. Новым методом реакция проходит в одну стадию при более низкой температуре и за более короткое время. Соответственно, выход реакции стал значительно больше (для примера с рис. 7 — в 3 раза). Также новый метод позволил ввести в катализаторы более объемные группы, которые раньше ввести не получалось из-за того, что реакция шла тяжелее. Вдобавок, впервые удалось ввести чувствительные сверхкислотные активные группы (см. рис. 9).
Рис. 8. Модельная реакция окисления серы с помощью старого и нового (более объемного) катализаторов
Чтобы продемонстрировать потенциал катализаторов, произведенных новым методом, ученые провели несколько модельных реакций (две из них показаны на рис. 8 и 9). В реакции, приведенной на рис. 8, синтезируется хиральный сульфоксид (см. sulfoxide; хиральный центр находится на атоме серы — в качестве четвертого заместителя выступает несвязанная электронная пара). С новым более объемным катализатором реакция произвела на 3,5% более хирально чистую молекулу, чем со старым. С более объемными группами движение молекулы сильнее затруднено и окисление серы чаще проходит в нужной конфигурации.
Рис. 9. Модельная реакция снятия кремниевой защитной группы с третбутил-метил-эстера
В реакции, показанной на рис. 9, используется наиболее кислотный катализатор: ученые хотели продемонстрировать катализ реакции снятия кремниевой защитной группы с кислорода. Такие реакции имеют огромное значение в органической химии (см., например, новость Связи кремний-водород можно каталитически хлорировать соляной кислотой без участия металлов, «Элементы», 18.01.2018), но при этом до сих пор не было известно, идут ли они с хиральными катализаторами.
В обоих случаях вроде результат не ахти: увеличение энантиоселективности в реакции с рис. 8 произошло всего на 3,5%, а в реакции с рис. 9 (хоть она и проведена впервые) — продукт вовсе не хиральный. Но авторы дают понять, что это всего лишь «тизер» и что они готовят новые публикации, где полностью раскроют потенциал реакций с новыми катализаторами. Ждём!
Как уже говорилось, важность асимметричного органокатализа сложно недооценить. Фармацевтические компании уже давно используют органические катализаторы вместо катализаторов с переходными металлами для проведения асимметричных реакций, где только возможно. Но помимо важности для «народного хозяйства» есть в этом методе какая-то высшая красота и праздник человеческого интеллекта. Похожий по своей научной красоте случай был, пожалуй, и с открытием молекулярных машин (см. новость Нобелевская премия по химии — 2016, «Элементы», 19.10.2016), но их, в отличие от катализаторов, пока нигде не используют. Идея спланировать без эволюции и сконструировать небольшой катализатор, который несколькими слабыми связями, правильно расположенными в пространстве, и без способностей переходных металлов играть электронами, как угодно, будет двигать высокоэнергетические процессы с блестящей селективностью видится мне, несомненно, величественной и заслуживающей высшей научной награды.
Источники:
1) Pinglu Zhang, Nobuya Tsuji, Jie Ouyang, and Benjamin List. Strong and Confined Acids Catalyze Asymmetric Intramolecular Hydroarylations of Unactivated Olefins with Indoles // Journal of the American Chemical Society. 2021. DOI: 10.1021/jacs.0c12042.
2) Sebastian A. Schwengers, Chandra Kanta De, Oleg Grossmann, Joyce A. A. Grimm, Natascha R. Sadlowski, Gabriela G. Gerosa, and Benjamin List. Unified Approach to Imidodiphosphate-Type Brønsted Acids with Tunable Confinement and Acidity // Journal of the American Chemical Society. 2021. DOI:10.1021/jacs.1c07067.