кишечнорастворимые лекарственные формы разрабатываются для
Кишечнорастворимые лекарственные формы разрабатываются для
Данное научное исследование направлено на доказательство эффективности использования кишечнорастворимых капсул для доставки препаратов. Этот метод достаточно инновационный и стремительно набирает популярность среди производителей лекарственных средств. В статье приводятся основные принципы работы капсул с энтеросолюбильным покрытием и детально описанный научный эксперимент, который проводился для оценки этой технологии.
— Преимущества кишечнорастворимых капсул
— Эксперимент: эффективность кишечнорастворимых капсул
— In Vitro тесты и результаты
— Результаты исследования в организме человека
Заказать кишечнорастворимые капсулы, прошедшие подтверждение соответствия, можно на нашем сайте по этой ссылке >>>
или по телефону: +7 (499) 350 80 20
Технология доставки лекарств кишечнорастворимой капсулой (ECDDT) была разработана для обеспечения пероральной доставки с полной кишечной защитой и быстрым высвобождением в верхнем желудочно-кишечном тракте (GI) без использования покрытий. Энтеросолюбильные свойства ECDDT достигаются путем включения фармацевтически одобренных кишечных полимеров в оболочку капсулы с использованием обычных способов изготовления капсул с покрытием. Исключая стадии подготовки и применения, используемые для кишечнорастворимого покрытия, технология ECDDT может предложить ускоренные сроки разработки и снизить программный риск. ECDDT также может позволить пероральную доставку чувствительных молекул, таких как нуклеотиды и пептиды, биологические продукты, такие как вакцины, и живые биотерапевтические продукты (LBP), которые чувствительны к высоким температурам или к водному раствору для покрытия, связанному с процессом его нанесения. Было показано, что энтеросолюбильные свойства и быстрое высвобождение специализированных оболочек капсул ECDDT соответствуют стандартам фармакопеи, как внутри организма, так и вне его. В качестве модельного соединения используется эсмепразол магния тригидрат (EMT).
Преимущества кишечнорастворимых капсул
Энтеросолюбильная защита исторически придавалась твердым лекарственным формам путем нанесения герметичного слоя с последующим нанесением покрытия с относительно высоким коэффициентом усиления (обычно ≥ 10%) с помощью рН-чувствительных полимерных систем с использованием роторных перфорированных панелей или оборудования с псевдоожиженным слоем.
Этапы производства, связанные с энтеросолюбильным покрытием, добавляют сложность, время и риск для действующего вещества. Оценка H2 Pharma Consulting приводит следующие моменты, на которые надо обратить внимание при использовании технологии ECDDT, чтобы уменьшить сложность разработки и обработки лекарственных форм для растворения в кишечнике:
Основная проблема при доставке препарата пероральным способом – защита различных чувствительных молекул, таких, как нуклеотиды, пептиды, живые биофармацевтические продукты, а также вакцин, от кислотного и ферментативного расщепления в желудочно-кишечном тракте. В некоторых случаях пероральная доставка может быть исключена полностью из-за необходимости кишечного покрытия. Высокие температуры (> 40 ° C), связанные с нанесением функционального покрытия и сушкой, могут деградировать эти чувствительные вещества и, как таковые, часто требуются парентеральные или другие пути доставки. Таким образом, использование кишечнорастворимых капсул может позволить пероральную доставку таких активов, обеспечивая полную энтеральную защиту и быстрое высвобождение вещества в верхнем желудочно-кишечном тракте.
Эксперимент: эффективность кишечнорастворимых капсул
Описание эксперимента
Энтеросолюбильные свойства кишечнорастворимых капсул оценивали с использованием эсмепразола магния тригидрата (ЕМТ) в качестве модельного соединения в виде гранул без покрытия. EMT был выбран в качестве модельного соединения как из-за релевантности рынка, так и высокой чувствительности к кислотной среде желудка. Известно, что ЕМТ быстро разрушается в кислых средах с кратковременной химической нестабильностью. Этот процесс легко идентифицируется желто-коричневым обесцвечиванием.
In Vitro тесты и результаты
Препараты в кишечнорастворимой капсуле с использованием ЕМТ были показаны в соответствии со спецификациями как для фармакопейного дезинтеграции, так и для испытания на растворение для гастроустойчивых лекарственных форм, как обсуждается далее.
Капсулы (n = 6) заполняли 20 мг гранул ЕМТ, не покрытых оболочкой, и затем оценивали с использованием устройства для дезинтеграции EP / USP типа B. Тест проводили в течение 2 часов на стадии кислоты (pH 1,2) без диска, а затем около 1 часа на буферной стадии (рН 6,8) с помощью диска. Для сравнения коммерчески доступные «кислотоупорные» капсулы, не предназначенные для предотвращения поступления жидкости в среду с pH 1,2, заполнялись теми же таблетками ЕМТ и тестировались с использованием того же метода.
Кишечнорастворимые капсулы (ECDDT) не показали никаких признаков раннего распада, разрыва или выделения содержимого, и после 2 часов на кислотной стадии не наблюдалось значительного обесцвечивания среды (рисунок 1). В буфере с pH 6,8 капсулы быстро дезинтегрировали в течение 30 минут в буферной стадии. Однако кислотоупорные капсулы показали явное свидетельство деформации и выделения содержания в кислотной стадии с быстрым обесцвечиванием среды желтым / коричневым цветом.
После кислотной стадии оба образца капсулы были открыты для наблюдения за заполненным содержимым. Содержание коммерческих кислотоупорных капсул состояло из коричневой жидкости с частично растворенными гранулами ЕМТ, демонстрируя, что значительное количество кислой среды мигрировало внутри капсул, что приводило к деградации ЕМТ. Гранулы ЭМТ в капсулах ECDDT показали минимальное обесцвечивание, что указывало на незначительную деградацию.
Капсулы ECDDT (n = 6), заполненные гранулами ЕМТ, также оценивали в соответствии с тестом на растворение EP / USP для гастроустойчивых лекарственных форм с использованием аппарата USP II (весло). Испытание проводили при 37 ° С / 100 об / мин в течение 2 часов на стадии кислоты (рН 1,2), а затем 1 час на буферной стадии (рН 6,8) с отбором проб в регулярные моменты времени. Было также оценено поведение растворения капсул с замедленным высвобождением Nexium 20 мг (n = 6) с использованием того же протокола. Для теста на растворение не наблюдалось солюбилизации капсул ECDDT, и каждая капсула показала менее 2% (LOD) высвобождения эзомепразола через 2 часа на стадии кислоты и более 90% высвобождения через 30 минут на буферной стадии.
Результаты исследования в организме человека
Известно, что эзомепразол демонстрирует быстрое пероральное всасывание (пик плазмы = от 1 до 3,5 часов) и короткий период полураспада (1,5 часа). Чтобы оценить эффективность in vivo для новой технологии, кишечнорастворимые капсулы заполняли гранулами без покрытия EMT и сравнивали с капсулами препарата Nexium, выбранного для исследования. В нем использованы желатиновые капсулы без покрытия, содержащие множественные частицы с лекарственным и энтеросолюбильным покрытием. Капсулы препарата выбирались в рандомизированной открытой однократной дозировке. Также, были проведены фармакокинетическое и гамма-фармакосинтетиграфическое исследования с использованием здоровых добровольцев в состоянии голодания.
Результаты in vivo (рисунок 2) показали, что гранулы не высвобождались из кишенорастворимых капсул в желудке и что капсула быстро открывалась в тонком кишечнике в течение 30 минут после опорожнения желудка до начала высвобождения лекарственного средства из растворения гранул. Капсулы Nexium открыли и выпустили их содержимое в желудок до опорожнения желудка.
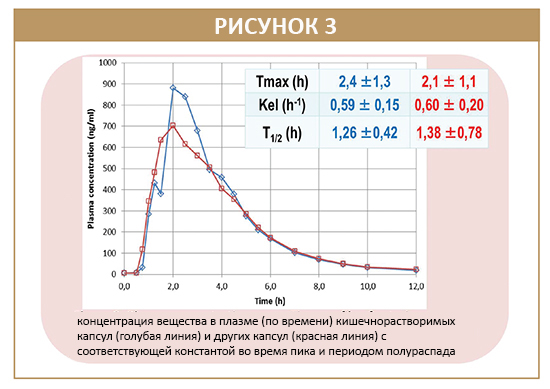
Профили PK капсул ECDDT и капсул Nexium показали сходную скорость абсорбции лекарственного средства, особенно в отношении пикового времени Tmax, константы элиминации kel и периода полураспада t½ (рисунок 3). Общая биодоступность ЕМТ была увеличена с использованием композиций капсул ECDDT, при этом Cmax и AUC увеличились на 56% и 32% соответственно по сравнению с Nexium.
Итоги
Технология доставки лекарств с помощью кишечнорастворимой капсулы использует фармацевтическую целлюлозную энтеросолюбильную композицию в качестве водной дисперсии для получения оболочек капсул с помощью традиционной технологии изготовления капсул. Энтеросолюбильные свойства капсул оценивали «in vitro» и результаты показали, что они соответствуют фармакопейным критериям времени растворения. Это продемонстрировано как при тестировании «in vitro», так и «in vivo» при помощи гамма-фармакосинтетики человека, что кишечнорастворимые капсулы защищают активное вещество (ЕМТ) от влияния кислотной среды желудка, не открываются в желудке и обеспечивают быстрое высвобождение в двенадцатиперстной кишке.
Кишечнорастворимые капсулы (ECDDT) представляют собой новое, более быстрое и простое средство для пероральной доставки лабильных веществ, таких как пептиды, нуклеотиды, живые биофармацевтические продукты и вакцины. Интегрированная энтеросолюбильная функциональность в дозированной форме капсулы дает новые возможности для быстрого создания прототипа и скрининга рецептуры, позволяет быстро тестировать результаты «in vivo» и минимизирует риск событий вне спецификации при проблемах с кишечной продуктивностью при испытаниях на расширение и стабильность производства. Избежание высоких температур, связанных с применением кишечнорастворимого покрытия, также может обеспечить пероральную передачу активных веществ, требующих энтеральной защиты, но чувствительных к термическому разложению.
В настоящее время проводятся испытания кишечнорастворимых капсул для дальнейшей оценки диапазона и применения технологии, включая оральные биофармацевтические продукты, вакцины и пероральные пептидные продукты от фазы III доклинических исследований.
Кишечнорастворимые лекарственные формы разрабатываются для
В. В. Могилюк, менеджер службы инноваций Корпорации «Артериум»
Первые упоминания о препарате, который растворяется после прохождения желудка, датируются 1843 годом во французском патенте. Авторы использовали кусочки мембраны, изготовленные из кишечника овцы, которые после смачивания наносили на пилюлю и подвергали сушке. Подготовленная пилюля обвязывалась тонкой нитью и скреплялась каплей желатина. Авторы заявляли, что приготовленная таким образом пилюля проходит через желудок невредимой и дезинтегрирует в кишечнике, что позволяет исключить «тошнотворную отрыжку», которая случалась при применении желатиновых капсул.
Это были первые задокументированные попытки получения пероральных лекарственных форм (ЛФ) устойчивых к среде желудка и высвобождавших активное начало в кишечнике. Впоследствии, в 1884 г. швейцарским фармацевтом была предпринята удачная попытка улучшить кишечнорастворимое покрытие. Для разработки рецептур были использованы неперевариваемые в желудке материалы: жиры, воски и резины. Первичный успех на рынке завершился разочарованием, так как была обнаружена тенденция кишечнорастворимого покрытия к абсорбции влаги, набуханию и преждевременному разрыву. В 1895 г. другой швейцарский фармацевт использовал новый подход — замачивание наполненных желатиновых капсул в растворе формальдегида с последующей сушкой. Такая обработка капсул упрочняла желатиновую оболочку, замедляла ее растворение, что позволяло высвобождаться активному фармацевтическому ингредиенту (АФИ) в кишечнике. Работодатель изобретателя в 1904 г. получил патент на способ производства пустых желатиновых капсул посредством обработки желатина в формальдегиде, что позволило ему производимые в Германии капсулы экспортировать в США.
В 1938 г. ученые (J. T. Gorleyи C. O. Lee) сфокусировали свое внимание на трех основных материалах: стеариновая кислота, смола Сандарак и шеллак, которые испытывались как отдельно, так и в комбинации с другими вспомогательными веществами (эксципиентами). Учеными было обнаружено, что при использовании спиртового раствора, содержащего шеллак (80 частей) и касторовое масло (20 частей) удается получить подходящее кишечнорастворимое покрытие на поверхности как таблеток, так и капсул.
На сегодняшний день фармация далеко отошла от широкого использования экстемпоральных лекарственных средств. Для нанесения кишечнорастворимых покрытий на таблетки, капсулы, пеллеты, гранулы (рис. 1), кристаллы (рис. 2), при промышленном производстве лекарственных средств (ЛС), используется разнообразное высокотехнологичное фармацевтическое оборудование и робастные формуляции.