компактная форма хроматина это
Компактная форма хроматина это
• Индивидуальные хромосомы могут быть видны только в митозе
• В интерфазе основная масса хроматина находится в форме эухроматина, который по сравнению с митотическими хромосомами упакован менее плотно
• В интерфазе гетерохроматиновые области остаются плотно упакованными
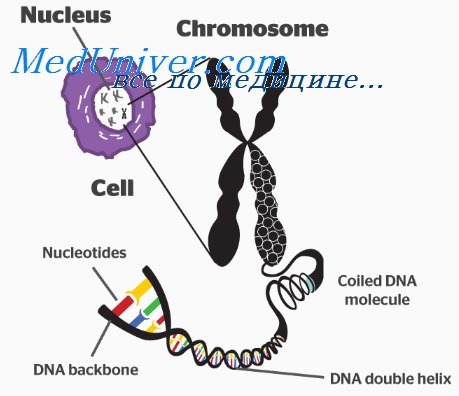
Каждая хромосома содержит очень длинную двойную цепь ДНК, которая скручена в фибриллу, расположенную по всей хромосоме. Таким образом, при разработке модели структуры интерфазного хроматина и митотических хромосом, мы должны предусмотреть упаковку одной, крайне длинной молекулы ДНК в форму, которая позволяет транскрипцию и репликацию, и периодически может менять степень своей упаковки.
В клетках эукариот индивидуальные хромосомы заметны только в момент деления, когда отчетливо видна каждая из них. На рисунке ниже представлена фотография пары сестринских хроматид в метафазе, полученная в электронном микроскопе. (Сестринские хроматиды представляют собой дочерние хромосомы, образовавшиеся при репликации, но на этой стадии митоза еще остающиеся связанными друг с другом.) Каждая хроматида состоит из фибриллы мозаичного вида диаметром около 30 нм.
Плотность упаковки ДНК в хромосоме в 5-10 раз превышает плотность ее упаковки в интерфазном хроматине.
Однако в течение большей части цикла эукариотической клетки, ее генетический материал занимает в ядре пространство, в котором нельзя различить отдельные хромосомы. 30-нм фибрилла, составляющая основу хроматина, организована так же, как митотическая хромосома, или близка к ней по структуре.

Видны области компактного гетерохроматина, расположенные преимущественно в области ядрышек и ядерной оболочки.
Хроматин обладает двумя типами структуры, каждую из которых можно наблюдать на ядерных препаратах:
• В большинстве областей фибриллы упакованы гораздо менее плотно, чем в митотических хромосомах. Эти области содержат эухроматин. Он отличается относительно менее плотной упаковкой и занимает большую часть ядра.
• Некоторые области, содержащие хроматин, очень плотно упакованы фибриллами, что напоминает упаковку митотических хромосом. Эти области содержат гетерохроматин. Обычно гетерохроматин локализуется в области центромеры, но также может располагаться и в других местах. На протяжении клеточного цикла степень конденсации гетерохроматина практически не изменяется. В ядре гетерохроматин расположен в виде отдельных скоплений, но чаще его области агрегируют, образуя интенсивно прокрашивающийся хромоцентр. (Этот термин применяется к областям ядра, которые всегда содержат гетерохроматин, называемый конститутивным гетерохроматином. Наряду с этим, существует другой вид гетерохроматина, который называется факультативный гетерохроматин. Для него характерна возможность перехода в эухрома-тиновое состояние.)
Одна и та же фибрилла находится в области эу- и гетерохроматина. Это позволяет предполагать, что два вида хроматина отражают различную степень конденсации генетического материала. Точно так же различной степенью конденсации характеризуются области эухроматина в интерфазе и митозе. Таким образом, генетический материал организован таким образом, чтобы обеспечить одновременное существование в хроматине альтернативных состояний и циклических изменений его упаковки между интерфазой и делением. Далее мы обсудим молекулярные основы такой организации.
Структурное состояние генетического материала коррелирует с его функциональной активностью. Конститутивный гетерохроматин характеризуется следующими особенностями:
• Он постоянно находится в конденсированном состоянии.
• В нем часто присутствуют многократные повторы небольших нетранскрибируемых участков ДНК.
• В гетерохроматиновой области плотность генов гораздо ниже, чем в эухроматине, и гены, которые транслоцируются в эту или расположенную поблизости область, часто инактивируются.
• По-видимому, из-за своей плотной упаковки гетерохроматин реплицируется позже, чем эухроматин, и отличается низкой частотой генетических рекомбинаций.
Известны некоторые молекулярные маркеры, позволяющие констатировать изменения свойств ДНК и белковых компонентов хроматина. К числу их относится снижение степени ацетилирования гистонов, усиление метилирования одного из этих белков, и гиперметилирование цитозино-вых остатков в ДНК. Эти молекулярные изменения приводят к конденсации хроматина, которая является причиной отсутствия у него метаболической активности.
Хотя в эухроматине находятся активные гены, в каждый данный момент времени транскрибируется лишь небольшое количество последовательностей ДНК Таким образом, локализация гена в эухроматине является необходимым, но недостаточным условием для его экспрессии.
каждая из которых содержит фибриллу (диаметром 30 нм),
компактно упакованную в хромосому.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Компактная форма хроматина это
Определять содержание полового хроматина наиболее удобно в клетках слизистой оболочки полости рта после одномоментной окраски мазка ацетоорсеином; соскоб берут обычно шпателем со слизистой оболочки щеки. Число обнаруживаемых одиночных телец полового хроматина зависит от техники окраски и метода сосчитывания. Обычно подсчитывают 100 клеток, учитывая только клетки срединного слоя с расположением полового хроматина у ядерной оболочки. Мазки не должны иметь признаков бактериального инфицирования.
Индивидуумы с одиночным тельцем полового хроматина в указанной пропорции в клетках буккального мазка имеют две Х-хромосомы, с 2, 3 и 4 тельцами — соответственно 3, 4 или 5 Х-хромосом. При отсутствии полового хроматина имеется лишь одна Х-хромосома, а наличие большого или, наоборот, маленького тельца полового хроматина может свидетельствовать о нарушениях в Х-хромосоме. Низкое содержание полового хроматина иногда указывает на мозаицизм по половым хромосомам.
Половой хроматин может также обнаруживаться в полиморфно-ядерных лейкоцитах в виде так называемых барабанных палочек. У женщин на каждые 500 полиморфно-ядерных лейкоцитов обнаруживается избыток в виде шести барабанных палочек. У мужчин вообще находят только отдельные барабанные палочки. Как и тельца полового хроматина (тельца Барра), барабанные палочки представляют собой гетеропикнотическую Х-хромосому и обнаруживаются не так легко, как при исследовании буккального мазка, однако технически мазок корви приготовить легче.
Препараты крови готовят обычным способом, окрашивают по Фельгену фуксинсернистой кислотой, по Паппенгейму метиловым зеленым — пиронином или гематоксилином по Грюнвальду — Гимзе. Число барабанных палочек подсчитывают в 500 клетках; достоверным считается, когда половой хроматин обнаруживается в 6 и больше из 500 лейкоцитов.
Dokumov и Spasov описали колебания в содержании полового хроматина в течение менструального цикла. У большинства женщин при нормальном менструальном цикле эти колебания соответствуют изменениям эозинофильного индекса кольпоцитограммы. Наибольшее падение полового хроматина совпадает с периодом овуляции, заметное уменьшение отмечается в фазе роста и созревания фолликула, а также при лечении гормональными препаратами.
По наблюдениям Даутовой Ф. Р. и Сотниковой Л. Г., содержание полового хроматина у здоровых женщин меняется с возрастом. Так, до 45 лет процент хроматинположительных клеток находится в пределах 32—68, а в возрасте 46—62 лет снижается до 28—42.
Исследования, проведенные в нашей клинике Филлипповой В. В., Чибиковой Т. В. и Чилингариди А. П., выявили наличие циклическх колебаний уровня содержания полового хроматина в элементах буккального и влагалищного эпителия у здоровых женщин с нарастанием его в фазе желтого тела, а также более высокое содержание во влагалищном по сравнению с буккальным.
Содержание полового хроматина с интенсивностью гормональных влияний непосредственно не связано. Вместе с тем Л. И. Тычинекий, обнаруживший снижение содержания полового хроматина у больных с синдромом склерокистозных яичников, наблюдал нарастание его спустя 4 мес и больше после операции в противоположность падению уровня экскреции 17-КС. Половой хроматин снижен у больных с первичным бесплодием, при дисфункции яичников, развившейся после родов и абортов [Ф. Р. Даутова, Л. Г. Сотникова].
Приведенные данные показывают, что путем исследования полового хроматина можно достаточно четко отграничить больных с хромосомными аномалиями развития половой системы от больных с первичными эндокринопатиями. По мнению Dew-hurst, Barr и др., показаниями к исследованию полового хроматина в гинекологии являются первичная аменорея, нарушение дифференцировки наружных половых органов, вторичная аменорея в сочетании с клиническими симптомами дисгенезии гонад.
Показанием к исследованию кариотипа является отсутствие полового хроматина или низкий процент и малый размер телец Барра. Zizka и соавт. рекомендуют параллельно проведению цитогенетических исследований при клиническом обследовании обращать внимание на массу тела и рост обследуемой, возраст родителей при ее рождении, развитие и состояние здоровья братьев и сестер, их плодовитость, проводить изучение родословной. Генные дефекты могут также способствовать возникновению отклонений от правильных гармоничных соотношений между отдельными частями тела, вследствие чего телосложение приобретает иногда диспластические черты.
Компактная форма хроматина это
Весь генетический материал клетки находится в упакованном виде в относительно ограниченном объеме. У бактерий генетический материал находится в виде нуклеоида, который образует в клетке дискретную массу. В интерфазном ядре эукариотической клетки генетический материал упакован в массе хроматина.
Упаковка хроматина характеризуется гибкостью и на протяжении клеточного цикла меняется. Во время деления (митоза или мейоза), когда становятся видимыми отдельные хромосомы, интерфазный хроматин становится упакованным более плотно.
Хромосомы представляют собой форму изоляции генетического материала при клеточном делении. Характерной структурной особенностью, благодаря которой это достигается, является центромера, представляющая собой перетяжку на теле хромосомы, видимую в световом микроскопе. При достаточно высоком разрешении видно, что центромера включает кинетохор, структуру, посредством которой она прикрепляется к микротрубочкам.
Обычно эукариотические хромосомы состоят из очень длинных линейных молекул ДНК, и еще одной их характерной особенностью является наличие теломеры, которая стабилизирует концы хромосом и достраивается по специальному механизму, в обход трудности репликации концов линейной ДНК.
ДНК упакована с высокой плотностью. Для нуклеоида бактерий она составляет около 10 мг/мл, для ядра клетки эукариот порядка 100 мг/мл, а для головки фага Т4 более 500 мг/мл. Растворы такой концентрации представляют собой вязкий гель, и по непонятной причине столь высокая концентрация необходима для проявления белками способности находить сайты связывания на ДНК. Различные процессы, протекающие с участием ДНК, например репликация и транскрипция, должны осуществляться в очень ограниченном пространстве.
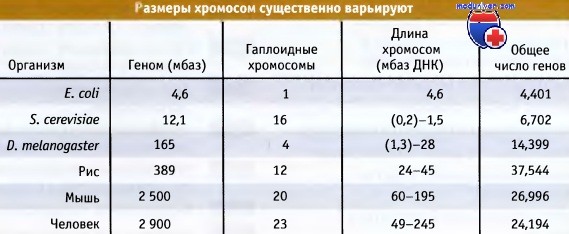
Организация ядерного материала должна соответствовать переходам от неактивного к активному состоянию хроматина. Рисунок ниже иллюстрирует сильные различия в размере генома и в содержании ДНК хромосом некоторых организмов.
Длина линейной молекулы ДНК существенно превышает размер того региона, в котором она находится. Плотно упакованная структура образуется в результате связывания ДНК с основными белками. Положительно заряженные группы белков нейтрализуют отрицательно заряженные группы в ДНК. Организация нуклеопротеидного комплекса определяется взаимодействием белков с ДНК, в результате чего образуется плотно спирализованная структура.
Таким образом, в отличие от распространенной картинки, на которой ДНК представлена в виде протяженной двойной спирали, она, как правило, подвержена структурным деформациям сгиба или скручивания, обеспечивающим образование более компактной структуры.
Большая часть хроматина обладает довольно рыхлой структурой; он называется эухроматин и содержит активные гены. Отдельные участки хроматина упакованы более плотно; они соответствуют генетически неактивному гетерохроматину.
Какова общая структура хроматина и какие существуют различия между активными и неактивными последовательностями? Высокая плотность упаковки генетического материала позволяет предполагать, что ДНК не может быть прямо упакована в конечную структуру хроматина. Должна существовать определенная иерархия ее пространственной организации. Основной вопрос заключается в специфичности упаковки. Следует ли скручивание ДНК определенному общему принципу или же происходит по разному в каждой индивидуальной копии генома? Каким образом меняется вид упаковки при репликации или транскрипции сегмента ДНК?
Основная структурная единица хроматина во всех эукариотических клетках одна и та же. Нуклеосома содержит примерно 200 пн ДНК и является октамером, состоящим из небольших основных белков, имеющим форму бусины. Эти белки представляют собой гистоны. Они образуют внутреннее ядро частицы, а ДНК находится на ее поверхности. В интерфазном ядре и в митотических хромосомах нуклеосомы являются постоянным компонентом эу- и гетерохроматина.
Нуклеосомы обеспечивают начальный уровень организации хроматина. Они обеспечивают упаковку молекулы ДНК длиной 67 нм в структуру, диаметром 11 нм. Компоненты нуклеосом и их строение хорошо изучены. Последовательность нуклеосом, расположенная линейно образует «10-нм нуклеосомную нить».
Следующий уровень организации представляет собой скручивание последовательности нуклеосом в спиральные витки. При этом создается фибрилла диаметром около 30 нм; она присутствует в интерфазном хроматине и в митотических хромосомах. В результате плотность упаковки увеличивается в 6-7 раз на ед. длины. Упаковка в такую структуру требует участия дополнительных белков и исследована недостаточно.
Окончательная плотность достигается на третьем уровне организации, включающем упаковку самой 30-нм фибриллы. Этот уровень приводит к 50-кратно-му увеличению плотности упаковки в эухроматине по сравнению с упаковкой в 30-нм фибрилле. Эухроматин периодически упаковывается в митотические хромосомы, при этом плотность упаковки возрастает в 5-10 раз. Обычно плотность упаковки гетерохроматина такая же, как в митотических хромосомах.
В хроматине содержится примерно в два раза больше белка, чем ДНК. Примерно половина всего количества белка сосредоточена в нуклеосомах. Количество РНК составляет менее 10% от содержания ДНК. Большая часть РНК представлена вновь образованными транскриптами, еще связанными с матричной ДНК.
Изменения структуры хроматина обеспечиваются связыванием дополнительных или модификациями существующих белков. Репликация и транскрипция требуют раскручивания ДНК, и, таким образом, должны включать разупаковку структуры, которая позволяет соответствующим ферментам работать на ДНК. Вероятно, это сопровождается изменениями на всех уровнях организации.
Все белки хроматина, за исключением гистонов, относятся к негистоновым белкам. По сравнению с гистонами, в разных тканях и организмах эти белки характеризуются более разнообразным составом, и в хроматине их содержится меньше, чем гистонов. Они также составляют более многочисленную группу, так что любой индивидуальный негистоновый белок присутствует в количествах гораздо меньших, чем любой гистон.

каждая из которых содержит фибриллу (диаметром 30 нм),
компактно упакованную в хромосому.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Путешествие внутрь клеточного ядра, или Системная биология хроматина
Путешествие внутрь клеточного ядра, или Системная биология хроматина
За последние десятилетия наука о хроматине из чисто описательной цитологической дисциплины превратилась в область системной биологии, активно использующую высокопроизводительное секвенирование для реконструкции пространственной организации генетической «начинки» клеточного ядра.
Автор
Редакторы
Развитие технологий высокопроизводительного секвенирования позволило изучить структуру хроматина на ранее невиданном для клеточных биологов уровне — на уровне взаимодействий отдельных участков генома! Четвертая статья цикла «Пятерка по системной биологии» расскажет, как устроена современная наука о хроматине. Проекты стипендиатов посвящены как фундаментальным аспектам динамики хроматина и внутрихроматиновых взаимодействий, так и изучению организации хроматина с помощью высокопроизводительных методов у разных живых организмов.
Пятерка по системной биологии
Победителями Стипендиальной программы по системной, клеточной и молекулярной биологии, организованной российскими аффилированными лицами компании «Филип Моррис Интернэшнл» (ФМИ) на базе Центра наук о жизни Сколковского института науки и технологий, ежегодно становятся пять молодых ученых до 35 лет. Знания по своим темам у стипендиатов, без сомнения, также заслуживают «пятерки» — поэтому спецпроект и получил такое название.
В статьях цикла наши авторы пообщаются со стипендиатами разных лет, профессорами и преподавателями Сколтеха, а также с представителями ФМИ.
Партнер спецпроекта — российские аффилированные лица компании «Филип Моррис Интернэшнл» (ФМИ), которая активно ведет исследования в области биомедицины, системной биологии и биотехнологий.
Наука о хроматине: вчера, сегодня, завтра
Под термином «хроматин» понимают комплекс геномной ДНК и белков, в виде которого генетический материал упакован в ядре эукариотической клетки (впрочем, сложная упаковка генома присуща не только эукариотам, а, например, еще и археям [2]). Этот термин в 1879 году предложил немецкий цитолог Вальтер Флемминг. Он изучал митоз с помощью светового микроскопа [3] и обнаружил, что в определенный момент в ядре клетки появляются легко визуализируемые нитевидные структуры. Сам Флемминг считал, что введенный им термин надолго не закрепится: «Слово “хроматин” будет существовать, пока его химическая природа остается неизвестной. Пока же им следует обозначать нитевидные, легко окрашиваемые структуры в ядре делящейся клетки [4]».
Вряд ли Флемминг мог предположить, что через более чем сто лет слово «хроматин» не только не исчезнет из словаря клеточной и молекулярной биологии, но и будет регулярно появляться в заголовках статей ведущих научных журналов, а сама наука о хроматине из области цитогенетики вырастет в динамично развивающееся междисциплинарное направление на стыке биологии, химии и информатики.
Но давайте обо всем по порядку.
Бурное изучение химической природы ДНК, начавшееся в первой половине XX века и завершившееся триумфальным открытием структуры ДНК Уотсоном и Криком, положило начало новой главе в изучении хроматина. В 1960-х годах биологи занялись исследованием белковой составляющей хроматина, а также его эпигенетических модификаций (подробнее об эпигенетике читайте в нашей статье «Эпигенетика: невидимый командир генома» [5]).
Однако несмотря на все успехи «охотников за хроматином», в те годы всё еще не было убедительного ответа на «детский» вопрос: как длинная, очень длинная молекула ДНК (у человека длиной 2 м в каждой клетке) умещается в крошечном пространстве клеточного ядра?
Подробнее об истории развитий представлений об организации хроматина, интервью с Леонидом Мирным из Массачусетского технологического института (о нем тоже идет речь в тексте) и о том, что сейчас известно о пространственной организации генома, читайте в нашей статье «Организовать геном: запутанная история гипотез и экспериментов» [6].
Во второй половине XX века специалисты по электронной микроскопии всерьез занялись изучением пространственной организации хроматина в клеточном ядре и достигли в этом существенных успехов. Так, в 1974 году была описана нуклеосома — «диск» из восьми молекул гистонов, на который намотана ДНК длиной примерно 200 пар оснований [7].
Однако попытки идентифицировать с помощью электронной микроскопии в хроматине структуры более высокого порядка дали неоднозначные результаты. Дело в том, что пробоподготовка препаратов для электронной микроскопии приводит к появлению множества артефактов, поэтому ряда структурных элементов хроматина, визуализируемых с помощью электронного микроскопа, в действительности в живой клетке просто нет.
Принципиально новая глава в изучении хроматина открылась на рубеже XX–XXI веков в связи с развитием методов высокопроизводительного секвенирования хроматина. Благодаря приходу биоинформатики в классическую цитологию биологи получили беспрецедентную возможность изучать пространственную организацию хроматина в живой клетке на уровне взаимодействий отдельных участков генома! Новые методы изучения организации хроматина, которые называют C-методами по названию первого разработанного из них — Chromosome Conformation Capture, — основываются на идее, что фрагменты генома, контактирующие друг с другом и, следовательно, располагающиеся рядом, можно сшить в одну молекулу ДНК, которую далее можно отсеквенировать [8] и узнать последовательности взаимодействующих участков.
Один из самых популярных методов для изучения пространственной организации хроматина — Hi-C (подробнее о нем см. во врезке ниже). Он позволяет изучать на полногеномном уровне взаимодействия различных участков генома.
Рисунок 1. Екатерина Храмеева, кандидат биологических наук, старший преподаватель Сколтеха
«Перелом случился с изобретением метода Hi-C в 2009 году, — рассказывает “Биомолекуле” Екатерина Храмеева, стипендиат 2016 года, которая, кстати, сейчас принимает участие в оценивании заявок на стипендию (рис. 1). — Статья с описанием метода Hi-C, вышедшая в Science [9], насчитывает около 3000 цитирований, что очень много. Hi-C — это, возможно, один из самых сложных протоколов в молекулярной биологии, в основном из-за своей многоступенчатости. Каждый отдельный шаг не вызывает запредельных трудностей, но все их нужно выполнить очень аккуратно и не допустить ошибки. И, главное, если всё же допущена ошибка на каком-то из этапов, об этом становится известно только в самом конце пути, когда потрачено много времени и денег на реактивы и секвенирование. Из-за таких трудностей на заре становления метода эксперименты Hi-C умели делать считанные лаборатории в мире (наши коллабораторы — лаборатория Сергея Владимировича Разина в Институте биологии гена РАН — была одной из них), но теперь Hi-C научились делать многие группы, и публикации о хроматине без Hi-C-данных — редкость.
«Биомолекула» опубликовала интереснейшую статью, повествующую о становлении нового подхода к изучению клеточного ядра «из первых рук»: «Новый взгляд на геном: не просто цепочка генов, а трехмерная сеть, интегрирующая функциональные домены ядра» [10]. Ее автор, Сергей Владимирович Разин, стал одним из основателей новой науки о хроматине и пионером этой области в России. Результаты, полученные его лабораторией, неоднократно публиковались в ведущих научных журналах, в частности, в 2017 году Nature опубликовал их исследование, посвященное реорганизации хроматина ооцита после оплодотворения [11], [12]. — прим. автора статьи.
Интересно, что ключевым прорывом стало именно использование высокопроизводительного секвенирования. Методы, похожие на Hi-C, были известны и до 2009 года, но они позволяли расшифровать укладку хроматина только на небольшой части генома, из-за чего их применимость была ограничена. Hi-C же впервые позволил получить полногеномную карту упаковки хроматина в ядре, причем очень точную. Такая карта — это очень большой объем информации, что называется, “большие данные”: огромная матрица, весь геном против всего генома. Поэтому сразу возникла необходимость в разработке новых вычислительных, биоинформатических методов для анализа этих данных, т.к. никакие из существующих не годились. Леонид Мирный и Максим Имакаев из Массачусетского технологического института были пионерами в этом направлении, потом другие группы подключились, в том числе и наша».
Метод Hi-C — основа изучения организации хроматина
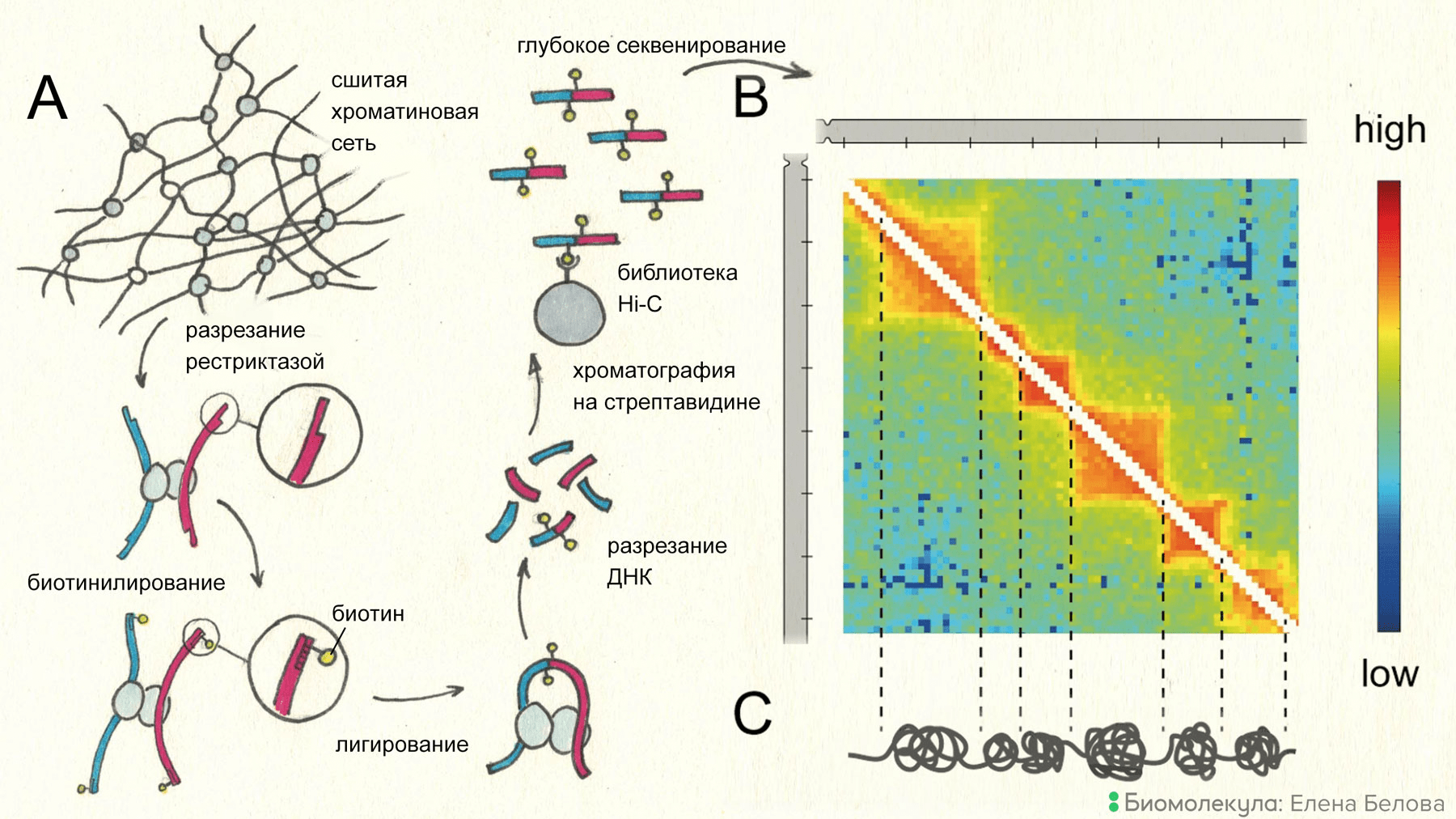
Hi-C (рис. 2) выглядит следующим образом. Сначала клетки фиксируют формальдегидом, при этом между взаимодействующими участками хроматина образуются кросс-сшивки. Далее с ДНК удаляют гистоны, которые не были сшиты с другими белковыми молекулами при фиксации, и очищенную ДНК, связанную через гистоны в местах контактов, обрабатывают рестриктазой. При этом образуются липкие концы, которые достраивают, включая в состав фрагментов нуклеотиды, меченные биотином. После этого образуются комплексы, состоящие из двух молекул ДНК, соответствующих взаимодействующим участкам генома и меченных биотином, которые ковалентно связаны с одними и теми же гистонами, которые в клетке покрывали взаимодействующие участки генома. Теперь фрагменты генома, которые в клетке находились в непосредственном контакте, можно с помощью процедуры лигирования (то есть сшивания) объединить в одну молекулу и за счет биотина, включенного в состав фрагментов, отобрать из клеточного экстракта при помощи белка стрептавидина, обладающего очень высоким сродством к биотину. В результате получается библиотека молекул ДНК, каждая из которых состоит из двух ковалентно сшитых друг с другом участков генома, которые взаимодействовали друг с другом в клетке.
Рисунок 2. Принцип метода Hi-C. Конфигурацию хроматиновой фибриллы в ядре фиксируют формальдегидом. После экстракции непришитых гистонов ДНК разрезают рестриктазой и застраивают липкие концы с использованием биотинилированного предшественника. Далее проводят лигирование. Сшитые фрагменты выделяют посредством аффинной хроматографии на шариках со стрептавидином, который специфически связывает биотин. Полученный препарат секвенируют и результаты накладывают на референсный геном. Получаемая в итоге «тепловая карта» позволяет судить о частотах контактов между удаленными геномными элементами. На приведенной в секции B тепловой карте красный цвет соответствует наиболее высокой частоте пространственных взаимодействий. Выраженные треугольники на карте свидетельствуют о существовании контактных доменов, внутри которых пространственные взаимодействия наблюдаются намного чаще, чем в хроматине между доменами. Контактные домены обычно отождествляют с хроматиновыми глобулами, хотя убедительные свидетельства в пользу такой интерпретации появились лишь недавно.
После глубокого секвенирования фрагментов и биоинформатической обработки полученных прочтений на выходе получается тепловая карта взаимодействий, на которой отображена частота выявленных взаимодействий между разными участками генома. По каждой из двух осей карты откладывают крупный участок генома (например хромосому), и квадратики, получающиеся при разбиении каждой из осей на участки генома некоторой длины, закрашивают в зависимости от частоты взаимодействия двух участков генома. Такая карта симметрична относительно диагонали, и более ярко окрашенные треугольники на ней соответствуют хроматиновым доменам, которые также называют топологически-ассоциированными. Внутри этих доменов участки хроматина взаимодействуют друг с другом намного чаще, чем за их пределами. Как удалось недавно доказать, хроматиновые домены, выявленные с помощью Hi-C, примерно тождественны хроматиновым глобулам, которые можно обнаружить в живых клетках с помощью микроскопии [13].
Помимо лаборатории Сергея Разина из Институте биологии гена РАН в России есть и другие группы, освоившие метод Hi-C, например, группа Вениамина Фишмана из Новосибирского государственного университета или лаборатория Олега Гусева в Казанском федеральном университете. Лаборатория Екатерины Храмеевой, одного из пионеров новой науки о хроматине в России, анализирует экспериментальные данные Hi-C, поставляемые учеными из ИБГ РАН.
«Сейчас ведутся попытки разработать новый метод, лучше Hi-C, — продолжает Екатерина. — Но пока появляются только улучшенные версии Hi-C с небольшими модификациями, повышающими качество данных на выходе. В целом, развитие идет скорее количественно. В последние годы публикуется всё больше и больше данных Hi-C в разных модельных системах и организмах, так как метод стал более доступным, да и секвенирование упало в цене. А для Hi-C это особенно важно: стоимость секвенирования для Hi-C примерно равна квадрату стоимости секвенирования для любого другого типа эксперимента, поскольку на выходе получаются двумерные данные в виде матрицы, а не одномерные, как для измерения экспрессии генов, например. Работ публикуется много, но мне кажется, что анализ данных не всегда поспевает за их производством: часто снимают только “сливки”, хотя еще столько интересного можно было исследовать!»
На вопрос о потенциальном практическом применении знаний о хроматине, полученных с помощью высокопроизводительных методов, Екатерина отвечает, что нарушения упаковки хроматина приводят к изменениями в экспрессии генов, и, как следствие, к тяжелым заболеваниям — нарушениям развития и онкологическим болезням: нейробластоме, лейкемии, медуллобластоме, глиоме, раку прямой кишки. Эти онкологические заболевания являются многофакторными и у каждого пациента могут быть вызваны поломками в разных местах генома. Таким образом, изучение всего многообразия нарушения упаковки хроматина необходимо для развития персональной медицины, для разработки новых методов лечения и диагностики.
«Если рассуждать более широко, то изучение хроматина позволит нам лучше понять известные и, возможно, определить новые молекулярные механизмы регуляции экспрессии генов, — считает Екатерина Храмеева. — Здесь особенно полезны знания о взаимосвязи структуры и функции, чем наша лаборатория в основном и занимается. Понимание регуляции экспрессии, в свою очередь, важно для идентификации механизмов развития целого спектра заболеваний. Без расшифровки этих механизмов невозможна разработка новых лекарственных препаратов и подходов к лечению».
Область на стыке клеточной биологии и биоинформатики, занимающуюся изучением пространственной организации хроматина, называют 3D-геномикой. Она позволяет взглянуть на многие биологические процессы с совершенно нового ракурса — изменений организации хроматина. Какие изменения в структуре хроматина можно найти в раковых клетках? Отличаются ли по пространственной организации хроматина клетки разных тканей одного организма или клетки разных биологических видов? Как меняется структура хроматина в клеточном ядре при разнообразных видах стресса? Есть в молодой науке о хроматине и огромный простор для улучшения старых и разработки новых алгоритмов, позволяющих получить как можно более точное представление об организации хроматина в разных типах клеток и разных организмах. «Биомолекула» узнала все подробности об этом из первых рук — от молодых российских исследователей, занимающихся хроматином.
Исследования «Филип Моррис Интернэшнл» по системной токсикологии
Джулия Хёнг (Julia Hoeng), директор по системной токсикологии «Филип Моррис Интернэшнл», рассказала «Биомолекуле», почему для ФМИ представляют интерес работы, связанные с системной биологией хроматина.
Токсикология — это область медицины, изучающая ядовитые вещества. Системная токсикология интегрирует классическую токсикологию и количественный анализ разнообразных и молекулярных изменений, которые происходят в организме под действием ядов, на всех уровнях [14].
К числу этих подходов относится и эпигенетика. Исследователи ФМИ пытаются выяснить, каким образом курение сигарет и других табачных продуктов влияет на эпигеном (совокупность всех эпигенетических меток) человека и, следовательно, экспрессию генов и риск возникновения различных заболеваний.
Оценивая воздействие на организм человека бездымных продуктов с пониженным риском, специалисты ФМИ, помимо прочего, исследуют изменения в метилировании ДНК, модификациях гистонов и доступности хроматина.
Что же касается пространственной организации генома, то ученые ФМИ используют Hi-C прежде всего для сборки геномов растений. Дело в том, что метод Hi-C включает этап глубокого секвенирования с высоким покрытием. Хотя Hi-C и родственные методы позволяют изучать взаимодействия участков генома, в том числе и энхансеров с соответствующими промоторами, а также исследовать транскрипционную активность участков генома, специалисты ФМИ пользуются преимущественно методом иммунопреципитации хроматина с последующим секвенированием (ChIP-seq), поскольку этот метод больше подходит для масштабных токсикологических исследований.
У Джулии Хёнг также есть свое видение будущего 3D-геномики:
— 3D-геномика, особенно на уровне единичных клеток, — это очень молодая область, и для дальнейшего использования в биомедицине и системной токсикологии она должна пройти стандартизацию и оптимизацию. Быстрый прогресс методов высокопроизводительного секвенирования, в частности, развитие технологий длинных прочтений (секвенирование третьего поколения [15]), может привести к существенному повышению чувствительности и точности методов изучения единичных клеток до уровня, сопоставимого с биомедицинскими исследованиями [16], [17].
Как устроен хроматин мыши и дрозофилы
Стипендиат 2018 года: Александра Галицына, аспирант четвертого года Центра наук о жизни Сколковского института науки и технологий.
Название проекта: «Интерпретируемая модель для предсказания вероятности контактов хроматина».
Биология — пожалуй, самая антропоцентричная из всех естественных наук. Подавляющее большинство научных исследований по биологии, не связанных напрямую с изучением биоразнообразия, так или иначе ставят своей целью выяснение определенных деталей функционирования человеческого организма. Даже если непосредственным объектом изучения является мышь или другой живой организм, зачастую ученые пытаются на нем воспроизвести и детально рассмотреть некоторый аспект биологии Homo sapiens или характерный для него биологический процесс, в том числе патологический. Работы, направленные на исследование разнообразных живых организмов на молекулярном уровне, встречаются существенно реже.
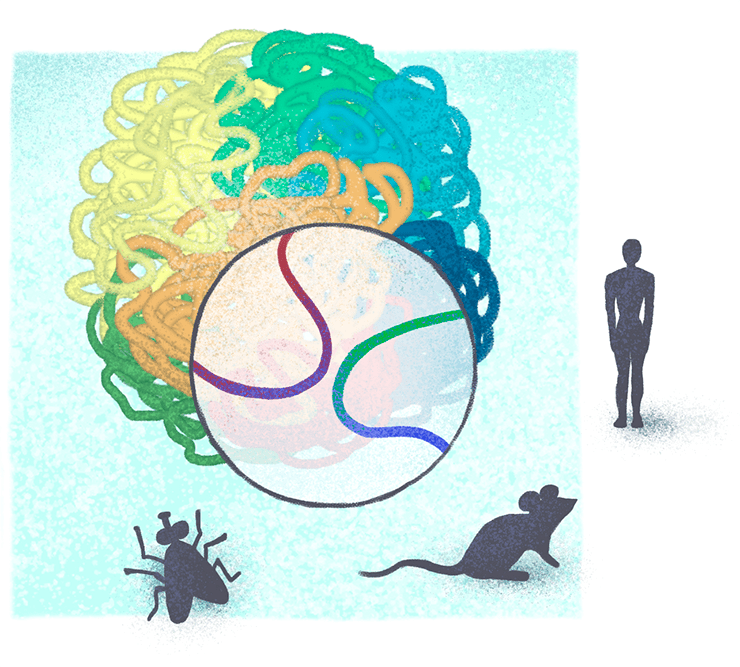
Александра Галицына учится в аспирантуре Центра наук о жизни Сколковского института науки и технологий и в рамках стипендиальной программы ФМИ изучает трехмерную организацию хроматина у дрозофилы и мыши и сравнивает ее с таковой у человека (подробнее о Центре наук о жизни Сколтеха читайте в нашей статье «Биологический наукоград: как работает Центр наук о жизни Сколтеха» [18]).
Почему именно мышь и дрозофила? «Дело в том, что для использования методов машинного обучения и, в особенности, нейронных сетей, требуется большая обучающая выборка. Чем больше случайный шум в данных, тем бóльшим должен быть ее размер. Таким образом, я могу выбрать только те организмы, для которых этот шум достаточно низок, а объем полученных данных — достаточно высок. Конечно, что такое “достаточно” — вопрос спорный, но на данный момент под мои критерии подходят только три организма: человек, мышь и дрозофила (рис. 3)», — объясняет Александра. Однако не исключено, что в ближайшее время список организмов, для которых получены данные о трехмерной организации хроматина с подходящим качеством, будет пополняться. По мнению Александры, ближайший кандидат — нематода Caenorhabditis elegans.
«Биомолекула» ранее писала об одном исследовании хроматина дрозофилы, опубликованном лабораториями Екатерины Храмеевой и Сергея Разина [19].
Рисунок 3. Работа Александры Галицыной посвящена изучению и сравнению пространственной организации хроматина у дрозофилы, мыши и человека. Подробности в тексте.
Два важнейших фактора для предсказания пространственной укладки участка генома — это его гуанин-цитозиновый состав и транскрипционная активность, которая тесно связана с открытостью хроматина. Эти два признака определяют, насколько данный участок вообще склонен к взаимодействию с другими участками хроматина. Александра и коллеги смогли найти любопытную закономерность, характерную для хроматина человека и мыши: «Если какой-то локус однажды изменил свое расположение в геноме в ходе эволюции, например, переместился из большой хромосомы общего предка человека и мыши на маленькую или наоборот, его свойства образовывать контакты независимы от локального контекста нового положения, — рассказывает Александра “Биомолекуле”. — Таким образом, мы нашли некоторое общее правило, которое, хотя и одинаково применимо для мыши и человека, но, тем не менее, приводит к различию в структуре хроматина этих двух организмов». Это интересное наблюдение уже опубликовано в журнале PeerJ [20].
С участием Александры также удалось выявить интересные различия между механизмами формирования топологически-ассоциированных доменов у человека и у дрозофилы, на этот раз с помощью применения нейронных сетей. «У млекопитающих за образование хроматиновых доменов в основном отвечают два белка: когезин и CTCF. Согласно одной из основных современных гипотез — модели выпетливания ДНК, — когезин активно формирует петли хроматина и сворачивает ДНК. Однако он не может пройти сквозь расположенные на ДНК барьеры — связанные с ДНК молекулы CTCF, — которые и приводят к образованию границ доменов. Удивительно, но в дрозофиле это не является правилом: CTCF не приводит к столь выраженному образованию границ. Вместо этого действуют другие белковые факторы, в частности, новый потенциальный доминантный инсулятор дрозофилы Chriz. Это удалось показать с помощью применения рекуррентных нейронных сетей, которые учитывают локальный контекст ДНК».
Александра считает, что главной сложностью, с которой она столкнулась во время работы над «хроматиновым» проектом, оказалась нехватка вовсе не научных статей по теме или подходящих исследовательских инструментов, а общения с другими специалистами, исследующими хроматин. «Допустим, я обнаружила новую особенность в трехмерной организации хроматина, но заслуживает ли она внимания? Нашелся хороший метод или способ интерпретации результатов, но достаточно ли его применение обоснованно? Могу ли я сделать напрашивающийся теоретический вывод из моего анализа? На практике все эти вопросы оказываются намного тоньше и сложнее, — признается Александра. — Решение этой проблемы, я бы даже сказала, способ развивать свою мысль, который был хорошо известен и до меня, — это общение с ведущими мировыми специалистами. Часть средств стипендии пошла на то, чтобы такое общение обеспечить. Так, мне удалось рассказать о результатах своих исследований на нескольких конференциях и, благодаря обратной связи международных специалистов, разобраться со многими исследовательскими вопросами и проблемами. Наконец, главной для меня оказалась стажировка в Массачусетском технологическом институте, которая вряд ли случилась бы без поддержки стипендии. Там я познакомилась с последними достижениями теоретической мысли о структуре хроматина, что позволило мне объяснить многие наблюдаемые феномены».
Кстати, у «Биомолекулы» выходит целый цикл статей о модельных организмах, обязательно загляните!
«Что касается немодельных организмов, здесь возможна любая экзотика, — продолжает Александра. — Из примечательного — внушительный американский проект DNA Zoo, в котором с помощью Hi-C собирают геномы и исследуют свойства хроматина десятков видов. Существуют и препринты о хроматине организмов, которые по-настоящему меняют наше представление о возможностях организации хроматина. Например, это работа из лаборатории Йоба Деккера на динофлагелляте Symbiodinium microadriaticum [22]. Хроматин этой водоросли, возможно, находится в кристаллоподобном состоянии, в нем отсутствуют привычные для других организмов компартменты, а домены обладают рядом уникальных и необъяснимых свойств. Думаю, что в этой области в ближайшие годы нас ждут важные открытия и смена ряда гипотез. Наконец, у нас в Сколтехе сейчас занимаются очень любопытным объектом — слизевиком Dictyostelium discoideum. Это одноклеточная амеба, которая в течение своего спороносного цикла претерпевает радикальные изменения поведения и фенотипа и, как мы надеемся, структуры хроматина. Проект выполняется в большой коллаборации, в которой задействованы группы Сергея Владимировича Разина, Михаила Сергеевича Гельфанда и Екатерины Храмеевой из Сколтеха, а также группа Леонида Мирного из Массачусетского технологического института. Я надеюсь, что о подробностях нам удастся рассказать в готовящейся работе».
Александра Галицына о стипендии ФМИ
— Почему вы решили подать заявку на стипендию ФМИ?
Подробнее о проекте Екатерины можно прочесть в первой статье этого спецпроекта — «Инициатива, которая вдохновляет» [24].
— В чем, на ваш взгляд, преимущества стипендии ФМИ по сравнению с другими стипендиями для молодых ученых? Что она дала вам?
— Во-первых, стипендия позволила мне написать одну из первых своих заявок на конкурс. Правила подачи — строгие и близкие к тем заявкам на грант, которые обычно пишут «взрослые» исследователи. Это помогает прощупать почву под ногами: определиться, подойдет ли такой способ работы в дальнейшем. С другой стороны, для человека, желающего развиваться в академической среде, это жизненно необходимый навык. Программа ФМИ ему удачно способствует.
Во-вторых, чтобы податься на стипендию, неизбежно приходится фокусироваться только на одной, самой стоящей гипотезе и продумать детали своих исследований на три года вперед. Распланировать свои действия на такой долгий срок, предусмотрев вероятности провала на каждом этапе — довольно сложная задача, которая меня организовала и, признаться, отрезвила. Важно, что разработанному в заявке плану нужно обязательно следовать. Речь не о том, что нужно заполнить строгий формальный отчет по пунктам: в программе ФМИ отчет проходит в формате написания свободного текста и доклада каждый год. Это здорово: получается как бы «сверять стрелки», целостно формулировать свое продвижение за год. Если ты шел в неверном направлении, то на подобных отчетах и случается осознание и поворот. Я, например, долгое время потратила на разработку своего метода предсказания карт контактов ДНК, в то время как группы-конкуренты успели выпустить около пяти статей по этой теме. Мне стоило воспользоваться их наработками, а не упорно набивать те же шишки — это стало понятно на одном из промежуточных отчетных докладов. На мой взгляд, такой режим способствует развитию в современной научной среде и достижению поставленных целей. Ведь изобилие информации, постоянно выходящих новых результатов исследований, большой шанс отрицательного результата экспериментов — всё это требует от молодого исследователя быть гибким и вовремя переориентировать свой подход.
— Как вы видите свою исследовательскую деятельность после стипендии? Планируете ли вы заниматься тематикой хроматина в дальнейшем?
— Я думаю, что стипендия дала мне уверенность: я готова и могу развивать свои научные идеи, если у меня есть на это ресурсы, а также возможность регулярно обсуждать результаты с научным руководителем, коллегами и получать обратную связь от экспертов стипендиальной программы и других стипендиатов. Я отношусь к годам выполнения проекта как к некоторой репетиции своей дальнейшей «взрослой жизни» в этой области.
Вы тоже можете стать стипендиатом Systems Biology Program!
Если вы — российский биолог, вам не более 35 лет, вы занимаетесь исследованиями в области биологии и имеете не менее двух публикаций в международных рецензируемых журналах с импакт-фактором более 2,0, в том числе одну публикацию с первым или последним авторством, вы можете подать заявку на стипендию Systems Biology Program уже сейчас! Подробная информация и полный список номинаций доступны на официальном сайте стипендиальной программы. Прием заявок продлится до 1 февраля 2021 года. Желаем успеха!
Моделируя хроматин
Стипендиат 2018 года: Павел Кос, младший научный сотрудник кафедры физики полимеров и кристаллов физического факультета МГУ им. М.В. Ломоносова.
Название проекта: «Двунаправленное изучение организации хроматина в клеточном ядре эукариот».
Биологи привыкли рассматривать хроматин как носитель наследственной информации, опуская, что он собой представляет с точки зрения физики. В то же время для изучения пространственной организации хроматина именно свежий взгляд со стороны физики может дать весьма интересные результаты.
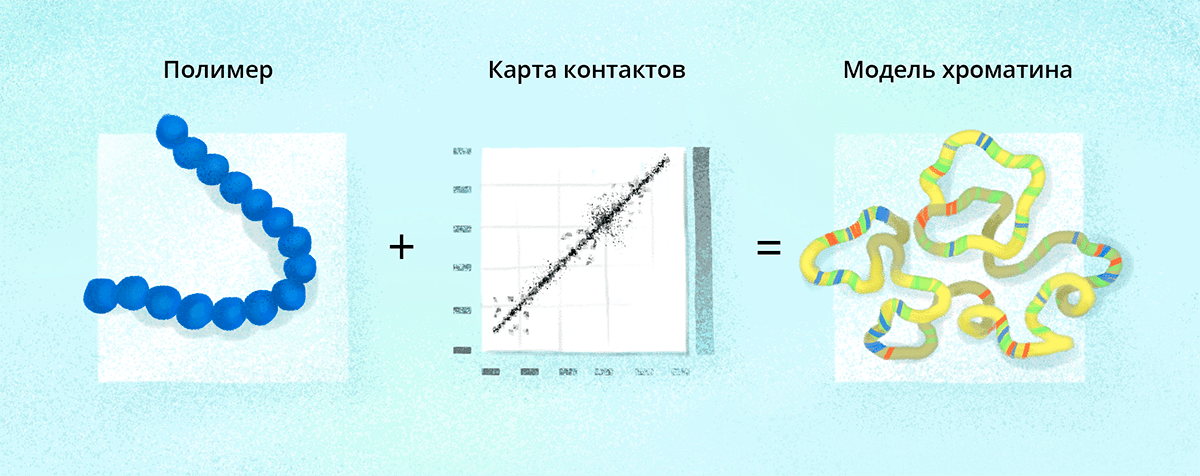
Павел Кос, сотрудник кафедры физики полимеров и кристаллов физического факультета МГУ, изучает не только трехмерную конформацию хроматина саму по себе, но и моделирует кинетику ее поведения с помощью физического подхода. «Если говорить грубо, то хроматин является длинной полимерной цепью. О поведении длинных полимерных цепей в физике полимеров известно довольно много (рис. 4). Однако далеко не всегда поведение полимерной системы может быть описано аналитически, и в этом случае используют компьютерное моделирование», — рассказывает Павел «Биомолекуле».
Рисунок 4. Моделируя хроматин, Павел в качестве исходной модели использовал полимерную цепь, представленную в виде шариков на пружине. Длина цепи соответствует хромосоме в масштабе 1 шарик к 10 тысячам пар оснований. Затем, используя экспериментальную информацию о контактах между участками хромосомы в одиночной клетке, группа Павла получила трехмерную структуру хромосомы. Далее исследователи раскрасили ее в соответствии с экспериментальными данными об активности хроматина. Это позволило изучить распределение активного и неактивного хроматина в трехмерном пространстве внутри хромосомной территории в клеточном ядре. Оказалось, что некоторые элементы укладки хроматина повторяются в различных клетках, несмотря на большую межклеточную вариабельность пространственной организации хроматина.
иллюстрация Любови Колосовской по наброску Павла Коса
Павел отмечает, что результаты компьютерного моделирования необходимо подтверждать с помощью экспериментов: «При моделировании изучаемый эффект воспроизводится в идеальном окружении, то есть с использованием выбранного набора факторов. Реальность, как правило, далека от идеального случая».
Экспериментальные результаты, использованные в работе Павла [25], предоставляла лаборатория Сергея Владимировича Разина из ИБГ РАН. «Из экспериментальных данных мы использовали информацию о контактах между разными участками хроматина, а также тип этих участков. Эта информация была перенесена в модель, — объясняет Павел. — При построении модели любой системы мы всегда ориентируемся на теоретические предсказания и экспериментальные эффекты, которые хотелось бы описать. Персистентная длина (жесткость полимерной цепи), параметры взаимодействия между мономерными звеньями и растворителем, а также технические параметры были взяты преимущественно из литературы. В некоторых случаях требовались дополнительные исследования поведения системы в зависимости от конкретного параметра, по результатам которых и выбирались оптимальные значения. В ходе работ было также проведено множество положительных и отрицательных контрольных тестов, чтобы подтвердить выявленные эффекты. Все многочисленные сложные расчеты выполнялись на суперкомпьютере “Ломоносов-2”, для расчета одной системы использовалось 84–140 ядер, а время расчета одной системы составляло до шести суток».
Рассказывая о результатах своей работы в рамках стипендиальной программы ФМИ, Павел отмечает:
«Во-первых, мы разработали мощный инструмент для построения трехмерной архитектуры хроматина в ядре клетки и подтвердили его состоятельность на большом массиве экспериментальных данных. Он позволяет изучать не только статику и кинетику, но также и динамику хроматина. Это очень ценно, так как хроматин подвижен, и многие эффекты невозможно описать без учета этого. Во-вторых, в ходе исследований было установлено, что, несмотря на большую межклеточную вариабельность, ряд мотивов укладки хроматина воспроизводится в отдельных клетках. Иначе говоря, коллективные особенности трехмерной архитектуры проявляются в одиночных клетках. На практике гипотетически результаты моей работы могут позволить выявить место поломки регуляции транскрипции и, как минимум, объяснить причину, а, как максимум, устранить такую поломку. Однако такие рассуждения неизбежно приводят нас к этическим вопросам. Дело в том, что даже при наличии надежного инструмента редактирования генома, неясным остается, до каких пор мы можем его использовать: тяжелые генетические заболевания, легкие заболевания, косметические изменения. Чем меньше необходимость изменений для нормальной жизни, тем больше к ним вопросов».
Павел Кос о стипендии ФМИ
— Почему вы решили отправить заявку на стипендию ФМИ?
— На момент начала проекта я был аспирантом, а теперь являюсь сотрудником кафедры физики полимеров и кристаллов физического факультета МГУ, и область моих научных интересов тесно связана с биологией. Тематика моих исследований подходила под программу, и я захотел попробовать. После первой попытки я получил очень подробную и полезную рецензию на свой проект, доработал его, расширил. Вторая попытка была удачной.
— Что выделяет стипендию ФМИ среди других стипендий для молодых исследователей? Что она дала лично вам?
— Большое количество возможностей в плане получения гранта у молодых исследователей появилось буквально в последние два года. До этого аспиранты и молодые ученые участвовали, как правило, в больших проектах. Это не всегда позволяло работать над интересующими тебя вопросами в полной мере. Стипендия ФМИ позволила мне самостоятельно ставить и решать научную задачу. Собственно, в этом и есть, наверное, главное преимущество этой стипендии: она позволяет работать над интересными тебе задачами, а также получать ценный опыт управления проектом.
Заключение
Что же ждет науку о хроматине в ближайшие несколько лет? «Я вижу большой потенциал в развитии методов анализа, — продолжает делиться с “Биомолекулой” Екатерина Храмеева. — Данных по хроматину уже много и будет еще больше, при этом анализ отстает. Надо думать, что мы дополнительно можем полезного извлечь из этих данных, если копнем глубже и будем более аккуратными в вычислениях. Уверена, что очень многое можно сделать. Мы смотрим в направлении методов машинного обучения, нейронных сетей, пробуем применять их к анализу хроматиновых данных, а также пытаемся переносить математические методы из других областей науки на хроматин [26].
Что касается экспериментальной части, есть мнение, что Hi-C скоро отойдет на второй план, и его заменят принципиально другие методы, основанные на микроскопии. Действительно, это направление сейчас бурно развивается, появляются очень интересные и перспективные методы. Но пока они уступают Hi-C: либо не позволяют получить полногеномную картину, либо слишком трудоемкие. Посмотрим, удастся ли им победить эти проблемы и вытеснить Hi-C по популярности».
Применение новых методов для изучения структуры хроматина открывает широчайшие возможности для исследования клеток разных типов и организмов, в том числе клеток сложнейшего органа — головного мозга. Например, Екатерина Храмеева использует метод Hi-C для изучения мозга на уровне отдельных нейронов. Следующая статья нашего спецпроекта расскажет о проектах по изучению системной нейробиологии, которые ведутся в рамках стипендии ФМИ на базе Сколтеха.