Миелопролиферативное заболевание крови что это такое
Миелопролиферативное заболевание крови что это такое
Хронические миелопролиферативные заболевания
Что такое хронические миелопролиферативные заболевания?
Хронические миелопролиферативные заболевания — группа онкопатологий крови, для которых характерно патологическое деление одного или нескольких видов кровяных телец.
Хронические миелопролиферативные заболевания считаются достаточно редкой патологией крови. Частота встречаемости составляет 1 случай на 100 тысяч населения. Подавляющее большинство пациентов — люди старше 40 лет. У мужчин подобные заболевания встречаются несколько чаще, чем у женщин.
Хронические миелопролиферативные заболевания характеризуются патологическим делением определенного вида стволовых клеток, которые при этом сохраняют способность к дифференциации. Как результат – активизируется один из ростков гемопоэза. Клетка-клон оседает в костном мозге или других органах, усиленно делится, вытесняя функциональные ткани. Так возникают экстрамедуллярные (внекостномозговые) очаги гемопоэза.
Группа хронических миелопролиферативных заболеваний включает следующие гемобластозы:
Симптомы
В норме состав крови стабилен. Смещение равновесия в пользу определенных форменных элементов становится причиной неблагоприятных последствий. Однако долгое время заболевание протекает скрыто. Первые симптомы появляются при существенных нарушениях в картине крови. Клинические проявления гемобластозов неспецифические. Они могут быть следующими:
Для некоторых видов миелопролиферативных заболеваний характерны специфические симптомы. Так, истинная полицитемия может проявляться покраснением кожных покровов и выраженным зудом после контакта кожи с жидкостями. Тромбоцитемия сопровождается кровотечениями из десен, носа, мелкими кровоподтеками на коже (петехии) и медленным заживлением ран.
Все онкогематологические заболевания развиваются постепенно – тяжесть симптоматики нарастает с течением времени. В любой момент заболевание может начать активно прогрессировать и выйти из-под контроля тех медикаментов, которые ранее были эффективны.
Причины
Механизм и точные причины развития миелопролиферативных заболеваний точно не установлены. Некоторые формы патологии обусловлены генетическими нарушениями и предаются «по наследству». Поэтому наличие гемобластоза у кого-либо из кровных родственников указывает на повышенный риск заболевания. К таковым относится истинная полицитемия и эссенциальная тромбоцитемия.
Другие хронические миелопролиферативные заболевания связывают с сочетанным воздействием ряда неблагоприятных внешних и внутренних факторов. Например, воздействие радиации или токсических веществ на фоне метаболических нарушений, гормональных сбоев, повышенного воспалительного фона и возрастных изменений может стать пусковым фактором развития патологий костного мозга.
Хронические миелопролиферативные заболевания
Хронические миелопролиферативные заболевания — это группа патологий, при которых происходит неконтролируемый рост кровяных клеток. Нарушение вызвано генетическими мутациями.
Акции
Полное обследование на онкологические заболевания для мужчин и женщин.
Онкоконсилиум может потребоваться как при лечении в «СМ-Клиника», так и пациентам других медицинских учреждений с целью получения альтернативного мнения.
«СМ-Клиника» предоставляет своим пациентам предоперационное обследование со скидкой до 72%!
Консультация врача-хирурга по поводу операции бесплатно!
Содержание статьи:
ХМПЗ (хроническое миелопролиферативное заболевание) — это группа патологических состояний организма, течение которых характеризуется неконтролируемым ростом клеток крови. Данное нарушение возникает в результате генетических мутаций. К ХМПЗ относят эозинофильный и нейтрофильный рак крови, миелолейкоз, эритремию, сублейкемический миелоз и хроническое миелопролиферативное заболевание эссенциальная тромбоцитемия.
Распространенность ХМПЗ невысокая. Обычно заболевает не более 1 человека на 100 000 населения. Точные причины развития данной патологии неизвестны. В ряде случаев имеется связь с наличием в анамнезе пациента других онкологических заболеваний, при лечении которых использовалась лучевая терапия и цитостатики.
Чаще всего заболевание диагностируют у людей среднего (от 40 лет) и пожилого возраста. У всех видов ХМПЗ есть общие характеристики, а именно:
Эффективность терапии хронической миелопролиферативной болезни зависит от вида патологии и ее стадии.
Классификация хронических миелопролиферативных заболеваний
Выделяют следующие виды ХМПЗ:
Все ХМПЗ характеризуется отсутствием диспластических изменений в костном мозге и кровяных клетках на начальных этапах заболевания.
Помимо вышеперечисленных видов в современной онкологии отдельно выделяют группу с миелоидной дисплазией, которая занимает промежуточное положение между ХМПЗ и миелодиспластическим синдромом.
Классификация ХМПЗ с миелодисплазией:
Причины и факторы риска развития ХМПЗ
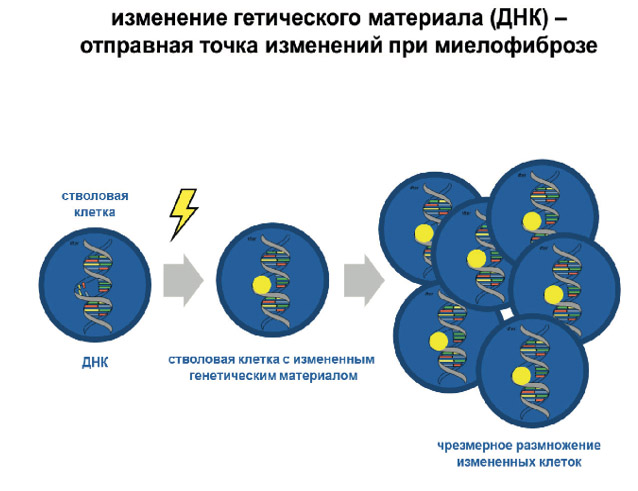
МПЗ относятся к группе клональных заболеваний. Патологические изменения в организме при таких болезнях начинаются с одного либо нескольких сбоев в ДНК всего лишь одной стволовой клетки костного мозга.
По мере накопления патологически измененных клеток крови состояние пациента начинает ухудшаться. В большинстве случаев причина, по которой произошел запуск патологического процесса в костном мозге, остается неизвестной.
К факторам, которые могут спровоцировать развитие болезни, относят ошибки при делении клеток, факторы внешней среды, вредные привычки и так далее. ХМПЗ не относятся к наследственным заболеваниям, хотя зарегистрированы случаи возникновения истинной полицитемии, эссенциальной тромбоцитемии у членов одной семьи. Причиной развития ХМПЗ являются приобретенные генетические мутации, которые возникают во время жизни пациента.
Одним из основных факторов риска при миелопролиферативных патологиях является возраст больного. После 70 лет увеличивается клональное кроветворение, что повышает риск развития ХМПЗ в 11-13 раз.
Симптомы
Клинические проявления хронических миелопролиферативных заболеваний крови не специфичны, поэтому необходима тщательная дифференциальная диагностика с другими патологиями. На начальном этапе, когда опухолевая масса небольшая, у пациентов наблюдается умеренный лейкоцитоз.
Клинически заболевание может проявляться следующими симптомами:
При истинной полицитемии у пациентов повышается уровень гемоглобина в крови, что проявляется сильным покраснением кожи лица, которое многие ошибочно принимают за проявление алкоголизма. Кроме этого, одним из характерных симптомов данного заболевания ХМПЗ является кожный зуд, возникающий при контакте с водой. Одним из самых опасных состояний при ХМПЗ является тромбоцитоз (склонность к образованию тромбов). Это резко повышает риск закупорки крупных сосудов, что приводит к развитию инсультов, инфарктов и угрожает не только здоровью, но и жизни пациента.
Течение ХМПЗ хроническое. При отсутствии лечения болезнь со временем прогрессирует с возможным развитием острого миелолейкоза, миелодиспластического синдрома. Кроме этого наблюдается прогрессирующее увеличение размеров селезенки.
Диагностика хронической миелопролиферативной болезни
Основными методами диагностики ХМПЗ являются лабораторные методы исследования и биопсия.
Лабораторные методики
Биопсия
Взятие образцов костного мозга и последующее их исследование под микроскопом проводятся в большинстве случаев. При помощи данных методик проводят дифференциальную диагностику ХМПЗ от миелодиспластического синдрома. При проведении гистологии образцов костного мозга обнаруживают повышенное содержание паренхиматозных клеток. Миелофиброз диагностируют путем окрашивания образцов ткани ретикулином.
Пациенты с установленными диагнозами остаются под наблюдением гематолога пожизненно.
Методы лечения ХМПЗ
Для лечения хронических миелопролиферативных заболеваний часто применяют цитостатики. Препараты из этой группы обладают способностью воздействовать на конкретный гематологический росток, что позволяет уменьшить скорость патологического деления клеток крови.
Кроме этого, для лечения ХМПЗ могут использоваться препараты, которые снижают негативные последствия полицитемии (глюкокортикостероиды, средства для разжижения крови, противотромботические соединения и ряд других). С их помощью можно убрать повышенную вязкость крови, которая является следствием усиленного размножения кровяных клеток, снять общее воспаление, предотвратить тромбообразование.
Крайне важно при терапии ХМПЗ остановить аномальное увеличение селезенки. Для этого используют лучевую терапию. Если лечение не дает эффекта, то проводят операцию по удалению селезенки.
Кроме этого, для каждого вида ХМПЗ существуют свои специфические методы терапии. Например, при эозинофильном лейкозе показан прием антигистаминных средств, которые снижают проявления аллергии. При истинной полицитемии одним из вариантов терапии является кровопускание. При тромбоцитемии больным назначают антикоагулянты.
Если ХМПЗ диагностируют у молодых людей (что бывает редко), то возможно проведение радикального лечения, которое включает в себя пересадку стволовых клеток и приводит к полному выздоровлению. К сожалению, большинство пожилых людей в силу возраста не могут перенести эту операцию.
Прогноз при ХМПЗ крови
При хроническом миелопролиферативном лейкозе в течение 3-5 лет идет хроническое развитие заболевания. Затем наступает акселерированная фаза, которая переходит в бластный криз. После этого прогноз выживаемости — от нескольких месяцев до года.
Выживаемость при хронических миелопролиферативных болезнях при грамотной своевременно начатой терапии составляет около 20 лет. Если лечение не проводится, то пациент умирает в течение полутора лет. При этом с каждым месяцем повышается риск развития тромбоэмболий, что еще более ухудшает прогноз. Запущенная стадия заболеваний проявляется снижением уровня эритроцитов, что сопровождается усилением спленомегалии и изменениями в костном мозге.
Профилактика ХМПЗ
Эффективной специфической профилактики не существует. Для снижения вероятности развития ХМПЗ необходимо соблюдать следующие рекомендации:
Хронический миелолейкоз
Хронический миелолейкоз – это злокачественное миелопролиферативное заболевание, характеризующееся преимущественным поражением гранулоцитарного ростка. Может долгое время протекать бессимптомно. Проявляется склонностью к субфебрилитету, ощущением полноты в животе, частыми инфекциями и увеличением селезенки. Наблюдаются анемия и изменение уровня тромбоцитов, сопровождающиеся слабостью, бледностью и повышенной кровоточивостью. На заключительной стадии развиваются лихорадка, лимфоаденопатия и кожная сыпь. Диагноз устанавливается с учетом анамнеза, клинической картины и данных лабораторных исследований. Лечение – химиотерапия, радиотерапия, пересадка костного мозга.
МКБ-10
Общие сведения
Хронический миелолейкоз – онкологическое заболевание, возникающее в результате хромосомной мутации с поражением полипотентных стволовых клеток и последующей неконтролируемой пролиферацией зрелых гранулоцитов. Составляет 15% от общего количества гемобластозов у взрослых и 9% от общего числа лейкозов во всех возрастных группах. Обычно развивается после 30 лет, пик заболеваемости хроническим миелолейкозом приходится на возраст 45-55 лет. Дети до 10 лет страдают исключительно редко.
Хронический миелолейкоз одинаково распространен у женщин и у мужчин. Из-за бессимптомного или малосимптомного течения может становиться случайной находкой при исследовании анализа крови, взятого в связи с другим заболеванием или во время профилактического осмотра. У части больных хронический миелолейкоз выявляется на заключительных стадиях, что ограничивает возможности терапии и ухудшает показатели выживаемости. Лечение проводят специалисты в области онкологии и гематологии.
Причины
Хронический миелолейкоз считается первым заболеванием, при котором достоверно установлена связь между развитием патологии и определенным генетическим нарушением. В 95% случаев подтвержденной причиной хронического миелолейкоза является хромосомная транслокация, известная как «филадельфийская хромосома». Суть транслокации заключается во взаимной замене участков 9 и 22 хромосом. В результате такой замены формируется устойчивая открытая рамка считывания. Образование рамки вызывает ускорение деления клеток и подавляет механизм восстановления ДНК, что увеличивает вероятность возникновения других генетических аномалий.
В числе возможных факторов, способствующих появлению филадельфийской хромосомы у больных хроническим миелолейкозом, называют ионизирующее облучение и контакт с некоторыми химическими соединениями.
Патогенез
Итогом мутации становится усиленная пролиферация полипотентных стволовых клеток. При хроническом миелолейкозе пролиферируют преимущественно зрелые гранулоциты, но аномальный клон включает в себя и другие клетки крови: эритроциты, моноциты, мегакариоциты, реже – В- и Т-лифоциты. Обычные гемопоэтические клетки при этом не исчезают и после подавления аномального клона могут служить основой для нормальной пролиферации кровяных клеток. Для хронического миелолейкоза характерно стадийное течение.
Источником бластов становятся лимфатические узлы, кости, кожа, ЦНС и т. д. В фазе бластного криза состояние больного хроническим миелолейкозом резко ухудшается, развиваются тяжелые осложнения, завершающиеся гибелью больного. У некоторых пациентов фаза акселерации отсутствует, хроническая фаза сразу сменяется бластным кризом.
Симптомы хронического миелолейкоза
Клиническая картина определяется стадией заболевания. Хроническая фаза в среднем продолжается 2-3 года, в некоторых случаях – до 10 лет. Для этой фазы хронического миелолейкоза характерно бессимптомное течение или постепенное появление «легких» симптомов: слабости, некоторого недомогания, снижения трудоспособности и чувства переполнения живота. При объективном осмотре больного хроническим миелолейкозом может обнаруживаться увеличение селезенки. По анализам крови выявляется повышение количества гранулоцитов до 50-200 тыс./мкл при бессимптомном течении заболевания и до 200-1000 тыс./мкл при «легких» признаках.
На начальных стадиях хронического миелолейкоза возможно некоторое снижение уровня гемоглобина. В последующем развивается нормохромная нормоцитарная анемия. При исследовании мазка крови пациентов с хроническим миелолейкозом отмечается преобладание молодых форм гранулоцитов: миелоцитов, промиелоцитов, миелобластов. Наблюдаются отклонения от нормального уровня зернистости в ту или иную сторону (обильная или очень скудная). Цитоплазма клеток незрелая, базофильная. Определяется анизоцитоз. При отсутствии лечения хроническая фаза переходит в фазу акселерации.
О начале фазы акселерации может свидетельствовать как изменение лабораторных показателей, так и ухудшение состояния пациентов. Возможно нарастание слабости, увеличение печени и прогрессирующее увеличение селезенки. У больных хроническим миелолейкозом выявляются клинические признаки анемии и тромбоцитопении или тробоцитоза: бледность, быстрая утомляемость, головокружения, петехии, кровоизлияния, повышенная кровоточивость. Несмотря на проводимое лечение, в крови пациентов с хроническим миелолейкозом постепенно увеличивается количество лейкоцитов. При этом отмечается возрастание уровня метамиелоцитов и миелоцитов, возможно появление единичных бластных клеток.
Бластный криз сопровождается резким ухудшением состояния больного хроническим миелолейкозом. Возникают новые хромосомные аномалии, моноклоновое новообразование трансформируется в поликлоновое. Отмечается нарастание клеточного атипизма при угнетении нормальных ростков кроветворения. Наблюдаются ярко выраженные анемия и тромбоцитопения. Суммарное количество бластов и промиелоцитов в периферической крови составляет более 30%, в костном мозге – более 50%. Пациенты с хроническим миелолейкозом теряют вес и аппетит. Возникают экстрамедуллярные очаги незрелых клеток (хлоромы). Развиваются кровотечения и тяжелые инфекционные осложнения.
Диагностика
Диагноз устанавливается на основании клинической картины и результатов лабораторных исследований. Первое подозрение на хронический миелолейкоз часто возникает при повышении уровня гранулоцитов в общем анализе крови, назначенном в порядке профилактического осмотра или обследования в связи с другим заболеванием. Для уточнения диагноза могут использоваться данные гистологического исследования материала, полученного при стернальной пункции костного мозга, однако окончательный диагноз «хронический миелолейкоз» выставляется при выявлении филадельфийской хромосомы при помощи ПЦР, флюоресцентной гибридизации или цитогенетического исследования.
Вопрос о возможности постановки диагноза хронический миелолейкоз при отсутствии филадельфийской хромосомы остается дискутабельным. Многие исследователи считают, что подобные случаи могут объясняться комплексными хромосомными нарушениями, из-за которых выявление данной транслокации становится затруднительным. В ряде случаев филадельфийскую хромосому можно обнаружить при использовании ПЦР с обратной транскрипцией. При отрицательных результатах исследования и нетипичном течении заболевания обычно говорят не о хроническом миелолейкозе, а о недифференцированном миелопролиферативном/миелодиспластическом расстройстве.
Лечение хронического миелолейкоза
Тактику лечения определяют в зависимости от фазы заболевания и выраженности клинических проявлений. В хронической фазе при бессимптомном течении и слабо выраженных лабораторных изменениях ограничиваются общеукрепляющими мероприятиями. Больным хроническим миелолейкозом рекомендуют соблюдать режим труда и отдыха, принимать пищу, богатую витаминами и т. д. Лечение может включать:
Прогноз
Прогноз при хроническом миелолейкозе зависит от множества факторов, определяющим из которых является момент начала лечения (в хронической фазе, фазе активации или в период бластного криза). В качестве неблагоприятных прогностических признаков хронического миелолейкоза рассматривают значительное увеличение печени и селезенки (печень выступает из-под края реберной дуги на 6 и более см, селезенка – на 15 и более см), лейкоцитоз свыше 100×10 9 /л, тромбоцитопению менее 150×10 9 /л, тромбоцитоз более 500х10 9 /л, повышение уровня бластных клеток в периферической крови до 1% и более, повышение суммарного уровня промиелоцитов и бластных клеток в периферической крови до 30% и более.
Вероятность неблагоприятного исхода при хроническом миелолейкозе возрастает по мере увеличения количества признаков. Причиной гибели становятся инфекционные осложнения или тяжелые геморрагии. Средняя продолжительность жизни пациентов с хроническим миелолейкозом составляет 2,5 года, однако при своевременном начале терапии и благоприятном течении заболевания этот показатель может увеличиваться до нескольких десятков лет.
Миелопролиферативное заболевание: понятие, формы и патогенез, диагностика, лечение, прогноз
Миелопролиферативное заболевание (МПЗ) — довольно редкая гематоонкологическая патология, при которой красный костный мозг продуцирует чрезмерное количество клеток крови. Это опасное заболевание несет серьезную угрозу жизни человека. «Миело» означает «костный мозг», а пролиферация – «быстрое деление». Недуг чаще развивается у мужчин 40-50 лет. Среди детей и женщин встречаются единичные случаи болезни. Лица, имеющие плохую наследственность по развитию онкопатологии кроветворных органов, составляют группу риска.
В норме в губчатом веществе костного мозга, находящегося в полостях крупных костей скелета, продуцируются незрелые стволовые клетки. Постепенно они созревают и преобразуются в полноценные форменные элементы:
созревание форменных элементов крови в норме
При наличии у человека миелопролиферативного заболевания в кровь поступают клетки, неспособные выполнять свои функции. Стволовые клетки при патологии часто преобразуются только в один тип форменных элементов. Патологический процесс отличается медленным прогрессированием.
Миелопролиферативное заболевание — это собирательное понятие, включающее группу гемобластозов, которые характеризуются аномальным разрастание костномозговых структур, отвечающих за образование кровяных телец. Выделяют несколько основных форм МПЗ, при которых поражаются разные клеточные элементы крови:
Эти формы имеют общие признаки и называются «классическими». Они встречаются чаще всего. Лица, получающие надлежащее лечение, не предъявляют никаких жалоб. Клинические проявления болезни минимальны или полностью отсутствуют долгое время. Лица с МПЗ вынуждены всю жизнь наблюдаться у врача и принимать медикаментозные средства, поддерживающие здоровье на оптимальном уровне. Невозможно самостоятельно справиться с дисфункцией костного мозга. При отсутствии адекватного лечения патология приводит к развитию тромбогеморрагических осложнений.
Причины
пример jak2 мутации при истинной полицитемии (избытке эритроцитов)
В основе МПЗ лежит приобретенная генная мутация, обусловленная влиянием негативных внешних или внутренних факторов. Мутация генов MPL и jak 2 приводит к повреждению ДНК одной гемопоэтической клетки, которая дает начало всем типам клеточных элементов. Аномально изменившаяся бластная форма приобретает отрицательные черты — перестает развиваться, не созревает полностью, не самоуничтожается, а непрерывно делится и порождает многочисленные клоны. Именно поэтому МПЗ называют клональным. Клоны также остаются на начальном уровне развития и имеют полностью недифференцированную структуру. Повреждаться может как один, так сразу несколько ростков кроветворения.
В результате в костном мозге увеличивается количество клеток-предшественниц эритроцитарного, тромбоцитарного и лейкоцитарного типов. По мере их накопления в кровяном русле ухудшается самочувствие больных. От того, какой росток переродился, зависит характер патологии, ее симптоматика и прогноз. Формы МПЗ отличаются медленным развитием. Если заболевание было выявлено на ранней стадии, у больного есть все шансы добиться стойкой ремиссии.
Причины, вызвавшие мутационные процессы, остаются до конца неизученными. Одни ученые относят к ним негативные факторы окружающей среды, другие — ошибки при делении клеток. МПЗ не является наследственным. Мутации генов могут возникать на протяжении всей жизни человека. Они называются приобретенными. Риск развития патологии увеличивается с возрастом. Лицам старше 50 лет необходимо внимательно относиться к здоровью и при появлении подозрительной симптоматики обращаться к гематологу. Вероятность развития недуга повышается под воздействием факторов риска — облучения и химикатов, оказывающих токсическое влияние на организм.
Классификация
Миелопролиферативные заболевания имеют код по МКБ 10 — D47.1. По типу течения их подразделяют на острые и хронические. В первую группу входят максимально агрессивные и быстро прогрессирующие недуги, поражающие в основном молодых людей. К группе хронических миелопролиферативных заболеваний относятся медленно развивающиеся патологии, имеющие относительно благоприятный прогноз и возникающие у пожилых лиц.
В зависимости от пораженного ростка кроветворения выделяют следующие формы процесса:
Классификация МПЗ имеет важное значение для диагностики онкологических заболеваний органов кроветворения. С ее помощью гематологи-онкологи могут легко определить тип сформировавшейся патологии и подобрать больному адекватную терапию, которая может спасти жизнь.
Видео: лекция по классификации и патогенезу ХМПЗ
Развитие и симптомы
Существует три пути распространения заболевания по организму:
Гематогенное распространение злокачественных клеток считается самым опасным. Таким пациентам вместе с лечебными мероприятиями проводят динамическое наблюдение за функционированием внутренних органов. Данный тип патологии дает метастазы в самые отдаленные участки организма человека, что приводит к формированию вторичных онкологических очагов.
Клиническая картина МПЗ зависит от конкретной формы процесса, сопровождающегося разрастание кроветворных тканей костного мозга и чрезмерным поступлением в кровоток остановившихся в своем развитии атипичных кровяных телец. Каждый вид заболевания отличается характерной симптоматикой. Но существуют общие распространенные симптомы. Это признаки анемии или тромбоза:
Это общая симптоматика, возникающая при любой форме МПЗ. Существуют также специфические проявления, характерные для каждой из них.
картина крови при тромбоцитемии
общая клиника лейкозов
Диагностика
Симптоматика МПЗ — основание для назначения пациенту диагностических процедур, позволяющих подтвердить или опровергнуть наличие процесса, а также выяснить, в какой именно форме протекает патология органов кроветворения.
Обследование начинают с опроса и сбора анамнеза. Врачи уточняют, какой образ жизни ведет больной, имеет ли пагубные пристрастия, какие заболевания перенес и чем лечился. Осмотр пациента – определение общего состояния и выявление признаков, которые обычно отсутствуют у здоровых людей.
Лабораторная диагностика МПЗ заключается в проведении целого ряда исследований и испытаний:
пункция КМ для миелограммы
Помимо лабораторной диагностики для постановки диагноза необходимы результаты инструментальных исследований. Больным проводят УЗИ брюшной полости для определения степени гепатоспленомегалии. В диагностически сложных случаях их направляют на томографическое исследование.
Если больному поставлен диагноз «Хроническое миелопролиферативное заболевание jak 2 позитивное», ему необходимо лечиться. В течение всей жизни он должен находится под наблюдением гематолога. Повторное диагностическое исследование проводится после завершения курса лечения. Результаты лабораторных анализов позволяют вовремя выявить рецидив заболевания и остановить его развитие.
Лечение
Онкогематологи назначают лечение своим больным по результатам диагностических исследований. Существуют стандартные терапевтические методики, которые применяют при различных видах МПЗ. Если у пациента обнаружена начальная стадия процесса, когда еще отсутствуют клинические признаки, за ним устанавливают динамическое наблюдение. При появлении первых признаков патологии переходят непосредственно к лечению.
Каждому больному подбирается индивидуальная лечебная методика в соответствии с его состоянием и степенью выраженности имеющихся нарушений.
трасплантация КМ – наиболее радикальная, но и потенциально действенная методика при удачном исходе
После проведения полного лечебного курса наступает период реабилитации. Больной должен находится под постоянным наблюдением доктора и строго выполнять все его предписания, позволяющие организму быстрее восстановиться.
Миелопролиферативное заболевание — рецидивирующий процесс, способный обостриться в любое время. Именно поэтому всем пациентам необходимо регулярно посещать лечащего врача и проходить диагностические исследования с профилактической целью.
Прогноз МПЗ считается благоприятным только в случае успешной трансплантации костного мозга, которая разрешена не всем больным. Хронические формы переносятся легче острых. Продолжительность жизни пациентов в этом случае составляет 5–7 лет при условии получения комплексной терапии. Если у больных обнаружены метастазы, прогноз становится неутешительным — они погибают в течение 6 месяцев.
Видео: лекция об опыте лечения ХМПЗ
Миелофиброз
Общие сведения
Миелопролиферативное заболевание (МПЗ) – представляет собой группу заболеваний, которая согласно квалификации ВОЗ (2016) включает несколько подкатегорий: первичный миелофиброз, хронический миелолейкоз, хронический эозинофильный лейкоз, истинную полицитемию, хронический нейтрофильный лейкоз, эссенциальную тромбоцитемию и неклассифицированные миелопролиферативные неоплазии.
Заболевание возникает на уровне стволовой кроветворной клетки и обусловлено ее трансформацией. Для него характерен миелопролиферативный синдром. Термин «миелопролиферативный» означает неконтролируемое разрастание одной/нескольких линий миелопоэза, сопровождаемое повышенной продукцией миелоидных клеток (мегакариоцитов, гранулоцитов, тучных эритроидных клеток).
Первичный миелофиброз (синоним — идиопатический миелофиброз) — это заболевания костного мозга, относящееся к группе клональных миелопролиферативных заболеваний для которого характерен фиброз костного мозга, увеличение селезенки и печени и формирование в этих органах экстрамедуллярных очагов кроветворения. Термин «идиопатический» означает заболевание неизвестного происхождение, возникающее самостоятельно. По сути, первичный миелофиброз — это хроническое миелопролиферативное заболевание, представляющее собой генерализованный процесс с изменением гемопоэза и перестройками в различных областях костного мозга фибротического и/или склеротического характера, который сопровождается полным изменением архитектоники кроветворения.
Первичный миелофиброз (ПМФ) протекает в двух стадиях: миелопролиферативной, при которой в костном мозге вырабатываются патологические форменные элементы крови (гиперплазия гемопоэтических клеток костного мозга) и костномозговой недостаточности с явлениями фиброза. Течение заболевания хроническое и в начальной стадии бессимптомное. В литературе это заболевание описывалось и в разные времена называлось как первичный остеомиелофиброз, остеосклероз, агногенная миелоидная метаплазия, фибромиелолейкоз, хронический миелофиброз. Согласно последней классификации миелоидных новообразований (ВОЗ, 2016 г) эти синонимы не употребляются и принято единое название — первичный миелофиброз.
Заболевание встречается редко, показатели заболеваемости ПМФ варьируют в пределах 0,3-1,6
случая/100 000 населения. Гендерных различий нет, наиболее часто заболевание диагностируется в возрасте после 50 лет, медиана 62,5 лет с вариациями от нескольких месяцев до 10-15 лет. Заболевание зачастую осложняется быстро прогрессирующей анемией, симптомами опухолевой интоксикации и спленомегалией. Причинами смерти пациентов чаще всего являются бластная трансформация и прогрессирующие заболевания, осложненные портальной гипертензией, аутоиммунной гемолитической анемией, тромбозами, развитием кровотечений и присоединением инфекции.
Патогенез
Патогенез ПМФ чрезвычайно сложен и до конца не изучен. Развитие заболевания представляет собой цепь патогенетических процессов, основой которых является появление (образование) патологического клона, являющегося главным двигателем заболевания и развившегося воспалительного процесса, протекающего с характерным изменением остова костного мозга и выраженной экспрессией цитокинов.
В процессе пролиферации мегакариоциты и лейкемические моноциты активно продуцируют различные виды патологических цитокинов, избыточное содержание которых стимулирует процесс фиброза и приводит к остеосклерозу. При этом, грубо нарушается связь стволовых клеток костного мозга с микроокружением, что при водит к формированию экстрамедуллярных очагов гемопоэза в селезенке и печени. Выброс цитокинов является также ведущей причиной возникновения комплекса симптомов опухолевой интоксикации, приводящей к выраженному ухудшению качества жизни больных.
В патогенез заболевания вовлечен ростовой фактор, продуцируемый тромбоцитами, эндотелиальный (сосудистый) фактор роста и трансформирующий фактор роста бета-миелоидных предшественников. Вероятно, что под влиянием цитокинов, металлопротеиназ и хемокинов формируется межклеточное патологическое взаимодействии мегакариоцитов, нейтрофилов и моноцитов, приводящее к выходу миелоидных предшественников. По сути, в основе миелофиброза лежит неспецифическая воспалительная реакция на образующиеся медиаторы воспаления и цитокины, продуцируемые трансформированным клоном. При этом, значение имеет не только выраженная пролиферация и дефект созревания мегакариоцитарного ростка, но и пролиферация базофилов и тучных клеток, гиперплазия моноцитов-макрофагов.
Классификация
В клинике ПМФ выделяют две фазы, которые отражают степень прогрессирования тяжести заболевания: хроническую фазу и бластную фазу (фазу терминальную бластной трансформации).
Стадии ПМФ
По морфологическому (гистологическому) признаку выделяют:
Переход пре-фиброзной стадии в фиброзную в среднем занимает около 4 лет и наблюдается в 65% случаев, трансформация в острый лейкоз варьирует в пределах 5-30% случаев. Однако, процесс прогрессирования в фиброзную стадию может замедляться или вообще отсутствовать в течение 10-15 лет.
Причины развития и факторы, способствующие заболеванию
Этиология ПМФ до настоящего времени точно не установлена. Принято считать, что в основе возникновения заболевания лежит врожденная предрасположенность к болезни. Ее реализация (повреждение генома физиологически нормальной гемопоэтической клетки) происходит под воздействием различных внешних факторов, способствующих ее злокачественной трансформации.
Наиболее вероятной причиной развития болезни являются мутации в генах JAK2 и MPL, что приводит к активации JAK-STAT сигнального пути и усиленной пролиферации миелоидного ростка, однако причина выраженного процесса фиброза костного мозга до настоящего времени остается неясной.
Также развитию первичного миелофиброза способствует нарушение иммунного статуса пациентов (в периферической крови — повышенный уровень иммунных комплексов и IgG, увеличение содержания иммунокомпетентных клеток, моноклональная гаммапатия).
Симптомы заболевания костного мозга
Клиника первичного миелофиброза вариабельна и не имеет патогномоничных симптомов. В подавляющем большинстве случаев заболевание на протяжении ряда лет протекает бессимптомно, а его манифестация проявляется несколькими синдромами. Нередко заболевание обнаруживаются при обращении пациента по поводу другого заболевания и проведения клинического анализа крови, в котором присутствуют специфические изменения картины периферической крови или во время проведения профилактического осмотра при случайном выявлении спленомегалии.
Основными клиническими проявлениями заболевания являются:
Тяжесть и выраженность тех или иных симптомов тесно коррелирует со стадийностью патологического процесса. На начальном этапе заболевания происходит быстрое наращивание опухолевой массы и усиленная секреция цитокинов, что вызывает симптоматику опухолевой интоксикации. Выход в периферическую кровь клеток-миелоидных предшественников является причиной возникновения очагов экстрамедуллярного кроветворения в селезенке/печени с развитием спленомегалии и соответствующих симптомов, прежде всего — синдрома портальной гипертензии.
Развившийся тромбоцитоз/лейкоцитоз нарушает микроциркуляции в кровеносных сосудах и способствует развитию тромбозов, что способствует развитию симптоматики сердечно-сосудистых заболеваний. Изменения стромы костного мозга в виде остеомиелофиброза приводят к полному нарушению архитектоники кроветворения и развитию цитопений: анемического синдрома с клиническими проявлениями, лейкопении с развитием инфекционных осложнений, тромбоцитопении с развития спонтанных кровотечений, которые в ряде случаев могут представлять опасность для жизни. Дальнейшая пролиферация опухолевого клона вызывает более высокую степень малигнизации, являющуюся следствием бластной трансформации с развитием терминальной стадии заболевания.
Анализы и диагностика
Диагноз первичного миелофиброза устанавливается на данных комплексного обследования пациента, который включает:
Согласно классификации ВОЗ 23016 года диагноз первичный миелофиброз ставится при наличии 3-х больших и 2-х малых диагностических критериев (рис. ниже).
Лечение
Стандарт оказания медицинской помощи при хроническом миелофиброзе дополнен и пересмотрен в 2015 г. Медикаментозное лечение не приводит к полному излечению, но улучшает качество жизни (устранение анемии, тромбоцитопении, спленомегалии, интоксикации), увеличивает общую выживаемость и предупреждает осложнения и прогрессирование заболевания.
Стандарт оказания медицинской помощи включает:
Лечение хронической фазы проводится цитостатическими лекарственными препаратами или интерферонами, как в виде монотерапии, так и сочетанного их применения. В бластной фазе — по программам лечения острых лейкозов с учетом возраста больных. Выбор тех или иных лекарственных средств и, в целом тактики лечения, зависит от группы риска, степени выраженности симптомов и возраста больного.
Лечение пациентов группы низкого риска
Это больные, имеющие нормальные значения гемоглобина, умеренный лейкоцитоз и фиброз костного мозга, у них отсутствует бластемия. При отсутствии симптомов интоксикации часто проводится только динамическое наблюдение, поскольку использование агрессивных методов лечения вызывает риск побочных эффектов.
У пациентов низкого риска, но с минимальными клиническими проявлениями, которым еще не показана специфическая терапия, проводится симптоматическое лечение:
Эритропоэз-стимулирующие препараты назначают с целью стимуляции эритропоэза и устранения анемии. Лечение анемической формы заболевания без ретикулоцитоза заключается в применении препаратов рекомбинантного эритропоэтина, который вводится подкожно. Эффект от применения эритропоэтинов сохраняется около года.
Глюкокортикоиды назначаются для быстрого купирования симптомов опухолевой интоксикации. Особенно показано их назначение при гемолитической анемии и тромбоцитопении. Эта группа препаратов снижает секрецию цитокинов, уменьшает разрастание фибробластов и соединительной ткани. Они подавляют катаболизм (распад) белков и стимулируют гибель клеток опухоли. Вместе с тем, имеют побочные реакции, а эффект их применения нестойкий, поэтому нужна поддерживающая терапия (почти постоянная).
Гормональные препараты применяются не только в качестве симптоматической терапии, но и в комбинированной терапии с иммуномодуляторами. При использовании глюкокортикостероидов необходимо учитывать противопоказания (остеопороз, сахарный диабет) и побочные эффекты (усугубление остепороза, развитие синдрома Иценко Кушинга).
Андрогены (анаболические стероиды) показаны при анемической форме заболевания. Их механизм действия близок к кортикостероидам и основное действие — уменьшение опухолевой интоксикации, угнетение катаболизма, стимуляция гемопоэза. У 30–40 % больных после их применения отмечается повышение уровня гемоглобина. Вводятся внутримышечно раз в неделю. Эффективность оценивается через 6 месяцев. Побочные эффекты: задержка жидкости, гирсутизм, токсическое действие на печень и повышение риска опухолей печени. Противопоказаны при раке простаты в анамнезе.
В случае, если быстро увеличиваются размеры селезенки и появляется угроза ее разрыва, не устраняются слабость, потливость, что говорит о неэффективности симптоматической терапии, больным показано применение цитостатиков, ингибиторов jak2 (Руксолитиниб), а также препаратов интерферона.
Лечение пациентов группы промежуточного-2 и высокого риска
У этих больных отмечается выраженная анемия, высокий лейкоцитоз и сдвиг до бластов, тромбоцитопения, выраженный фиброз костного мозга. Возможно быстрое развитие бластной трансформации.
В данном случае назначаются основные группы препаратов:
Выбор той или иной группы препаратов, а также назначение их в различных комбинациях зависит от возраста больного и клинической картины. У лиц до 45 лет, не имеющих сопутствующей патологии, сразу обсуждается возможность проведения трансплантации. При невозможности ее выполнения предлагается медикаментозное лечение. Показанием к цитостатической терапии служит нарастающий лейкоцитоз, тромбоцитоз и увеличение селезенки. Помимо цитостатиков у молодых пациентов целесообразно применение препаратов интерферона.
В возрасте 45-65 лет чаще всего используется стандартная лекарственная терапия. При отсутствии противопоказаний редко, но выполняется алло-ТКМ. У больных старше 65 лет важно поддерживать качество жизни и купировать осложнения заболевания. В этом возрасте проводится лечение ингибиторами jak2 (ингибиторы янускиназ), руксолитинибом (Джакави).
Характеристика основных лекарственных групп, применяемых для лечения.
Для пациентов промежуточного-2 и высокого риска препараты ингибиторов янускиназ являются препаратами выбора, а для больных промежуточного-1 риска они рекомендуются в случае нечувствительности к другим цитостатикам. Данные препараты являются основными для пациентов, которым необходимо быстро уменьшить размеры селезенки и устранить симптомы интоксикации перед операцией по пересадке костного мозга.
Лечение и профилактика осложнений основного заболевания:
Хронические РН-негативные миелопролиферативные заболевания
Общая информация
Краткое описание
Одобрен объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «28» ноября 2017 года
Протокол №33
Истинная полицитемия – клональное миелопролиферативное заболевание, которое характеризуется пролиферацией эритроидного, гранулоцитарного, мегакариоцитарного ростков кроветворения с преимущественной пролиферацией эритроидного ростка кроветворения, увеличением числа эритроцитов и повышением уровня гемоглобина, тромбоцитозом, лейкоциозом в периферической крови (панмиелоз).
Все больные являются носителями мутации JAK2 V617F и/или CALR, MPL.
Эссенциальная тромбоцитемия – клональное миелопролиферативное заболевание с постоянной повышенной пролиферацией мегакариоцитов и повышенным образованием тромбоцитов, характеризующееся повышенным числом больших, зрелых мегакариоцитов в костном мозге, тромбоцитозом в периферической крови (>450х109/л) и клинически – эпизодами тромбозов и/или кровотечений.
Миелопролиферативное заболевание неклассифицируемое — согласно рекомендациям ВОЗ 2008г данный диагноз следует использовать при наличии клинических, лабораторных и гистологических (в трепанобиоптате костного мозга) признаков МПЗ, не соответствующих какой-либо определенной нозологической форме Ph-негативных миелопролиферативных заболеваний – ИП, ЭТ, ПМФ.
Хронический миеломоноцитарный лейкоз — клональное заболевание кроветворной системы, которое характеризуется хроническим моноцитозом в периферической крови, отсутствием Ph хромосомы, гена BCR-ABL1, а также бластозом в костном мозге ≤20%.
Код(ы) МКБ-10:
| МКБ-10 | |
| Код | Название |
| D 45.0 | Истинная полицитемия |
| D 47.3 | Эссенциальная (геморрагическая) тромбоцитемия |
| D 47.1 | Хроническая миелопролиферативная болезнь |
Дата разработки/пересмотра протокола: 2017 год.
Пользователи протокола: врачи общей практики, терапевты, онкологи, гематологи.
Категория пациентов: взрослые, беременные.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор рандомизированных клинических исследований (РКИ) или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или |
| Неконтролируемое исследование или | |
| Мнение экспертов | |
| GPP | Наилучшая клиническая практика. |
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
13-15 октября, Алматы, «Атакент»
600 брендов, более 150 компаний-участников из 20 стран.
Новинки рынка стоматологии. Цены от производителей
Классификация
1. Хронический нейтрофильный лейкоз
2. Истинная полицитемия
3. Первичный миелофиброз
— Префибротическая стадия
— Фибротическая стадия
4. Эссенциальная тромбоцитемия
5. Хронический эозинофильный лейкоз NOS
6. Мастоцитоз
7. Хроническое миелопролиферативное заболевание неклассифицируемое
Миело-/лимфоидные заболевания с эозинофилией и перестройкой PDGFRA, PDGFRB, или FGFR1, или с PCM1-JAK2:
1. Миело-/лимфоидные заболевания с перестройкой PDGFRA
2. Миело-/лимфоидные заболевания с перестройкой PDGFRB
3. Миело-/лимфоидные заболевания с перестройкой FGFR1
4. Миело-/лимфоидные заболевания с перестройкой PCM1-JAK2
Миелодиспластические/миелопролиферативные заболевания (МДС/МПЗ)
1. Хронический миеломоноцитарный лейкоз (ХММЛ)
2. Атипичный хронический миелолейкоз (аХМЛ) bcr-abl1 негативный
3. Ювенильный миеломоноцитарный лейкоз (ЮММЛ)
4. МДС/МПЗ с кольцевыми сидеробластами и тромбоцитозом (МДС/МПЗ-КС-Т)
5. МДС/МПЗ неклассифицируемый
Факторы и группы риска
Истинная полицитемия:
Стратификация риска у больных ИП используется для оценки вероятности тромботических осложнений, превносящих наибольший вклад в структуру смертности и инвалидизации, обусловленную заболеванием, а не для оценки выживаемости или риска трансформации в лейкоз/миелофиброз.
Наиболее устойчивыми факторами риска для тромботических осложнений при ИП являются возраст старше 60 лет и наличие тромбозов в анамнезе. При этом целесообразно также учитывать общие факторы риска для сердечно- сосудистых и тромботических осложнений (табл. 2) (УД – B).
Таблица 2. Стратификация риска развития тромбогеморрагических осложнений при ИП.
| Категории риска | Возраст старше 60 лет и/или тромбозы в анамнезе. | Сердечно-сосудистые факторы риска. |
| Низкий. | — | — |
| Промежуточный. | — | + |
| Высокий. | + | +/— |
*сахарный диабет, артериальная гипертензия, курение
Таблица 4. Прогностическая шкала для пациентов с ИП
| Прогностическая шкала | Группы риска и клиническая значимость |
| Обычная оценка тромбоза (рекомендации Европейского LeukemiaNet) 70 | |
| По меньшей мере 1 из следующих факторов риска: | Низкий риск: возраст |
| • Возраст ≥ 60 лет | высокий риск: возраст ≥60 лет И / ИЛИ наличие тромбоза в анамнезе, по крайней мере, один из факторов риска |
| • Предшествующий тромбоз | Пациентам с низким уровнем риска назначают ацетилсалициловую кислоту с низкой дозой и подвергают регулярной флеботомии, чтобы сохранить гематокрит |
| IPSS для общей выживаемости в PV78 | |
| Факторы риска (вес): | низкий риск: 0 (средняя выживаемость, 28 лет) |
| • Возраст ≥67 лет (5 баллов) | Промежуточный риск: 1-2 балла (средняя выживаемость, 19 лет) |
| • Количество лейкоцитов ≥15 × 109 / L (1 балл) • | |
| • Предшествующий венозный тромбоз в анамнезе (1 балл) |
* Сердечно-сосудистые факторы риска включают гипертонию, диабет и курение.
Прогностическая шкала для Хронического миеломоноцитарного лейкоза: используется для определения группы риска при ХММЛ (данная шкала представлена в виде электронного калькулятора, которым можно воспользоваться пройдя по ссылке 1
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ 9
Диагностические критерии:
Жалобы, анамнез, данные физического исследования имеет значение в диагностике и в дифференциальной диагностике хронических миелопролиферативных заболеваний, но неспецифичны в связи, с чем не относятся к диагностическим критериям.
Жалобы при ИП (характер возникновения и проявления болевого синдрома) на головокружение, головные боли, ухудшение зрения, кожный зуд, приступы стенокардии – плеторический синдром, наиболее характерен для истинной полицитемии.
Кожный зуд, потливость, слабость, повышенная температура тела, боли в костях – миелопролифератитвный синдром;
NB! Плеторический синдром (от слова «плетора» – полнокровие) – характеризуется увеличением массы циркулирующих эритроцитов, что приводит к появлению жалоб на головокружение, головные боли, ухудшение зрения, кожный зуд после мытья, жгучие боли и парестезии в кончиках пальцев, приступы стенокардии. При осмотре кожа и видимые слизистые оболочки с синюшним оттенком (положительный симптом Купермана). Сосудистые осложнения – тромбозы любой локализации, приступы покраснения пальцев рук и ног, которые сопровождаются болью и жжением (эритромелалгия). Увеличение объёма циркулирующих эритроцитов приводит к появлению артериальной гипертензии у пациентов, которые до начала заболевания не жаловались на данный симптом, либо усугубление уже имеющейся гипертонической болезни, которая плохо поддаётся лечению традиционными гипотензивными препаратами. Более выраженными становятся симптомы ишемической болезни сердца, церебрального атеросклероза.
В раннюю стадию заболевания отмечается эритроцитоз, в костном мозге – панмиелоз. Так как заболевание развивается постепенно, от его начала до постановки диагноза проходит от 2 до 4 лет. Длительность данной стали – до 5 лет.
NB! Миелопролиферативный синдром обусловлен гиперплазией трех ростков кроветворения. Проявляется в виде кожного зуда, потливости, слабости, повышенной температуры тела, болей в костях. Повышенный распад гранулоцитов сопровождается нарушением уратового обмена, что проявляется в виде мочекислого диатеза, камнеобразования в почках, подагры, подагрической полиартралгии. Спленомегалия может быть обусловлена увеличением секвестрирующей функции селезенки.
Инструментальные исследования:
· УЗИ органов брюшной полости – с определением объема селезенки, для исключения развития инфаркта селезенки, тромбоза в системе портальных вен.
· трепанобиопсия костного мозга с гистологической оценкой и гистохимическим исследованием для выявления ретикулинового и коллагенового фиброза; также необходимо для оценки эффекта терапии, прогрессирования и трансформации заболевания. Для сопоставления с гистологической картиной в дебюте заболевания (до лечения).
Показания для консультации специалистов:
· консультации других узких специалистов – по показаниям.
Диагностический алгоритм 9:
Дифференциальный диагноз
| (ВОЗ 2016) | Большие критерии | Малые критерии | Подтверждение диагноза |
| ИП | 1. Гемоглобин> 165 г/л у мужчин или более 160 г/л у женщин, или гематокрит> 49% у мужчин или у 48% у женщин, или увеличенная масса эритроцитов (более чем на 25% выше среднего прогнозируемого значения) 2. При биопсии костного мозга – трехростковая гиперплазия (панмиелоз): увеличение пролиферации элементов эритроидного, гранулоцитарного, мегакариоцитарного ростков миелопоэза. 3. Наличие JAK2 (V617F) или JAK2 экзона 12 мутации | 1. Уровень эритропоэтина (ЭПО) сыворотки ниже референсных значений. | Диагноз ИП подтверждается при наличии двух больших и одного малого критерия или при наличии первого большого и двух малых критериев. Примечание: Критерий № 2 (биопсия КМ) может не потребоваться в случаях с устойчивым абсолютным эритроцитозом: уровень гемоглобина > 18,5 г/дл у мужчин (гематокрит, 55,5%) или более 16,5 г/дл у женщин (гематокрит, 49,5%). Однако первичный миелофиброз (имеющийся у 20% пациентов) может быть обнаружен только при проведении биопсии КM; |
| ЭТ | 1. Количество тромбоцитов ≥450 × 109 /л 2. В костном мозге пролиферация мегакариоцитов с увеличением числа зрелых мегакариоцитов с гиперглобулированными ядрами. Не наблюдается сдвига влево в нейтрофильном гранулопоэзе или эритропоэзе и редко увеличение ретикулиновых волокон. 3. Отсутствие критериев BCR-ABL1 + ХМЛ, ЭТ, ПМФ, миелодиспластических синдромов или других миелоидных новообразований 4. Наличие мутации JAK2, CALR или MPL | Наличие клонального маркера или отсутствие доказательств для реактивного тромбоцитоза | Диагностика ЭТ требует наличия всех четырех больших критериев или первых трех больших критериев и малого критерия |
| префибротический ПМФ | 1. Пролиферация и атипия* мегакариоцитов, сочетающиеся с ретикулиновым и/или коллагеновым фиброзом костного мозга; при отсутствии выраженного ретикулинового фиброза – повышенная клеточность костного мозга с пролиферацией клеток гранулоцитарного ряда и угнетением эритропоза (префиброзная клеточная фаза ПМФ). |
2. Отсутствие критериев ИП, BCR/ABL1+ХМЛ, МДС или других миелопролиферативных заболеваний.
3. Наличие мутаций JAK2, CALR или MPL, а при их отсутствии – исключение реактивного фиброза (инфекции, аутоиммунные заболевания, хроническое воспаление, волосатоклеточный лейкоз, другие лимфопролиферативные заболевания, метастазы солидных опухолей, токсические миелопатии)
• Анемия, не связанная с сопутствующим заболеванием
• лейкоцитоз (количество лейкоцитов ≥11 × 109 / л)
• Пальпируемая спленомегалия
• Повышение активности ЛДГ
Примечание: При отсутствии какой-либо из 3 основных клональных мутаций поиск наиболее часто встречающихся сопутствующих мутаций (например, ASXL1, EZH2, TET2, IDH1 / IDH2, SRSF2, SF3B1) помогает в определении клональной природы заболевания
2. Отсутствие критериев для BCR-ABL1 + CML, PV, ET, миелодиспластическим синдромам или другим миелоидным новообразованиям
3. Наличие мутаций JAK2, CALR или MPL, а при их отсутствии – исключение реактивного фиброза (инфекции, аутоиммунные заболевания, хроническое воспаление, волосатоклеточный лейкоз, другие лимфопролиферативные заболевания, метастазы солидных опухолей, токсические миелопатии)
• Анемия, не связанная со сопутствующим заболеванием
• лейкоцитоз (количество лейкоцитов ≥11 × 109 / л)
• пальпируемая спленомегалия
• Уровень ЛДГ увеличен до уровня выше верхней границы нормы
• Лейкоэритробластоз
Примечание: При отсутствии какой-либо из 3 основных клональных мутаций поиск наиболее часто встречающихся сопутствующих мутаций (например, ASXL1, EZH2, TET2, IDH1 / IDH2, SRSF2, SF3B1) помогает в определении клональной природы заболевания
Диагностические критерии МДС/МПЗ с кольцевыми сидеробластами и тромбоцитозом:
| Анемия, ассоциированная с дисплазией эритроидного ростка с/или мультилинейной дисплазией, ≥15% кольцевых сидеробластов, |
| Наличие тромбоцитоза с количеством тромбоцитов ≥450 × 109/L |
| Наличие мутации SF3B1 или, отсутствие мутации SF3B, отсутствие в анамнезе цитотоксической или колони стимулирующей терапии, которые могут быть причиной развития МДС/МПЗ |
| Отсутствие BCR-ABL1, отсутствие перестроек PDGFRA, PDGFRB, или FGFR1; или PCM1-JAK2; отсутствие (3;3)(q21;q26), inv(3)(q21q26) или del(5q) |
| Отсутствие в анамнезе МПЗ, МДС (за исключением MDS-RS), или другие типы МДС/МПЗ |
Диагностические критерии аХМЛ BCR-ABL1−:
| Лейкоцитоз в периферической крови за счет увеличения количества нейтрофилов и их предшественников (промиелоцитов, миелоцитов, метамиелоцитов), включающей ≥10% от лейкоцитов) |
| Дисгранулопоэз, который может включать аномальное содержание хроматина |
| Отсутствие или минимальная абсолютная базофилия; количество базофилов |
| Отсутствие или минимальный абсолютный моноцитоз; моноциты |
| Гиперклеточный КМ с гранулоцитарной пролиферацией и дисплазией гранулоцитов, с/или дисплазией эритроидного и мегакариоцитарного ростков |
| Не доказанные перестройки PDGFRA, PDGFRB, или FGFR1, или PCM1-JAK2 |
| Не соответствует критериям ВОЗ BCR-ABL1+ ХМЛ, ПМФ, ИП, или ЭТ |
Диагностические критерии ХММЛ:
| Персистирующий моноцитоз ≥1 × 109 / L, при этом моноциты составляют ≥10% от количества лейкоцитов |
| Не соответствует критериям ВОЗ для BCR-ABL1 + ХМЛ, ПМФ, ИП или ЭТ |
| Дисплазия в 1 или более миелоидных ростках. Если миелодисплазия отсутствует или минимальна, диагноз ХММЛ может быть выставлен, если присутствуют другие критерии |
| Клональная цитогенетическая и молекулярно-генетическая поломка присутствующая в гемопоэтических клетках |
| или |
| Моноцитоз сохраняется в течение по меньшей мере 3 месяцев |
| Все другие причины моноцитоза были исключены |
Уровень лейкоцитов (> 10 × 109 / л), без ответа на терапию
«Предварительные критерии ответа на терапию ИТК»
Нарастающая спленомегалия, без ответа на терапию
Резистентность к первой линии ИТК
Тромбоцитоз (> 1000 × 109 / л), без ответа на терапию
Резистентность к двум последовательным линиям ИТК
Появление 2 или более мутаций в BCR-ABL1 во время терапии ИТК
20% или более базофилов в КМ
10-19% бластных клеток в периферической крови или КМ
Дополнительные хромосомные абберации в клетках Ph + (трисомия 8, изохромосома 17q, трисомия 19), комплексный кариотип или аномалии 3q26.2
Любая новая клональная хромосомная аномалия в клетках Ph +, которая возникает во время терапии
Лечение
Препараты (действующие вещества), применяющиеся при лечении
| Анагрелид (Anagrelide) |
| Ацетилсалициловая кислота (Acetylsalicylic acid) |
| Бусульфан (Busulfan) |
| Гепарин натрия (Heparin sodium) |
| Гидроксикарбамид (Hydroxycarbamide) |
| Иматиниб (Imatinib) |
| Интерферон альфа (Interferon alfa) |
| Клопидогрел (Clopidogrel) |
| Леналидомид (Lenalidomide) |
| Меркаптопурин (Mercaptopurine) |
| Надропарин кальция (Nadroparin calcium) |
| Руксолитиниб (Ruxolitinib) |
| Тиклопидин (Ticlopidine) |
| Цитарабин (Cytarabine) |
| Эноксапарин натрия (Enoxaparin sodium) |
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ 20: для пациентов с установленным диагнозом, лечение и профилактика осложнений может проводиться в амбулаторных условиях.
Определение тактики терапии при ИП:
Цели терапии ИП (УД – D):
· предотвращение и лечение тромбогеморрагических осложнений;
· контроль симптомов опухолевой интоксикации (снижение веса, потливость, лихорадка, зуд);
· сведение к минимуму риска развития острого лейкоза и пост-ИП МФ;
· предупреждение осложнений в случае беременности, хирургических операций.
Определение тактики терапии при ЭТ:
Цели терапии ЭТ (УД – D):
· предупредить возникновение тромботических или геморрагических осложнений;
· минимизировать риск прогрессирования заболевания с исходом в пост-ЭТ МФ или ОМЛ;
· контроль симптомов интоксикации;
· предупреждение осложнений в случае беременности, хирургических манипуляций. Целевой уровень тромбоцитов менее 400 х 109/л.
Методы терапевтического воздействия при ЭТ:
· Профилактика тромботических осложнений:
— ацетилсалициловая кислота (40-325 мг/сут), клопидогрель (75 мг/сут), тиклопидин (500-750 мг/сут).
· Циторедуктивная терапия:
— Цитостатики: Гидроксимочевина 10-30 мг/кг/сут;
— Интерферон-альфа 1,5-5 млн МЕ 3 раза в неделю;
— Анагрелид 2-10 мг/сут.
· Лечение осложнений заболевания (тромбозы, тромбоэмболии).
Определение тактики терапии при ПМФ:
Цели терапии больных ПМФ (УД – D):
1) Контроль болезни: предупреждение прогрессии, увеличение общей и безрецидивной выживаемости.
2) Облегчение симптоматики: улучшение качества жизни (лечение анемии и другой цитопении, уменьшение спленомегалии, контроль симптомов интоксикации).
3) Предупреждение осложнений в случае беременности, хирургических операций.
Терапия ХФ ПМФ, как правило, проводится с помощью лекарственных препаратов в виде циторедуктивной терапии, интерферонотерапии или их сочетанного применения. В бластной фазе лечение может проводиться по программам лечения острых лейкозов с учетом возраста и коморбидности больных.
После подтверждения диагноза и определения прогностической группы ПМФ должна быть определена тактика специальной терапии. Основными факторами, влияющими на выбор варианта лечения, являются следующие:
· группа риска (по системам IPSS, DIPSS, DIPSS+);
· наличие и степень выраженности симптомов заболевания;
· возраст больного;
· коморбидность;
· наличие совместимых по системе HLA доноров и возможность выполнения алло-ТГСК.
Определение тактики терапии при ХММЛ:
1) Лечение больных ХММЛ с агрессивным типом течения проводится либо в виде монотерапии гидроксимочевиной или этопозидом, либо с использованием различных схем полихимиотерапии, применяемых для лечения острых лейкозов.
2) Дополнительное лечение: как при МДС.
3) Трансплантация аллогенных кроветворных клеток: единственный метод обеспечивающий вылечивания, рекомендуется рассмотреть у молодых пациентов, имеющих совместимого по системе HLA донора; результаты аналогичны к резу льтатам лечения МДС.
4) Циторедуктивная терапия: чаще всего гидроксимочевина, прежде всего при МП-ХММЛ.
5) Гипометилирующие препараты: азацитидин при МД-ХММЛ с бластозом в костном мозге ≥10%.
Определение тактики терапии при хроническом нейтрофильном лейкозе:
Лечение больным ХрНЛ длительное время не проводится, хотя при выраженном гиперлейкоцитозе и нарастании размеров печени и селезенки с целью циторедукции может быть использована гидроксимочевина. Вместе с тем, все больные ХрНЛ должны быть под постоянным наблюдением гематолога.
Определение тактики терапии при атипичном хроническом миелолейкозе:
Заболевание характеризуется крайне агрессивным течением. Длительность жизни больных составляет в среднем 11-18 месяцев. При атипичном хроническом миелолейкозе использование препарата Гливек не эффективно. Единственным эффективным методом лечения является аллогенная трансплантация стволовых клеток. Однако и данный метод лечения обеспечивает длительную безрецидивную выживаемость только у 30% пациентов.
Немедикаментозное лечение 20:
· Режим: общеохранительный;
· Диета: стол №15 (общая).
Медикаментозное лечение
Выбор циторедуктивной терапии
· низкий риск тромбозов – циторедуктивная терапия, как правило, не требуется;
· промежуточный риск:
— возраст 60 лет: 1-ая линия гидроксимочевина, 2-ая линия анагрелид и/или ИФН-альфа;
· высокий риск:
— возраст 40 лет: 1-ая линия гидроксимочевина, 2-ая линия анагрелид и/или ИФН-альфа; Сочетанная терапия (гидроксимочевина + анагрелид, гидроксимочевина + ИФН-альфа)
может стать альтернативой в качестве терапии 2-ой линии у пациентов, если при монотерапии развиваются побочные эффекты, не позволяющие прием дозы препарата, адекватной для контроля уровня тромбоцитов.
Гидроксимочевина
Терапевтический эффект гидроксимочевины заключается в снижении тромбоцитоза, профилактике тромботических осложнений. В исследовании РТ-1 показана большая эффективность гидроксимочевины в сравнении с анагрелидом в предотвращении артериальных тромбозов [22]. Определенные опасения вызывает возможный лейкозогенный эффект при длительном применении, в связи с чем гидроксимочевину в первой линии молодым больным с ожидаемой длительной продолжительностью жизни следует назначать с осторожностью.
Рекомендации (УД – B): гидроксимочевина рекомендуется как препарат выбора в качестве терапии первой линии у больных ЭТ с промежуточным риском развития тромбозов в возрасте > 60 лет и у больных ЭТ с высоким риском развития тромбозов в возрасте > 40 лет. Вторая линия терапии у других категорий больных с промежуточным и высоким риском развития тромбозов.
Гидроксимочевину не следует использовать при беременности или при планировании беременности.
Интерферон-альфа
Лечение препаратами ИФН-альфа является эффективным и безопасным препаратом для лечения. ИФН-альфа не оказывает лейкозогенного или тератогенного действия. Рекомендации (УД – С): ИФН-альфа рекомендуется как препарат выбора в качестве терапии первой линии у больных ЭТ с промежуточным риском развития тромбозов в возрасте
| Фармакологическая группа | Международное непатентованное наименование ЛС | Способ применения, доза | Уровень доказательности |
| Лекарственные средства, профилактирующие тромботические осложнения | ацетилсалициловая кислота или | Внутрь, определяется уровнем тромбоцитов (50, 75, 100мг) | А 35 |
или
или
или
или
или
или
или
или
или
подкожно
или
Эноксапарин
При возникновении осложнений лечение проводится в соответствии с клиническим протоколом данного осложнения.
Хирургическое вмешательство нет.
Дальнейшее ведение: согласно клинического протокола по медицинской реабилитации.
Ведение пациентов с ХМПЗ подразумевает за собой длительный динамический контроль. Профилактика тромбозов и тромбоэмболических осложнений, так как основной причиной, приводящей к инвалидизации и снижению продолжительности жизни, при ЭТ является склонность к тромбозам и тромбоэмболиям.
Стратификация риска у больных ЭТ, как и при ИП предназначена для оценки вероятности тромботических осложнений, в основном обусловливающих инвалидизацию и ограничивающих продолжительность жизни больных.
Из-за риска сердечно-сосудистых осложнений, аритмий и кардиомиопатии, все пациенты должны проходить алвновое обследование сердечно-сосудистой системы (ЭКГ, эхокардиографию).
Индикаторы эффективности лечения [22]
Критерии клиникогематологического ответа при лечении ЭТ:
| Ответ | Критерии ответа | |
| Полный ответ (сохранение ответа в течение 12 недель) | 1 Тромбоциты ≤400 х 109 /л | |
| 2 Нет симптомов, опосредованных заболеванием (микрососудистые нарушения, зуд, головная боль) | ||
| 3 Нормальные размеры селезенки (УЗИ/КТ/МРТ) | ||
| 4 Лейкоциты ≤10 х 109 /л | ||
| Констатация полной ремиссии возможна только при наличии всех 5 критериев. | ||
| Частичный ответ | Пациенты, кто не соответствует критериям полного ответа | |
| (сохранение ответа в течение 12 недель) | 1 Тромбоциты ≤600 х 109 /л или снижение более 50% от исходного уровня. | |
| Нет ответа | Любой ответ, который не удовлетворяет критериям частичного ответа. | |
· нет достоверных рекомендаций по контролю молекулярного ответа (качественный, количественный молекулярный анализ на JAK2V617F).
· исследование костномозгового кроветворения целесообразно проводить только при оценке трансформации в миелофиброз.
Критерии клинико-гематологического ответа при лечении ИП [22]:
| Ответ | Критерии ответа при ИП |
| Полный ответ (ответ в течение 12 недель) | 1 Гематокрит |
| 2 Тромбоциты ≤400 х 109 /л | |
| 3 Лейкоциты ≤10 х 109 /л | |
| 4 Нормальные размеры селезенки (УЗИ/КТ/МРТ) | |
| 5 Нет симптомов, опосредованных заболеванием (микрососудистые нарушения, зуд, головная боль) | |
| Констатация полной ремиссии возможна только при наличии всех 5 критериев. | |
| Частичный ответ (ответ в течение 12 недель) | 1 Гематокрит |
| 2 Ответ по всем другим критериям | |
| Нет ответа | Любой ответ, который не удовлетворяет критериям частичного ответа |
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ [26]: стационарное лечение показано пациентам с развитием жизнеугрожающих тромботических состояний, которое проводится в соответствии с клиническими протоколами: «Венозные тромбозы и тромбофлебиты, посттромбофлебитический синдром», «Тромбоэмболические осложнения в акушерстве», «Тромбоэмболия легочной артерии», «Эмболия и тромбоз аорты и артерий».
Немедикаментозное лечение:
· Режим: общеохранительный.
· Диета: общая.
Медикаментозное лечение: см. Амбулаторный уровень.
Хирургическое вмешательство:
· Спленэктомия – проводится строго по показаниям:
Показания:
· прогрессирующая спленомегалия с компрессионным синдромом (абдоминальный дискомфорт, постоянное чувство тяжести, боль, признаки кишечной непроходимости);
· интоксикация, обусловленная огромной опухолевой массой;
· тяжелые гиперкатаболические симптомы, включая кахексию;
· глубокая анемия, рефрактерный гемолиз, тромбоцитопения, резистентная к традиционным методам терапии;
· обширные инфаркты селезенки с угрозой разрыва;
· внепеченочная портальная гипертензия с угрозой развития кровотечения из желудка и пищевода.
Противопоказания:
· тяжелые сердечно-сосудистые заболевания;
· неконтролируемая коагулопатия;
· отсутствие согласия больного.
Дальнейшее ведение: см. Амбулаторный уровень.
Индикаторы эффективности лечения: см. Амбулаторный уровень.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации:
· проведение курсов химиотерапии;
· проведение трепанобиопсии гребня подвздошной кости в случае отсутствия возможности проведения в амбулаторных условиях;
· спленэктомия;
· аллогенная трансплантация гемопоэтических стволовых клеток
Показания для экстренной госпитализации:
· соматически тяжелый пациент (ECOG≥3). Госпитализация в отделение паллиативной помощи пациентам с массивной симптоматической спленомегалией, с уровнем тромбоцитов >50 х 109/л.
Информация
Источники и литература
Информация
| АЛТ | – | аланинаминотрансфераза |
| АСТ | – | аспартатаминотрансфераза |
| БФ | – | бластная фаза |
| ГСК | – | гемопоэтические стволовые клетки |
| ГЦ | – | герменативный центр |
| ЗНО | – | злокачественное новообразование |
| ИГХ | – | иммунногистохимия |
| ИП | – | истинная полицитемия |
| ИФα | – | интерферлн-альфа |
| ИФА | – | иммунноферментный анализ |
| ИФТ | – | иммуннофенотипирование |
| КП | – | клинический протокол |
| КТ | – | компьютерная томография |
| ЛДГ | – | лактатдегидрогеназа |
| МПЗ | – | миелопролиферативные заболевания |
| МФ | – | миелофиброз |
| МДС | – | миелодиспластический синдром. |
| МКБ | – | международная классификация болезней |
| МОБ | – | минимальная остаточная болезнь |
| ОАК | – | общий анализ крови |
| ОБП | – | органы брюшной полости |
| ПХТ | – | полихимиотерапия |
| ПЦР | – | |
| РКИ | – | рандомизированное клиническое исследование |
| ТКМ | – | трансплантация костного мозга |
| УД | – | уровень доказательности |
| УЗДГ | – | ультразвуковая доплерография |
| УЗИ | – | ультразвуковое исследование |
| ЭКГ | – | электрокардиограмма |
| ЭТ | – | эссенциальная тромбоцитемия. |
| FISH | – | Fluorescence in situ hybridization |
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА
Список разработчиков протокола с указание квалификационных данных:
1) Кемайкин Вадим Матвеевич – кандидат медицинских наук, Руководитель департамента онкологии Филиала КФ «UMC» Национальный научный центр онкологии и трансплантологии.
2) Вильданова Рузаль Фауатовна – гематолог Филиала КФ «UMC» Национальный научный центр онкологии и трансплантологии.
3) Тусипова Адия Айткалиевна – гематолог Филиала КФ «UMC» Национальный научный центр онкологии и трансплантологии.
4) Смагулова Газиза Ажмагиевна – кандидат медицинских наук, заведующая кафедрой пропедевтики внутренних болезней и клинической фармакологии РГП на ПХВ «Западно-Казахстанский государственный медицинский университет имени М.Оспанова».
Консультант: Рапильбекова Гульмира Курбановна – доктор медицинских наук, профессор, акушер-гинеколог акушерского отделения №1 Филиала КФ «UMC» Национальный научный центр материнства и детства».
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
Рамазанова Райгуль Мухамбетовна –доктор медицинских наук, заведующая курсом гематологии АО «Казахский медицинский университет непрерывного образования».
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Приложение 1
к типовой структуре
Клинического протокола диагностики и лечения
АЛГОРИТМ ДИАГНОСТИКИ И ЛЕЧЕНИЕ НА ЭТАПЕ СКОРОЙ НЕОТЛОЖНОЙ ПОМОЩИ (схемы)
1) Диагностические мероприятия: сбор жалоб и анамнеза.
2) Медикаментозное лечение: симптоматическая терапия.
Приложение 2
Программа лечения ХМПЗ во время беременности:
В связи с тем, что все Ph-негативные хМПЗ имеют много общих клинико-морфологических характеристик, принципы ведения беременности и лечебная тактика у данной группы пациенток во многом сходны. На основании анализа данных разработан алгоритм обследования женщин с хМПЗ во время беременности, включающий:
— исследование показателей периферической крови и гемостаза, включающее количество тромбоцитов, их функциональную активность, состояние плазменного звена гемостаза, а также исследование содержания маркеров внутрисосудистого свертывания каждые 2 нед.;
— диагностику АФС (волчаночный антикоагулянт, антикардиолипиновые антитела), а также исследование мутаций генов, сопряженных с наследственной тромбофилией, уровня гомоцистеина, в случае если эти исследования не были проведены до беременности;
— УЗИ плода дважды в каждом триместре;
— допплерометрию с исследованием фетоплацентарного и маточно-плацентарного кровотока и кровотока в средней мозговой артерии плода (наиболее информативного показателя для определения гипоксии плода) начиная с 22 нед. каждые 4 нед.;
— кардиотокографию плода с 33 нед. беременности (на 33, 36 и 38-й неделях).
Миелопролиферативные и миелодиспластические нарушения, нейтропении
Миелопролиферативные заболевания
Нарушения деятельности стволовых клеток, характеризующиеся автономной пролиферацией одного или более ростков гемопоэза (эритроидного, миелоидного, мегакариоцитарного) в костном мозге; результатом чего является избыточное количество клеток в периферической крови и, в некоторых случаях, печени и селезенке (экстрамедуллярный гемопоэз). Различают четыре типа нарушений.
Хронический миелоидный (гранулоцитарный) лейкоз (ХМЛ)
Характеризуется спленомегалией и лейкоцитозом (в типичных случаях число лейкоцитов равно 50 000–200 000) с широким спектром как предшественников гранулоцитов, так и зрелых гранулоцитов в крови. Сочетается с характерной хромосомной аномалией (Филадельфийская хромосома, а 9;22 транслокация). Различают две фазы заболевания — хроническая, относительно безболезненная, длится 2–3 года, впоследствии переходит в властную фазу, напоминающую острый лейкоз, обычно быстро завершающуюся летальным исходом.
Лечение. В хронической фазе терапия цитостатиками (бусульфан, гидроксимочевина) и (или) интерфероном может регулировать количество гранулоцитов, однако не является радикальной; трансплантация костного мозга излечивает некоторых больных.
Polycythemia vera
Polycythemia vera (истинная полицитемия) — нарушение, проявляющееся избыточным образованием эритроидных клеток и ведущее к повышению гемоглобина и гематокрита в крови. Чрезмерную продукцию лейкоцитов и тромбоцитов также наблюдают более чем у 1/2 больных. Увеличение эритроцитарной массы ведет к повышению объема и вязкости крови.
Клинические проявления зуд, плетора лица, ретинальная венозная гиперемия, ухудшение мозгового кровообращения (головная боль, шум в ушах, головокружение, расстройства зрения, транзиторные ишемические эпизоды). Характерно ускоренное развитие атеросклеротических и тромботических заболеваний (инсульт, инфаркт миокарда, поражение периферических сосудов; не характерны тромбоз мезентериальных и печеночных вен); кровотечения (носовые, из ЖКТ); спленомегалия У 75% больных.
Диагноз устанавливают, исключая вторичные причины увеличения эритроцитной массы (хроническая гипоксемия, избыток карбоксигемоглобина, эритропоэтинпродуцирующие опухоли).
Лечение. Цель — уменьшение эритроцитной массы до нормального уровня, обычно с помощью повторных флеботомий и радиотерапии. У 20% больных заболевание прогрессирует до миелофиброза, у 5% развивается лейкоз (чаще у больных, которых лечили алкилирующими препаратами; их длительное применение не рекомендуют).
Миелофиброз (миелоидная метаплазия)
Фиброз костного мозга и экстрамедуллярный гемопоэз (миелоидная метаплазия), поражающие селезенку и печень (спленомегалия во всех случаях; гепатомегалия — у половины больных).
Клинические проявления: увеличение частоты тромбозов, кровотечение не характерно.
Диагностика. Анемия с изменениями в мазках крови: атипичные эритроциты (клетки «падающей капли», другие пойкилоциты, ядерные эритроидные клетки, базофильная пунктация, гигантские формы тромбоцитов). Биопсия костного мозга служит определяющим тестом, фиброз костного мозга может быть зафиксирован при окрашивании на ретикулин. Может развиваться остеосклероз (повышение плотности кости). Вторичные причины миелофиброза, которые необходимо учитывать в дифференциальной диагностике, включают метастазы опухолей, туберкулез, болезнь Педжета, болезнь Гоше.
Лечение поддерживающее, средний период выживания составляет около 4 лет.
Эссенциальный тромбоцитоз (тромбоцитения)
Чрезмерная пролиферация мегакариоцитов, приводящая к тромбоцитозу; количество тромбоцитов более 800 000/мкл. Характерна вторичная (железодефицитная) анемия, развивающаяся в результате кровопотери.
Клинические проявления такие же, как при polycythemia vera: рецидивирующие кровотечения и тромбоз.
Диагноз. В мазке крови наблюдают увеличение количества тромбоцитов и аномальные их формы (гигантские тромбоциты), необходимо исключить вторичные причины тромбоцитоза
Лечение. Его цель — снижение количества тромбоцитов (алкилируюшие средства, гидроксимочевина, радиооблучение). Острое уменьшение количества тромбоцитов посредством тромбоцитафереза показано у больных с периодически возникающими тяжелыми кровотечениями. Применение антитромбоцитарных средств (аспирин, дипиридамол) показано больным с рецидивирующими тромбозами.
Миелодиспластические синдромы
Гетерогенная группа нарушений у лиц старше 50 лет, характеризующихся периферическими цитопениями (одного или более ростков гемопоэза) при наличии нормо- или гиперцеллюлярного костного мозга и диспластического созревания клеток костного мозга, одного или более ростков; у 2550% больных заболевание прогрессирует в острый миелоидный лейкоз (ОМЛ), синдромы часто относят к предлейкозу.
Лечение, после трансформации заболевания в острый лейкоз, редко бывает успешным, в противоположность лечению больных первичным ОМЛ.
Нейтропении наследственные — группа редких наследственных заболеваний с почти полным отсутствием в крови нейтрофилов, обнаруживаемым постоянно (постоянные нейтропении) или через равные промежутки времени (периодические нейтропении). Как правило, болезни наследуются рецессивно. Патогенез первичных механизмов нейтропении изучен плохо, инфекционные воспалительные процессы обусловлены нейтроленией.
Клиническая картина — склонность к инфекциям (как правило, стафилококковым), тяжелая альвеолярная пиорея с детства (обнаженные шейки зубов, их расшатывание и выпадение). При периодической форме болезни — лихорадка и инфекции строго периодичны и соответствуют дням нейтропении. В крови почти полностью отсутствуют нейтрофилы, повышено число эозинофилов и моноцитов. При периодической форме эти изменения продолжаются несколько дней, возникая через строго определенные отрезки времени. Анемии, тромбоцитопении нет. В костном мозге — обрыв созревания нейтрофилов на стадии промиелоцита (реже миелоцита), моноцитоз (у детей часто много промоноцитов), эозинофилия.
Лечение. Антибиотики при наличии инфекционных осложнений, непрерывная терапия альвеолярной пиореи.
Прогноз. Ликвидация инфекций позволяет сохранить жизнь больных детей; с годами тяжесть болезни ослабевает.
Профилактика. При периодической форме назначают антибиотики (например, оксациллин) перед кризом, что позволяет ослабить тяжесть инфекции.
Миелофиброз
Что провоцирует / Причины Миелофиброза:
Патогенез (что происходит?) во время Миелофиброза:
Симптомы Миелофиброза:
Миелофиброз может возникнуть на фоне истинной полицитемии или тромбоцитемии, однако обычно он развивается как первичный процесс. Следует еще раз подчеркнуть, что это болезнь людей среднего и пожилого возраста: максимальная заболеваемость отмечается в возрастной группе 50-70 лет. Лица обоего пола болеют одинаково часто.
Нередко обнаруживаются признаки подагры. Больные также страдают от зуда, который становится особенно мучительным в тепле. Возникают судороги в икроножных мышцах, боли в костях, причем все эти симптомы очень легко можно отнести за счет возраста пациента.
Встречающиеся иногда функциональные нарушения тромбоцитов бывают причиной внутрикожных кровоизлияний и желудочно-кишечных кровотечений. Примерно у 1/3 больных миелофиброзом обнаруживается очаговый остеосклероз, обычно захватывающий кости осевого скелета и проксимальные эпифизы плечевых и бедренных костей. Изредка поражаются и другие участки скелета, например череп.
Течение и прогноз
Состояние многих пациентов долгие годы остается стабильным при нормальном уровне гемоглобина и минимальной спленомегалии. У некоторых больных заболевание протекает менее доброкачественно, характеризуется постепенным ухудшением состояния здоровья, прогрессированием анемии и спленомегалии. Средний срок жизни от момента установления диагноза составляет 3 года, но многие больные живут дольше. Неблагоприятными прогностическими признаками являются тяжелая анемия, которую не удается устранить с помощью переливаний крови, выраженная лейкопения, спонтанные кровотечения и быстрая потеря массы тела. Все эти симптомы могут быть обусловлены дефицитом фолиевой кислоты. Причиной смерти чаще всего является прогрессирующая анемия, примерно 20 % больных умирают от острого миелобластного лейкоза.
Диагностика Миелофиброза:
Ко времени обращения за медицинской помощью анемия обнаруживается у 2/3 всех больных. Будучи слабо или умеренно выраженной на ранних стадиях заболевания, по мере его прогрессирования она становится более тяжелой. Отмечаются полихромазия, анизоцитоз, пойкилоцитоз, появляются клетки каплевидной формы. В периферической крови нередко встречаются ядросодержащие эритроциты и незрелые гранулоциты. Часто возникает дефицит фолиевой кислоты, вызванный недостаточным поступлением ее с пищей и повышенным оборотом клеток крови. В случае кровопотерь возникает дефицит железа. Число лейкоцитов часто увеличено, они представлены главным образом зрелыми лейкоцитами, обычно встречаются и незрелые формы.
Число тромбоцитов может быть снижено или увеличено в зависимости от стадии заболевания. На ранних фазах их число может достигать 1000·10 9 /л. Морфология тромбоцитов изменена, в мазке периферической крови встречаются гигантские формы и фрагменты циркулирующих мегакариоцитов. По мере прогрессирования болезни и увеличения селезенки число тромбоцитов уменьшается.
Пункции костного мозга обычно безуспешны («сухой прокол»), однако из-за очагового характера поражений при миелофиброзе иногда удается получить пунктаты гиперплазированных участков. Для точной диагностики следует провести трепанобиопсию подвздошной кости. Активность кроветворных клеток и степень костномозгового фиброза вариабельны. С помощью» метода серебрения увеличение количества ретикулиновых волокон удается обнаружить даже в гиперплазированных фрагментах.
Уровень мочевой кислоты в крови при миелофиброзе обычно высок.
Лечение Миелофиброза:
Специфического лечения нет. Больные с умеренно выраженными симптомами нуждаются только в периодическом обследовании. Анемия является главным поводом для начала терапии. Нередко возникающий дефицит фолатов хорошо поддается лечению фолиевой кислотой. Миелофиброз — одна из немногих болезней, при которых показан длительный профилактический прием фолиевой кислоты в дозе 5 мг/сут. Следует убедиться в том, что у больного не нарушено всасывание витамина B12. Многим больным назначают андрогены, однако последние не всегда эффективны, улучшение состояния если и наступает, то только спустя несколько недель.
Если анемия настолько тяжела, что вызывает сердечно-сосудистые нарушения, то необходимо переливать кровь, стараясь поддерживать гемоглобин на уровне 90-100 г/л. Однако прежде чем приступить к программе повторных гемотрансфузий, следует внимательно оценить общее состояние пациента. После переливания крови подъем уровня гемоглобина часто бывает меньше ожидаемого, и в конечном итоге его прирост становится все меньше по величине и короче по времени, а улучшение состояния длится только 1-2 нед. Это может быть обусловлено разрушением перелитых эритроцитов в селезенке.
Для уменьшения размеров селезенки используют также ее облучение, результаты которого неоднозначны. Прибегать к спленэктомии у больных пожилого возраста не рекомендуется из-за высокой летальности и многочисленных осложнений, а также из-за возможного реактивного увеличения содержания тромбоцитов. Более безопасен метод эмболизации через внутриартериальный катетер.
Профилактика Миелофиброза:
К каким докторам следует обращаться если у Вас Миелофиброз:
Миелопролиферативное заболевание крови что это такое
Миелодиспластическое/миелопролиферативное заболевание (МДС/МПЗ) – редкое хроническое заболевание крови, имеющее признаки как миелопролиферативного, так и миелодиспластического синдрома.
В этом случае в заболевшей стволовой клетке произошли такие изменения, что ее потомки имеют как явно опухолевые черты (миелопролиферации), так и признаки нарушения их созревания (дисплазии).
К болезням, сочетающим в себя все эти признаки, относятся
Диагноз
Поставить диагноз МДС\МПЗ довольно сложно, потому что врачу нужно найти у одного пациента черты двух болезней: опухолевые клетки (потомки заболевшей стволовой) и признаки нарушения созревания («взросления») здоровых клеток крови. Для этого необходимо выполнить цитологическое, цитогенетические, гистологическое исследование костного мозга, крови, а также провести другие специальные анализы.
Лечение
Лечение зависит прежде всего от диагноза и общего состояния пациента. Так, к примеру, на начальном этапе при рефрактерной анемии с кольцевидными сидеробластами и тромбоцитозом от активной терапии можно иногда воздержаться: такие пациенты нуждаются время от времени только в переливаниях крови. Атипичный хронический миелоцитарный лейкоз и ювенильный хронический миеломоноцитарный лейкоз всегда требуют лечения. Одной из главных опасностей МПЗ\МДС является переход болезни в острый лейкоз. Если это произошло, то больных лечат по схемам острых лейкозов. Молодых пациентов можно вылечить с помощью пересадки стволовых (материнских) клеток крови.
Миелолейкоз
Миелолейкоз относится к группе миелопролиферативных злокачественных заболеваний крови с патологическим делением нескольких или единственной группы кровяных телец. Пролиферация означает процесс, когда увеличивается количество клеток, а в медицине это определяется как разрастание тканей за счет аномального деления клеток в организме. Клетка-клон попадает в костный мозг, другие органы, происходит ее деление и вытеснение тканей, осуществляющих жизненно важные функции. Хронический миелолейкоз (ХМЛ) является редким заболеванием, встречается лишь один случай на 100 тысяч человек, и в основном это происходит со взрослыми людьми, пик болезней приходится на возраст 45-55 лет. Диагностировать миелолейкоз достаточно трудно, поскольку долгое время он протекает без каких-либо симптомов, или они незначительны. Часто эта разновидность онкологического заболевания выявляется при аналитических исследованиях крови.
Цены на услуги
| Наименование услуги | Цена (руб.) |
|---|---|
| Первичная консультация гематолога | 2200 |
| Повторная консультация гематолога | 1800 |
Миелолейкоз относится к группе миелопролиферативных злокачественных заболеваний крови с патологическим делением нескольких или единственной группы кровяных телец. Пролиферация означает процесс, когда увеличивается количество клеток, а в медицине это определяется как разрастание тканей за счет аномального деления клеток в организме. Клетка-клон попадает в костный мозг, другие органы, происходит ее деление и вытеснение тканей, осуществляющих жизненно важные функции. Хронический миелолейкоз (ХМЛ) является редким заболеванием, встречается лишь один случай на 100 тысяч человек, и в основном это происходит со взрослыми людьми, пик болезней приходится на возраст 45-55 лет. Диагностировать миелолейкоз достаточно трудно, поскольку долгое время он протекает без каких-либо симптомов, или они незначительны. Часто эта разновидность онкологического заболевания выявляется при аналитических исследованиях крови.
Причины развития хронического миелолейкоза
Ученые склоняются к тому, что главная среди причин миелолейкоза – наличие транслокации хромосом, то есть когда участки 9-й и 22-й хромосом меняются местами. В результате присоединения онкогена ABL из 9-й хромосомы к гену BCR в 22-й образуется гибридный ген, который служит источником онкогенного белка. Он и защищает опухолевые клетки от гибели, они попадают в кровяное русло, достаточно быстро развивается заболевание.
Называется такая мутация хромосомы филадельфийской по месту ее открытия американскими учеными в начале 60-х годов прошлого века. Способствует появлению этой аномалии облучение ионизирующего типа и контакт с химическими веществами (антрациклины, эпиподофилотоксины), но по причинам образования этого изменения в кариотипе человека у ученых нет единого мнения. 95 процентов случаев болезни связаны с наличием в кариотипе филадельфийской хромосомы и формирования из-за этого открытой рамки считывания устойчивого типа, что и является причиной миелолейкоза. Вероятность его увеличивается при синдроме Блума и анемии Фанкони.
Патогенез
Механизм зарождения хронического миелолейкоза связан с генетикой, и характеризуется образованием BCR – ABL гена при филадельфийской транслокации хромосом. Образование такого гена является предшественником последующей болезни. При этом кодируется белок химерного типа, который значительно увеличивает тирозинкиназную активность. Его участки активируются, начинается процесс увеличения клеточного деления, приводящий к болезни. В основном числе случаев появляется патология гранулоцитарного ростка, но бывают, что поражаются и другие гемопоэтические ростки – лейкоцитов, моноцитов…
Начинается все без симптомов для человека, и если причина не выявлена, эффективное лечение не проведено, то в конечном итоге происходит развитие болезни, что приводит к самой тяжелой стадии бластному кризу при миелолейкозе, схожему с острой формой лейкоза, выживаемость при котором небольшая.
Признаки хронического миелолейкоза
Наличие признаков хронического миелолейкоза зависят от стадии болезни:

Диагностика
Решающее значение для выявления хронического миелолейкоза дают показатели крови. Об этом более подробно будет рассказано ниже. Для диагностики применяются следующие анализы:
Современные методы диагностики позволяют безошибочно выявить болезнь, при эффективном лечении возможно приостановить ее прогрессирование.
Стадии миелолейкоза
В процессе классификации болезни выделяют три стадии миелолейкоза:
Поскольку чаще всего болезнь выявляется на первой стадии, то никаким приговором диагноз не является, главное понимать, что это за заболевание – миелолейкоз – через какие стадии оно проходит, и как лечится. В значительном числе случаев удается достичь продолжительной ремиссии, важно только не упускать драгоценное время, чаще бывать у врача, хотя бы раз в год или чаще сдавать общий анализ крови, а также анализ на лейкоцитарную формулу крови. В ней присутствует пять типов лейкоцитов (нейтрофилы, лимфоциты, базофилы, эозинофилы, моноциты), особое внимание стоит уделить базофилам. В любом случае все шаги следует согласовывать с врачом, и в медицинском центре “Вера в НАС” есть квалифицированные и грамотные специалисты по ряду основных медицинских направлений. Здесь проходят качественную диагностику и получают полноценные консультации.
Лечение хронического миелолейкоза

На стадии бластного криза перечисленные выше лекарства вряд ли окажут помощь, там их применяют по возможности и в разных комбинациях и используют терапию по аналогии с индукцией при остром течении лейкоза.
Кроме этого, на ранних стадиях болезни рекомендуют циторедуктивную и цитостатическую терапию, для того чтобы уменьшить массу возникшей опухоли. Лекарственные виды воздействия на организм больного являются основными на основных стадиях течения болезни. В составе комплексного лечения есть и вспомогательные процедуры. Когда ухудшившееся кроветворение вследствие развития заболевания и высокого уровня лейкоцитов и вязкости крови оказывают серьезное влияние на кровоснабжение жизненно важных органов, применяется лейкаферез или отделение и удаление белых кровяных клеток. Накопление лейкоцитов после процедуры уменьшается.
Применяется также лучевая терапия, которая ставит своей целью разрушить лейкозные клетки при помощи ионизированного облучения. Такое облучение содействует возникновению филадельфийской хромосомы и бывает причиной возникновения ХМЛ, но когда болезнь уже возникла, лучевая терапия способствует уменьшения симптомов. Ее применяют и перед пересадкой костного мозга. Кроме того, применяют трансплантацию стволовых клеток от самого пациента или имеющихся доноров. Это позволяет лучше переносить интенсивную химиотерапию и довольно быстро достичь продолжительной ремиссии в целом ряде наблюдаемых случаев.
Отдельно следует сказать о радикальном способе лечения – пересадке костного мозга. Часть клеток с генетическими изменениями, вызывающие ХЛМ, несмотря на интенсивное терапевтическое лечение, сохраняются чаще всего в костном мозге, хотя и не дают тяжелой клинической картины. Это так называемая минимальная остаточная болезнь, и чтобы искоренить ее, нужно идти на кардинальные меры, чтобы добиться полной ремиссии. К этому как раз и ведет пересадка костного мозга, которая связана с высоким риском для пациента в связи с возможным отторжением трансплантата организмом хозяина. Там есть другие проблемы, связанные с химиотерапией, угрозой инфекций, но если вести речь о полном выздоровлении, то трансплантация костного мозга от донора при успешном проведении процедуры его зачастую дает. Чаще такая операция проводится для молодых пациентов с наличием родственного донора, в этом случае риски снижаются, а вероятность полного выздоровления увеличивается.
Но и терапевтическая схема лечения доказала свою высокую эффективность, она намного продлевает жизнь пациентам, в ряде случаев дает нормальные условия на протяжении продолжительного периода времени. Чем раньше диагностируется ХЛМ, чем раньше его обнаружила система здравоохранения и сам человек – тем легче его лечить и продлевать жизнь больному.
Прогноз
Течение не всегда поддается точному прогнозу. Примерно пять процентов случаев диагностируют уже на третьей стадии, и бывает так, что у этих больных и селезенка сильно не увеличена, и лейкоцитоз не очень значительный, а картина характерна для бластного криза. Просто в данном случае хроническая стадия была до крайности быстротечной, и быстро наступила терминальная фаза.
В целом врачи выделяют следующие факторы, влияющие на прогноз при хроническом миелолейкозе:
Самая длительная продолжительность жизни при постановке такого диагноза на данный момент составляет 30 лет. Важно, что период жизни больных резко увеличился в последнее время из-за появления новых препаратов. Только до 5 процентов больных до последнего десятилетия жили дольше 10 лет при постановке диагноза ХМЛ. Но сейчас нередки случаи продления жизни до 15-20 лет.
Очень важно начать лечение как можно раньше! Дело в том, что если болезнь переходит в стадию акселерации, то срок жизни больного обычно – 1-1.5 года, а при его тяжелом состоянии и бластном кризе этот период измеряется уже несколькими месяцами. Нужно знать, что по исследованиям, проводимым до появления современных препаратов типа иматиниба, медианным прогнозом продолжительности жизни больных ХЛМ с момента постановки диагноза был 44-51 месяц. Сейчас срок вырос, как и количество пациентов с длительной ремиссией.
В любом случае все это средние значения по многим исследованиям, и какие-либо прогностические моменты по течению болезни того или иного пациента высказываются только лечащим врачом. Все это сугубо индивидуально, зависит от стадии болезни, возраста, особенностей организма и многих других факторов.
Профилактика миелолейкоза
Поскольку до конца не понятен механизм появления “филадельфийской” хромосомы в организме человека и не выявлены факторы, на это влияющие, то специфических методов профилактики именно этой, к счастью редко встречающейся болезни, не существует.
Важной задачей являются регулярные визиты к врачу с целью своевременной диагностики коварной болезни. Нужно делать общие анализы крови, позволяющие в первом приближении распознать хронический миелолейкоз на ранней стадии, и принять незамедлительные меры по лечению. Если появляются малейшие сомнения, прежде всего по количеству лейкоцитов – проконсультируйтесь с врачом! Возможно, что потребуется анализ лейкоцитарной формулы, какие-то другие исследования, которые позволят диагностировать ХМЛ и назначить эффективное лечение. Все это безболезненно и быстро, зато вы будете спокойны, что кроветворная система у вас в порядке.
Хорошие возможности для диагностики и лечения созданы в медицинском центре “Вера в НАС”, где быстро и качественно проведут необходимые лабораторные исследования, грамотно проконсультируют по возникающим проблемам, отправят в случае необходимости к профильным специалистам.
Отличными методами профилактики любых онкологических заболеваний, в том числе и ХМЛ и ОМЛ, является здоровый образ жизни, занятия спортом, хорошее питание, соблюдение рационального режима труда и отдыха. Не всегда удается уделять этому времени, но профилактическое значение ЗОЖ трудно переоценить!