Молибден что это
Молибден что это
Молибден: все, что нужно знать об элементе
Молибден (лат. molybdaenum) — химический элемент с атомным номером 42 и атомной массой 95,94. Обозначается символом Mo. Это ковкий переходный металл, который имеет серый цвет со стальным оттенком в свободном состоянии и становится серо-черным в диспергированном виде. Открыто порядка 20 минералов молибдена, а в свободном виде он не встречается.
Название металла происходит из греческого слова «молибдос», что в переводе означает «свинец». Такое название было выбрано из-за того, что минеральный молибден имеет характерный блеск, очень похожий на блеск свинца.
В 1778 году шведский химик К. Шееле впервые получил минеральный молибденит путем прокаливания молибденовой кислоты. Еще один шведский химик П. Гьельм получил молибден в виде нечистого металла в 1781 году и только в 1817 году Й. Берцелиусу удалось вывести этот элемент в чистом виде.
Присутствие в природе
В земной коре находится 0,003 % молибдена в составе минералов. Он распространен относительно равномерно, более концентрирован в породах, в которых содержится диоксид кремния. Для кристаллизации металла необходимы высокая кислотность и восстановительная среда. Наименьшее содержание молибдена фиксируется в карбонатных и ультраосновных породах.
Металл также содержится в нефти, углях, золе растений и воде — речной и морской. Морские воды на глубине более обогащены молибденом, чем воды у берега. В космосе зафиксировано аномально высокое содержание молибдена внутри красных гигантов с нейтронными звездами.
Самые крупные месторождения металла находятся в США, России, Армении, Канаде, Мексике, Чили, Австралии и Норвегии.
Физические свойства
Плотность при 20°С
Коэффициент линейного расширения
Химические свойства
Молибден устойчив при нормальных условиях. Окисление начинается, когда металл нагревается до температуры 400 ⁰С. После 600 ⁰С происходит быстрый переход в триоксид молибдена.
Основные химические свойства металла представлен в таблице:
Электроотрицательность (по Полингу):
Производство молибдена
Для производства молибдена в России и мире в качестве сырья используются молибденитовые концентраты, из которых получается чистый металл — основа для сплавов. В концентратах содержится около 20 % примесей, 1-9% оксида кремния, 28-32% серы и примерно 50 % молибдена.
Этапы производства:
Для получения ферромолибдена применяется реакция восстановления молибденитового концентрата, который предварительно подвергается обжигу.
Обработка молибдена
Как правило, используется термообработка молибдена, так как у него невысокая вязкость, а при низких температурах металл показывает низкую пластичность. Небольшие штабики обрабатывают на обжимных машинах, а для крупных заготовок применяют спекание и горячую прокатку.
Иногда возможна механическая обработка молибдена резанием. Для этого используют инструменты из быстрорежущей стали с такими же углами заточки резцов, как и при резании чугуна.
Достоинства и недостатки молибдена
Благодаря низкой плотности молибдена сплавы на его основе имеют большую удельную прочность.
Высокий модуль упругости.
Высокая коррозионная устойчивость. Молибден не реагирует с плавиковой, соляной, серной кислотами и с большей частью щелочных растворов.
Металл имеет малый температурный коэффициент расширения.
При использовании молибденовых сплавов сварные швы отличаются хрупкостью.
При низких температурах обладает малой пластичностью.
При нагартовке можно упрочнять металл только до температуры 800 ⁰С. При дальнейшем нагревании происходит образный эффект — металл разупрочняется.
Низкий уровень окалийности.
Молибден в организме человека
Молибден относится к микроэлементам, необходимым человеку. Он содержится преимущественно в костях, почках и печени, а также в головном мозге, щитовидной и поджелудочной железах, надпочечниках.
Роль и функции молибдена для организма:
Суточная потребность в молибдене составляет от 70 до 300 мкг в зависимости от массы тела. В случае дефицита микроэлемента в организме и болезней, которые им вызваны, суточная норма увеличивается.
Основные марки молибдена
В промышленности используется чистый молибден и с различными присадками. Среди наиболее распространенных можно выделить следующие марки:
Сплавы молибдена
Используется два сплава на основе данного металла: с вольфрамом (МВ) и рением (МР).
Сплавы молибдена с вольфрамом необходимы для повышения жаропрочности первого. При этом ухудшается деформируемость и повышается удельный вес. В таких сплавах содержится от 48 % вольфрама и от 49 до 51 % молибдена, остальное — примеси. МВ является тугоплавким, отличается высокой прочностью и устойчивостью к коррозии. Используется для изготовления тонкой проволоки, которая сворачивается в катушки или бухты.
Рений необходим для повышения пластичности молибдена. Сплавы МР содержат более 50 % рения и около 47 % молибдена. Они также используются для производства тонкой проволоки, которая применяется в специальном приборостроении.
Применение молибдена
Металл используется в разных областях:
Молибден и его сплавы применяются для обшивки сверхзвуковых самолетов и ракет, а также в производстве головных частей самолетов и ракет: они могут использоваться в качестве основного конструкционного материала или служить тепловым экраном.
Молибден значительно повышает прокаливаемость стали, прочность, устойчивость к коррозии и вязкость. Сплавы стали с добавлением молибдена применяют для изготовления ответственных изделий и деталей.
Использование молибдена в цветной металлургии также охватывает сплавы кобальта и хрома. Такая добавка повышает твердость, в результате чего сплав может быть использован для истирающихся кромок деталей. Молибден также входит в состав жаростойких кислотоупорных сплавов на основе хрома, никеля и кобальта.
Так как молибден имеет высокую температуру плавления, его применяют при изготовлении инструментов для горячей обработки стали. Из него также производят стержни для литья под давлением различных сплавов.
Из молибдена делают оборудование, работающее в кислотной среде. Из него также изготавливают нагревательные элементы для печей, которые работают в атмосфере водорода.
Многие соединения молибдена служат катализаторами реакций. Некоторые из них также входят в состав глазурей и красок.
Этот металл устойчив в расплавленном стекле, благодаря чему его применяют при плавке стекла и производстве электродов.
Из молибдена изготавливают детали вакуумных приборов — рентгеновских трубок, электронных ламп и др.
Продукты питания богатые молибденом

Название элемента в переводе с греческого означает «свинец». Это связано с тем, что молибден долгое время путали с данным металлом.
Соединение добывают из молибденита – минерала, который по внешнему виду похож на графит, имеет характерный свинцовый блеск. Интересно, что только в конце XVIII века ученому из Швеции К. Шееле после обработки молибденовой руды концентрированной азотной кислотой удалось установить, что получаемый металл это абсолютно другое вещество. В ходе реакции образовалась масса белого цвета, которую шведский химик прокалил и получил новый химический элемент.
В чистом виде молибден открыт в 1817 году шведским химиком Й. Берцелиусом путем восстановления его оксида водородом. В природе минерал без примесей не встречается.
Характеристика
Очищенный молибден – мягкий металл серебристого цвета с легким блеском. В человеческом организме присутствует не сам микроэлемент, а его соединения, которые при взаимодействии с серой всасываются в кровь и разносятся к тканям и органам. Наибольшее количество молибдена сосредоточено в печени, почках, щитовидной железе, мозге. В составе ферментов, он действует как кофактор, способствуя детоксикации организма. Помимо этого, элемент нужен для нормальной работы нервной системы, активирует обмен серосодержащих аминокислот, удерживает фтор в костях, укрепляет эмаль зубов, оберегает ее от разрушения.
В теле человека содержится 9 мг молибдена. Суточная потребность в соединении для взрослых людей варьирует в пределах от 75 до 250 мкг; для лиц, достигших 75 лет, его потребление нужно уменьшить до 200 мкг.
Молибден из продуктов питания легко абсорбируется в желудке и тонкой кишке в форме растворимых комплексов. Уровень всасывания соединения, поступающего с пищей, достигает 80%. После попадания в организм, микроэлемент связывается с белками (в частности, с альбумином), затем транспортируется к тканям, клеткам всех органов.
В крови минерал распределяется в равных пропорциях между плазмой и форменными элементами. Экскреция растворимых соединений молибдена происходит с мочой, калом и желчью.
«На страже здоровья» или биологическая роль молибдена
Физиологическое значение микроэлемента для человека впервые засвидетельствовано в 1953 году после открытия влияния соединения на активность фермента ксантиноксидазы, отвечающего за обмен пуринов в организме.

Помните, прием вольфрама, свинца и натрия снижают усвояемость молибдена, при этом сульфат меди усиливает выведение соединения с желчью. Дефицит меди и железа, наоборот, увеличивает уровень микроэлемента в организме.
Нехватка молибдена и как с ней бороться
Дефицит молибдена – редкое явление, которое может развиться вследствие:

Последствия недостаточности соединения:
Симптомы и последствия дефицита могут быть устранены после добавления молибдена в ежедневный рацион. Рекомендуется сделать упор на следующие продукты, богатые данным микроэлементом: бобовые, листовые овощи, печень, почки, мозги крупного рогатого скота, молочные изделия.
Хронический дефицит молибдена восполняют за счет употребления БАДов, лекарственных препаратов. К ним относят следующие витаминно-минеральные комплексы, содержащие элемент: «Stay Healthy», «Центури 2000», «Vitrum», «МультиМакс», «Геримакс Энерджи», «Центрум», «Алфавит», «Дуовит» и радиоактивный изотоп «Молибден-99», предназначенный для проведения диагностических процедур, лечения онкологических заболеваний.
Оценку содержания минерала в организме проводят по итогам исследования волос и крови. В норме уровень молибдена в прядях находится в диапазоне от 0,02 до 2 мкг на грамм, в кровяном русле – 0,3 – 1,2 мкг на литр. При недостаточном поступлении концентрация соединения в моче, плазме и волосах уменьшается. Помимо этого, падает активность ксантиноксидазы эритроцитов, уровень церулоплазмина в сыворотке крови, меди в урине.
«Много не всегда хорошо» или передозировка молибдена

Причины отравления соединениями молибдена:
Случаи острой передозировки организма минералом практически не встречаются, а хроническое отравление имеет схожие симптомы с состоянием, развивающимся при дефиците соединения в организме.
В случае появления симптомов передозировки срочно обратитесь к врачу, поскольку последствия несвоевременного купирования симптомов отравления могут представлять угрозу для жизни пострадавшего.
Молибден: где его искать
Количество микроэлемента в продуктах растительного происхождения (овощах, фруктах, злаках) зависит от почвы, где они прорастали. Наибольшее количество молибдена сосредоточено в бобовых культурах, цветной, брюссельской капусте, моркови, зеленых листовых овощах, подсолнечных семечках, чесноке. Среди источников соединения животного происхождения можно выделить постные сорта мяса, молоко, субпродукты.
| Наименование изделия | Количество минерала в 100 г продукта, микрограмм |
|---|---|
| Говяжья печень | 110 |
| Соль поваренная | 110 |
| Соя | 95 |
| Говяжьи почки | 87 |
| Горох | 83 |
| Свиная печень | 81 |
| Чечевица | 76 |
| Печень цыпленка, бройлера | 70 |
| Печень куриная | 55 |
| Почки свиные | 43 |
| Пшеница в зернах | 42 |
| Яйцо куриное | 41 |
| Какао бобы | 41 |
| Фасоль | 39 |
| Овсяная крупа | 38 |
| Гречиха | 35 |
| Молоко | 35 |
| Паста из томатов | 29 |
| Индейка | 28 |
| Кукурузная крупа | 27 |
| Рыба холодного копчения, ставрида | 26 |
| Рис | 25 |
| Смородина черная | 24 |
| Кальмар | 20 |
| Сердце свиное | 19 |
| Зеленый лук | 19 |
| Мозги, сердце говядина | 18 |
| Крупа пшенная | 17 |
| Рожь (зерно) | 17 |
| Курица | 16 |
| Мука пшеничная | 15 |
| Малина | 14 |
| Треска | 13 |
| Ячмень (зерно) | 13 |
| Батон | 13 |
| Свинина | 12 |
| Крупа ячневая | 12 |
| Крупа перловая | 12 |
| Макаронные изделия | 11 |
| Шпроты в масле | 11 |
| Крыжовник | 11 |
| Говядина | 10 |
Помните, соединения молибдена теряются при размораживании мяса в воде, длительной варке овощей в очищенном виде. Включив в ежедневный рацион выпечку, субпродукты, зерновые, молочные продукты, вы без проблем сможете обеспечить организм нужным уровнем минерала в организме.
Таким образом, молибден – микроэлемент молодости и красоты. Он обеспечивает качественную детоксикацию организма, укрепляет костную ткань, активизирует обмен веществ, что особенно ценно для людей, желающих сбросить лишний вес. Регулярное поступление соединения в достаточном количестве (75 – 250 мг) способствует оптимальной работе внутренних органов.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru
Молибден (Mo, Molybdenum)
История молибдена
История открытия молибдена началась в 1778 году, когда химик из Швеции Карл Шееле получил минеральный молибденит в результате прокаливания молибденовой кислоты (calorizator). Через несколько лет, в 1781 году П.Гьельм получил молибден в виде металла, чистый же молибден был получен только в 1817 году Й. Берцелиусом.
По причине схожести внешнего вида минерального молибдена со свинцовым блеском, сначала их называли одинаково – от древнегреческого μόλυβδος, что означает свинец.
Общая характеристика молибдена
Молибден является элементом VI группы V периода периодической системы химических элементов Д.И. Менделеева, имеет атомный номер 42 и атомную массу 95,94. Принятое обозначение – Mo (от латинского Molybdaenum).
Нахождение в природе
Молибден в свободном виде в природе не распространён. Имеется в виде нескольких десятков известных минералов в земной коре, морской и речной воде, в нефти, углях, мизерное количество в воздухе. Основные месторождения молибдена находятся на территории США, Мексики, Чили, Канаде, России и Армении.
Физические и химические свойства
Молибден является переходным мягким металлом светло-серого цвета с характерным металлическим блеском. Устойчив во время нахождения на воздухе при комнатной температуре, процесс окисления начинается при температуре выше 400˚с.
Суточная потребность в молибдене
Суточная потребность в молибдене меняется в зависимости от возраста, на неё влияют также физическая нагрузка и масса тела. Норма для детей с рождения и до 10-летнего возраста составляет 15-150 мкг в день, для взрослых – 75-250 мкг, после 70-ти лет потребность в молибдене снижается и не должна превышать 200 мкг в сутки. Обычно необходимое количество данного микроэлемента человек получает с пищей, поэтому дополнительный приём не требуется.
Полезные свойства молибдена и его влияние на организм
Молибден важен для:
Взаимодействие с другими
Молибден является важной частью фермента, отвечающего за утилизацию железа. При избытке молибдена нарушается утилизация меди и синтез витамина В12.
Продукты питания богатые молибденом
Главными поставщиками молибдена в организм человека являются зелёные листовые овощи (салат, шпинат, капуста, щавель), злаки, крупы (овсянка, пшено, гречка, ячневая) и бобовые (горох, фасоль, кукуруза, чечевица). Присутствует молибден в говяжьей печени, индейке, рыбе, моркови, орехах и ягодах.
Применение молибдена в жизни
Основное применение молибдена – металлургическая промышленность, также используется при производстве ламп накаливания.
Признаки избытка молибдена
Чрезмерное количество молибдена случается у работников металлургической сферы промышленности, проявляется так называемой молибденовой подагрой, которая обусловлена повышением мочевой кислоты в крови.
Признаки нехватки молибдена
Недостаточное количество молибдена (дефицит) встречается крайне редко, как правило, в регионах, где в почвах не хватает минерала или у людей со скудным рационом питания. Признаками нехватки молибдена являются: замедление роста, выпадение волос, возникновение отёков, дряблость кожи и мышц, дерматиты и грибковые поражения кожных покровов.
МОЛИБДЕН — универсальный металл
Молибденит люди узнали давно. Только его сходство с галенитом и графитом сыграло плохую шутку. Все три минерала называли одинаково — Molybdaena.
Родом из Швеции
История открытия металла родилась в Швеции. В середине XVIII века шведский химик А.Ф. Кронштедт предположил, что под именем Molybdaena скрываются разные вещества. После серии экспериментов К.В. Шееле (тоже швед) получил «Wasserbleyerde», особую белую землю, и дал ей название молибденовая кислота.
А в 1782 году П.Я. Гьельм (конечно, тоже швед) получил королек из молибденовой кислоты.
Гьельм был счастлив:
«Радуюсь, что мы теперь обладаем металлом – молибденом!».
Свойства металла
Молибден, Molybdaenum (Mo) — элемент № 42, расположенный в шестой группе 5-го периода таблицы Менделеева. Его относят к переходным металлам.
Некоторые характеристики элемента:
Химические свойства во многом обусловлены степенями окисления: +2, +3, +4, +5, +6 (последняя самая устойчивая).
С водородом и азотом металл практически не реагирует.
При нормальных условиях молибден не вступает в реакции с газами воздуха. Начинает окисляться при нагреве выше 400°С.
При воздействии восстановителей в слабокислой среде образует молибденовые сини. Эти вещества используют как красители (например, в окраске шелка).
| Свойства атома | |
|---|---|
| Название, символ, номер | Молибде́н / Molybdaenum (Mo), 42 |
| Атомная масса (молярная масса) | 95,96(2)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 4d5 5s1 |
| Радиус атома | 139 пм |
| Химические свойства | |
| Ковалентный радиус | 130 пм |
| Радиус иона | (+6e) 62 (+4e) 70 пм |
| Электроотрицательность | 2,16 (шкала Полинга) |
| Электродный потенциал | −0,2 |
| Степени окисления | 6, 5, 4, 3, 2 |
| Энергия ионизации (первый электрон) | 684,8 (7,10) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 10,22 г/см³ |
| Температура плавления | 2623 °C |
| Температура кипения | 4885 K |
| Уд. теплота плавления | 28 кДж/моль |
| Уд. теплота испарения | |
| Молярная теплоёмкость | 23,93[2] Дж/(K·моль) |
| Молярный объём | 9,4 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | 3,147 Å |
| Температура Дебая | 450 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 138 Вт/(м·К) |
| Номер CAS | 7439-98-7 |
Добыча, месторождения
Молибден — металл редкий. В природе его нахождение в чистом виде исключено.
Известно почти два десятка молибденсодержащих минералов:
| Минерал | Содержание рудообразующего металла |
| Молибденит | 57-60% |
| Ферримолибдит | 40-60% |
| Повелит | 48% |
| Вульфенит | 27–46% |
| Зейригит | До 24% |
Другие содержащие молибден руды (чиллагит, комозит, кехлинит, иордизит и другие) не представляют интереса для промышленного использования.
Значимые месторождения металла принадлежат:
Рейтинг добычи молибденовых руд возглавляет Китай, на втором месте с большим отрывом США, на третьем месте Чили.
В Госбалансе запасов полезных ископаемых РФ числятся 34 месторождения молибдена.
Происхождением молибденовые руды из скарновых, грейзеновых, гидротермальных месторождений.
Как получить Molybdaenum
Получение молибдена можно разделить на несколько стадий:
Плюсы и минусы металла
Свойства молибдена диктуют его хорошие и плохие стороны.
| Достоинства | Недостатки |
| Высокая удельная прочность | Сварные швы очень хрупкие |
| Высокий модуль упругости | Маленькая пластичность при низких температурах |
| Прекрасная термостойкость | Невысокая окалийность |
| Большая коррозионная устойчивость | Упрочнение наклепкой возможно при температуре до 800°С |
| Низкий коэффициент расширения при нагреве |
Применение: от лампочки до ракеты
Обработка металла давлением проще, чем аналогичная обработка вольфрама.
Цена на LME
Стоимость тонны молибдена на Лондонской бирже металлов 24000 долларов США.
Мне 42 года и я специалист в области минералогии. Здесь на сайте я делюсь информацией про камни и их свойства — задавайте вопросы и пишите комментарии!
Молибден. Свойства, применение, производство, продукция
| Статья «Молибден. Свойства, применение, производство, продукция» с различных сторон рассматривает тугоплавкий металл молибден. Для удобства чтения и изучения данная статья разделена на главы и параграфы, а также содержит графические материалы. |
Введение
В статье “Молибден. Свойства, применение, производство, продукция” подробно рассматривается тугоплавкий металл молибден. Описаны свойства молибдена, указаны области его применения. Также перечислены различные марки молибдена с указанием их особенностей.
Статья освещает процесс производства молибдена от стадии обогащения руды до стадии получения заготовок в виде штабиков и слитков. Отмечаются характерные особенности каждой стадии.
Особое внимание в статье уделяется продукции (проволока, прутки, листы, полосы, порошок и др.). Описаны процессы изготовления той или иной продукции из молибдена, ее характерные особенности и области применения.
Статья содержит ссылки на стандарты, такие как ГОСТ и ТУ, на другие статьи, описывающие смежные темы.
Глава 1. Молибден. Свойства и области применения молибдена
§1. Свойства молибдена
Основные физические и механические свойства молибдена представлены в таблице. Стоит также заметить, что электропроводность молибдена выше по сравнению с электропроводностью железа и ниже, чем аналогичное свойство меди. По механической прочности молибден немного уступает вольфраму, но, в тоже время, легче поддается обработке давлением.
§2. Марки молибдена
Во вторую группу входят такие сплавы молибдена, как ЦМ5, ЦМ6, ЦМ-2А, ВМ-1, ТСМ4 с типичным содержанием углерода (по массе) 0,004-0,05% С, а также сплавы ЦМ10 и ТСМ-7 с пониженным содержанием углерода. Сплавы ЦМ5 и ЦМ6 относятся к системе молибден-цирконий (Mo-Zr), а сплавы ЦМ-2А, ВМ-1 легированы одновременно небольшими добавками титана и циркония. Сплав ТСМ4, помимо циркония, содержит небольшие концентрации никеля и углерода, это сплав системы молибден-цирконий-никель-углерод (Mo-Zr-Ni-C). Среди сплавов второй группы наиболее широко распространен малолегированный сплав ЦМ-2А, отличающийся достаточной технологичностью и более высокой жаропрочностью по сравнению с чистым молибденом. Сплав ЦМ-2А наименее склонен к хладноломкости после деформации. Рекристаллизация повышает его склонность к хрупкости. Сплав ВМ-1 по составу и свойствам близок к сплаву ЦМ-2А. Сплав ЦМ5 более жаропрочен, чем ЦМ-2А. Сплав ЦМ6 с меньшим содержанием циркония и углерода уступает сплаву ЦМ5 по жаропрочности, но является более технологичным, менее склонен к хладноломкости в рекристаллизованном состоянии, хорошо сваривается.
В третью группу (низколегированные высокоуглеродистые сплавы) входит ВМ-3 с повышенным содержанием углерода, доходящим (по массе) до 0,25-0,50%. Чтобы связать весь углерод в карбиды, этот сплав легирован большим количеством титана и циркония; дополнительное упрочнение обеспечивает ниобий. Карбиды титана (TiC) и циркония (ZrC) улучшают жаропрочность сплава. В то же время карбид молибдена (Mo2C) оказывает негативное влияние на технологические свойства сплавов. Его присутствие снижает пластичность как при комнатной, так и при высокой температуре. Для исключения образования Mo2C титан, цирконий и углерод вводят в сплавы в определенных пропорциях.
К четвертой группе (высоколегированные сплавы) относятся ЦМВ30, ЦМВ50 и МР47ВП. Для сплавов ЦМВ30 и ЦМВ50 характерна высокая жаропрочность, обусловленная их легированием большими количествами вольфрама, а сплав МР47ВП системы молибден-рений (Mo-Re) отличается высокими прочностными свойствами при умеренных температурах и большой технологичностью. Жаропрочность последнего сплава может быть существенно повышена введением карбидов ZrC и ТiС.
§3. Области применения молибдена
Тугоплавкий металл молибден нашел широкое применение в современной промышленности как в качестве легирующей добавки к различным сплавам, так и в качестве конструкционного материала.
Основные направления применения молибдена
1. Легирующий элемент в различных сталях и сплавах цветных металлов
В качестве легирующей добавки молибден активно используется в черной металлургии при производстве сталей и чугунов. В состав конструкционных сталей входит до 0,5 % данного тугоплавкого металла. Благодаря молибдену значительно улучшается структура конструкционной стали. Она становится более однородной и мелкозернистой. Добавление молибдена позволяет улучшить механические свойства сталей и сплавов, а именно: предел упругости, сопротивление износу и удару. Одно из ценных свойств молибдена – его способность устранять отпускную хрупкость аустенитной стали.
Молибден активно применяется при производстве различных инструментальных сталей. Стали, из которых изготавливают штампы, обычно содержат 1-1,5 % данного тугоплавкого металла, быстрорежущие стали – 5-8,5 %. Молибден повышает красностойкость инструментальных сталей, их твердость, прочность, сопротивление образованию закалочных трещин, износу.
Хромистые и хромоникелевые стали также имеют в своем составе молибден. Он снижает хрупкость и повышает жаропрочность данных сталей в условиях длительной работы. Введение 2-4 % молибдена в нержавеющие хромоникелевые стали улучшает их коррозионную стойкость.
Тугоплавкий металл молибден также включают и в состав чугунов. Введение в чугун 0,2-0,5 % молибдена повышает вязкость, сопротивление износу и улучшает свойства при высоких температурах, а также уменьшает склонность к росту зерен.
2. Антикоррозионные и жаропрочные сплавы
Очень часто молибден входит в состав жаропрочных и кислотостойких сплавов. Металлы кобальт и никель, как правило, являются основой жаропрочных сплавов (50-60 %), также такие сплавы содержат хром (20-28 %) и молибден (3-10 %). В качестве примера можно привести жаропрочный сплав, который используется для изготовления лопаток и дисков роторов газовых турбин: Ni – 37 %, Co – 20 %, Cr – 18 %, Fe – 17 %, Mo – 3 %, Ti – 2,8 %
Кислотостойкие сплавы, содержащие 17-28 % молибдена, а также хром, вольфрам и железо, устойчивы к воздействию всех минеральных кислот (например, серная кислота, соляная кислота и другие), кроме плавиковой.
Молибден используется для изготовления обшивки и элементов каркаса сверхзвуковых самолетов и ракет, а также теплообменников, оболочек возвращающихся на землю ракет и капсул, тепловых экранов, передних кромок ракет, носовых конусов ракет, обшивки кромок крыльев сверхзвуковых самолетов.
Молибден с присадками ниобия, ванадия, титана и других металлов, которые повышают жаропрочность, применяется для изготовления ответственных деталей ракетных двигателей и газовых турбин: сопловые и рабочие лопатки газовых турбин, выхлопные сопла и камеры сгорания прямоточных реактивных двигателей.
Металл молибден является тугоплавким и достаточно хорошо устойчив к воздействию жидких металлических теплоносителей типа лития и свинцововисмутового сплава. Указанные свойства молибдена позволяют использовать его в качестве конструкционного материала в энергетических атомных реакторах при температуре до 800 °С. Из тугоплавкого металла молибден изготовляют контейнеры, оболочки, трубы и другие элементы активной зоны реактора.
4. Материал для изготовления оборудования для обработки металлов давлением
Жаропрочность молибдена, его тугоплавкость, высокая теплопроводность и низкий коэффициент расширения позволяют использовать данный метал для изготовления элементов оборудования, предназначенного для горячей обработки металлов давлением. Так из молибдена производят оправки прошивных станов, матрицы, пресс-штемпели. Стоит заметить, что по данным экспериментов прошивные пуансоны для прошивки заготовок из нержавеющей стали, изготовленные из сплава молибдена с 0,5% титана, прошивают до момента выхода из строя в 100 раз больше заготовок по сравнению с пуансонами из других материалов. Также из тугоплавкого металла молибден производят пресс-формы и стержни машин для литья под давлением сплавов меди, цинка и алюминия.
Молибденовые прутки применяют также в качестве электродов в печах для плавки стекла. Как правило, для данных целей используют прутки диаметром от 25 до 150 мм и длиной до 1,8 м. Также встречаются плавильные печи с электродами в виде молибденовых пластин. Стоит заметить, что молибден практически не вступает в реакцию с расплавленным стеклом. Это позволяет использовать данный металл для изготовления деталей стеклоплавильных печей.
6. Материал для производства электроламп и электровакуумной техники
Такие свойства, как жаропрочность, высокая электропроводность, высокая температура плавления, позволяют применять молибден в производстве электроламп и электровакуумных приборов. Молибденовая проволока применяется для изготовления крючков, которые поддерживают вольфрамовую нить в лампе накала. Также молибден используют в качестве керна для навивки вольфрамовой проволоки.
Молибденовые прутки служат для ввода тока в различные электровакуумные приборы и колбы мощных источников света. Листы из молибдена применяются для производства анодов генераторных ламп. Также из данного метала изготовляют сетки приемно-усилительных ламп, вспомогательные электроды генераторных ламп, катоды газоразрядных трубок.
Молибден также нашел применение и в рентгеновской технике. Например, из него производят фокусирующие электроды, вводы катодов.
Глава 2. Производство молибдена
§1. Процесс получения тугоплавкого металла молибден
§2. Получение компактного молибдена
Методы порошковой металлургии
Данный способ получения ковкого молибдена является наиболее распространенным, так как позволяет более равномерно распределять присадки, которые улучшают физико-механические свойства молибдена. В качестве присадок могут использоваться титан (Ti), цирконий (Zr), ванадий (V) и другие металлы.
Предварительное спекание штабиков обычно проводят в муфельных или трубчатых печах при температуре 1110-1200 °С. Спекание (сварку) осуществляют при температуре 2200-2400 °С в специальных аппаратах для высокотемпературного спекания. Если заготовки крупногабаритные, то для их спекания предпочтительнее использовать печь с косвенным нагревом. Примером подобной печи является вакуумная печь непрерывного действия для высокотемпературного спекания штабиков косвенным нагревом, где в качестве нагревателей используются графитовые стержни. Стоит заметить, что предварительное спекание штабиков осуществляется в среде водорода, что способствует упрочнению заготовки и повышению электропроводности.
При дуговой плавке в качестве электродов служат пакеты спеченных молибденовых прутков, которые, в свою очередь, получают путем сваривания (спекания) штабиков. Подобные прутки, как правило, имеют длину 1-2,5 м и объединяются в пакеты по 4-16 прутков, а в некоторых случаях и больше.
После дуговой плавки молибденовые слитки содержат следующие примеси (приблизительно), %: O2 – 1-3 ∙ 10-4, H2 – 1-2 ∙ 10-5, N2 – 10-3-10-4. В результате электронно-лучевой плавки удается избавиться от большого числа примесей, среди которых кислород, азот, углерод, железо, медь, никель, марганец, кобальт. Стоит заметить, что при получении молибденовых слитков любым из приведенных способов для глубокой очистки молибдена от кислорода (содержание в металле
На первом этапе штабики нагревают до тепературы 1350-1400 °С. Непосредственно ковку осуществляют при температуре около 1300 °С. В результате термической обработки плотность пористых штабиков увеличивается, а поры на границах зерен внутри кристаллов исчезают. В итоге прочность материала на растяжение резко повышается и в несколько раз превосходит прочность спеченного штабика. Как правило, для нагрева используются печи сопротивления с нагревателями из молибдена и водородной атмосферой. Для подогрева больших штабиков иногда применяют муфельные печи, в которые в зависимости от размеров муфеля можно помещать одновременно несколько штабиков. Печи размещаются рядом с ковочной машиной, чтобы избежать чрезмерного охлаждения штабиков во время их извлечения из печи и введения в рабочий канал машины. Подача заготовок в ковочную машину осуществляется вручную. На данном этапе получают прутки, диаметр которых составляет 20-25 мм. На следующих этапах температуру ковки постепенно уменьшают с уменьшением диаметра прутков. Ковку прутков, имеющих диаметр 2,5-3 мм, осуществляют при температуре 950-1000 °С.
Когда длина прутков значительно возрастает, переходят на непрерывную ковку. Данный переход осуществляют при диаметре прутка 3 мм, если исходными заготовками были штабики сечением 10х10 или 12х12 мм. Подача прутков в ковочную машину осуществляется механически, а для подогрева используется газовая печь. При непрерывной ковке прутки покрывают смазкой – аквадагом или гидроколлагом (водные коллоидные суспензии графита). Смазка предохраняет пруток от окисления и уменьшает износ матриц ковочной машины.
К недостаткам ротационной ковки можно отнести трудоемкость процесса и неровность поверхности получаемых прутков. При нагреве заготовок возникают значительные потери молибдена вследствие его окисления. Для снижения потерь и улучшения пластических свойств молибдена разработаны процессы ковки в атмосфере инертного газа.
Помимо спеченных штабиков заготовками для производства молибденовых прутков могут служить слитки. Слитки плавленого молибдена имеют грубую крупнозернистую структуру и значительно труднее поддаются обработке давлением, чем спеченные заготовки. Поэтому горячую ковку можно применять только для слитков диаметром до 100 мм. Ковка осуществляется при температуре 1400-1450 °С. Заготовки диаметром 150 мм и больше обрабатывают методом прессования. Ковка таких заготовок может привести к образованию трещин.
Перед прессованием слиток нагревают до температуры 760 °С, покрывают специальной эмалью, на которую затем накатывают тонкоизмельченное стекло. Стекло в данном случае выступает в качестве смазки. Затем заготовку нагревают до 1260 °С и еще раз покрывают стеклом. Далее осуществляется прессование. После прессования слитки подвергают горячей ковке при температуре 1425 °С. У полученного в результате ковки прутка обрезают концы. Затем пруток обтачивают на глубину до 25 мм с целью удаления стекла и слоя окалины. В дальнейшем прутки могут подвергаться ковке для получения необходимого размера.
Стоит заметить, что изделия из спеченных и плавленых заготовок молибдена не отличаются по свойствам.
Применение
Одним из направлений применения продукции из молибдена является изготовление нагревателей высокотемпературных электрических печей (см. Глава 1 §3). Молибденовые прутки могут использоваться в качестве таких нагревателей. Как правило, нагреватели из молибденовых прутков являются свободноизлучающими, то есть тепло передается от нагревателя непосредственно нагреваемому изделию, за счет чего достигается более эффективное использование мощности печи. Крепление таких нагревательных элементов должно быть очень надежным, чтобы исключить их провисание. Нагреватели из молибденовых прутков обладают высокой прочностью. Они используются в высокотемпературных электрических печах, обладающих большой мощностью.
Одной из наиболее важных областей применения молибденовых прутков является производство проволоки, где молибденовые прутки выступают в качестве заготовок (см. Глава 3 §2).
§2. Молибденовая проволока
Исходными материалами для производства проволоки из молибдена являются прутки. Диаметр таких прутков обычно составляет менее 3 мм. При таком диаметре молибденовые прутки обладают достаточной пластичностью, чтобы их можно было наматывать на барабан или катушку для дальнейшего изготовления проволоки методом протяжки.
Принципиальная схема установки для протяжки молибденовой проволоки представлена на рисунке.
Устройство установки для протяжки молибденовой проволоки
1 – ведущий барабан, 2 – фильера, 3 – газовая печь, 4 – смазочная коробка, 5 – спускной барабан
Данный способ позволяет получить проволоку, диаметр которой составляет до 0,012-0,010 мм. Для изготовления более тонкой проволоки применяют методы химического или электролитического травления. Исходным материалом для указанных способов является проволока большего диаметра, чем тот, который требуется получить.
Протяжку осуществляют в несколько этапов. На каждом этапе получают молибденовую проволоку определенных диаметров, при этом условия протяжки несколько изменяются в зависимости от диаметра, который требуется получить. В общем случае с уменьшением диаметра проволоки уменьшается температура и увеличивается скорость протяжки, уменьшение диаметра за один переход составляет, как правило, 10-20%.
После волочения поверхность молибденовой проволоки очищают. Для очистки проволоку подвергают отжигу в атмосфере водорода при температуре 1300-1400 °С. Также для очистки поверхности могут применяться электролитическое травление (как правило, используется для очистки толстой проволоки), травление в расплаве азотистокислого натрия, отжиг в азоте.
При протяжке проволоки возможно возникновение дефектов. Среди наиболее часто встречающихся дефектов можно выделить растрескивание и расслоение проволоки (как правило, на стадии грубого волочения) или обрыв (при протяжке тонкой проволоки). Для предотвращения описанных дефектов следует использовать не загрязненный примесями исходный материал, четко соблюдать правильные режимы ковки штабиков и протяжки проволоки.
Указанные термопары позволяют выполнять измерения температур, превышающих 2000 °С. Например, термопара вольфрам-вольфрам/молибден применялась в экспериментах по определению точки плавления молибдена, термопара вольфрам-молибден – точки плавления хрома.
Стоит заметить, что с изменением температуры термоэлектродвижущая сила (термо-ЭДС) изменяется сравнительно мало. Поэтому для точного измерения термо-ЭДС, на основе которого определяется температура, требуется использовать высокочувствительные приборы.
Молибденовая проволока используется при производстве ламп накаливания. Из нее изготовляют крючки и петли, поддерживающие вольфрамовую спираль, а также керны для навивки вольфрамовой спирали. Проволока из молибдена, применяемая для изготовления поддерживающих крючков и петель, не должна содержать железа, которое может привести к быстрому почернению оболочки лампы. Обычно используют блестящую неотожженную или полуотожженную проволоку диаметра от 0,02 до 1,1 мм, относительное удлинение которой составляет 5-15%. Применение молибдена в качестве материала для изготовления крючков и петель, поддерживающих вольфрамовую спираль, обусловлено его значительной прочностью при высоких температурах, а также сохранением данным металлом пластичности и прочности после рекристаллизации.
Молибден в виде проволоки нашел активное применение в производстве приемо-усилительных ламп. Данный металл используется в качестве конструкционного материала. Из молибденовой проволоки изготавливают сетки. Как правило, такие сетки несут высокую тепловую нагрузку и к ним предъявляются высокие требования по точности навивки. Молибден, в свою очередь, обладает высокой точкой плавления, достаточно формоустойчив при высоких температурах и имеет ряд других положительных свойств, которые делают данный металл широко применяемым в производстве сеток приемо-усилительных ламп. Также стоит отметить хорошую свариваемость молибдена с никелем, из которого изготовляют траверсы сеток.
Молибденовая проволока, предназначенная для изготовления сеток, должна иметь чистую блестящую поверхность. Проволока может быть твердой или мягкой, относительное удлинение должно быть в интервале от 0 до 20%, овальность должна быть минимальной: отклонения от абсолютно круглого сечения не должны превышать 1,5%. Твердость и относительное удлинение исходной проволоки определяется в зависимости от способа производства сеток.
Проволока из молибдена также применяется и в производстве генераторных ламп. Из нее изготавливают сетки, различные держатели накаливаемых катодов, упругие элементы (например, натяжные пружины для крепления катодов).
В рентгеновских трубках из молибденовой проволоки выполнены вводы катодов, которые герметично впаяны в тугоплавкое боросиликатное стекло, являющееся материалом колбы рентгеновской трубки.
Из молибденовой проволоки изготавливают нагреватели высокотемпературных электрических печей. Молибденовые нагреватели используют при температурах до 2000 °С. Нагрев осуществляется в защитной атмосфере, так как при взаимодействии с кислородом молибден легко окисляется.
§3. Молибденовые листы (ленты, полосы, фольга, пластины)
Наиболее распространенными заготовками для получения молибденовых пластин толщиной 2-8 мм являются молибденовые штабики прямоугольного сечения с размерами 25х25 мм, 12,5х12,5 мм и 8х8 мм. Плоскую ковку таких штабиков, как правило, осуществляют пневматические молоты. Схематичное изображение молота представлено на рисунке.
Устройство пневматического молота
1 – молот, 2 – молибденовый штабик, 3 – наковальня
Перед ковкой заготовки подвергаются нагреву. Плоскую ковку по сравнению с круглой (см. Глава 3 §1) ведут при более высоких температурах. Так при плоской ковке температура нагрева составляет 1500-1600 °С в начале процесса и около 1000 °С в конце. Нагрев заготовок осуществляется с помощью муфельных печей, расположенных рядом с молотом. После нагрева штибики подаются под молот с помощью специального механического устройства. Ковку ведут до получения пластины определенной толщины, которая зависит от размеров исходного штабика. Толстые штабики обычно проковываются до толщины, равной 1/3 от исходной, более тонкие – до 1/4 исходной толщины. Например, молибденовый штабик сечением 25х25 мм куют до получения пластины (листа) толщиной 8-10мм, штабик сечением 12,5х12,5 мм – до пластины толщиной 4 мм, штабик сечением 8х8 мм – до пластины толщиной 2 мм. После плоской ковки перед прокаткой молибденовые листы (пластины) очищают от слоя окислов. Очищение производят химическим способом. Пластины из молибдена погружают в расплав 90% гидроокиси натрия и 10% азотистокислого натрия. Также в процессе ковки на молибденовой пластине могут появиться небольшие трещины. Данные дефекты убирают путем шлифования.
После очистки ленты из молибдена подвергают холодной прокатке, которая производится при комнатной температуре. В результате этого процесса получают изделие необходимого размера. Также в процессе холодной прокатки материал приобретает необходимую пластичность. Если во время прокатки ленты (полосы) излишне нагартовываются, то производят их промежуточный отжиг. Отжиг молибденовых лент осуществляют при температуре не более 850 °С. После завершения холодной прокатки ленты из молибдена снова подвергаются очистке. Способы очистки аналогичны тем, что применяются после горячей прокатки. В качестве окончательной обработки лент (полос) может осуществляться их полировка мелким порошком окиси алюминия.
Применение
Молибденовая лента и полоса может использоваться в электрических печах в качестве нагревателей. В электровакуумной промышленности такие печи применяются для отжига спиралей и проволоки при высоких температурах. При изготовлении нагревателя молибденовую ленту изгибают, придавая ей форму цилиндра или полуцилиндра. Концы нагревателя закрепляют в массивных зажимах из молибдена. Нагрев осуществляется в среде защитного газа.
Молибденовые пластины (листы) часто применяют в качестве конструкционного материала при производстве изделий в авиа- и ракетостроении. Из них изготовляют тепловые экраны, элементы обшивки ракет и самолетов, а также другие детали, материал которых должен иметь высокую жаропрочность (см. Глава 1 §3).
Пластины, ленты, полосы и тонкая фольга из молибдена используются для изготовления анодов генераторных ламп. Аноды больших размеров, как правило, делают составными. Отдельные пластины соединяются с помощью клепки или точечной сварки.
§4. Молибденовый порошок

Молибденовый порошок получают из ангидрида молибдена (молибденовой кислоты MoO3) путем восстановления водородом. Условия процесса восстановления определяются в зависимости от конечного назначения получаемого порошка. Молибденовый порошок, предназначенный для дальнейшего изготовления проволоки, прутков, листов и прочей продукции, должен содержать 99,9% молибдена и иметь мелкозернистую структуру. Порошок из молибдена, который используется при производстве сталей, должен на 99,0-99,5% состоять из молибдена и может иметь более крупные зерна.
Чистота получаемого порошка молибдена во многом зависит от чистоты исходной окиси MoO3. Очень важно, чтобы окись молибдена содержала незначительное количество примесей. Величина зерен получаемого порошка зависит от условий восстановления и от величины зерен окиси молибдена. Как правило, молибденовый порошок получается тем крупнее, чем больше величина зерен исходной молибденовой кислоты. Температура, при которой осуществляется восстановление молибдена, и концентрация водяных паров также влияют на величину зерен. Средняя величина зерна молибденового порошка растет с повышением температуры восстановления. Подбирая соответствующие условия восстановления и ангидрид молибдена MoO3 можно получить порошок молибдена со средней величиной зерна от 0,5 до 10 мк и больше.
Восстановление осуществляют в две стадии:
Такой подход препятствует значительному увеличению зерна. После восстановления полученный молибденовый порошок просеивают через мелкое сито и помещают в плотно закрывающиеся сосуды. Влажный воздух вредно влияет на порошок молибдена – последний начинает активно окисляться.
Свойства
Порошок чистого молибдена марки МЧ характеризуется набором свойств, таких как насыпной объем, объем утряски, коэффициент окисления. В таблице приведен пример численных значений указанных свойств для порошка молибденового МЧ.
| Вид порошка | Насыпной объем, см 3 /100 г | Объем утряски, см 3 /100 г | Коэффициент окисления | |
|---|---|---|---|---|
| измеренный | теоретический | |||
| Чистый молибден | 70-110 | 45-62 | 48,4 | 50,03 |
Применение
Большая часть производимого молибденового порошка идет на изготовление сталей и чугунов. Молибден в данном случае выступает в качестве легирующей добавки, которая улучшает свойства получаемых сплавов (см. Глава 1 §3). При этом не предъявляются требования к высокой чистоте порошка молибдена. Молибденовый порошок может содержать до 0,5-1% примесей.
Другой областью применения порошка является производство компактного молибдена (см. Глава 2 §2). Компактный молибден в виде штабиков получают из молибденового порошка методами порошковой металлургии. Для указанных целей используют мелкозернистый порошок, содержание примесей в котором не превышает 0,1%. Из полученных штабиков компактного молибдена затем изготовляют прутки, проволоку, полосы, ленты, листы и другие изделия.
Заключение
Как описано в статье, процесс получения данного металла состоит из многих стадий и является достаточно трудоемким. Авторы постарались выделить наиболее значимые этапы производства молибдена и обратить внимание на важные особенности.
Обзор свойств и областей применения молибдена показывает, что это очень важный материал, без которого в некоторых отраслях промышленности просто невозможно обойтись. Он обладает уникальными свойствами, которые в некоторых ситуациях нельзя получить путем применения других материалов.
Авторы надеются, что приведенный в статье материал будет интересен и полезен читателям. Свои замечания и предложения читатели могут присылать на адрес info@metotech.ru.
Список литературы
телефоны:
8 (800) 200-52-75
(495) 366-00-24
(495) 504-95-54
(495) 642-41-95
молибден
Полезное
Смотреть что такое «молибден» в других словарях:
МОЛИБДЕН — (греч. molibdaine, от molybdos свинец). Беловатый металл, встречающийся в молибдените, в соединении с серою. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. МОЛИБДЕН блестящий хрупкий металл; уд. в. = 9,01; раствор … Словарь иностранных слов русского языка
МОЛИБДЕН — МОЛИБДЕН, хим. элемент, симв. Mo, порядковый номер 42, ат. вес 96,0; стоит в 6 й группе периодической системы. Природные соединения М.: молибденовый блеск MoS2 и желтая свинцовая руда РЬМо04. Получается М. из MoS2 обжиганием и последующим… … Большая медицинская энциклопедия
МОЛИБДЕН — (символ Мо), серебристо белый ПЕРЕХОДНЫЙ ХИМИЧЕСКИЙ ЭЛЕМЕНТ, металл, впервые открытый в 1778 г. Добывается из руд, содержащих МОЛИБДЕНИТ (МоS2). Концентрированный минерал обжигается для получения триоксида молибдена, который смешивается с железом … Научно-технический энциклопедический словарь
МОЛИБДЕН — (латинское Molybdaenum), Mo, химический элемент VI группы периодической системы, атомный номер 42, атомная масса 95,94; металл, tпл 2623 шC. Молибден используют для легирования сталей, как компонент жаропрочных сплавов в авиационной, ракетной и… … Современная энциклопедия
Молибден — Mo (лат. Molybdaenum, от греч. molybdos свинец * a. molybdenum; н. Molybdan; ф. molybdene; и. molibdeno), хим. элемент VI группы периодич. системы Менделеева, ат. н. 42, ат. м. 95,94. B природном M. семь стабильных изотопов; 92Mo (15,86%) … Геологическая энциклопедия
Молибден — (латинское Molybdaenum), Mo, химический элемент VI группы периодической системы, атомный номер 42, атомная масса 95,94; металл, tпл 2623 °C. Молибден используют для легирования сталей, как компонент жаропрочных сплавов в авиационной, ракетной и… … Иллюстрированный энциклопедический словарь
МОЛИБДЕН — [дэ], молибдена, муж. (от греч. molybdos свинец) (хим.). Химический элемент твердый металл с белым блеском. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
МОЛИБДЕН — [дэ ], а, муж. Химический элемент твёрдый блестящий серебристо белый металл. | прил. молибденовый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
МОЛИБДЕН — (Molybdenum), Mo, хим. элемент побочной подгруппы VI группы нериодич. системы элементов, ат. номер 42, ат. масса 95,94. В природе представлен 7 стабильными изотопами: 92Mo (14,84%), 94Mo (9,25%), 95Mo (15,92%), 96Mo(16,68%), 97Mo (9,55%), 98Mo… … Физическая энциклопедия
молибден — сущ., кол во синонимов: 2 • металл (86) • элемент (159) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Молибден
Молибде́н / Molybdaenum (Mo), 42
2,16 (шкала Полинга)
Молибде́н — элемент побочной подгруппы шестой группы пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 42. Обозначается символом Mo (лат. Molybdaenum ). Простое вещество молибден (CAS-номер: 7439-98-7) — переходный металл светло-серого цвета. Главное применение находит в металлургии.
Содержание
История и происхождение названия
Открыт в 1778 году шведским химиком Карлом Шееле, который, прокаливая молибденовую кислоту, получил МоО3. В металлическом состоянии впервые получен П. Гьельмом в 1782 г. восстановлением оксида углём: он получил молибден, загрязненный углеродом и карбидом молибдена. Чистый молибден в 1817 году получил Й. Берцелиус.
Нахождение в природе
Известно около 20 минералов молибдена. Важнейшие из них: молибденит MoS2 (60 % Mo), повеллит СаМоО4 (48 % Мо), молибдит Fe(MoO4)3·nH2O (60 % Mo) и вульфенит PbMoO4.
Месторождения
Генетические группы и промышленные типы месторождений
1. Контактово-метасоматические (скарновые)
А. Высокотемпературные (грейзеновые)
в. кварц-халькопирит-молибденитовые (меднопорфировые руды)
Получение
Промышленное получение молибдена начинается с обогащения руд флотационным методом. Полученный концентрат обжигают до образования оксида МоО3:
который подвергают дополнительной очистке. Далее МоО3 восстанавливают водородом:
Полученные заготовки обрабатывают давлением (ковка, прокатка, протяжка).
Физические свойства
Химические свойства
При комнатной температуре на воздухе молибден устойчив. Начинает окисляться при 400 °C. Выше 600 °C быстро окисляется до триоксида МоО3. Этот оксид получают также окислением дисульфида молибдена MoS2 и термолизом молибдата аммония (NH4)6Mo7O24·4H2O.
Мо образует оксид молибдена (IV) МоО2 и ряд оксидов, промежуточных между МоО3 и МоО2.
С галогенами Mo образует ряд соединений в разных степенях окисления. При взаимодействии порошка молибдена или МоО3 с F2 получают гексафторид молибдена MoF6, бесцветную легкокипящую жидкость. Mo (+4 и +5) образует твердые галогениды MoHal4 и MoHal5 (Hal = F, Cl, Br). С иодом известен только дийодид молибдена MoI2. Молибден образует оксигалогениды: MoOF4, MoOCl4, MoO2F2, MoO2Cl2, MoO2Br2, MoOBr3 и другие.
При нагревании молибдена с серой образуется дисульфид молибдена MoS2, с селеном — диселенид молибдена состава MoSe2. Известны карбиды молибдена Mo2C и MoC — кристаллические высокоплавкие вещества и силицид молибдена MoSi2.
Особая группа соединений молибдена — молибденовые сини. При действии восстановителей — сернистого газа, цинковой пыли, алюминия или других на слабокислые (рН=4) суспензии оксида молибдена образуются ярко-синие вещества переменного состава: Мо2О5·Н2О, Мо4О11·Н2О и Мо8О23·8Н2О.
Mo образует молибдаты, соли не выделенных в свободном состоянии слабых молибденовых кислот, хН2О· уМоО3 (парамолибдат аммония 3(NH4)2O·7MoO3·zH2O; СаМоО4, Fe2(МоО4)3 — встречаются в природе). Молибдаты металлов I и III групп содержат тетраэдрические группировки [МоО4].
Существуют двойные молибдаты, в состав которых входят сразу два катиона, например, М +1 М +3 (МоО4)2, М +1 5М +3 (МоО4)4. Оксидные соединения, содержащие молибден в низших степенях окисления — молибденовые бронзы, например, красная K0,26MoO3 и синяя К0,28МоО3. Эти соединения обладают металлической проводимостью и полупроводниковыми свойствами.
Применение
Молибден используется для легирования сталей, как компонент жаропрочных и коррозионностойких сплавов. Молибденовая проволока (лента) служит для изготовления высокотемпературных печей, вводов электрического тока в лампочках. Соединения молибдена — сульфид, оксиды, молибдаты — являются катализаторами химических реакций, пигментами красителей, компонентами глазурей. Гексафторид молибдена применяется при нанесении металлического Mo на различные материалы, MoS2 используется как твердая высокотемпературная смазка. Mo входит в состав микроудобрений. Радиоактивные изотопы изотопные индикаторы.
В 2005 году мировые поставки молибдена (в пересчёте на чистый молибден) составили, по данным «Sojitz Alloy Division», 172,2 тыс. тонн (в 2003—144,2 тыс. тонн). Чистый монокристаллический молибден используется для производства зеркал для мощных газодинамических лазеров. Теллурид молибдена является очень хорошим термоэлектрическим материалом для производства термоэлектрогенераторов (термо-э.д.с 780 мкВ/К). Трёхокись молибдена (молибденовый ангидрид) широко применяется в качестве положительного электрода в литиевых источниках тока.
Молибден применяется в высокотемпературных вакуумных печах сопротивления в качестве нагревательных элементов и теплоизоляции. Дисилицид молибдена применяется в качестве нагревателей в печах с окислительной атмосферой, работающих до 1800 °С.
Биологическая роль
Физиологическое значение молибдена для организма животных и человека было впервые показано [кем?] в 1953 г, с открытием влияния этого элемента на активность фермента ксантиноксидазы. Молибден промотирует (делает более эффективной) работу антиокислителей, в том числе витамина С. Важный компонент системы тканевого дыхания. Усиливает синтез аминокислот, улучшает накопление азота. Молибден входит в состав ряда ферментов (альдегидоксидаза, сульфитоксидаза, ксантиноксидаза и др.), выполняющих важные физиологические функции, в частности, регуляцию обмена мочевой кислоты. Молибденоэнзимы катализируют гидроксилирование различных субстратов. Альдегидоксидаза окисляет и нейтрализует различные пиримидины, пурины, птеридины. Ксантиноксидаза катализирует преобразование гипоксантинов в ксантины, а ксантины — в мочевую кислоту. Сульфитоксидаза катализирует преобразование сульфита в сульфат.
Недостаток молибдена в организме сопровождается уменьшением содержания в тканях ксантиноксидазы. При недостатке молибдена страдают анаболические процессы, наблюдается ослабление иммунной системы. Тиомолибдат аммония (растворимая соль молибдена), является антагонистом меди и нарушает ее утилизацию в организме.
Круговорот азота
Молибден входит в состав активного центра нитрогеназы — фермента для связывания атмосферного азота (распространён у бактерий и архей).
Микроэлемент
Микроколичества молибдена необходимы для нормального развития организмов, используется в составе микроэлементной подкормки, в частности, под ягодные культуры.
Влияет на размножение (у растений).
Стоимость
Физиологическое действие
Пыль молибдена и его соединений раздражает дыхательные пути.
Молибден
Молибден – химический элемент, занимающий значительное место в обеспечении жизнедеятельности растений, особенно бобовых. Он входит в состав фермента нитратредуктазы и тесно связан с восстановлением нитратов в растениях. Относится к числу рассеянных элементов. Является компонентом (действующим веществом) различных комплексных и микроудобрений, добавляется в минеральные удобрения. Используется для внесения в почву внекорневой подкормки и для предпосевной обработки семян.
Содержание:
Молибден – это очень прочный и тугоплавкий металл, поэтому довольно трудно вообразить, чтобы он находился в составе какого-нибудь хрупкого соединения. Однако много тысячелетий назад дисульфид молибдена использовали для письма по пергаменту. Кристаллы этого минерала хорошо затачивались и оставляли при письме заметные, хорошо различимые следы. По внешнему виду вещество напоминало уголь, однако большая, чем у угля, твердость, а также сероватый блеск придавали ему сходство и со свинцом. Собственно, как раз это сходство и определило присвоенное элементу название – в переводе с греческого языка, «молибдос» означает «свинец».
В 1778 году Карл Шееле выделил из дисульфида оксид металла, а затем шведский химик П. Хьельм получил чистый молибден, нашедший, ввиду своей химической инертности, ограниченное применение. Тем не менее, там, где этот элемент используется, мало что способно составить ему конкуренцию. Например, его сплавы с титаном применяются в изготовлении нагревающихся частей различных приборов, так как они выдерживают температуру до 1500°С.
В свете его устойчивости, молибден сложно представить среди активных компонентов динамической внутренней среды живых организмов. Тем не менее, он относится к числу важных микроэлементов, которые содержатся в растительных и животных клетках и участвуют в процессах метаболизма. [11]
Молибденит
Физические и химические свойства
Молибден (лат. Molybdenum), Mo, – элемент побочной подгруппы VI группы периодической системы Менделеева. Атомный номер – 42, атомная масса – 95,94. В природе молибден представлен семью стабильными изотопами с массовыми числами 92, 94–98 и 100. Наиболее распространен 98 Mo (23,75 %).
При комнатной температуре молибден химически устойчив, но при нагревании на воздухе превращается в белый порошок – молибденовый ангидрид МоО3. В серной и соляной кислотах элемент растворим при температуре 80–100°С. Азотная кислота, перекись водорода и царская водка медленно растворяют металл на холоде и быстро при нагревании. Молибден хорошо растворим в смеси серной и азотной кислот. [7]
Содержание молибдена (в мг/кг) в почвах стран СНГ, согласно данным: [6]
Почва
Среднее содержание
Пределы колебаний
Подзолистые
Болотные
Серые лесные
Черноземы
Каштановые
Засоленные
Сероземы
Красноземы
Горные
Содержание в природе
В природных условиях
В магматических породах
Содержание молибдена в различных типах почв
В почвах молибден находится в следующих формах:
Содержание молибдена в почвах обычно близко к концентрации в материнской породе и в почвах мира изменяется в пределах 0,013–17 мг/кг. Почвы, образованные на гранитных породах и обогащенных органикой сланцах, содержат большее количество молибдена. В отличие от других металлов, молибден менее растворим в кислых почвах и легко подвижен в щелочных. [5]
Потребность с/х культур в молибдене и симптомы его недостатка, согласно данным: [12] [10]
Хлороз листовой пластинки
Зерновые
Зернобобовые
Желто-зеленая окраска листьев
Стебли и черешки становятся красно-бурыми
Клубеньки мелкие и серые
Масличные
Овощные
Хлороз на краях листьев
Доли первой и второй пар настоящих листьев желтеют, заворачиваются краями кверху
Возникает сначала крапчатый, а затем сплошной хлороз
Вздуваются ткани между жилками на остальных листочках
Листовые пластинки узкие, уродливые
Либо листовая пластинка не образуется
Пропашные
Свекла сахарная, кормовая, столовая
Кормовые
Листья тусклые, зеленовато-желтые
Края листьев вялые, закрученные вниз, красно-коричневые
Листья увядают, черешки изгибаются
Кукуруза на силос и зеленую массу
Валовое содержание молибдена в почвах стран СНГ колеблется от 1,5 до 12 мг/кг, в среднем составляя 2,6 мг/кг, при этом 12 мг/кг содержат земли тундры. Все остальные почвы, как-то: дерново-подзолистые, серые лесные, черноземные, каштановые, красноземные – содержат приблизительно одинаковое количество молибдена. Высоким содержанием отличаются участки, прилегающие к месторождениям молибденовых руд.
Самое высокое содержание молибдена в черноземных почвах в среднем составляет 4,6 мг/кг. Наиболее бедны им засоленные почвы (0,95 мг/кг), немногим богаче каштановые (1,1 мг/кг) и сероземы (1,3 мг/кг). Среднее положение по наличию молибдена занимают красноземы, подзолистые и болотные почвы. Значительно колеблется содержание металла в горных породах: от 0,5 до 12, 0 мг/кг. [6]
Кроме того, содержание молибдена зависит от механического состава почв. Наиболее бедны им образцы с легким механическим составом – песчаные и супесчаные. Глинистые и суглинистые, как правило, богаче. Плодородные окультуренные почвы отличаются большим содержанием данного элемента, чем неокультуренные. Почвы, образовавшиеся на серпентинитах, также отличаются низким содержанием молибдена. [6]
Роль в растении
Биохимические функции
Молибден входит в состав немногих растительных белков. Он поступает в растения в форме аниона Mo 2- 4 и концентрируется в растущих, молодых организмах. Наибольшее его количество содержат бобовые, причем, в листьях его больше, чем в корнях и стеблях. В листовых пластинках молибден сосредоточен в составе хлоропластов. [8]
Установлено, что корневые клубеньки содержат в несколько раз больше молибдена, чем ткани листьев. Значительная часть элемента в клубеньках связана с нитратредуктазой корней и стеблей и, кроме того, нитрогеназой клубеньковых бактерий. Молибден – важный компонент нитрогеназы и нитратредуктазы. Эти два молибденсодержащих фермента непосредственно участвуют в метаболизме азота, играя важную роль как в фиксации N2, так и в восстановлении оксида азота NO3. Потребность растений в молибдене непосредственно связана с обеспечением их азотом. Однако установлено, что растения, поглощающие NH4–N, испытывают гораздо меньшую потребность в молибдене, чем усваивающие NO3–N. [5]
Молибден присутствует и в других ферментах (оксидазах), ускоряющих разнообразные, не связанные между собой реакции. Основная ферментативная роль молибдена непосредственно связана с функцией переноса электронов. Этому способствует переменная валентность Mo. [5]
Молибден, как и железо, необходим для синтеза леггемоглобина (белка – переносчика кислорода в клубеньках). Его дефицит приводит к изменению цвета клубеньков на желтый или серый (нормальная окраска красная). Известно более 20 молибденосодержащих ферментов. Среди них альдегидоксидаза (катализирует превращение абсцизового альдегида в фитогормон абсцизовую кислоту), сульфитоксилаза (окисляет SO 2- 3 до SO 2- 4), ксантиндегидрогеназа и другие. Во всех вышеперечисленных ферментах молибден присутствует в виде молибдоптерина, именуемого молибденовым фактором, что обеспечивает устойчивость молибдена к окислению. [8]
Недостаток (дефицит) молибдена в растениях
Симптомы дефицита молибдена проявляются у растений, находящихся на кислых минеральных почвах с высоким содержанием гидроксидов марганца и железа. Обострение дефицита вызывает присутствие в почвенном растворе сульфатных анионов, конкурирующих с анионами молибдата. Критический уровень содержания молибдена в растениях колеблется от 0,1 до 1 мг/кг сухой массы листьев.
Изменение внутреннего строения
При дефиците молибдена растения становятся неустойчивы к низким температурам и дефициту воды. Наблюдаются нарушения в формировании пыльцы.
Внешние признаки
Например, у капусты пятнистость сопровождается увяданием краев листьев, а у томата и картофеля листовые пластинки закручиваются.
Недостаток молибдена негативно сказывается и на формировании цветков. У томатов они мельчают, почти сидят на стебле и не раскрываются, у цветной капусты деформируются и становятся рыхлыми. У бобовых при недостатке данного элемента нарушается образование клубеньков на корнях. [3]
Избыток молибдена
Фитотоксичность молибдена проявляется только в очень высоких его концентрациях. Например, признаки молибденового отравления молодых проростков ячменя отмечались при содержании Mo 135 мг/кг сухой массы.
Избыток молибдена в растениях токсичен для животных и человека. Применять молибденовые микроудобрения следует с учетом токсичности этого элемента для животных и человека, проявляющейся даже при крайне низких концентрациях. Особенно это характерно для кормовых растений. [5]
Содержание молибдена в различных соединениях
Молибден – малораспространенный элемент. Молибденовые удобрения получают из молибденовых руд. Массовая доля металла в них составляет 0,1–1 %. В дополнение к этому источнику, значительную часть молибдена добывают из различных отходов промышленности, в частности, электролампового производства. [3]
Известно около двадцати минералов, содержащих молибден. Важнейший из них – молибденит MoS2, являющийся единственным первичным минералом. Остальные – вторичного происхождения. Промышленное значение имеют повелит CaMoO4, молибдит Fe2(MoO4)3 х nH2O и вульфенит PhMoO4. [7]
Содержание молибдена в удобрениях, мг/кг, согласно данным: [3] [9]
Молибден
| Молибден | |
|---|---|
| Блестящий металл серебристо-белого цвета | |
 | |
| Название, символ, номер | Молибден / Molybdaenum (Mo), 42 |
| Атомная масса (молярная масса) | 95,96(2) а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 4d 5 5s 1 |
| Радиус атома | 139 пм |
| Ковалентный радиус | 130 пм |
| Радиус иона | (+6e) 62 (+4e) 70 пм |
| Электроотрицательность | 2,16 (шкала Полинга) |
| Электродный потенциал | −0,2 |
| Степени окисления | 6, 5, 4, 3, 2 |
| Энергия ионизации (первый электрон) | 684,8 (7,10) кДж/моль (эВ) |
| Плотность (при н. у.) | 10,22 г/см³ |
| Температура плавления | 2623 °C |
| Температура кипения | 4885 K |
| Уд. теплота плавления | 28 кДж/моль |
| Уд. теплота испарения | |
| Молярная теплоёмкость | 23,93 Дж/(K·моль) |
| Молярный объём | 9,4 см³/моль |
| Структура решётки | кубическая объёмноцентрированая |
| Параметры решётки | 3,147 Å |
| Температура Дебая | 450 K |
| Теплопроводность | (300 K) 138 Вт/(м·К) |
| Номер CAS | 7439-98-7 |
Молибден — элемент шестой группы (по старой классификации — побочной подгруппы шестой группы) пятого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 42. Обозначается символом Mo (лат. Molybdaenum ). Простое вещество молибден — переходный металл светло-серого цвета. Главное применение находит в металлургии.
Содержание
История и происхождение названия
Открыт в 1778 году шведским химиком Карлом Шееле, который, прокаливая молибденовую кислоту, получил MoO3. В металлическом состоянии впервые получен П. Гьельмом в 1781 году восстановлением оксида углём: он получил молибден, загрязнённый углеродом и карбидом молибдена. Чистый молибден в 1817 году получил Й. Берцелиус восстановлением оксида водородом.
Нахождение в природе
Известно около 20 минералов молибдена. Важнейшие из них: молибденит MoS2 (60 % Mo), повеллит CaMoO4 (48 % Mo), молибдит Fe(MoO4)3·nH2O (60 % Mo) и вульфенит PbMoO4.
Месторождения
Крупные месторождения молибдена известны в США, Мексике, Чили, Канаде, Австралии, Норвегии, России. В России молибден выпускают на Сорском ферромолибденовом заводе. Более 7 % от мировых запасов молибдена расположены в Армении, причем 90 % из них сосредоточены в Каджаранском медно-молибденовом месторождении.
В космосе
Аномально высокое содержание молибдена наблюдается в звёздных образованиях, состоящих из красного гиганта (или сверхгиганта), внутри которого находится нейтронная звезда — объектах Ландау — Торна — Житковой.
Добыча
| Страна | Залежи (тыс. т) | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2014 |
|---|---|---|---|---|---|---|---|---|---|
| США | 2700 | 37,6 | 32,3 | 29,9 | 41,5 | 58,0 | 59,8 | 59,4 | 68,2 |
| Китай | 3000 | 28,2 | 30,33 | 32,22 | 29,0 | 40,0 | 43,94 | 46,0 | 103,0 |
| Чили | 1905 | 33,5 | 29,5 | 33,4 | 41,48 | 47,75 | 43,28 | 41,1 | 48,8 |
| Перу | 850 | 8,35 | 8,32 | 9,63 | 9,6 | 17,32 | 17,21 | 17,25 | 17,0 |
| Канада | 95 | 8,56 | 7,95 | 8,89 | 5,7 | 7,91 | 7,27 | 8,0 | 9,7 |
| Россия | 360 | 3,93 | 4,29 | 3,57 | 3,11 | 3,84 | 3,94 | 4,16 | 4,8 |
| Мексика | 135 | 5,52 | 3,43 | 3,52 | 3,7 | 4,25 | 2,52 | 4,0 | 14,4 |
| Армения | 635 | 3,4 | 3,6 | 3,5 | 3,0 | 2,75 | 3,0 | 3,0 | 7,1 |
| Иран | 120 | 2,6 | 2,4 | 2,4 | 1,5 | 2,0 | 2,0 | 2,5 | 4,0 |
| Монголия | 294 | 1,42 | 1,59 | 1,6 | 1,7 | 1,19 | 1,2 | 1,5 | 2,0 |
| Узбекистан | 203 | 0,58 | 0,5 | 0,5 | 0,5 | 0,57 | 0,6 | 0,5 | 0,5 |
| Болгария | 10 | 0,4 | 0,4 | 0,2 | 0,2 | 0,2 | 0,4 | 0,4 | ? |
| Казахстан | 130 | 0,09 | 0,05 | 0,05 | 0,23 | 0,23 | 0,25 | 0,4 | — |
| Киргизия | 100 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | 0,25 | ? |
| Прочие | 1002 | — | — | — | — | — | — | — | — |
| Итого | 11539 | 134,4 | 124,91 | 129,63 | 141,47 | 186,26 | 185,66 | 188,71 |
Генетические группы и промышленные типы месторождений
1. Контактово-метасоматические (скарновые).
А. Высокотемпературные (грейзеновые). Б. Среднетемпературные. а. кварц-молибденитовые. б. кварц-сфалерит-галенит-молибденитовые. в. кварц-халькопирит-молибденитовые (меднопорфировые руды). г. настуран-молибденитовые.
Получение
Промышленное получение молибдена начинается с обогащения руд флотационным методом. Полученный концентрат обжигают до образования оксида MoO3:
который подвергают дополнительной очистке. Далее MoO3 восстанавливают водородом:
Полученные заготовки обрабатывают давлением (ковка, прокатка, протяжка).
Физические свойства
Молибден — светло-серый металл с кубической объёмноцентрированной решёткой типа α-Fe (a = 3,14 Å; z = 2; пространственная группа Im3m), парамагнитен, шкала Мооса определяет его твёрдость 4,5 баллами. Механические свойства, как и у большинства металлов, определяются чистотой металла и предшествующей механической и термической обработкой (чем чище металл, тем он мягче). Обладает крайне низким коэффициентом теплового расширения. Молибден является тугоплавким металлом с температурой плавления 2620 °C и температурой кипения 4639 °C.
Изотопы
Природный молибден состоит из семи изотопов: 92 Mo (15,86 % по массе), 94 Mo (9,12 %), 95 Mo (15,70 %), 96 Mo (16,50 %), 97 Mo (9,45 %), 98 Mo (23,75 %) и 100 Mo (9,62 %). Шесть из них стабильны, 100 Mo слаборадиоактивен (период полураспада 8,5⋅10 18 лет, что в миллиард раз больше возраста Вселенной). Из искусственных изотопов самым стабильным является 93 Mo, с периодом полураспада 4 тысячи лет, период полураспада остальных изотопов не превышает 3 суток.
Химические свойства
При комнатной температуре на воздухе молибден устойчив. Начинает окисляться при 400 °C. Выше 600 °C быстро окисляется до триоксида MoO3. Этот оксид получают также окислением дисульфида молибдена MoS2 и термолизом молибдата аммония (NH4)6Mo7O24·4H2O.
Mo образует оксид молибдена (IV) MoO2 и ряд оксидов, промежуточных между MoO3 и MoO2.
С галогенами Mo образует ряд соединений в разных степенях окисления. При взаимодействии порошка молибдена или MoO3 с F2 получают гексафторид молибдена MoF6, бесцветную легкокипящую жидкость. Mo (+4 и +5) образует твердые галогениды MoHal4 и MoHal5 (Hal = F, Cl, Br). С йодом известен только дийодид молибдена MoI2. Молибден образует оксигалогениды: MoOF4, MoOCl4, MoO2F2, MoO2Cl2, MoO2Br2, MoOBr3 и другие.
При нагревании молибдена с серой образуется дисульфид молибдена MoS2, с селеном — диселенид молибдена состава MoSe2. Известны карбиды молибдена Mo2C и MoC — кристаллические высокоплавкие вещества и силицид молибдена MoSi2.
Особая группа соединений молибдена — молибденовые сини. При действии восстановителей — сернистого газа, цинковой пыли, алюминия или других на слабокислые (pH=4) суспензии оксида молибдена образуются ярко-синие вещества переменного состава: Mo2O5·H2O, Mo4O11·H2O и Mo8O23·8H2O.
Mo образует молибдаты, соли не выделенных в свободном состоянии слабых молибденовых кислот, xH2O· MoO3 (парамолибдат аммония 3(NH4)2O·7MoO3·zH2O; CaMoO4, Fe2(MoO4)3 — встречаются в природе). Молибдаты металлов I и III групп содержат тетраэдрические группировки [MoO4].
Существуют двойные молибдаты, в состав которых входят сразу два катиона, например, M +1 M +3 (MoO4)2, M +1 5M +3 (MoO4)4. Оксидные соединения, содержащие молибден в низших степенях окисления — молибденовые бронзы, например, красная K0,26MoO3 и синяя K0,28MoO3. Эти соединения обладают металлической проводимостью и полупроводниковыми свойствами.
Применение
Молибден используется для легирования сталей как компонент жаропрочных и коррозионностойких сплавов. Молибденовая проволока (лента) служит для изготовления высокотемпературных печей, вводов электрического тока в лампах накаливания. Соединения молибдена — сульфид, оксиды, молибдаты — являются катализаторами химических реакций, пигментами красителей, компонентами глазурей. Гексафторид молибдена применяется при нанесении металлического Mo на различные материалы, MoS2 используется как твёрдая высокотемпературная смазка. Mo входит в состав микроудобрений. Радиоактивные изотопы 93 Mo (T1/2 = 6,95 ч) и 99 Mo (T1/2 = 66 ч) — изотопные индикаторы.
Молибден-99 используется для получения технеция-99, который используется в медицине при диагностике онкологических и некоторых других заболеваний. Общее мировое производство молибдена-99 составляет около 12 000 кюри в неделю (из расчёта активности на шестой день), стоимость молибдена-99 — 46 млн долларов за 1 грамм (470 долларов за 1 Ки).
В 2005 году мировые поставки молибдена (в пересчёте на чистый молибден) составили, по данным «Sojitz Alloy Division», 172,2 тыс. тонн (в 2003 году — 144,2 тыс. тонн). Чистый монокристаллический молибден используется для производства зеркал для мощных газодинамических лазеров. Теллурид молибдена является очень хорошим термоэлектрическим материалом для производства термоэлектрогенераторов (термо-ЭДС 780 мкВ/К). Трёхокись молибдена (молибденовый ангидрид) широко применяется в качестве положительного электрода в литиевых источниках тока.
Молибден применяется в высокотемпературных вакуумных печах сопротивления в качестве нагревательных элементов и теплоизоляции. Дисилицид молибдена применяется в качестве нагревателей в печах с окислительной атмосферой, работающих до 1800 °C.
Из молибдена изготовляются крючки-держатели тела накала ламп накаливания, в том числе ламп накаливания общего назначения.
Молибденовая проволока диаметром 0,05—0,2 мм используется в проволочных электроэрозионных станках для резки металлов с очень высокой точностью (до 0,01 мм), в том числе и заготовок большой толщины (до 500 мм). В отличие от медной и латунной проволоки, которые используются однократно в подобных станках, молибденовая — многоразовая (
300—500 метров хватает на 30—80 часов непрерывной работы), что несколько уменьшает точность обработки, но повышает её скорость и снижает её стоимость.
Биологическая роль
Физиологическое значение молибдена для организма животных и человека было впервые показано в 1953 году, с открытием влияния этого элемента на активность фермента ксантиноксидазы. Молибден промотирует (делает более эффективной) работу антиокислителей, в том числе витамина С. Важный компонент системы тканевого дыхания. Усиливает синтез аминокислот, улучшает накопление азота. Молибден входит в состав ряда ферментов (альдегидоксидаза, сульфитоксидаза, ксантиноксидаза и др.), выполняющих важные физиологические функции, в частности, регуляцию обмена мочевой кислоты. Молибденоэнзимы катализируют гидроксилирование различных субстратов. Альдегидоксидаза окисляет и нейтрализует различные пиримидины, пурины, птеридины. Ксантиноксидаза катализирует преобразование гипоксантинов в ксантины, а ксантины — в мочевую кислоту. Сульфитоксидаза катализирует преобразование сульфита в сульфат.
Недостаток молибдена в организме сопровождается уменьшением содержания в тканях ксантиноксидазы. При недостатке молибдена страдают анаболические процессы, наблюдается ослабление иммунной системы. Тиомолибдат аммония (растворимая соль молибдена), является антагонистом меди и нарушает её утилизацию в организме.
Круговорот азота
Молибден входит в состав активного центра нитрогеназы — фермента для связывания атмосферного азота (распространён у бактерий и архей).
Микроэлемент
Микроколичества молибдена необходимы для нормального развития организмов, используется в составе микроэлементной подкормки, в частности, под ягодные культуры.
Влияет на размножение (у растений).
Стоимость
На 2016 год стоимость молибдена составляет около 11 750 USD за тонну.
Физиологическое действие
Пыль молибдена и его соединений раздражает дыхательные пути, при длительном вдыхании — неизлечимое и необратимое заболевание (пневмокониоз). Также могут развиться полиартралгии, артрозы, гипотония, в крови может снизиться концентрация гемоглобина, число эритроцитов и лейкоцитов.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| 8 | Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs |
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu,
Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2,
W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au
МОЛИБДЕН
МОЛИБДЕН – (Molybdenum), Mo – химический элемент 6 (VIb) группы периодической системы, атомный номер 42, атомная масса 95,94. Известен 31 изотоп молибдена с 83 Мо по 113 Мо. Из них стабильные: 92 Мо, 94 Мо – 98 Мо. Шесть этих изотопов и 100 Мо (Т½ = 1,00·10 19 лет) встречаются в природе: 92 Мо(14,84%), 94 Мо(9,25%), 95 Мо(15,92%), 96 Мо(16,68%), 97 Мо(9,55%), 98 Мо(24,13%), 100 Мо(9,63%). Самые нестабильные изотопы элемента № 42 имеют периоды полураспада менее 150 нс. Наиболее устойчивая степень окисления +6.
История открытия.
Молибденит (дисульфид молибдена, MoS2) был известен древним грекам и римлянам с незапамятных времен. Этот свинцово-серый с металлическим блеском минерал (другое название – молибденовый блеск) сходен с галенитом (свинцовым блеском, PbS) и графитом. Мягкость минерала позволяла использовать его (вместе с графитом) как грифель для карандашей, поэтому долгое время молибденит путали с галенитом и графитом, хотя, в отличие от последнего, он оставлял на бумаге зеленовато-серый цвет. Сходство древнегреческих названий свинца – mólubdV, и галенита – molubdaina было причиной того, что в средневековой Европе три минерала (PbS, MoS2 и графит) имели одно название – Molybdaena. История открытия элемента № 42 связана со Швецией. В 1758 шведский минералог и химик Аксель Фредерик Кронштедт (Axel Fredrik Cronstedt) (1722–1765) высказал предположение, что графит, галенит и молибденовый блеск три самостоятельных вещества. Двадцать лет спустя, в 1778, химическим составом молибденита заинтересовался шведский химик Карл Вильгельм Шееле. Прокипятив его с концентрированной азотной кислотой, он получил белый осадок «особой белой земли» (Wasserbleyerde), которую назвал молибденовой кислотой (Acidum Molybdaenae). Хотя во времена Шееле и не знали, что «земли» представляют собой оксиды металлов, уникальная химическая интуиция подсказывала ему, что металл можно получить прокаливанием молибденовой кислоты с углем. Экспериментальные трудности (у него не было подходящей печи) не позволили Шееле самостоятельно решить эту задачу и лишь в 1782 шведскому химику Петеру Якобу Гьельму (Peter Jacob Hjelm), которому Шееле прислал образец молибденовой кислоты, удалось восстановить ее углем и получить королек металла (сильно загрязненного карбидами). После удачно проведенного опыта Шееле писал Гьельму: «Радуюсь, что мы теперь обладаем металлом – молибденом!»
Относительно чистый металл удалось получить много лет спустя Йенсу-Якобу Берцелиусу в 1817. Совершенно чистый молибден, способный к ковке, получили лишь в начале 20 в.
Молибден в природе. Типы месторождений. Молибден относится к редким элементам, его кларк в земной коре равен 1,1·10 –4 % по массе. Кроме того, оценено общее содержание его во Вселенной (5·10 –7 % по массе или 10 –8 % от общего количества атомов), на Солнце (9·10 –7 %(масс.) или 10 –8 %(ат.)), углеродистых метеоритах (1,2·10 –4 (масс.) или 2,5·10 –5 %(ат.)), морской воде (10 –6 %(масс.) или 6,4·10 –8 %(ат.)), речной воде (8·10 –8 %(масс.) или 8·10 –10 %(ат.)). В природе этот металл встречается только в виде соединений, известно около двух десятков его минералов, среди которых наиболее важны молибденит (MoS2), повелит (CaMoO4), молибдо-шеелит (Ca(Mo,W)O4), молибдит (xFe2O3·yMoO3·zH2O) и вульфенит (PbMoO4). Промышленное значение имеет только молибденит.
Молибденовые руды принято делить по минеральному составу и форме рудных тел на жильные (кварцевые, кварц-серицитовые и кварц-молибденит-вольфрамитовые), прожилково-вкрапленные (кварц-молибденит-серицитовые, медно-молибденовые, медные порфировые с молибденом), скарновые (молибденовые, воьфрамо-молибденовые и медно-молибденовые). Серицит – природный алюмосиликат. Скарны – это породы, образовавшиеся на контакте известняков и кислых магматических пород типа гранитов, богатых кварцем. Медно-порфировые месторождения представлены породами, в которых кварцевые жилы с молибденитом образуют прожилки в измененной породе. Раньше наибольшее промышленное значение имели кварцевые жильные месторождения, сейчас жильные месторождения, в основном, выработаны и ценны прожилково-вкрапленные и скарновые месторождения. Более 60% запасов молибдена и около 70 % его добычи приходится на медно-молибден-порфировые месторождения. Из них молибден добывается попутно с медью.
Еще в 2001 США считались мировым лидером по запасам молибдена, но недавно ситуация изменилась с открытием новых молибденовых месторождений в Китае. Распределение (на 2004) разведанных ресурсов молибденовых руд (в пересчете на свободный металл) по странам мира представлено в Таблице 1:
















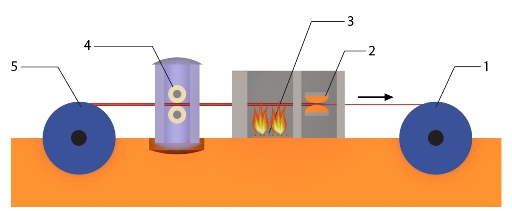
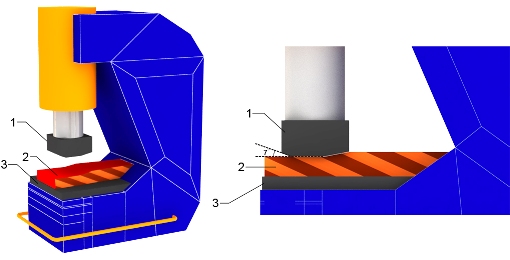










 и множество других побочных процесов, заметно влияющих на последующее извлечение молибдена:
и множество других побочных процесов, заметно влияющих на последующее извлечение молибдена: