Саркопения что это такое
Саркопения что это такое
Саркопения
Саркопения – это патологическое состояние, ассоциированное с возрастом, характеризующееся снижением массы скелетной мускулатуры. Клинически проявляется уменьшением мышечной силы и функциональности. Может привести к проблемам с самообслуживанием, инвалидности и даже смерти. Диагноз саркопении ставится при помощи исследований, измеряющих мышечную силу и массу, а также специально разработанных тестов. В качестве лечения назначаются регулярные физические упражнения, коррекция питания (увеличение в рационе белковых продуктов), витамин Д. В тяжелых случаях применяют анаболические стероиды, гормон роста.
МКБ-10
Общие сведения
Саркопения (от греческого «sarx» — тело, плоть + «penia» — снижение) – дегенеративный процесс, при котором происходит постепенная потеря функциональных мышечных волокон. Использовать данный термин впервые предложил американский врач И. Розенберг в 1989 году. Атрофические изменения в мышцах, связанные с возрастом, известны очень давно. Однако саркопения только в 2016 году была выделена в самостоятельную нозологическую единицу и включена в международную классификацию болезней. В 2009 году была создана Европейская рабочая группа по саркопении у старых людей (EWGSOP). Распространенность патологии составляет 30% среди лиц 60-летнего возраста и около 50% среди населения старше 80 лет. Соотношение мужчин и женщин 1:1.
Причины саркопении
Данное состояние считается следствием инволютивных и нейродегенеративных явлений, происходящих при старении как во всем организме в целом, так и в скелетных мышцах. К ним относятся снижение способности к регенерации миосателлитных клеток, ухудшение функционирования нервно-мышечных синапсов и т. д. Немаловажную роль играет возрастная недостаточность гормонов, активирующих анаболические процессы в мышцах – тестостерона, соматотропина, инсулиноподобного фактора роста-1.
К предрасполагающим факторам, усугубляющим мышечную дистрофию, относятся низкая физическая активность, дефицит витамина Д. Неблагоприятное действие оказывает и недостаточное поступление белка с пищей, которое может быть вызвано как неправильным составлением своего рациона, так и патологиями желудочно-кишечного тракта, препятствующими нормальному усвоению аминокислот (хроническим панкреатитом, болезнью Крона, целиакией). К саркопении также приводят хронические заболевания – ревматоидный артрит, хроническая обструктивная болезнь легких, тяжелые болезни печени.
Патогенез
Механизм изменений в мышечной ткани при саркопении сложен. С одной стороны, присутствует напрямую связанное со старением физиологическое действие апоптоза (запрограммированной клеточной гибели), с другой ‒ влияние многочисленных факторов, ускоряющих апоптоз. Дефицит анаболических гормонов, витамина D, аминокислот сдвигает баланс между синтезом и распадом белков в мышцах в сторону последнего. Недостаточная физическая активность ухудшает кровообращение мышц, что нарушает биогенез митохондрий в мышечных клетках и запускает окислительный стресс, который повреждает клеточные мембраны.
Вырабатываемые медиаторы и цитокины (интерлейкин-6, С-реактивный белок, адипонектин) при хронических воспалительных заболеваниях также способствуют дисметаболизму в миоцитах. В последнее время ведущее патогенетическое значение отводится белку миостатину, тормозящему регенерацию мышечных волокон. Исходом этих процессов является уменьшение количества, объема миофибрилл, замещение их жировой и соединительной тканью.
Классификация
Традиционно саркопения считается болезнью пожилых и в подавляющем большинстве случаев встречается у людей старше 60 лет. Она часто сочетается со старческой астенией, кахексией. Вместе с тем, выделяют первичную саркопению, сопровождающую старение, и вторичную, которая развивается при некоторых хронических болезнях (печеночной недостаточности, ревматоидном артрите). Также существуют следующие фенотипические формы:
Представленные фенотипы характерны как для первичной, так и для вторичной формы. В зависимости от тяжести состояния пациента и количества имеющихся диагностических критериев различают:
Симптомы саркопении
Клиническая симптоматика развивается медленно. При минимальных атрофических изменениях в мышцах человек начинает плохо переносить привычную для него физическую нагрузку (быстро наступает усталость, требуется большее время для отдыха). При прогрессировании патологических процессов пациенту становится трудно подниматься по лестнице, нести даже небольшой груз (2-3 кг), расчесывать волосы на голове.
Из-за выраженной слабости мышц у больного подкашиваются ноги при ходьбе по прямой поверхности, нарушается равновесие, возникают частые падения. Поражение диафрагмы и межреберных мышц сопровождается смешанной одышкой. Когда преобладающее количество мышечных волокон замещено соединительной и жировой тканью, больной не может сам себя обслуживать, ему нужна помощь, чтобы встать с кровати.
Осложнения
Саркопения является тяжелым заболеванием, приводящим к временной или стойкой утрате трудоспособности и инвалидности по причине критичной мышечной слабости. Самые опасные для жизни состояния возникают из-за функциональной неполноценности дыхательной мускулатуры – это аспирационная пневмония и дыхательная недостаточность. Наиболее частые осложнения (переломы длинных трубчатых костей) вызваны постоянными падениями. При вторичной саркопении неблагоприятные последствия связаны с основным заболеванием (например, кровотечение при печеночной недостаточности). Также саркопения ввиду повышения инсулинорезистентности может ухудшить течение сахарного диабета 2 типа. Саркопеническое ожирение усугубляет ишемическую болезнь сердца и хроническую сердечную недостаточность.
Диагностика
Курацией пациентов с саркопенией занимаются врачи-гериатры. Для выявления клинических признаков патологии пользуются опросником SARC-F. В опроснике нужно ответить на такие вопросы, как «насколько сложно вам совершать прогулки вокруг дома?», «испытываете ли вы трудности при подъеме по лестнице?», «как часто вы падали за последний год?». Европейской рабочей группой был разработан специальный диагностический алгоритм, позволяющий определить мышечную силу, массу и функцию. Если человек, отвечая на вопросы SARC-F, набирает большое количество баллов, целесообразно проведение следующих исследований:
Саркопению необходимо дифференцировать с мышечными дистрофиями, дермато- и полимиозитом, неврологическими заболеваниями (миастения, синдром Гийена-Барре). Тяжелые формы требуют обязательного исключения злокачественных новообразований и ВИЧ-инфекции. В дифференциальной диагностике принимают участие неврологи, онкологи.
Лечение саркопении
Из лекарственных средств применяются нативные препараты витамина Д; при наличии остеопороза назначаются активные формы витамина. При выраженных признаках мышечной атрофии используются анаболические стероиды (нандролона деканоат). При их неэффективности прибегают к аналогам гормона роста (соматотропин). В настоящее время ведутся клинические исследования новых перспективных лекарственных препаратов – ингибиторов миостатина, агонистов грелина и селективных модуляторов андрогенных рецепторов. Терапия вторичной формы дополнительно включает лечение основного заболевания.
Профилактика и прогноз
Саркопения является тяжелой патологией, снижающей работоспособность, приводящей пациентов к инвалидности, лишающей их способности к самообслуживанию. Риск летального исхода составляет около 5-10%. Основные причины смерти – дыхательная недостаточность, сердечно-сосудистая патология, кахексия. Саркопения снижает продолжительность жизни у больных с циррозом печени и другими сопутствующими заболеваниями. Профилактика заключается в регулярном выполнении физических нагрузок, полноценном питании (нормальном потреблении белка), приеме превентивных доз витамина D.
Саркопения — новое имя старого недуга
Что такое саркопения и как поддерживать состояние костей и мышц в тонусе, рассказала Наталья Валерьевна Поленова, кандидат медицинских наук, кардиолог, диетолог, семейный врач GMS Clinic.
Что же такое саркопения? Слово явно нерусское и многим незнакомое.
Да, действительно, термин «саркопения» имеет греческое происхождение: sarx — «плоть», penia — недостаток, нехватка. Саркопения представляет собой патологическое состояние, особенно характерное для пожилых людей, при котором происходит уменьшение мышечной массы, а также ухудшение силы и функции мышц. Термин был предложен к использованию еще в 80-х годах прошлого века, однако статус официально признанного заболевания получил в прошлом, 2019 году. Такое внимание к проблеме саркопении было продиктовано растущей продолжительностью жизни в мире, увеличением количества пожилых и необходимостью формирования более точных подходов к диагностике и лечению данного состояния. Для системы здравоохранения любой развитой страны очевидно, что граждане зрелого возраста хотят быть не только здоровы, но физически и социально активными.
Чем опасна саркопения?
Саркопения опасна не только нарушениями двигательной активности пациентов, приводящими к заболеваниям опорно-двигательного аппарата: остеопорозу, артрозу, переломам и др. Саркопения на сегодняшний день признана значимым фактором риска развития и прогрессирования сердечно-сосудистых заболеваний, иммунодефицита, сахарного диабета, хронического неспецифического воспаления. Являясь одним из важнейших гериатрических синдромов, саркопения обуславливает инвалидность и смертность у больных пожилого и старческого возрастов наряду с такими известными врагами здоровья, как избыточная масса тела, недостаточное потребление овощей и фруктов, курение и гиподинамия.
Каковы причины возникновения этого заболевания?
Основная причина развития саркопении банальна — возраст. В среднем к 65 годам человек теряет более 1/3 мышечной массы по сравнению с ее пиком, приходящимся на 20–30 лет. При снижении веса у пожилых людей до 1/4 потери массы тела приходится на мышечную массу, а набор веса происходит главным образом за счет жировой ткани. При быстрой потере массы тела могут происходить значительное снижение минеральной плотности костной ткани и повышение частоты переломов. Очень плохую службу здесь может оказать неправильное, несбалансированное похудение, особенно в зрелом возрасте. При сознательном снижении веса необходимо обязательно задаваться вопросом: «Не теряю ли я мышечную массу?» Чтобы этого не происходило, нужно поддерживать достаточную физическую активность и адекватное потребление белка в рационе.
Как понять, что процесс уже идет или приближается? Каковы симптомы?
Есть объективные, измеримые критерии диагностики саркопении, такие как кистевая динамометрия (измерения силы мышц кисти), тест 6-минутной ходьбы (какое расстояние пациент может пройти за 6 минут) и многие другие методы исследования, хорошо знакомые практикующим врачам. Однако особую важность представляет также субъективная оценка пациентом своих двигательных возможностей. Например, по неясным обстоятельствам привычные нагрузки стали восприниматься как более утомительные. Это очень важно, постарайтесь не пропустить момент, когда необходима помощь специалиста. Помимо физических проявлений (необъяснимая потеря массы тела, переутомление, выраженная слабость, медленная походка, низкая физическая активность) могут наблюдаться признаки снижения когнитивных функций и социальной активности. Все это не должно остаться незамеченным. Саркопения — обратимое состояние: чем раньше принять меры, тем эффективнее будет борьба с возрастными изменениями мышц.
Есть ли основные стадии развития этой болезни? И чем они характерны?
Да, эксперты разделяют течение саркопении на три стадии. Так, на первой стадии (пре-саркопения) отмечается только снижение мышечной массы без заметных клинических проявлений. На второй стадии снижение мышечной массы уже начинает вызывать тот или иной функциональный дефицит, то есть будет иметь место снижение мышечной силы или мышечной функции. На третьей стадии (тяжелая саркопения) имеют место все три проявления саркопении: снижены и масса мышц, и сила, и функция.
Как выявить и лечить саркопению, если она уже диагностирована?
Для оценки мышечной массы в клинической практике применяются двухэнергетическая рентгеновская абсорбциометрия, денситометрия (оценка плотности тканей организма), биоимпедансометрия (определение соотношения жировой и мышечной ткани), компьютерная или магнитно-резонансная томография.
Для оценки функции мышц специалистами применяются следующие методики: определение скорости ходьбы на короткое расстояние (4 метра), 5-кратное вставание со стула и возможность удержания равновесия в положении стоя в течение 10 секунд, 400 метров ходьбы на время или дальняя ходьба на время, лестничная проба, тест «встать и идти» (10 секунд), опросники, оценивающие устойчивость походки и частоту падений.
Каждый из указанных параметров «стоит» определенное число баллов. По итогам оценки доктор принимает решение о наличии диагноза «саркопения» у данного пациента.
Таблеток от саркопении пока нет. Рассматривается возможность применения витамина D, антагонистов гормона грелина, антицитокиновых препаратов, используемых в лечении ревматоидного артрита, однако это пока — скорее основание для проведения специально спланированных исследований. А вот что не подлежит сомнению, так это диета с достаточным содержанием белка (не менее 1–1,2 г/кг массы тела) и все виды физической активности: силовая, аэробная, упражнения на гибкость и равновесие. Все указанные виды физических упражнений в режиме умеренной, но регулярной активности способны помочь в борьбе с возрастным снижением мышечной массы и силы.
Возможно ли предотвратить эту болезнь? Что рекомендуется в качестве профилактических мер?
Не только возможно, но и очень желательно! Саркопению гораздо проще предотвратить, чем лечить. Диета с повышенным содержанием белка, а также регулярная физическая активность должны быть рекомендованы всем пациентам пожилого возраста с подтвержденным или предполагаемым диагнозом «саркопения». Чем раньше начать, тем дальше отодвинется развитие саркопении, проще говоря, старости как таковой. Все в наших руках!
Расскажите о необычных случаях из вашей практики.
На мой взгляд, заслуживают внимания случаи так называемого саркопенического ожирения. То есть общая масса тела в норме или даже превышена, а мышечной массы категорически не хватает. Более того, человек может сам придерживаться сомнительных рационов питания, как правило, жестких и несбалансированных по содержанию белка. Допустим, через месяц или два общая масса тела убывает, мы оцениваем состав тела и с сожалением отмечаем, что теряется не жировая масса, а мышечная. В связи с тем, что жировая масса практически инертна в отношении обмена веществ, такой пациент имеет риск вскоре набрать гораздо больше килограммов, чем он потерял, так называемый рикошетный набор веса. Поэтому очень важно худеть правильно, обратиться к специалисту и не потерять столь важную мышечную массу в попытке нормализовать массу тела.
У вас уже есть примеры исцеления или предотвращения болезни?
Конечно! Пожалуй, наиболее мне близкий и показательный пример — мой собственный дедушка, ему 91 год.
Очень отзывчивый пациент, следует практически всем рекомендациям в течение многих-многих лет. Ни одного его дня не проходит без утренней гимнастики, физическая и социальная активность — на запредельном уровне. Рацион иногда приходится корректировать, но в целом о пользе белка и овощей, а также о вреде быстрых углеводов он постоянно слышит от меня и, к моей радости, большую часть советов принимает. И хоть в рекомендациях по саркопении этого пункта нет, позволю добавить от дедушки и от себя: позитивный настрой очень важен в любом возрасте. В добром расположении духа физическая и социальная активность возрастают, а организм с благодарностью отвечает отменным здоровьем.
Саркопения у больных: возможности диагностики и перспективы лечения

Саркопения достаточно часто встречается в клинической практике. Она является независимым фактором риска развития осложнений, в том числе жизнеугрожающих. Предупреждение саркопении и перехода ее в кахексию является основной задачей лечения у различных кат
Sarcopenia is quite common in clinical practice. It is an independent risk factor for development of complications. Sarcopenia prevention and prevention of its transition into cachexy is a basic problem of treatment in different categories of patients, because cachexy is easier to prevent, and at irreversible stage cachexy is almost incurable.
Многие заболевания, как острые, так и хронические, сопровождаются непреднамеренной потерей массы тела. Результатом этого может быть развитие недостаточного питания или истощения. Согласно определению, недавно предложенному Европейским обществом по клиническому питанию (European Society for Clinical Nutrition and Metabolism, ESPEN, 2015), недостаточным питанием называется состояние, при котором в результате недостаточного поступления в организм или усвоения в нем питательных веществ отмечаются изменения в компонентном составе организма, в частности снижение тощей массы тела, приводящие к нарушению физических и психических функций организма, ухудшающие клинический исход заболевания [1]. Ранее нами было предложено похожее определение недостаточности питания как «патологического состояния, обусловленного несоответствием поступления и расходов питательных веществ, приводящим к снижению массы тела и изменению компонентного состава организма» [2].
Компонентный состав организма в упрощенном виде состоит из двух частей — жировой массы и так называемой «тощей» или безжировой массы. При углубленном рассмотрении состав тощей массы неоднороден, в нее входят вода, мышечная масса, кости, кожа, внутренние органы [3].
Возможности детального анализа компонентного состава тела раньше были весьма ограничены. В настоящее время диагностические возможности существенно расширились. Для анализа многокомпонентного состава организма используются такие инструментальные и высокотехнологичные методы, как биоимпедансометрия, компьютерная и магнитно-резонансная томографии, рентгеновская абсорбциометрия, денситометрия и др. Они позволяют как качественно, так и количественно оценить точное содержание жира, мышечной массы, костей, воды в различных частях организма. Недавно был разработан метод периферической количественной компьютерной томографии [4, 5].
Благодаря новым техническим возможностям сегодня стало возможно оценить влияние изменений отдельных компонентов состава организма на течение и исход заболеваний. Было установлено, что снижение мышечной массы тела имеет большее прогностическое значение, чем изменения в количестве жировой ткани. Также было показано, что изменения в тощей и мышечной массе тела у больных часто опережают снижение общей массы тела.
В настоящее время определяющее значение в оценке тяжести, динамике течения и прогнозе заболевания имеет наличие и степень выраженности мышечного истощения (саркопении) у больных. Термин «саркопения» (от греческих слов sarx — мясо, плоть и penia — недостаток) был предложен профессором из США Ирвином Розенбергом (Irwin Rosenberg) в 1988 г. [6]. Предлагались и другие термины, обозначающие дефицит мышечной массы: миопения, кратопения, динапения и др. [7, 8].
Согласно Европейскому консенсусу по саркопении (2010), под этим термином понимают уменьшение мышечной массы тела и снижение функции мышц (силы и производительности), обусловленные возрастными нейрогуморальными сдвигами, нарушениями питания или мышечным катаболизмом [9, 10].
В сентябре 2016 г. диагноз «саркопения» был официально включен в дополненную 10-ю международную классификацию болезней (МКБ-10) под кодом М 62.84 [11].
Причины развития саркопении разнообразны. Она может возникнуть вследствие естественных инволютивных (старческих) изменений в организме, длительного голодания, нарушений питания, мальабсорбции и т. п. Саркопения часто наблюдается при хронических сердечно-сосудистых заболеваниях, сопровождающихся недостаточностью кровообращения, хронических болезнях легких с дыхательной недостаточностью, тяжелых поражениях печени и почек (циррозы, нефриты и т. п.), нейродегенеративных заболеваниях (болезнях Альцгеймера, Паркинсона, рассеянном склерозе и др.), различных видах рака, а также при кахексии любого происхождения. Кроме того, саркопения развивается при длительном постельном режиме, малоподвижности, в невесомости (у космонавтов), а также при дефиците стероидных половых гормонов, в частности тестостерона, а также гормона роста.
Саркопения часто встречается в клинической практике [12]. Так, при хронических сердечно-сосудистых и бронхолегочных заболеваниях распространенность саркопении в 2 раза выше, а при циррозах печени — в 18–50 раз выше, чем недостаточности питания (табл. 1).
По оценкам международных экспертов, саркопения станет к 2045 г. общемировой проблемой [13]. Это связано со старением населения нашей планеты, увеличением продолжительности жизни, а следовательно, числа лиц пожилого и старческого возраста. По оценкам международных экспертов, число пожилых людей в мире с 2000 по 2050 гг. возрастет с 600 млн до 2 млрд человек. Распространенность саркопении в мире при этом вырастет на 70% — с 19 млн (в 2016 г.) до 32 млн человек (в 2045 г.).
В патогенезе развития саркопении у больных, находящихся как в стационарах, так и на дому, имеет место так называемый «порочный круг», когда заболевание и постельный режим сопровождаются потерей аппетита и развитием нарушений питания, в частности саркопении, а она, в свою очередь, приводит к снижению двигательной активности, постельному режиму и потере аппетита (рис. 1).
Рис. 1. Порочный круг саркопении
В последнее время установлено, что саркопения имеет определенное значение для прогноза течения и исхода заболевания, особенно у тяжелобольных. Показано, что за 10 суток нахождения больного в отделении реанимации он теряет около 17% массы мышц бедра. При этом величина снижения мышечной массы прямо коррелирует с тяжестью полиорганных нарушений. При потере от 5% до 10% массы мышц отмечается нарушение функции одного органа, от 10% до 20% — двух или трех органов, свыше 20% мышечной массы — четырех органов [14].
Таким образом, саркопения является независимым фактором риска развития осложнений, в том числе и жизнеугрожающих, таких как сепсис или полиорганная недостаточность. Установлено, что саркопения является независимым прогностическим фактором развития осложнений после радикальных операций при раке желудка и раке легких. В последнее время отмечается, что именно саркопения является основной причиной госпитализации, инвалидизации и смертности больных [15–17].
Если саркопения сопровождается критической потерей не только мышечной, но и жировой массы, она неизбежно переходит в форму кахексии (рис. 2) [18]. Под кахексией в настоящее время понимают тяжелое истощение, вызванное катаболизмом на фоне системной воспалительной реакции в организме [19]. Она наблюдается у многих пациентов с тяжелыми заболеваниями (сердечная, почечная, печеночная, раковая кахексии). Тяжелая кахексия характерна и для развернутой клинической картины СПИДа в 4-й и 5-й стадиях болезни [20].
При сочетании саркопении (потери мышц) с увеличением жировой массы развивается так называемое «саркопеническое ожирение». Такая форма саркопении наблюдается часто у лиц с резко выраженным ожирением, у пожилых и у больных, длительно находящихся на постельном режиме. Так, в проведенном во Франции исследовании EPIDOS показано, что у лиц до 70 лет саркопеническое ожирение наблюдалось в 10–12% случаев, в то время как у лиц старше 80 лет — уже у 15–27% [21].
В настоящее время для диагностики саркопении используются скрининговые и инструментальные методы. При этом оценивают как размеры (объем) мышечной ткани в организме, так и функцию мышц (мышечную силу и работоспособность). Для первичной скрининговой оценки наличия или отсутствия саркопении у больных сегодня используют достаточно простую шкалу оценки SARC-F [22]. В ней оцениваются такие показатели, как подъем груза, ходьба по комнате, вставание с кровати, подъем по лестнице, непроизвольные падения (табл. 2). Саркопения предполагается при наличии четырех и более баллов.
Для более точной диагностики наличия саркопении у пациентов используют такие инструментальные методы, как биоимпедансный анализ компонентного состава организма, компьютерную и магнитно-резонансную томографии, рентгеновскую абсорбциометрию, а в последнее время — и ультразвуковое исследование [18, 23].
Наиболее простым способом оценить состояние мышц является измерение окружности плеча и толщины кожно-жировых складок с последующим расчетом окружности мышц плеча. Затем по специальным формулам можно вычислить площадь мышц плеча и общую мышечную массу тела. При всей доступности антропометрического метода он является наименее точным и достаточно субъективным, так как зависит от навыка и мастерства исследователя. Кроме того, состояние мышц плеча не всегда отражает общую мышечную массу, в частности, объем мышц нижних конечностей.
В настоящее время для оценки компонентного состава организма достаточно широко используют метод биоимпедансометрии. Он основан на измерении сопротивления при прохождении слабого электрического тока через ткани организма. С помощью современных аппаратов для биоимпедансометрии можно достаточно точно определить содержание тощей и мышечной массы тела, активной клеточной массы и общее содержание белка в организме. Наличие саркопении устанавливается с помощью индекса тощей массы тела (табл. 3).
Вторым по частоте использования в клинической практике инструментальным методом является двухэнергетическая рентгеновская абсорбциометрия (DXA). Этот метод является относительно недорогим и отличается небольшой лучевой нагрузкой на пациента. С его помощью можно определить так называемый скелетно-мышечный индекс, основанный на суммарном измерении мышечной массы двух верхних и двух нижних конечностей.
Компьютерная и магнитно-резонансная томографии позволяют определить скелетно-мышечную массу на уровне третьего поясничного позвонка (L3) и оценить наличие или отсутствие саркопении, рассчитав так называемый поясничный скелетно-мышечный индекс (табл. 3). Кроме того, этими методами можно точно определить общую тощую массу тела [24].
Существенно снизить лучевую нагрузку на пациента позволяет метод периферической количественной компьютерной томографии (pQCT), при котором измеряется мышечный массив в одной конкретной конечности [25].
Ультразвуковым методом можно неинвазивно и без лучевой нагрузки для пациента точно измерить объем конкретной мышцы. Метод относительно недорог и может использоваться у лежачих больных [26].
Для оценки наличия или, наоборот, отсутствия саркопении необходимо оценить не только размеры, но и функцию мышц. Для этого используют динамометрию кистей рук, а в самое последнее время — и измерение силы мышц ног (квадрицепсов). Критерием снижения мышечной силы является выжимание ручным динамометром менее 30 кг для мужчин и менее 20 кг для женщин [23]. Важным показателем физической выносливости является скорость ходьбы. Для этого проводят 4-метровый тест. Критерием саркопении как у мужчин, так и у женщин является скорость ходьбы менее 0,8 м в секунду.
При наличии таких критериев, как снижение веса, саркопения, мышечная слабость (по динамометрии) и замедленная походка, устанавливается наличие синдрома «разбитости» (frailty syndrome) [27]. За рубежом для комплексной диагностики функционального состояния пациента и наличия или отсутствия саркопении проводят многоуровневый тест SARFRAIL [28].
До определенной стадии саркопения вполне обратима, за исключением возрастных инволютивных изменений. Для лечения саркопении используют усиленное белковое питание, стероидные и нестероидные анаболические средства, а также движение и физические упражнения.
Для профилактики и лечения саркопении необходимо увеличить синтез (анаболизм) и замедлить распад (катаболизм) белков в организме. С пищей в наш организм ежедневно поступает около 50–100 г белка, в то время как синтезируется и распадается у взрослого человека около 300 г белка в сутки. Поскольку белково-энергетическая недостаточность и нарушение синтеза белка всегда имеют место при саркопении, необходимо увеличить потребление белка до 1,2–1,5 г на кг массы тела в сутки. Для этого в последнее время используется дополнительное энтеральное питание, назначаемое перорально в виде жидких питательных смесей, выпиваемых медленно, со скоростью 100–200 мл в течение часа, так называемый пероральный сипинг [29].
В качестве дополнительного энтерального питания применяются сбалансированные питательные смеси, обогащенные как растительным, так и животным (молочным) белком. Жировой их компонент представлен комбинацией нескольких видов растительных масел (рапсового, подсолнечного, соевого, кокосового) и рыбьего жира, а углеводы — мальтодекстрином с высоким содержанием полисахаридов в виде крахмала. Также они содержат все необходимые витамины, макро- и микроэлементы (кальций, цинк, медь, железо, йод, фтор, хром, марганец, молибден, селен). Примером таких смесей может быть энтеральное питание Нутрикомп.
Для преодоления анаболической резистентности используются возможности таргетной фармакотерапии. Используются нестероидные и стероидные анаболические средства. Поскольку мужской половой гормон тестостерон влияет на пролиферацию и дифференцировку мышечных клеток, увеличивая синтез и уменьшая распад белка, таким образом увеличивая мышечную массу, силу и производительность, применяются синтетические аналоги тестостерона — стероидные анаболические средства, например, нандролон (Ретаболил). Эти препараты строго запрещены у спортсменов, так как относятся к допинговым средствам. Этой категории лиц, а также остальным пациентам могут быть беспрепятственно назначены нестероидные анаболические и энерготропные средства, в первую очередь левокарнитин (L-карнитин).
Карнитин в организме содержится в основном в мышечной ткани (95%). При его дефиците отмечается выраженная мышечная слабость, катаболизм белков мышц [30]. Показано, что прием L-карнитина приводит, в том числе, к увеличению содержания в крови анаболических гормонов, в частности, тестостерона и инсулиноподобного фактора роста [31]. При этом он не относится к запрещенным, допинговым средствам и может использоваться у спортсменов [32]. В нашей стране уже более 10 лет широко используется фармакологический препарат L-карнитина Элькар, назначаемый как перорально, так и парентерально. У больных с раковой саркопенией и кахексией карнитин снижает оксидативный стресс, подавляет выработку провоспалительных цитокинов, уменьшает атрофию мышц и мышечную слабость [33].
При переходе саркопении в стадию кахексии по показаниям назначают противовоспалительные (прогестины, глюкокортикоиды, каннабиноиды), антицитокиновые препараты (бимагрумаб, этанерцепт, талидомид и др.), а также гормон роста. В перспективе рассматривают возможность применения ингибиторов протеасом, антагонистов миостатина, аналога грелина — анаморелина [34, 35].
Большое значение при лечении саркопении имеет достаточная двигательная и физическая активность. Она способствует активизации анаболических процессов в организме, росту массы мышц и увеличению их силы и производительности. Показано, что физические упражнения увеличивают выработку инсулиноподобного фактора роста в организме в 4 раза [36, 37].
Результатом лечения саркопении должен быть не просто рост тощей (мышечной) массы тела, но и увеличение функции мышц, т. е. их силы и производительности, а также улучшение качества жизни больных.
Выводы
Саркопения достаточно часто встречается в клинической практике среди различных категорий терапевтических и хирургических пациентов.
Саркопения является независимым фактором риска развития осложнений, в том числе жизнеугрожающих, таких как сепсис и полиорганная недостаточность.
Диагноз «саркопения» с сентября 2016 г. официально включен в Международную классификацию болезней 10-го пересмотра (МКБ-10) под кодом М 62.84.
Для диагностики саркопении у пациентов используют скрининговые опросники, а также такие инструментальные методы, как биоимпедансный анализ компонентного состава организма, компьютерную и магнитно-резонансную томографии, двойную рентгеновскую абсорбциометрию, ультразвуковое исследование.
Для профилактики и лечения саркопении используют как усиленное по белку и энергии питание с включением сбалансированных энтеральных питательных смесей, так и стероидные или нестероидные анаболические средства, в том числе L-карнитин, а также физические упражнения.
Результатом лечения должно быть не просто увеличение массы мышц, но и повышение их функции, т. е. силы и производительности, а в итоге — улучшение качества жизни больных.
Предупреждение саркопении и перехода ее в кахексию является основной задачей лечения у различных категорий больных, поскольку кахексию проще предупредить, а в необратимой стадии кахексия практически неизлечима.
Литература
И. Е. Хорошилов, доктор медицинских наук
ФГБОУ ВО СЗГМУ им. И. И. Мечникова МЗ РФ, Санкт-Петербург
Саркопения глазами эндокринолога
Полный текст:
Аннотация
Одним из синдромов, существенно влияющим на состояние здоровья и жизнь пациента, является саркопения. Саркопения – это мультиэтиологичный синдром со сложным, недостаточно изученным патогенезом, в котором эндокринные факторы играют одну из ведущих ролей. Коморбидность пожилых пациентов создает трудности дифференциальной диагностики имеющейся патологии. Сочетание саркопении с различными эндокринными патологиями, такими как ожирение, остеопороз, гипотиреоз, гипопаратиреоз, дефицит витамина D, приводит к более тяжелому течению заболеваний и худшему прогнозу для качества и продолжительности жизни пациента. При этом вторичный генез саркопении в ряде ситуаций может позволить улучшить состояние пациента путем оценки патогенетических причин и их устранения.
Таким образом, эндокринологу следует уделять более пристальное внимание синдрому саркопении и его коррекции, а также мерам его профилактики на самых ранних стадиях.
Ключевые слова
Для цитирования:
Мокрышева Н.Г., Крупинова Ю.А., Володичева В.Л., Мирная С.С., Мельниченко Г.А. Саркопения глазами эндокринолога. Ожирение и метаболизм. 2018;15(3):21-27. https://doi.org/10.14341/omet9792
For citation:
Mokrysheva N.G., Krupinova J.A., Volodicheva V.L., Mirnaya S.S., Melnichenko G.A. A view at sarcopenia by endocrinologist. Obesity and metabolism. 2018;15(3):21-27. (In Russ.) https://doi.org/10.14341/omet9792
Эпидемиология
Распространенность саркопении в популяции по разным источникам варьирует от 4,3% до 73,3% и зависит от возрастных критериев включения и особенностей исследуемых групп (пациенты, получающие амбулаторную помощь, и жители домов престарелых имеют значимые отличия). Чаще встречаются данные о распространенности в диапазоне 5–13% среди лиц 60–70 лет и на уровне 50% – в группе старше 80 лет [3, 4]. В российской популяции частота составила 13% у пациентов старше 85 лет [5].
Этиология
Этиологически саркопению разделяют на первичную и вторичную. Первичную саркопению рассматривают в рамках возрастных изменений мышечной ткани, вторичную – как следствие других заболеваний и патологических состояний (онкологической патологии, сахарного диабета (СД) 2 типа, хронической сердечной недостаточности, гиподинамии и прочего, а также вследствие приема некоторых лекарственных препаратов).
Также обсуждается и генетическая предрасположенность к саркопении. Например, доказана связь генов ACE (кодирует ангиотензинпревращающий фермент), ACTN3 (кодирует альфаактинин 3), MSTN (кодирует миостатин), CNTF (кодирует цилиарный нейротрофический фактор), IGF1 (кодирует ИФР-1), IL-6 (кодирует интерлейкин 6) и VDR (кодирует рецептор витамина D) с силой и/или массой мышечной ткани. Особый интерес для изучения представляют такие гены-кандидаты, как GREM1 (кодирует Gremlin1), TRHR (кодирует рецептор тиреотропин-рилизинг гормона), ACVR1B (кодирует рецептор активина 1B). В ряде двойных слепых исследований продемонстрировано, что наследуемость некоторых показателей мышечной массы и силы достигает 80% [6, 7].
Патогенез
Саркопения – это мультиэтиологичный синдром со сложным патогенезом, в котором эндокринные факторы играют одну из ведущих ролей. Патогенез данного состояния изучен недостаточно, однако уже известно, что на развитие саркопении значимое влияние оказывает снижение уровня гормона роста (ГР), инсулиноподобного фактора роста-1 (ИФР-1), половых гормонов, витамина D, инсулинорезистентность. В то же время активно изучаются такие факторы, способствующие развитию саркопении, как особенности образа жизни (качество питания, физическая активность, иммобилизация) и пищевой статус. Снижение последнего приводит к недостаточному синтезу белка, развитию дегенеративных процессов, митохондриальной дисфункции и атрофии мышечных волокон, вследствие чего происходит потеря мышечной массы и силы [8]. На развитие саркопении также может влиять течение гестационного периода матери, окружающая среда в раннем детском возрасте, вес тела при рождении и в младенчестве, который прямо связан с мышечной массой и ее функциональными возможностями в старшем возрасте [6].
В основе патогенеза саркопении лежит утрата мышечной массы. Зрелые мышечные волокна состоят из многоядерных клеток, неспособных к делению, поэтому рост и регенерация мышц происходят за счет пролиферации клеток-сателлитов. При саркопении в первую очередь снижается количество клеток-сателлитов и волокон II типа, приводя к невозможности совершения пациентом быстрых движений [9]. Будучи ключевым звеном большинства клеточных процессов (обеспечение энергией, регуляция внутриклеточного гомеостаза кальция, активация клеточной пролиферации), митохондриальная дисфункция и дальнейшая потеря целостности митохондрий в миоцитах приводят к снижению окислительной способности, нарастанию уровня оксидативного стресса, повреждению клеток и развитию атрофии мышечных волокон (рис. 1).
Рис. 1. Этиология и патогенез саркопении.
Значительную роль играют системное воспаление, трансформация митохондрий и их взаимное усиление дегенеративного влияния на мышцы. В скелетных мышцах происходит повреждение транспортной цепи электронов, которое может определяться фокально в миоцитах или в дискретных областях отдельной клетки, и приводит к снижению активности цитохрома С-оксидазы и повышению активности сукцинатдегидрогеназы (СДГ) [10].
Доказательства, подтверждающие ключевую роль мутаций митохондриальной ДНК (мтДНК) в патогенезе старения, были получены в эксперименте на животных моделях, у которых имела место ошибка считывания в мтДНК-полимеразе γ (PolG), что проявлялось преждевременным старением, характеризующимся алопецией, кифозом, потерей слуха, остеопорозом, саркопенией и сокращением продолжительности жизни. У этих мышей накапливались соматические мутации мтДНК и демонстрировали системную дисфункцию митохондрий, включая снижение функции дыхательной цепи, ускоренный апоптоз в постмитотических тканях, при этом повышенного уровня окислительного стресса у них не наблюдалось. Интересно, что делеции мтДНК локализуются совместно с мутациями транспортной цепи электронов и при повышении определенного порога значений приводят к нарушению ее активности. В целом эти данные подтверждают гипотезу о том, что делеции мтДНК, накапливаясь в мышечных волокнах, компрометируют митохондриальную биоэнергетику и способствуют развитию атрофии мышц [10].
Другой путь, регулирующий метаболизм митохондрий во время старения, включает ИФР-1. Этот путь осуществляется путем фосфорилирования АТФ-цитрат-лиазы, фермента, катализирующего митохондриальное производное цитрат в оксалоацетат и ацетил-КоА. Предполагается, что возрастное снижение уровня ИФР-1 может нарушать митохондриальную активность посредством снижения АТФ-цитрат-лиазы, способствуя развитию саркопении [10].
Наличие воспалительной реакции также тесно связано с риском развития саркопении. Повышение фактора некроза опухоли-α способствует развитию воспаления через активацию ядерного фактора k-B, что приводит к потере мышечной массы (см. рис. 1) [11].
Таким образом, ИФР-1, механизмы контроля качества митохондрий и воспалительный путь являются основными звеньями, контролирующими мышечную массу.
Повреждения на любом уровне контроля состояния митохондрий сохраняются на протяжении их жизни, таким образом накапливаются поврежденные органеллы. Как следствие, увеличение отношения AMФ/ATФ и оксидативный стресс активируют катаболический путь, который приводит к атрофии мышц. Этот путь включает в себя как посредников, связанных с аутофагами, так и индукторов мышечного катаболизма (MuRF-1, атрогин), приводящих к деградации митохондрий и белка для обеспечения альтернативных источников энергии [11].
В исследовании, изучавшем взаимосвязь скелетной мышечной массы с сохранностью капиллярной сети при старении, сравнивались данные гистологического исследования мышечной ткани между группами молодых здоровых лиц (средний возраст – 22 года, мужчины (n=14), женщины (n=5)) и пожилых лиц (средний возраст – 74 года, мужчины (n=22), женщины (n=6)). Степень мышечной капилляризации и распределения капилляров определяли методом капиллярных доменов. Окислительную способность мышечных волокон оценивали с помощью количественной гистохимии. Обеспечение капиллярами волокон определялось главным образом размером волокна и лишь в малой степени окислительной способностью. Несмотря на атрофию волокон II типа на 18% (p=0,019) и снижение количества капилляров на одну клетку на 23% (р 10,75 кг/м²
Вместе с тем биоимпедансный метод исследования недостаточно точен, особенно у пациентов с заболеваниями, проявляющимися отечным синдромом (хроническая сердечная недостаточность, почечная недостаточность и лимфедема). Антропометрические измерения, такие как окружность икроножной мышцы или толщина кожной складки, неточны главным образом потому, что ожирение, отеки, а также изменения в жировой ткани и потеря эластичности кожи, связанные с возрастом, снижают специфичность метода в оценке мышечной массы. Они не рекомендуются для использования в целях диагностики саркопении, но могут быть альтернативными в случае отсутствия других методов [16, 18]. Антропометрический метод недостаточно информативен и при саркопеническом ожирении, включающем критерии саркопении и увеличение объема подкожной жировой клетчатки у мужчин ≥25%, у женщин ≥35%. При данном состоянии наблюдается жировое перерождение клеток-сателлитов, жировая инфильтрация мышц, которые способствуют снижению силы нижних конечностей и гиподинамии – возникает порочный круг. Однако на данный момент невозможно оценить, что развивается первично: саркопения или ожирение, так как при ожирении наблюдается хроническое воспаление, которое, в свою очередь, приводит к снижению мышечной массы и силы [16].
Остеосаркопения
Остеосаркопения – это относительно новое понятие, включающее в себя сочетание низкой мышечной массы и сниженной минеральной плотности костной ткани (МПК), связанное со старением и общим патогенезом [19]. Учитывая повышение риска развития как саркопении, так и остеопороза у пожилых лиц, требуется оценка состояния мышечной ткани у таких пациентов [20].
Состав тела пациентов с остеосаркопенией характеризуется снижением мышечной массы, МПК, ИМТ и индекса общего жира по сравнению с пациентами с изолированным остеопорозом или саркопенией. Клинические проявления остеосаркопении характеризуются слабостью, низкой скоростью ходьбы, потерей подвижности. В настоящее время отсутствуют специфические маркеры остеосаркопении, однако отмечено, что у пациентов с данной патологией уровень тестостерона, витамина D и гемоглобина ниже, чем у пациентов с изолированным остеопорозом или саркопенией.
Помимо возраста, существует ряд других факторов, которые способствуют развитию остеосаркопении. Генетические полиморфизмы GLYAT, METTL21C, MSTN, ACTN3 PGC-1α и MEF-2C связаны с потерей костной и мышечной ткани. Эндокринные заболевания (в основном СД, нарушение функции щитовидной железы и низкий уровень витамина D, половых гормонов, ГР, ИФР-1), алиментарная недостаточность, ожирение и прием кортикостероидов также влияют на развитие остеосаркопении [19]. Отмечено, что саркопения и мышечная слабость, так же как и частота переломов, встречаются чаще у пациентов с СД 2 типа, чем у здоровых людей [21].
Жировая инфильтрация мышц у пожилых вносит свой вклад в развитие остеосаркопении, что, возможно, связано с отрицательным воздействием продукции воспалительных цитокинов костным мозгом и жировой тканью. Установлено, что пациенты с саркопенией и остеопенией имеют высокие концентрации воспалительных цитокинов, преобладание интерлейкина-6 (IL-6) и фактора некроза опухолей альфа (ФНО-α), которые связаны как с системной, так и с локальной липотоксичностью. Кроме того, изменения в костном мозге тесно ассоциированы с изменениями мышечной массы. Скелетная и мышечная ткань взаимодействуют механически, физически, а также биохимически посредством паракринных и эндокринных факторов. В этом процессе существует много возможных путей, которые могут объяснить развитие и прогрессирование остеосаркопении. Один из них включает остеокальцин, который стимулирует пролиферацию β-клеток, секрецию инсулина и действует непосредственно на скелетную мышцу, коррелируя с мышечной силой. Другим внутренним механизмом, связывающим мышцы и кость, является секреция сосудистого эндотелиального фактора роста (VEGF) с помощью мезенхимальных стромальных клеток костного мозга, что стимулирует пролиферацию миобластов. Мышцы также секретируют несколько гормонов и активных веществ, влияющих на кость, таких как ИФР-1, остеоглицин, ирисин, остеонектин, фактор роста фибробластов-2, IL-6, IL-15 и миостатин. Миостатин является членом надсемейства бета-трансформирующего фактора роста, экспрессируемого в основном в скелетных мышцах. Изучен его эффект на рост мышц и влияние на кость. Дефицит гена MSTN и системное введение ACVR2B-Fc (inhibitor of the Activin Receptor 2B – блокатора рецептора активина 2B) приводят к гипертрофии мышечной ткани и увеличению костной массы [18]. Мышечная ткань также секретирует декорин, который, связывая миостатин, способствует росту мышечной ткани. Обнаружен и его противоопухолевый эффект. При изучении генетически модифицированных животных с выключенным геном DCN, кодирующим декорин, зафиксирован спонтанный рост опухолей. Однако влияние этого белка на физиологию человека изучено недостаточно.
Постменопаузальная остеосаркопения, развитие которой обусловлено генетическими факторами, изменением состава тела, низкой физической активностью, дефицитом эстрогенов и витамина D, приводит к снижению мышечной массы, силы, функциональных возможностей, а также к снижению МПК, что в сочетании с коморбидностью пожилых пациентов реализуется в увеличении частоты переломов, инвалидизации и смертности [20].
Также существует такое понятие как остеосаркопеническое ожирение, критериями которого являются снижение МПК по Т-критерию ≤-1,0 SD по данным DXA, снижение ИТМ 1 (для андроидного типа ожирения) или 2,34 мг/дл), гликемии (>112 мг/дл), а также более высокий риск переломов (FRAX>15%, r=0,316; p 30 нг/мл (50 нмоль/л) [18]. Баланс между витамином D и паратиреоидным гормоном (ПТГ) является ключевым регулятором мышечной силы: ПТГ способен модулировать работу мышечной ткани через увеличение внутриклеточного кальция.
Лечение и профилактика саркопении
В настоящее время отсутствует специфическое лечение саркопении, первичной является профилактика. Физические упражнения, особенно постепенно увеличивающиеся силовые нагрузки, являются стимулом для синтеза мышечного белка. Выполнение физических упражнений в течение минимум 20 минут в неделю значительно повышает мышечную и костную массу, силу, снижает функциональные ограничения, предотвращает падения и переломы у пожилых людей. Однако у пациентов с тяжелыми сопутствующими заболеваниями (такими как нейрокогнитивные и сердечные-сосудистые патологии) могут возникнуть сложности в достижении рекомендуемого уровня физической активности [18].
В ходе мета-анализа, включившего 37 исследований, 34 рандомизированных клинических исследования, оценивали влияние физических упражнений на мышечную массу у пожилых людей (почти в 80% случаев мышечная масса увеличилась с помощью физических упражнений). Влияние дополнительного питания на мышечную массу было зафиксировано только в 23,5% случаев. Мышечная сила увеличилась в 82,8% исследований после повышения физической активности, а пищевые добавки показали дополнительные преимущества только в небольшом количестве исследований (22,8%). Таким образом, физические упражнения оказывают положительное влияние на мышечную массу и силу или физическую работоспособность у здоровых лиц в возрасте от 60 лет и старше [24].
Белок пищи оказывает косвенное влияние на ключевые регуляторные белки и факторы роста, связанные со здоровьем мышц и костей, за счет увеличения абсорбции кальция, подавления ПТГ и увеличения секреции ИФР-I (костного и мышечного анаболического стимулятора). Потребление белка более 0,8 мг/кг массы тела в день, в основном животного происхождения, усиливает анаболизм мышечного белка наряду с защитой от возрастной потери мышц и костной ткани. У пациентов в возрасте 70–79 лет содержание белка в пище в количестве 1,1 г/кг массы тела в день приводит к отсутствию мышечной потери при 3-летнем наблюдении.
ESCEO рекомендует потребление белка с пищей от 1,0 до 1,2 г/кг массы тела в день, минимум 20–25 г чистого белка в каждой порции. Европейское общество клинического питания и обмена веществ (ESPEN) и Исследовательская группа PROT-AGE рекомендуют такое же потребление белка для здоровых людей старшего возраста, от 1,2 до 1,5 г/кг массы тела в день, а для пациентов с тяжелыми заболеваниями и недостаточным питанием – свыше 2 г/кг в сутки [18]. Пациенты с хронической болезнью почек (ХБП) додиализных стадий для профилактики саркопении должны снизить потребление белка до 0,2–0,5 г/кг в сутки (при СКФ <20 мл/мин/1,73 м²) вследствие возможного развития метаболического ацидоза [25]. Кроме того, потребление белка совместно с физическими упражнениями улучшает синтез мышечного белка и положительно влияет на состав тела, способствуя снижению жировой массы, увеличению или поддержанию мышечной ткани и сохранению кости [18] (табл. 2).
Таблица 2. Рекомендуемое количество потребления белка в сутки различным группам людей
Количество потребляемого белка в сутки, г/кг массы тела
Пресс-центр
Саркопения: как придумали новое имя для древней болезни

Саркопения в настоящее время – это гериатрический синдром, который признан фактором риска развития и прогрессирования многих заболеваний, повышения риска падений и переломов, снижения возможностей тела.
Точно выяснить, какие у пожилого человека гериатрические синдромы, могут врачи-гериатры. Так, врачи Республиканского гериатрического центра, который открылся в 2019 году на базе Госпиталя в рамках федерального проекта «Старшее поколение» национального проекта «Демография» в Чувашской Республике, уже несколько лет ведут приём лиц пожилого и старческого возраста.
Почему возникает саркопения?
Основная причина – возраст. Набор веса у пожилых людей происходит главным образом за счет жировой ткани, а потеря веса часто приходится на утрату до 1/4 мышечной массы. При быстрой потере массы тела могут происходить значительное снижение минеральной плотности костной ткани и повышение частоты переломов. Плохую службу здесь может оказать неправильное, несбалансированное похудение в зрелом возрасте.

Практикующие врачи пользуются объективными и измеримыми критериями диагностики саркопении. Среди них: кистевая динамометрия (измерения силы мышц кисти), тест 6-минутной ходьбы (какое расстояние пациент может пройти за 6 минут) и другие методики. О вашем организме многое расскажут следующие упражнения: 5-кратное вставание со стула и возможность удержания равновесия в положении стоя в течение 10 секунд, 400 метров ходьбы на время или дальняя ходьба на время, лестничная проба, тест «встать и идти» (10 секунд), опросные листы, оценивающие устойчивость походки и частоту падений. Каждый из указанных параметров оценивается баллами. По итогам подсчёта доктор принимает решение о наличии диагноза «саркопения» у конкретного пациента.
Не менее важна субъективная оценка пациентом двигательных возможностей своего тела. Например, по неясным обстоятельствам привычные нагрузки стали восприниматься как более утомительные. Это очень важно, постарайтесь не пропустить момент, когда необходима помощь специалиста. Помимо физических проявлений (необъяснимая потеря массы тела, переутомление, выраженная слабость, медленная походка, низкая физическая активность) могут наблюдаться признаки снижения когнитивных функций и социальной активности. Все это не должно остаться незамеченным. Саркопения — обратимое состояние: чем раньше принять меры, тем эффективнее будет борьба с возрастными изменениями мышц.
Есть ли основные стадии развития этой болезни? И чем они характерны?
Эксперты разделяют течение саркопении на три стадии. Так, на первой стадии (пре-саркопения) отмечается только снижение мышечной массы без заметных клинических проявлений. На второй стадии снижение мышечной массы уже начинает вызывать тот или иной функциональный дефицит, то есть будет иметь место снижение мышечной силы или мышечной функции. На третьей стадии (тяжелая саркопения) имеют место все три проявления саркопении: снижены и масса мышц, и сила, и функция.
Профилактика недуга
С недавнего времени саркопению стали относить к разряду патологий, с которыми нужно и можно бороться и о профилактике которых нужно заботиться. В настоящее время первичной является профилактика, а специфическое лечение отсутствует.
Важны: физические упражнения, достаточный объём белка в пище, витамин D и кальций.
Саркопению проще предотвратить или замедлить, чем лечить. Диета с повышенным содержанием белка, а также регулярная физическая активность должны быть рекомендованы пациентам пожилого возраста с подтвержденным или предполагаемым диагнозом «саркопения». Чем раньше начать, тем дальше отодвинется развитие саркопении, проще говоря, старости как таковой.
Саркопения
Определение.
Эпидемиология. Распространенность саркопении среди людей пожилого и старческого возраста в составляет от 15 до 50%.
Медико-социальные последствия саркопении:
1. Клинико-социальные (нарушение равновесия, гипомобильность, падения).
2. Социальные (увеличение общего уровня нетрудоспособности, увеличение риска и тяжести инвалидности, снижение жизненной активности, снижение функциональности, увеличение зависимости от посторонней помощи, снижение качества жизни).
Саркопения и ее проявления при преждевременном старении. Процессы преждевременного старения ассоциированы с повышенным риском развития и распространенности саркопении у людей не только пожилого, но и среднего возраста. Саркопения ассоциирована не только с ощущением усталости, снижением переносимости физических нагрузок, повышенной утомляемости, но и с эстетическими проблемами, которые проявляются в виде дряблости крупных мышц, потери эластичности кожи в их зоне, изменение осанки (сутулость), нарушение равновесия, формирование т.н. старческой походки, синдрома возрастной стопы и возрастной кисти, синдрома падений. В многочисленных исследованиях показана взаимосвязь саркопении и остеопороза, что в случае падений и травм повышает риск развития переломов. Если наблюдается только снижение мышечной массы, это состояние часто называют пресаркопенией, тогда как под саркопенией понимают уменьшение и объема, и силы мускулатуры.

Этиопатогенез саркопении.
В основе развития саркопении лежит шесть патогенетических механизмов: алиментарные факторы; возрастные изменения гормонального фона; изменение функции мышечной ткани как белкового депо; снижение способности мышечной ткани к регенерации; нарушение сигнального молекулярного взаимодействия; неврологические причины.
Саркопения как патология алиментарного генеза. В силу ряда физиологических особенностей пожилого организма (гиперлептинемия, нарушения моторики желудочно-кишечного тракта и пр.) в возрасте старше 60 лет формируется прогрессирующий феномен быстрого насыщения, в результате которого снижается потребление белка. Считается, что оптимальное количество потребляемого белка должно составлять 0,8 г/кг/день, но не менее 15% людей в возрасте старше 60 лет потребляют менее 75% от рекомендованного значения суточного количества белка. Обсуждается также роль ухудшения качества питания у пожилых лиц, что приводит к снижению поступления веществ, необходимых для обеспечения мышц, например, креатина.
Возрастные изменения гормонального фона. В снижении мышечной массы большое значение придается снижению уровня соматотропного гормона, соматомедина-С, эстрогенов и тестостерона.
Изменение функции мышечной ткани как белкового депо. Мышечная ткань является крупнейшим белковым депо организма, причем оно обладает определенной специфичностью, поскольку, только в мышечной ткани содержатся такие системы протеолиза как убихинин-протеосомная система и каспаза-3, расщепляющая актин и миозин на более мелкие фрагменты. С возрастом, в основном за счет гормональных влияний, происходит нарушение баланса между анаболическими и катаболическими процессами. В частности, снижение уровня анаболического гормона соматомедина-С, тестостерона подавляет анаболизм с одновременной активацией катаболических путей гомеостаза. Любопытно отметить, что скелетная мускулатура является органом продукции соматомедина-С, причем его системный уровень зависит от уровня физической активности. Чем выше уровень физической активности, тем выше уровень соматомедина-С. Обсуждается также роль физической активности в продукции механо-ростового фактора, который необходим для активации стволовых (сателлитных) клеток мышечной ткани, обеспечивающих ее объем.
Снижение способности мышечной ткани к регенерации. В пожилом возрасте происходит нарушение процессов гиперплазии, то есть формирования нового мышечного волокна. Дело в том, что в молодом и среднем возрасте под влиянием физической нагрузки на мышечную ткань происходит формирование микротравмы. В область микротравмы мигрируют стволовые (сателлитные) клетки, которые приходят в активное состояние и начинают продуцировать разнообразные миогенные факторы, что приводит к слиянию имеющихся мышечных волокон и стволовых клеток с формированием нового, увеличенного в объеме и обладающего большей силой, мышечного волокна (гиперплазия). Таким образом, в пожилом возрасте по неустановленным пока причинам происходит прерывание саногенного пути увеличения силы и объема мышц под влиянием физической активности и снижается, таким образом, способность мышечной ткани к гипертрофическим процессам.
Нарушение сигнального молекулярного взаимодействия. Так же, в результате старческой астении, снижается продукция и содержание иммуноглобулина А, G, интерлейкина-2, активируется продукция провоспалительных цитокинов (интерлейкин-6), происходит рост С-реактивного белка. Все выше перечисленные процессы приводят к активации катаболических процессов в организме пожилого человека, которые, в свою очередь, способствуют развитию саркопении.
Неврологические причины. В последнее время особое внимание специалистов уделяется изучению нейромышечных синапсов как ключевой структуре в осуществлении функциональной денервации, которая ведет к потере мышечной массы и слабости. Подтверждена роль возрастзависимого увеличения оксидативного стресса в развитии нейромышечной дегенерации и прогрессировании саркопении.
Патоморфология саркопении.
При гистологическом исследовании выявляются типичные явления дегенерационной атрофии мышечных волокон, которые напоминают по характеру гистологической картины поздние изменения при полиомиелите. Наблюдается атрофия миоцитов, снижается количество нейромускулярных единиц, двигательных мышечных волокон второго типа, которые являются волокнами быстрого сокращения и обеспечивают, прежде всего, быстрые действия человека (бег, например).
Классификация саркопении.
Выделяют 2 основные группы саркопении:
Если наблюдается только снижение мышечной массы, это состояние часто называют пресаркопенией, тогда как под саркопенией понимают уменьшение и объема, и силы мускулатуры
Клиническая картина характеризуется снижением мышечной объема и силы. Клиническая значимость саркопении подчеркивается увеличением у страдающих ею пожилых людей частоты падений, увеличением зависимости от посторонней помощи (например, требуется постоянная поддержка другого лица при ходьбе), увеличением общего уровня нетрудоспособности.
Диагностика саркопении.
На сегодняшний день для оценки скелетной мышечной массы, ее силы и функции существует широкий спектр методик (табл. 1). Стоимость, доступность и простота в использовании определяют их использование в клинической практике и при проведении клинических исследований.
Методы оценки состояния скелетной мускулатуры [1]
| Показатель | Методы, используемые в клинических исследованиях | Методы, используемые в клинической практике |
| Масса скелетной мускулатуры | Компьютерная томография | Биоимпедансный анализ |
| Магнитно-резонансная томография | Двухфотонная рентгеновская абсорбциометрия | |
| Двухфотонная рентгеновская абсорбциометрия | ||
| Биоимпедансный анализ | ||
| Тотальное или частичное определение калия в обезжиренных мягких тканях | ||
| Антропометрия | ||
| Сила скелетной мускулатуры | Динамометрия | Динамометрия |
| Степень сгибания/разгибания коленного сустава | ||
| Пиковая скорость выдоха | ||
| Функциональные возможности мышечной ткани | SPPB-тест (Short Physical Performance Battery) | SPPB-тест (Short Physical Performance Battery) |
| Тест на определение скорости ходьбы | Тест на определение скорости ходьбы | |
| Тест «подъем по лестнице» | Тест «подъем по лестнице» | |
| Тест «подняться и пройти» |
Вместе с тем, группой EWGSOP предложен конкретный алгоритм диагностики саркопении (рис. 1). При использовании данного алгоритма необходимо учитывать коморбидные состояния, индивидуальные особенности пациентов. У лиц моложе 65 лет применение алгоритма возможно при наличии факторов риска.
Рис. 1. Алгоритм диагностики саркопении (EWGSOP,2009)
У лиц моложе 65 лет применение рассматриваемого алгоритма имеет смысл при наличии факторов риска, о которых может свидетельствовать принадлежность к следующим группам пациентов: не выходящие за пределы своей квартиры (дома); неспособные встать из положения сидя без посторонней помощи; имеющие недостаточную масса тела либо при наличии исходного ожирения имеющие немотивированную потеря массы тела 5% от исходной; имеющие 2 и более падений за последний год; выписавшиеся из стационара после лечения, предполагавшего постельный или полупостельный режим; имеющие тяжелую соматическую патологию; имеющие синдром гипомобильности.
Ниже приведем варианты реализации отдельных компонентов алгоритма.
Измерение скорости ходьбы может быть выполнено следующим образом. Для выполнения теста необходимо преодолеть расстояние в 4 метра с обычной скоростью. Тест считается пройденным, если скорость передвижения испытуемого составляет больше 0,8 м/с. Если скорость передвижения менее 0,8 м/с, то необходимо провести измерение мышечной силы.
Динамометрия кисти служит для оценки мышечной силы и может быть выполнена в стандартных условиях при помощи динамометра. Нормальным показателем для женщин считается сила сжатия динамометра ≥ 20 кг, для мужчин ≥ 30 кг
Для оценки жировой и обезжиренной массы используют компьютерную томографию (КТ), магнитную резонансную томографию (МРТ) и двухфотонную рентгеновскую абсорбциометрию (Dual Energy X-ray Absorptiometry, DXA). КТ и МРТ являются золотым стандартом в диагностике физиологических и патологических состояний мягких тканей и часто используются в клинических исследованиях. В рутинной практике определение жировой ткани с помощью КТ и МРТ ограничено в связи с высокой стоимостью обследования и повышенным уровнем ионизирующего излучения. В данном случае DXA выступает альтернативой для определения жировой и обезжиренной ткани как в клинических исследованиях, так и на практике. Диагностической погрешностью использования ДXA в определении саркопении является невозможность разделения подкожной и висцеральной жировой ткани, а также то, что в состав обезжиренной ткани входят и паренхиматозные органы. Обезжиренная масса конечностей наиболее точно совпадает с их мышечной массой. Поэтому в клинических исследованиях по саркопении не только учитывают общий показатель обезжиренной массы, но и выделяют сумму показателей обезжиренной массы верхних и нижних конечностей — аппендикулярную массу скелетной мускулатуры. Тощая масса конечностей наиболее точно совпадает с их мышечной массой, т. к. в конечностях в тощую массу помимо мышц входят только кожа, связки и сосудистая система. В качестве клинического порога, при котором можно говорить о наличии саркопении у людей пожилого возраста, предложено считать снижение индекса нежировой массы мягких тканей конечностей (тощей массы) на 2 стандартных отклонения по сравнению с лицами молодого возраста (от 18 до 40 лет) с учетом пола. Индекс определяется как вес нежировой массы мягких тканей конечностей, выраженный в килограммах, деленный на квадрат роста пациента, выраженный в метрах (тощая масса (кг) / рост² (м²)). Соответственно данному индексу выделяют умеренную и тяжелую саркопению (табл.2.). Одновременно с помощью DXA возможно определить минеральную плотность костной ткани и выявить наличие остеопороза у людей пожилого возраста. Техническая ошибка при измерении процентного содержания жировой массы и аппендикулярной массы скелетной мускулатуры с помощью DXA составляет ±1,5 и ±3,0 % соответственно. При проведении ДРА лучевая нагрузка минимальна (0,037 mrem — GE Lunar Prodigy, 0,01 mGy — Hologic Discovery) по сравнению с другими методиками. Различия же в информативности ДРА, КТ и МРТ составляют менее 5 %.
| Диагностика саркопении с помощью DXA (по I. Janssen, 2002) | ||||
| Норма | Умеренная саркопения | Тяжелая саркопения | ||
| Мужчины | ≥ 10,76 кг / м² | 8,51–10,75 кг / м² | ≤ 8,50 кг / м² | |
| Женщины | ≥ 6,76 кг / м² | 5,76–6,75 кг / м² | ≤ 5,75 кг / м² | |
Более 10 лет для оценки жировой и обезжиренной ткани в практике применяют простой в использовании, недорогой и воспроизводимый метод — биоимпедансный анализ. Формулы разработаны для различных этнических групп, установлены референтные данные для мужчин и женщин различного возраста европеоидной расы. Поэтому биоимпедансный анализ является хорошей портативной альтернативной методикой двухфотонной рентгеновской абсорбциометрии.
Дифференциальная диагностика.
Дифференциальную диагностику необходимо провести со следующими заболеваниями:
1) Миопатический синдром с лимфомоноцитарной инфильтрацией мышечного волокна, который имеет место при полимиозите, дерматомиозите.
2) Эндокринные и метаболические миопатии: гипертироидная миопатия, гипотироидная миопатия, недостаток витамина Д, гиперальдостеронизм с явлениями гипокалиемии, гипопаротироз со снижением содержания кальция.
3) Лекарственная миопатия: ее развитие в пожилом возрасте возможно на фоне приема гиполипидемических препаратов (крайняя форма – рабдомиолиз), мышечная слабость может быть побочным действием бета-блокаторов.
4) Нутритивная миопатия: развивается у длительно лежащих и ослабленных гериатрических больных за счет развития синдрома мальнутриции с дефицитом поступления аминокислот, железа и других микроэлементов, необходимых для нормального функционирования мышечной ткани.
5) Токсическая миопатия: развивается при злоупотреблении алкоголем, сочетается с периферической нейропатией.
6) Ревматоидный артрит, хроническая ревматическая болезнь.
Лечение, реабилитация и профилактика.
Рекомендации для людей в возрасте 65 лет и старше:
Рекомендация для людей в возрасте до 65 лет:
Глоссарий к рекомендациям ВОЗ:
Физическая активность – это любые движения организма, производимые скелетными мышцами и требующие расхода энергии.
Тип физической активности – это способ участия в физической активности, тип физической активности может принимать различные формы: аэробика, силовые упражнения, упражнения на гибкость и равновесие.
Аэробика или ритмическая гимнастика – это деятельность, при которой крупные мышцы тела ритмично двигаются в течение определенного периода времени. Занятия аэробикой – иначе называемые упражнениями на выносливость – улучшают кардиореспираторное состояние. Виды аэробики: ходьба пешком, бег, плавание и езда на велосипеде.
Силовые упражнения – это физическая активность или упражнения, которые повышают силу, мощь, выносливость и массу скелетных мышц (например, силовые упражнения, упражнения с сопротивлением или упражнения на силу и сопротивление).
Упражнения на равновесие – это статичные или динамичные упражнения, направленные на улучшение возможностей человека противостоять проблемам, связанным с нарушением координации и потери устойчивости, вызванных самопроизвольными движениями, окружающей средой и другими объектами.
Физическая активность высокой интенсивности — по шкале индивидуальных возможностей человека от 0 до 10 физическая активность высокой интенсивности находится в пределах от 7 до 8.
Физическая активность средней интенсивности — по шкале индивидуальных возможностей человека от 0 до 10 физическая активность средней интенсивности находится в пределах от 5 до 6.
— использование общей вибрации (воздействие связано со стимуляцией проприорецепторов, происходящей вследствие частого изменения мышечного тонуса);
— электрическая стимуляция скелетных мышц.
3.1. Обеспечение поступления белка в организма в количестве не менее 0,8 г/кг массы тела в сутки.
3.2. Включение в рацион продуктов, богатых витамином Д.
3.3. Включение в рацион продуктов, содержащих большие количества эйкозопентаеновой кислоты (сельдь, скумбрия, лосось, сардины, печень трески).
3.4. Применение пищевых добавок для улучшения метаболизма мышечной ткани (такими добавками, в частности, являются широко применяемые спортсменами смеси разветвленных аминокислот — лейцин, изолейцин, валин — и метаболит лейцина β-гидрокси-β-метилбутират, в английской аббревиатуре HMB).
3.5. Применение пептидных биорегуляторов.
3.5. Прием добавок омега-3 жирных кислот.
3.6. Коррекция сопутствующего синдром мальнутриции путем применения средств специального энтерального и парентерального питания (см. выпуск «Синдром мальнутриции»).
Препаратов с зарегистрированными показаниями для лечения саркопении в настоящее время не существует. Однако назначенные по другим показаниям у пожилых пациентов препараты могут оказать протективное воздействие в отношение саркопении.
4.1. Препараты с доказанной эффективностью:
4.1.1. Препараты тестостерона: имеют положительное влияние на мышечную силу и мышечную массу, но их применение у пациентов пожилого возраста связано с рядом нежелательных явлений, например: вирилизация (у женщин), повышение сердечно-сосудистого риска.
4.1.2. Препараты витамина Д:
4.1.2.1. С профилактической целью – назначение нативного витамина Д (холекальциферола): способствует сохранению мышечной массы, оказывает положительное влияние на снижение риска сопутствующего гериатрического синдрома падений.
4.1.2.2. С целью фармакотерапии – назначение альфакальцидолоа дозе 1 мкг в сутки течение 6-12 месяцев. Эффекты: относительное увеличение доли мышечных волокон типа А, некоторое уменьшение доли волокон типа B, что сочетается с увеличением поперечного сечения волокон типа А; увеличение мышечной массы у пациентов с ее дефицитом и поддержание мышечной массы при исходно нормальных показателях, статистически значимое улучшению мышечной силы (изометрической силы разгибания колена) и функциональных возможностей (расстояние, которое пациенты могут пройти за две минуты, скорость одевания).
4.2. Препараты, находящиеся на стадии доклинических или клинических исследований:
4.2.2. селективные модуляторы андрогенных рецепторов,
4.2.3 анаболик-катаболик-трансформирующие агенты (MT-102),
4.2.5. ингибиторы ангиотензинпревращающего фермента,
Саркопения: современные подходы к диагностике и лечению
Саркопения – дегенеративная потеря мускулатуры (в среднем 0,5–1% каждый год после 25–30 лет), ухудшение качества мышечных волокон и снижение силы сокращения мышц. Саркопения наряду с остеопорозом является причиной немощности пожилых людей и потери ими независимости [1]. Снижение мышечной массы и связанной с этим способности к ежедневному самообслуживанию наблюдается у 4% мужчин и 3% женщин в возрасте 70–75 лет и до 16% среди мужчин и 13% среди женщин старше 85 лет [2]. Однако в первую очередь саркопения приводит к ухудшению функциональных возможностей быстрых мышечных волокон, отвечающих за сохранение равновесия при изменении положения центра тяжести, что в свою очередь увеличивает риск самопроизвольных падений: у пожилых людей через каждые 10 лет частота падений увеличивается на 10% [3]. Падения становятся причиной серьезных повреждений в 10–15% случаев [4], переломов в 5% случаев [4, 5]. При этом 5,3% всех госпитализаций и 90% переломов проксимального отдела бедра обусловлены падениями с высоты собственного роста [6, 7]. Среди факторов риска внепозвоночных переломов падения более значимы, чем снижение минеральной плотности костной ткани [8–10].
Патогенетические аспекты целого ряда заболеваний, связанных с возрастом (атеросклероз, сахарный диабет 2 типа, остеопороз, деменция), изучаются давно, в то время как причины потери мышечной массы стали исследовать совсем недавно.
В связи с этим нами проанализированы причины и ключевые механизмы развития саркопении, подходы к диагностике этого состояния и способы немедикаментозной и медикаментозной коррекции.
В подавляющем большинстве случаев саркопения связана со старением организма, поэтому чаще выявляется у пожилых людей. Однако это состояние встречается и у молодых пациентов.
Классификация потери мышечной ткани предполагает выделение первичной и вторичной саркопении, последняя подразделяется на формы в зависимости от первопричины заболевания [11]. Этиологическая классификация саркопении представлена в таблице.
Первичная саркопения обусловлена рядом факторов [11–13]:
В случае первичной саркопении процесс носит необратимый, прогрессирующий характер. Поэтому именно данная когорта пациентов нуждается в грамотной диагностике и разработке способов лечения.
При вторичных формах саркопении, как правило, отмечается один значимый этиологический фактор (таблица). Так, у пациентов, страдавших эндогенным гиперкортицизмом в 25–30-летнем возрасте, наблюдается значимое снижение функциональных возможностей и повышение риска переломов [14, 15]. Необходимо отметить, что в большинстве случаев эти процессы имеют полное или частичное обратное развитие после достижения ремиссии заболевания [16].
Диагностическая концепция саркопении
Термин «саркопения» для обозначения феномена потери мышечной массы с возрастом впервые был предложен в 1997 г. [17], диагностическая концепция заболевания – в 1998-м [18]. Саркопенией считалось снижение тощей массы на два стандартных отклонения, измеренных при двухэнергетической рентгеновской абсорбциометрии (dual-energy X-ray absorptiometry – DXA), по отношению к молодому здоровому взрослому человеку соответствующего пола. Такой подход имел целый ряд преимуществ. Определение было понятно большинству врачей, демонстрировало высокие прогностические возможности для негативного исхода, а диагностика могла проводиться в ходе обследования на исключение остеопороза.
В 2010 г. концепция саркопении была пересмотрена. Европейская ассоциация клинического питания и метаболизма предложила определять саркопению при снижении мышечной массы более двух стандартных отклонений по сравнению с молодыми здоровыми лицами того же пола и этнической принадлежности. Кроме того, снижение мышечной массы должно было сочетаться со снижением скорости ходьбы человека (менее 0,8 м/с при четырехметровом тесте) [19].
Расширяя это понятие, Европейская рабочая группа по изучению саркопении у пожилых людей предложила выделять стадии саркопении [11]:
Силу мышц сегодня оценивают при выполнении теста на силу сжатия динамометра, подъема со стула или из положения приседания и определении пикового респираторного объема (межреберные мышцы). Существует линейная зависимость между силой сжатия и силой мышц нижних конечностей, a также моментом силы разгибателя коленей и размером поперечного сечения икроножных мышц [20]. Сила сжатия кисти в проспективных наблюдениях коррелировала с частотой инвалидизации и невозможностью выполнять привычную домашнюю работу (возможностью проживать отдельно) [21]. Таким образом, стандартизованное исследование силы сжатия динамометра является альтернативой сложных тестов для измерения силы мышц нижних конечностей. Определение пикового респираторного объема у пациентов без первичной легочной патологии позволяет оценить силу мышц, участвующих в акте дыхания. Это сравнительно простой, но пока не доступный многим метод.
Тесты для оценки функциональных возможностей (короткий набор тестов функциональных возможностей, тест для определения скорости ходьбы, шестиминутный тест ходьбы и тест ходьбы по лестнице) ввиду сложности проведения и интерпретации используются только в клинических исследованиях [22]. В рутинной практике для оценки функциональных возможностей применяют тест оценки скорости ходьбы на 4 м.
В Европейском консенсусе по диагностике саркопении предложен алгоритм выявления пациентов с таким заболеванием. Отмечено, что исследование должны проходить пациенты старше 65 лет (или с факторами риска развития саркопении). Сначала оценивается скорость ходьбы (время прохождения 4 м). При скорости ходьбы более 0,8 м/с предлагается измерить силу сжатия динамометра. В случае нормальных показателей проводить исследование мышечной массы не надо. При скорости ходьбы менее 0,8 м/с или неадекватной силе сжатия динамометра необходимо исследовать мышечную массу (применяется DXA). Только после этого ставится диагноз.
Саркопения в составе других синдромов
Потеря мышечной массы наблюдается при кахексии. Кахексия – это комплексный метаболический синдром, который ассоциирован с основным заболеванием пациента и при котором происходит утрата мышечной массы с потерей жировой ткани или без таковой [23]. Кахексия часто сочетается с воспалительными процессами, инсулинорезистентностью, анорексией и ускоренным разрушением белков мышечной ткани [24].
Другой гериатрический симптомокомлекс, включающий в себя саркопению, – немощность. Данное состояние обусловлено прогрессирующим снижением функций всех органов и систем с ухудшением резервных возможностей гомеостаза, снижением устойчивости к стрессовым факторам. При нем повышается риск падений, частота госпитализаций и летальных исходов [25]. Помимо физических проявлений (спонтанная потеря массы тела, переутомление, выраженная слабость, медленная походка, низкая физическая активность) [26] немощность проявляется в снижении когнитивных функций, социальной активности и др. [25].
Немедикаментозная терапия. Традиционно считается, что дефицит физической активности является наиболее значимым фактором развития саркопении [27]. Однако даже у спортсменов, в том числе тех, кто продолжает активные тренировки, мышечная масса, мышечная сила и выносливость начинают снижаться после 30 лет [28, 29]. Тем не менее физические нагрузки – существенная составляющая терапии саркопении, поскольку было доказано, что непродолжительные силовые нагрузки повышают способность мышечной ткани синтезировать белок [29].
Медикаментозная терапия. Препарата с зарегистрированными показаниями для лечения саркопении пока не существует. Дегидроэпиандростерон и гормон роста человека показали минимальную эффективность или ее отсутствие в терапии саркопении. Гормон роста человека увеличивал синтез белков мышцей и, как следствие, мышечную массу, но это не повышало силу мышц и функциональные возможности [30]. Малоэффективным оказался и рекомбинантный инсулиноподобный фактор роста 1. Возможно, причиной стали сопутствующие воспалительные процессы и другие факторы, связанные с возрастом.
Тестостерон продемонстрировал определенное положительное влияние на мышечную силу и мышечную массу, но его применение у пациентов пожилого возраста было связано с рядом нежелательных явлений. Существует опасение в отношении развития рака предстательной железы, повышения сердечно-сосудистых рисков [31–33]. Кроме того, у женщин тестостерон вызывает вирилизацию.
Для коррекции или замедления развития саркопении сегодня рассматриваются потенциальные возможности грелина, ингибиторов ангиотензинпревращающего фермента и эйкозапентаеновой кислоты (ЭПК) [34]. ЭПК – полиненасыщенная жирная кислота класса омега-3, которая входит в состав липидов большинства тканей животных. В рацион человека ЭПК попадает в составе таких продуктов питания, как сельдь, скумбрия, лосось, сардины или печень трески. Восполнить ее содержание можно также при приеме добавок омега-3 жирных кислот, эффективность которых до сих пор обсуждается.
Наиболее благоприятный профиль (соотношение эффективности и безопасности) для лечения саркопении у пожилых пациентов имеют препараты витамина D.
Важность D-гормона для развития мышц и их функциональных возможностей была продемонстрирована во многих работах. Еще в середине 70-х гг. прошлого века было показано, что 25-гидроксивитамин D3 (25(ОН)D3) оказывает влияние на фосфатный метаболизм в мышцах диафрагмы животных с дефицитом витамина D [35]. В результате дальнейших исследований рецептор активной формы витамина D (1,25 дигидрохолекальциферола), или D-гормона, был обнаружен на клетках скелетной мускулатуры [36]. Следующие работы показали, что D-гормон влияет на скелетную мускулатуру на генетическом (изменение траскрипции генов) и тканевом уровне через регуляцию метаболизма кальция и контроль мышечных сокращений и расслаблений [37–40]. Важность D-гормона для удержания равновесия была дополнительно подтверждена в двух проспективных генетических исследованиях. Полиморфизм рецептора витамина D сопровождается увеличением частоты падений и снижением мышечной силы [41].
В ходе исследований было выявлено, что снижение содержания витамина D в сыворотке крови (25(ОН)D менее 40 нг/мл, по некоторым данным менее 20 нг/мл) повышает риск падений [42, 43].
Надо отметить, что в отдельных когортах пациентов дефицит D-гормона может наблюдаться даже при нормальном поступлении витамина D. Это больные с тяжелыми заболеваниями печени, снижением скорости клубочковой фильтрации (СКФ) – менее 65 мл/мин, больные ожирением, а также люди преклонного возраста.
У пациентов с ожирением нативный витамин D как жирорастворимый витамин преимущественно находится в жировом депо, поэтому и создается относительный дефицит циркулирующего D-гормона. При первичной патологии печени и почек нарушается превращение нативного витамина D в D-гормон. В исследовании с участием 1781 больного остеопорозом возрастное снижение функции почек было признано независимым фактором риска падений и снижения функциональных возможностей пациентов [44]. У людей пожилого возраста наблюдается снижение экспрессии рецептора к D-гормону по сравнению с молодыми [45]. Во всех этих когортах пациентов функциональные возможности хуже, а риск падений выше по сравнению со здоровыми лицами из группы контроля [46].
Назначение колекальциферола – нативного витамина D – оказывает положительное влияние на снижение риска падений и, как следствие, переломов, особенно у пациентов с дефицитом D-гормона [47].
Вместе с тем важно понимать разницу между профилактическим назначением нативного витамина D пожилым пациентам с дефицитом витамина D и фармакотерапией препаратами D-гормона или его аналогов [48]. Активная форма витамина D (альфакальцидол) нуждается в одном гидроксилировании в печени (25-гидроксилаза) для превращения в D-гормон. Этим определяется преимущество альфакальцидола перед кальцитриолом: большая продолжительность действия и меньшая частота гиперкальциемии. Альфакальцидол эффективен и при снижении СКФ. Описана способность альфакальцидола преодолевать резистентность рецепторов к D-гормону и увеличивать их экспрессию [45]. Сравнительный метаанализ (14 исследований, 21 268 пациентов) показал, что активные метаболиты витамина D (альфакальцидол и кальцитриол) статистически значимо (р = 0,049) уменьшают риск падений по сравнению с нативным витамином D (отношение рисков 0,79 (95%-ный доверительный интервал (ДИ) 0,64–0,96) против 0,94 (95% ДИ 0,87–1,01)) [49]. Лечение пациентов с остеопорозом альфакальцидолом в дозе 1 мкг в течение трех – шести месяцев приводило к относительному увеличению доли мышечных волокон типа А и некоторому уменьшению доли волокон типа B, что сочеталось с увеличением поперечного сечения волокон типа А. Время, которое требовалось пациентам, чтобы одеться, статистически значимо уменьшалось [50].
Кроме того, терапия альфакальцидолом в течение шести месяцев у пациенток пожилого возраста с дефицитом витамина D приводила к статистически значимому улучшению мышечной силы (изометрической силы разгибания колена) и функциональных возможностей (расстояние, которое они могли пройти за две минуты) [51].
У пациентов с остеопенией на фоне ревматоидного артрита и нормальным уровнем витамина D (49–59 нмоль/л), которые ежедневно получали 1 мкг альфакальцидола, статистически значимо повысилась мышечная сила по сравнению с больными, получавшими ежедневно нативный витамин D в дозе 1000 МЕ (60 против 18%) [52].
После успешных пилотных исследований были проведены рандомизированные плацебоконтролируемые исследования, доказавшие способность альфакальцидола предотвращать падения и переломы у пациентов старше 65 лет [53–55]. Особенно эффективным оказалось применение альфакальцидола (Альфа Д3-Тева®) в дозе 1 мкг у пациентов с возрастным снижением СКФ (менее 65 мл/мин): риск падений снизился на 71% [56].
Работа японских исследователей продемонстрировала эффективность приема альфакальцидола в дозе 1 мкг в течение года в отношении увеличения мышечной массы у пациентов с ее дефицитом (мышечная масса измерялась с помощью DXA) и поддержания мышечной массы при исходно нормальных показателях (согласно критериям, применяемым в Японии) [57].
Очевидно, что на фоне лечения альфакальцидолом улучшается мышечная функция, снижается риск падений и повышается минерализация костной ткани, следовательно, снижается риск переломов. Именно поэтому длительное время препарат использовался для лечения остеопороза [58]. Когда появились более эффективные препараты для лечения остеопороза, альфакальцидол стали применять в профилактических целях или в дополнение к антирезорбтивной терапии [58–64]. В ряде исследований альфакальцидол продемонстрировал преимущество перед нативным витамином D и возможность использования в тех случаях, когда комбинация антирезорбтивной терапии и нативных форм витамина D недостаточно эффективна [65, 66].
Наиболее широко применяемым альфакальцидолом является лекарственный препарат Альфа Д3-Тева®, имеющий широкий международный и российский опыт применения и большую доказательную базу.
На сегодняшний день поиск препаратов для лечения саркопении продолжается. Проводятся доклинические и клинические исследования эффективности миостатина, селективных модуляторов андрогенных рецепторов [67], а также принципиально нового класса анаболик-катаболик-трансформирующих агентов – MT-102, показавших хорошие результаты у животных [68].
Саркопения, обусловленная возрастными изменениями мышечной ткани, вносит существенный вклад в повышение риска падений, снижение функциональных возможностей и способности к самообслуживанию. Увеличение продолжительности жизни населения ставит перед медициной задачи по сохранению активной и независимой жизни пожилых людей. Разрабатываются методы лечения остеопороза, атеросклероза и онкологических заболеваний, все больше внимания уделяется саркопении. Среди существующих медикаментозных методов лечения эффективность продемонстрировали препараты тестостерона и витамина D. При этом активные метаболиты витамина D (альфакальцидол) представляются более эффективными по сравнению с нативным витамином D и безопасными по сравнению с тестостероном. Учитывая важность проблемы, в настоящее время ведется поиск новых методов медикаментозного лечения саркопении.
Саркопения и нутритивная поддержка больных пожилого и старческого возраста

Демографическое старение населения приводит к значительному увеличению доли лиц пожилого и старческого возраста как на амбулаторном, так и стационарном этапах лечения.
Abstract. Demographic aging of the population leads to a significant increase in the proportion of elderly and senile people, both at the outpatient and inpatient stages of treatment. Over the past decade, the average age of the main contingent of patients in intensive care and intensive care units is more than 65 years, with a tendency to increase, which predetermines the strategy for a more thorough assessment of approaches to treatment measures, taking into account polymorbidity and functional capabilities of patients of older age groups, as the period of stay in hospital, and at further stages of recovery and rehabilitation. It is known that, in general, the duration of stay in intensive care units for elderly patients is much longer, and the results of treatment and rehabilitation are significantly lower than that of younger patients. This is due to a combination of a number of factors: comorbidity/polymorbidity of elderly and senile patients, decreased functional reserves of the body, senile asthenia syndrome, the main components of which are sarcopenia, and malnutrition. The relationship of senile asthenia with an increase in the duration of hospitalization, a decrease in physical activity, the development of functional deficits, an increase in the risk of falls, fractures and mortality is well understood, however, in routine clinical practice, assessing nutritional status, diagnosing malnutrition and solving the problem of malnutrition in patients with senile asthenia syndrome and Insufficient attention is paid to sarcopenia, despite the known facts about the relationship of malnutrition, a decrease in skeletal muscle mass, including their strength or function, with unfavorable outcomes of the disease. In the outpatient phase, in addition to a sedentary lifestyle, the development and progression of sarcopenia is often facilitated by the presence of a severe illness accompanied by systemic inflammation, metabolic resistance, nutritional deficiency and depression characteristic of this category of patients. Modern approaches to the treatment of an elderly and senile patient imply a regular assessment of the nutritional status and counseling on rational nutrition with the introduction of nutritional support methods into a comprehensive management program for an elderly patient, along with basic treatment and rehabilitation measures in order to slow the progression of asthenia and sarcopenia syndrome. For citation: Novikova T. V., Pasechnik I. N., Rybintsev V. Yu. Sarcopenia and nutritional support for elderly and senile patients // Lechaschi Vrach. 2021; 12 (24): 62-66. DOI: 10.51793/OS.2021.24.12.009
Резюме. Демографическое старение населения приводит к значительному увеличению доли лиц пожилого и старческого возраста как на амбулаторном, так и стационарном этапах лечения. За последнее десятилетие средний возраст основного контингента больных в отделениях реанимации и интенсивной терапии составляет более 65 лет, с тенденцией к увеличению, что предопределяет стратегию более тщательной оценки подходов к проведению лечебных мероприятий с учетом полиморбидности и функциональных возможностей пациентов старших возрастных групп как в период пребывания в стационаре, так и на дальнейших этапах восстановления и реабилитации. Известно, что в целом длительность пребывания в отделениях интенсивной терапии пожилых пациентов значительно выше, а результаты лечения и реабилитации достоверно ниже, чем у более молодых. Это связано с сочетанием целого ряда факторов: коморбидности/полиморбидности пациентов пожилого и старческого возраста, снижения функциональных резервов организма, синдрома старческой астении, главными составляющими которого являются саркопения, недостаточность питания. Связь старческой астении с увеличением длительности госпитализации, снижением физической активности, развитием функциональных дефицитов, увеличением риска падений, переломов и смертности достаточно хорошо изучена, однако в рутинной клинической практике оценке нутритивного статуса, диагностике недостаточности питания и решению проблемы недостаточности питания пациентов с синдромом старческой астении и саркопении уделяется недостаточное внимание, несмотря на известные факты о взаимосвязи недостаточности питания, снижения массы скелетных мышц, в том числе их силы или функции с неблагоприятным исходами заболевания. В амбулаторном этапе, кроме малоподвижного образа жизни, развитию и прогрессированию саркопении часто способствуют наличие тяжелого заболевания, сопровождающегося системным воспалением, метаболическая резистентность, нутритивная недостаточность и депрессия, характерные для данной категории больных. Современные подходы к лечению пациента пожилого и старческого возраста подразумевают проведение регулярной оценки нутритивного статуса и консультирование по вопросам рационального питания с внедрением методов нутритивной поддержки в комплексную программу ведения пожилого пациента наряду с основными лечебными и реабилитационными мероприятиями с целью замедления прогрессирования синдрома астении и саркопении.
Улучшение бытовых условий и достижения медицины сопровождаются неуклонным увеличением продолжительности жизни населения в большинстве стран мира. Согласно критериям Всемирной организации здравоохранения (ВОЗ), пожилой возраст начинается в 60 лет, к старикам относят людей старше 75 лет, а к долгожителям – старше 89 лет. С учетом неравномерного развития стран и, соответственно, разной продолжительности жизни предлагаются и другие подходы к определению пожилого возраста. На наш взгляд, обоснованным является начало пожилого возраста, предложенное S. Scherbov и соавт., а именно вычитание 10 лет из ожидаемой продолжительности жизни в регионе [1].
Общее старение населения приводит к значительному увеличению доли лиц пожилого и старческого возраста (ПСВ), обращающихся за медицинской помощью. Причем число больных ПСВ увеличивается как на амбулаторном, так и стационарном этапах лечения. Даже в отделениях реанимации и интенсивной терапии основной контингент больных перешагнул рубеж 65 лет [2].
Лечение больных ПСВ представляет собой архисложную задачу, связанную, естественно, не с абсолютным количеством лет, прожитым конкретным больным (паспортный возраст), а с наличием прежде всего коморбидной патологии, определяющей биологический возраст.
Под коморбидностью/полиморбидностью понимают состояние, обусловленное наличием нескольких заболеваний у одного пациента, которые могут быть как связанными патогенетически, так и отдельными [3]. Курация таких больных требует привлечения специалистов различного профиля (мультидисциплинарной команды). Вопросы лечения отдельных нозологий подробно изложены в рекомендациях профильных сообществ. Однако алгоритм проведения терапии нескольких заболеваний одновременно до конца не разработан [4].
Еще одной важной проблемой больных ПСВ является уменьшение функциональных резервов организма и развитие синдрома старческой астении (ССА) (fraity syndrome), снижающих качество жизни [5]. В основе ССА лежат изменение обменных процессов и малоподвижный образ жизни, клинические проявления – саркопения, потеря веса, нутритивная недостаточность (НН), когнитивные нарушения и пр. [6]. Причин для НН у пациентов ПСВ много: снижение аппетита, ограниченные активность и ресурсы, дисфагия, сопутствующая патология и пр. Кроме того, не стоит забывать, что увеличение числа лекарственных средств, принимаемых коморбидным больным, ассоциировано с нарушениями пищевого статуса. Было установлено, что относительный риск снижения веса и возникновения НН при приеме 1-2 препаратов составляет 1,48 (95% ДИ = 0,85-2,59), 3-4 препаратов – 1,96 (95% ДИ = 1,08-3,54), а 5 и более – 2,78 (95% ДИ = 1,38-5,60) [7].
Саркопения и больной ПСВ
Саркопении как одной из составляющих ССА до недавнего времени не уделяли должного внимания. Вместе с тем снижение мышечной массы у больных ПСВ является фактором риска неблагоприятного исхода заболевания [8]. Кроме малоподвижного образа жизни, развитию и прогрессированию саркопении способствуют метаболическая резистентность и НН, характерные для возрастных больных.
Данный термин был введен в клиническую практику лишь в 1989 г. [9]. В дальнейшем представления о саркопении были расширены и ее перестали рассматривать как только гериат-рическую проблему [10]. Согласно современной классификации выделяют первичную (возраст-ассоциированную) и вторичную саркопению (рис. 1).
Определение саркопении, а также набор ее диагностических критериев разрабатываются под эгидой трех сообществ – Европейской рабочей группы по саркопении у пожилых людей (EWGSOP), Европейского общества по клиническому питанию и метаболизму (ESPEN-SIG) и Международной рабочей группы по саркопении (IWGS). На основе консенсуса в 2019 г. было принято следующее определение: «Саркопения – это синдром, характеризующийся прогрессирующей потерей массы и силы скелетных мышц, сопровождающийся высоким риском неблагоприятных исходов, таких как физическая нетрудоспособность, низкое качество жизни и смерть» [11].
Потеря мышечной массы тела начинается после 30 лет и составляет 0,1-0,5% в год. После 60-65 лет этот процесс сильно ускоряется, темп снижения может достигать 8% в год, увеличиваясь до 15% после 70 лет [12]. Некоторые исследователи рассматривают саркопению как физиологический процесс, однако в ряде случаев (14% от популяции 65-75 лет и до 45% среди людей старше 85 лет) она приводит к выраженным функциональным нарушениям [12, 13]. Уменьшение силы и массы мышц регистрируется у 35-40% больных стационара, среди пациентов отделений интенсивной терапии этот показатель варьирует от 50% до 70% [14, 15].
Возникновение саркопении – следствие нарушения функции различных внутриклеточных сигнальных каскадов, результатом которых является преобладание катаболических процессов в мышечных волокнах. Биохимическая природа саркопении отличается от другого состояния, проявляющегося потерей мышечной массы – кахексии. При кахексии центральная роль в патогенезе отводится воспалению и активации системы цитокинов. У больных с вторичной саркопенией оба эти процесса могут сочетаться.
Согласно последним исследованиям, универсального патогенетического пути потери мышечной массы не существует. Выделяются внешние и внутренние факторы, потенциально влияющие на состояние поперечнополосатой мускулатуры. К внутренним факторам относят снижение уровня анаболических гормонов, возрастную нейромышечную дегенерацию, хроническое воспаление и окислительный стресс. Ведущими внешними факторами являются НН, снижение физической активности, в том числе при развитии острых или хронических заболеваний. Для саркопении характерна резистентность к инсулину и аминокислотам, при этом требуется большее количество свободных аминокислот для стимуляции синтеза белка в клетках мышечной ткани [16].
При оценке состояния больного можно диагностировать сочетание снижения мышечной массы с другими нарушениями состава тела – сниженной костной массой (остеосаркопения), повышенной жировой массой (саркопеническое ожирение), либо и тем, и другим (остеосаркопеническое ожирение) [11]. На рис. 2 представлена фенотипическая классификация саркопении.
Прогностически саркопеническое и остеосаркопеническое ожирение – два крайне опасных метаболических нарушения. Установлено, что развитие саркопенического ожирения среди мужчин в возрасте от 60 до 80 лет ассоциировано с двукратным увеличением общего риска смерти [17]. Сочетание саркопении и ожирения приводит к развитию порочного круга и прогрессированию метаболических нарушений в обоих направлениях. Причем неважно, что возникло раньше. Для ожирения характерны избыточная продукция провоспалительных цитокинов и снижение чувствительности мышц к инсулину, что является элементами патогенеза саркопении. Уменьшение физической активности в свою очередь приводит к увеличению веса тела и жировой массы [11, 17].
Диагностика саркопении
Выделяют клинические (скрининговые) и инструментальные методы диагностики саркопении [18].
Клинические методы диагностики саркопении. Наиболее известным методом скрининга является опросник на силу и зависимость от помощи при ходьбе, вставании со стула, подъеме по лестнице, склонность к спонтанным падениям (Strength, Assistance with walking, Rising from chair, Climbing stairs and Falls, SARC-F) [11]. В него включены следующие параметры: подъем груза, ходьба по комнате, вставание со стула, подъем по лестнице, непроизвольные падения. Саркопению диагностируют при наборе пациентом четырех и более баллов (табл.).
Опросник SARC-F чаще всего используется у амбулаторных больных, способных к сотрудничеству и без выраженных когнитивных нарушений. Однако у пациентов, находящихся в стационаре, выполнение всех требований опросника не всегда возможно. Особенно это касается больных в критических состояниях. Кроме того, с помощью опросника трудно/невозможно оценивать динамику саркопении у пациентов реанимационного профиля, а также эффективность терапевтических мероприятий по профилактике снижения/увеличению мышечной массы. Альтернативой для таких ситуаций служат инструментальные методы исследования.
Инструментальные методы диагностики саркопении. Исходя из определения саркопении, можно полагать, что кроме мышечной массы для ее диагностики возможна оценка мышечной силы. Имеются данные, что мышечная сила может быть более важным предиктором неблагоприятных функциональных исходов, чем мышечная масса [19]. Для оценки мышечной силы широко используются функциональные тесты от простых и широко применяющихся на практике, таких как оценка силы хвата кисти, до более сложных, требующих наличия специального оборудования.
Инструментальная диагностика саркопении включает в себя двухэнергетическую рентгеновскую абсорбциометрию (DXA), биоэлектрический импедансный анализ, компьютерную и магнитно-резонансную томографии (КТ и МРТ), ультразвуковые методики [16, 18].
Не все вышеперечисленные методы широко используются в клинической практике, биоэлектрический импедансный анализ – удел научных исследований. Для изучения состава тела и оценки качественных характеристик мышечной ткани наибольшей информативностью обладают КТ и МРТ.
Золотым стандартом инструментальной диагностики саркопении на сегодняшний день является оценка площади поясничных мышц на аксиальном срезе на уровне третьего поясничного позвонка (L3) с дальнейшим расчетом скелетно-мышечного индекса (площадь поясничных мышц/рост2). Отдельно стоит подчеркнуть, что данные методики визуализации дают возможность оценки не только качественного, но и количественного состава скелетной мускулатуры. Например, при МРТ возможна оценка степени жировой дистрофии миоцитов, а также установление выраженности замещения мышечной ткани соединительной, однако настолько подробное описание требует большого опыта.
Проведение томографии исключительно для выявления саркопении нецелесообразно, учитывая значительную лучевую нагрузку и дороговизну процедуры. Однако оценка состояния мышечной системы может быть проведена при выполнении томографии по другим показаниям (например, при проведении исследования органов брюшной полости для исключения хирургической патологии).
Ультразвуковые методы исследования (УЗИ). УЗИ в настоящий момент не относят к основным методам диагностики саркопении, но это временное явление. Наработки последних лет свидетельствуют об эффективности и доступности этого метода [20].
В некоторых клиниках УЗИ может быть хорошим вариантом первоначальной оценки качества и количества массы скелетных мышц. Его основными преимуществами по сравнению с другими методами являются низкая стоимость, портативность и отсутствие радиационного облучения. Отсутствие лучевой нагрузки позволяет применять ультразвуковые методики для всех пациентов, включая детей и беременных женщин. Еще одно важное преимущество УЗИ заключается в том, что оно позволяет визуализировать целевую структуру в реальном времени и, благодаря оценке изменения эхогенности, может предоставить информацию о наличии воспаления, фиброза и инфильтрации жировой ткани. Основным ограничением УЗИ является отсутствие стандартизированного протокола, а также выраженная зависимость от способностей и навыков человека, выполняющего исследование [18].
Лечение и профилактика саркопении
В настоящее время отсутствуют общепринятые схемы лечения саркопении. Акцент делается на ее профилактику на основе физических нагрузок и высокобелкового питания.
При обсуждении лечения саркопении в стационаре большинство клиницистов используют высокобелковое питание, физические упражнения, которые являются необходимыми для синтеза мышечного белка. Отношение к фармакологическим методам лечения (тестостерон, соматотропин) остается сдержанным из-за недоказанной эффективности и большого числа побочных эффектов.
Несомненно, нутритивная поддержка у больных саркопенией обоснована. Это подтверждается рядом исследований. В частности, у 986 лиц ПСВ (65-79 лет) без выраженной патологии изучили влияние различного количества белка в пищевом рационе ( 1,2 г/кг/сут) на состояние мышечной массы [21]. Было установлено, что у лиц ПСВ для поддержания стабильного объема мышечной массы и силы может потребоваться увеличение в дневном рационе белка более 1,2 г/кг/сут. Схожие данные приводятся и в работе J. McKendry и соавт., которые утверждают, что для поддержания функции и массы мышц у больных ПСВ реанимационного профиля необходимо сочетать повышенное введение белка с физическими нагрузками [22].
В условиях сниженного аппетита у больных ПСВ адекватная доставка белка становится проблемной. Добиться результата можно с помощью перорального дополнительного питания в виде сипинга. Сипинг часто используется в ситуациях, когда обычное питание оказывается неполным или недостаточным для удовлетворения потребностей в макро- и микронутриентах с целью ускорения восстановления как при острых, так и при хронических состояниях. Так, например, у больных с острым нарушением мозгового кровообращения (ОНМК) наряду с мероприятиями по восстановлению основных функций организма и предотвращению вторичного повреждения головного мозга программа нутритивно-метаболической поддержки является одним из ключевых направлений современной концепции реабилитации [23].
Современные специализированные продукты для дополнительного перорального питания имеют различные вкусы, что позволяет выбрать подходящий напиток с учетом индивидуальных особенностей пациента. Идеальный напиток для сипинга имеет небольшой объем и характеризуется низкой способностью вызывать чувство насыщения, которое сохраняется в течение непродолжительного времени. Благодаря этому его применение не ведет к снижению приема обычной пищи. Кроме высокой калорийности и содержания белка в небольшом объеме, смеси для сипинга имеют и другие преимущества. В частности, они сбалансированы по содержанию основных нутриентов, обогащены микроэлементами и витаминами, могут дополнительно содержать пищевые волокна и биоактивные компоненты.
Не стоит забывать и о психологической стороне использования препаратов для сипинга. Обычно они представлены в красивой упаковке и имеют разнообразный вкус. Назначение сипинга на этапе диагностики заболевания и выявления НН позволяет врачу сразу начать коррекцию нарушений питания и создает определенный ореол «внимательности к своей персоне» в глазах пациента.
В настоящее время разработан ряд продуктов специализированного сипингового питания для пациентов с различными целями и потребностями. Продукты различаются по объему, содержанию белка и специальным добавкам.
Сипинг Нутридринк 200 мл является легкоусвояемым полноценным сбалансированным источником питания и предназначен для коррекции НН при широком спектре патологий, в том числе и при саркопении. В 200 мл готового к употреблению продукта содержится 12 г белка, 300 ккал энергии, полный спектр необходимых витаминов и минералов, в том числе повышенное содержание железа – 4,8 мг. Нутридринк 200 мл обогащен натуральными каротиноидами, содержит витамины группы B, С, Е и микроэлементы (хром, селен, медь), которые обеспечивают антиоксидантный эффект. Оптимальное содержание жирных кислот омега-6 и омега-3 в соотношении 5:1 помогает улучшать противовоспалительную и иммуномодулирующую защиту. Продукт может употребляться в качестве дополнительного, а при необходимости и единственного источника питания.
Оценка применения сипинга Нутридринк 200 мл у пожилых пациентов c ОНМК без нарушения глотания показала благоприятное влияние на клинические исходы и снижение смертности [24, 25].
У пожилых пациентов с нарушенной функцией желудочно-кишечного тракта (снижение моторной функции, склонность к запорам), в том числе на фоне длительной иммобилизации или проведения антибактериальной терапии, могут применяться сипинговые продукты с пищевыми волокнами.
Высококалорийный продукт специализированного питания Нутридринк Компакт с пищевыми волокнами со вкусом кофе также предназначен для пациентов с недостаточностью питания или риском ее развития, в том числе при снижении моторно-эвакуаторной функции кишечника и/или наличии клинических проявлений дисбактериоза кишечника. В 100 мл продукта Нутридринк Компакт с пищевыми волокнами (вкус кофе) содержится 240 ккал (2,4 ккал/мл), 9,5 г белка (16% энергии), 25,4 г углеводов (42% энергии), 10,4 г жиров (39% энергии) и 3,6 г клетчатки (3% энергии). В 125 мл продукта, полноценного по питательной ценности и обогащенного клетчаткой, содержится аналогичное количество питательных веществ, сопоставимое с 200 мл стандартной порции (1,5 ккал/мл, 16% энергии белка), что позволяет уменьшить объем потребления на 40% и избежать перегрузки жидкостью.
Следует отметить, что дозировка применения специализированных продуктов питания рассчитывается в зависимости от потребности в белке и энергии. Клинически значимый эффект наступает при приеме не менее чем в течение 3 недель.
Кроме высобелкового питания, определенный интерес для лечения саркопении представляют ω-3 полиненасыщенные жирные кислоты (ω-3 ЖК). Доказано, что назначение ω-3 ЖК – эйкозапентаеновой и докозагексаеновой – способствует уменьшению выраженности воспалительного процесса и увеличению мышечной массы у лиц ПСВ, что в свою очередь препятствует развитию и прогрессированию саркопении [26]. В другом исследовании G. I. Smith и соавт. рандомизировали в две группы 60 испытуемых в возрасте 60-85 лет [27]. 40 людей ПСВ в течение 6 месяцев получали в составе диеты рыбий жир, содержащий ω-3 ЖК, а 20 – кукурузное масло. Установили, что назначение ω-3 ЖК ассоциируется с увеличением объема и силы мышц.
Заключение
Акцент на саркопении в последних публикациях, посвященных больным ПСВ, обусловлен неуклонным увеличением числа лиц с проблемами со скелетной мускулатурой. Развитие различных фенотипов саркопении часто пропускается клиницистами и не учитывается в процессе лечения основной нозологии. Однако саркопения относится к факторам, ухудшающим прогноз заболевания. Инструментальные методы, особенно УЗИ-диагностика, позволяют наиболее полно оценивать динамику саркопении в процессе лечения. В основе профилактики и лечения саркопении лежит сочетание высокобелкового питания с реабилитационными мероприятиями по расширению физической активности. Обычного питания больным ПСВ недостаточно для поддержания мышечной массы. Использование перорального дополнительного питания в виде препаратов для сипинга позволяет обеспечить больного достаточным количеством субстратов для синтеза мышечного белка.
КОНФЛИКТ ИНТЕРЕСОВ. Статья подготовлена при участии компании ООО «Нутриция». Это никак не повлияло на мнение авторов.
CONFLICT OF INTERESTS. The article was prepared with the participation of Nutricia LLC. This did not affect the author’s opinion in any way.
Литература/References
1 ООО «Нутриция»; 143500, Россия, Истра, ул. Московская, 48
2 ФГБУ ДПО ЦГМА УДП РФ; 121359, Россия, Москва, ул. Маршала Тимошенко, 19, стр. 1А
Сведения об авторах:
Новикова Татьяна Валериановна, медицинский менеджер, Медицинский Департамент ООО «Нутриция»; 143500, Россия, Истра, ул. Московская, 48; tatyana.novikova@danone.com
Пасечник Игорь Николаевич, д. м. н., профессор, заведующий кафедрой анестезиологии и реаниматологии ФГБУ ДПО ЦГМА УДП РФ; 121359, Россия, Москва, ул. Маршала Тимошенко, 19, стр. 1А; pasigor@yandex.ru
Рыбинцев Владимир Юрьевич, к.м.н., доцент кафедры анестезиологии и реаниматологии ФГБУ ДПО ЦГМА УДП РФ; 121359, Россия, Москва, ул. Маршала Тимошенко, 19, стр. 1А; xxxvlad66@mail.ru
Information about the authors:
Tatiana V. Novikova, Medical Manager, Medical Department, Nutricia LLC; 48 Moskovskaya str., Istra, 143500, Russia; tatyana.novikova@danone.com
Igor N. Pasechnik, Dr. of Sci. (Med.), Professor, Head of department of Anesthesiology and Intensive Care of the Central State Medical Academy of the Administrative Department of the President of the Russian Federation; 19 b.1A Marshal Timoshenko str., Moscow, 121359, Russia; pasigor@yandex.ru
Vladimir Yu. Rybintsev, MD, Associate Professor of the department of Anesthesiology and Intensive Care of the Central State Medical Academy of the Administrative Department of the President of the Russian Federation; 19 b.1A Marshal Timoshenko str., Moscow, 121359, Russia; xxxvlad66@mail.ru
Саркопения и нутритивная поддержка больных пожилого и старческого возраста / Т. В. Новикова, И. Н. Пасечник, В. Ю. Рыбинцев
Для цитирования: Новикова Т. В., Пасечник И. Н., Рыбинцев В. Ю. Саркопения и нутритивная поддержка больных пожилого и старческого возраста // Лечащий Врач. 2021; 12 (24): 62-66. DOI: 10.51793/OS.2021.24.12.009
Теги: пожилые пациенты, питание, стационар, реабилитация
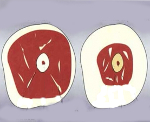
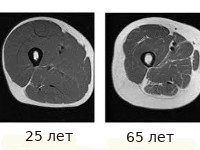


.gif)
.gif)
_575.gif)
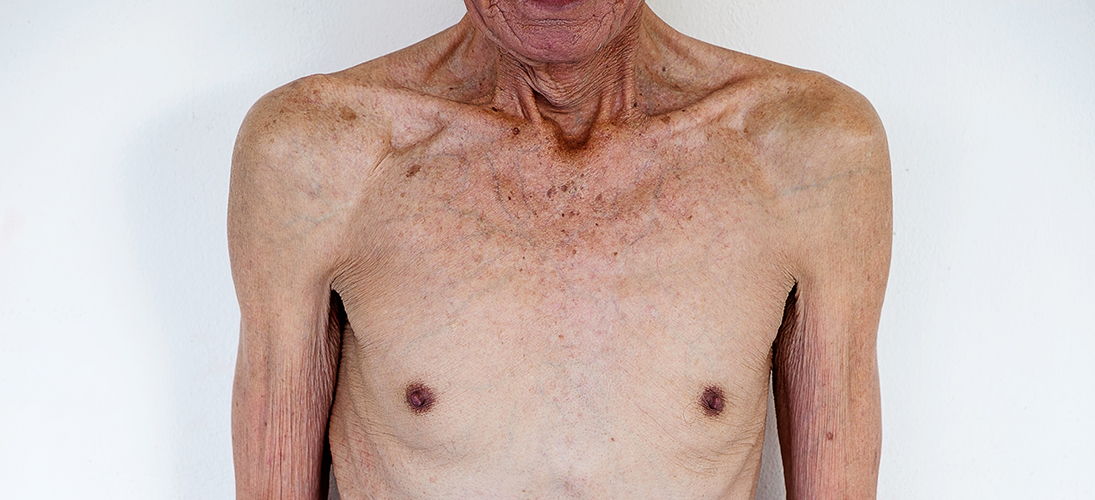
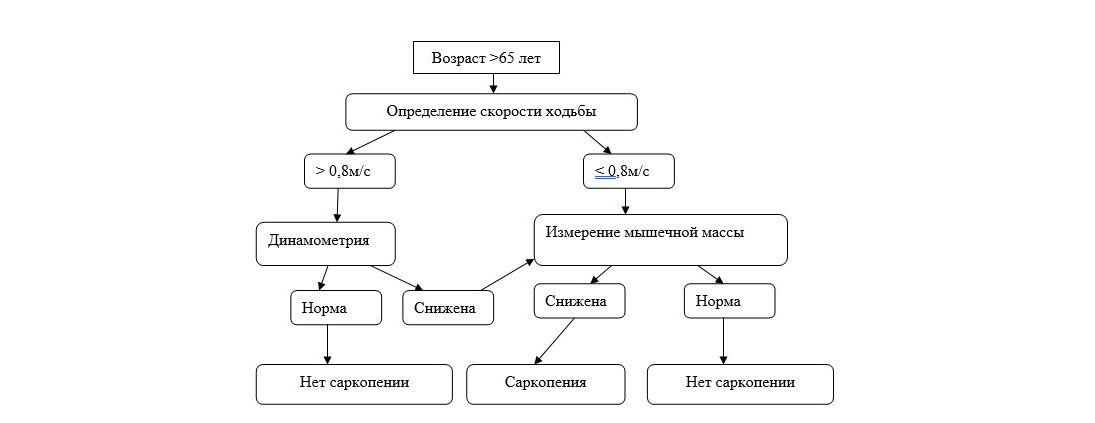
.gif)
.gif)
.gif)