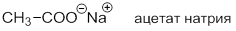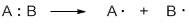за счет чего образуется ковалентная связь в органических соединениях
За счет чего образуется ковалентная связь в органических соединениях
Химия
3.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа
Химические связи в молекулах органических соединений
Химическая связь – это силы взаимодействия между атомами или группами атомов, приводящие к образованию молекул, ионов, и т.д. По своей природе химическая связь – это электростатические силы. Главную роль при образовании химической связи между атомами играют их валентные электроны, т. е. электроны внешнего уровня, наименее прочно связанные с ядром. Из курса общей химии вы знаете о существовании ковалентной и ионной связи.
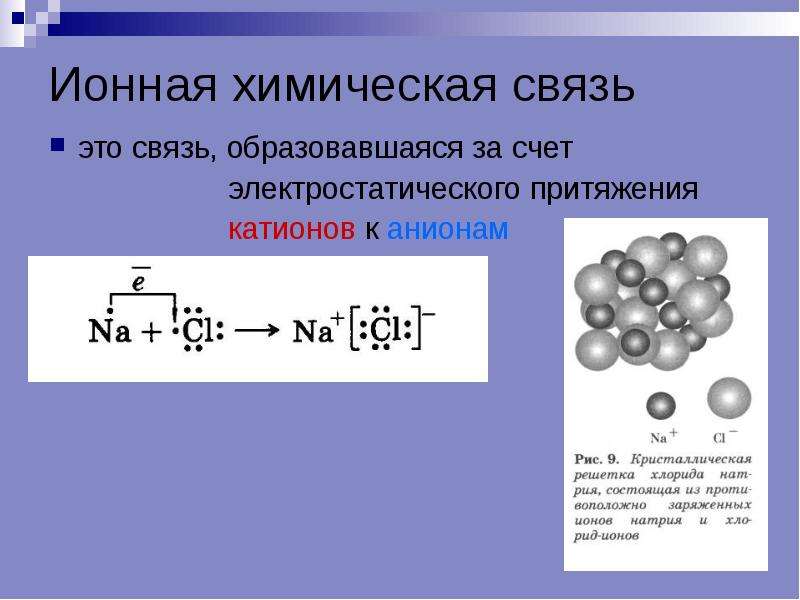
Ионная связь – это химическая связь, основанная на электростатическом притяжении ионов. Она возникает при большой разнице электроотрицательностей связываемых атомов. В органических соединениях ионные связи встречаются довольно редко, например, в солях карбоновых кислот:
Для органических соединений наиболее характерна ковалентная связь.
Ковалентная связь – это химическая связь, образованная за счет обобществления электронов двумя и более ядрами. Существуют два способа обобществления электронной пары: обменный и донорно-акцепторный.
По обменному механизму в образовании связи участвуют по одному электрону от каждого атома:
Н· + Cl· → H : Сl
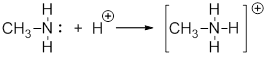
По донорно-акцепторному механизму ковалентная связь образуется за счет объединения электронной пары одного атома и свободной орбитали другого. Примером может служить взаимодействие молекулы амина с протоном с образованием метиламмоний катиона:
Классификация ковалентной связи по способам перекрывания атомных орбиталей
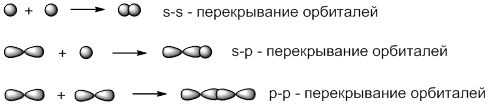
В зависимости от способа перекрывания атомных орбиталей различают σ- и π-связи. σ –связи образуются в результате перекрывания орбиталей вдоль линии, соединяющей центры ядер двух атомов:
π –связи образуются в результате бокового p-p-перекрывания орбиталей, в результате которого образуются две области повышенной электронной плотности:
Типы разрыва ковалентной связи
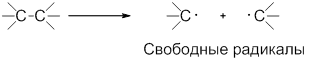
Разрыв ковалентной связи может происходить по гомолитическому или гетеролитическому механизмам.
Гомолитические реакции – реакции, в которых разрыв связи происходит симметрично, так что каждому из образующихся фрагментов отходит по одному электрону:
Гомолиз от греческого homos – одинаковый, lysis – разрыв.
В ходе гомолитических реакций в качестве интермедиатов образуются свободные радикалы – частицы, содержащие неспаренный электрон, например:
Радикал – атом или группа атомов, имеющие неспаренный электрон.
Гетеролитические реакции – реакции, в которых разрыв связи происходит несимметрично, так что пара электронов связи остается у одного из образующихся фрагментов:
Гетеролиз – это несимметричный разрыв ковалентной связи, в результате которого образуются разные по природе частицы: катион и анион.
Если заряды в таких частицах находятся на атоме углерода, их называют – карбокатионы и карбанионы, например:
Электронная пара остается у более электроотрицательного атома.
10 класс. Химия. Ковалентная связь в органических соединениях. Классификация органических соединений
10 класс. Химия. Ковалентная связь в органических соединениях. Классификация органических соединений
Вопросы
Задай свой вопрос по этому материалу!
Поделись с друзьями
Комментарии преподавателя
Химическая связь имеет в основном электростатический характер. Например, молекула водорода образуется из двух атомов, потому что двум электронам энергетически выгодно находиться в поле притяжения двух ядер (протонов). Это состояние в виде молекулы Н2 обладает меньшей энергией по сравнению с двумя отдельными атомами водорода.
Большинство органических веществ содержат ковалентные связи.
Для образования ковалентной связи между двумя атомами каждый атом обычно предоставляет в общее пользование по одному электрону.
В упрощенной модели используется двухэлектронное приближение, т.е. все молекулы строятся на основании суммирования двух электронных связей, характерных для молекулы водорода.
С точки зрения закона взаимодействия электрических зарядов (закон Кулона) электроны не могут сблизиться из-за огромных сил электростатического отталкивания. Но, согласно законам квантовой механики, электроны с противоположно направленными спинами взаимодействуют друг с другом и образуют электронную пару.
Если ковалентную связь обозначать как пару электронов, получим еще один вид записи формулы вещества – электронную формулу или формулу Льюиса
(амер. Дж. Льюис, 1916 г.). Рис. 1.
Рис. 1. Формулы Льюиса
В органических молекулах имеются не только одинарные связи, но еще двойные и тройные. В формулах Льюиса их обозначают, соответственно, двумя или тремя парами электронов. Рис. 2
Рис. 2. Обозначение двойной и тройной связей
Рис. 3. Ковалентная неполярная связь
Важной характеристикой ковалентной связи является ее полярность. Связь между одинаковыми атомами, например в молекуле водорода или между атомами углерода в молекуле этана неполярная – в ней электроны в равной степени принадлежат обоим атомам. См. Рис. 3.
Рис. 4. Ковалентная полярная связь
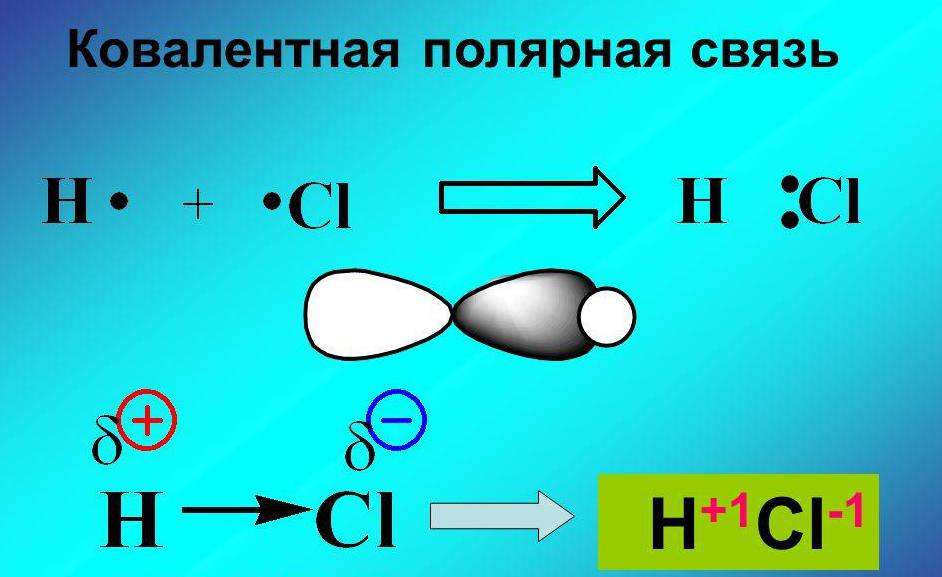
Если же ковалентная связь образована различными атомами, то электроны в ней смещены к более электроотрицательному атому. Например, в молекуле хлороводорода электроны смещены к атому хлора. На атомах возникают небольшие частичные заряды, которые обозначают d+ и d-. Рис. 4.
Чем больше разница между электроотрицательности атомов, тем более полярная связь.
Взаимное влияние атомов в молекуле приводит к тому, что может происходить смещение электронов связи, даже если они находятся между одинаковыми атомами.
Например, в 1,1,1-трифторэтане CH3CF3 электроотрицательные атомы фтора «стягивают» на себя электронную плотность с атома углерода. Часто это обозначают стрелочкой вместо валентной черточки.
В результате у атома углерода, связанного с атомами фтора, возникает недостаток электронной плотности, и он перетягивает валентные электроны к себе. Такое смещение электронной плотности по цепи связей называетсяиндуктивным эффектом заместителей. Рис. 5.
Рис. 5. Смещение электронной плотности в 1,1,1-трифторэтане
Длина и прочность связи
Важными характеристиками ковалентной связи являются ее длина и прочность. Длина большинства ковалентных связей составляет от 1*10-10 м до 2*10-10м или от 1 до 2 в ангстремах (1 А = 1*10-10 м).
Прочность связи – это энергия, которую нужно затратить, чтобы разорвать эту связь. Обычно приводят величины разрыва 1 моль или 6,023*1023 связей. См. табл. 1.
Одно время считалось, что молекулы можно изображать структурными формулами, лежащими в плоскости бумаги, и эти формулы отражают, почти отражают, истинное строение молекулы. Но примерно в середине 19 века выяснилось, что это не так. Впервые к такому выводу пришел, как я уже говорил на предыдущих уроках, тогда еще студент Вант-Гофф. А сделал он это на основании экспериментов выдающегося французского биолога и химика Пастера.
Дело в том, что Пастер занимался изучением солей винной кислоты. И ему, можно сказать, повезло. Кристаллизуя смешанную соль винной кислоты, он под микроскопом обнаружил, что у него получается, в общем-то, набор совершенно одинаковых, весьма симпатичных кристаллов. Но эти кристаллы легко разделить на две группы, которые никак не совместимы друг с другом, а именно: все кристаллы делятся на две части, одна из которых является зеркальным отражением другой.
Так была впервые открыта оптическая, или зеркальная, изомерия. Пастер смог вручную пинцетом под микроскопом разделить эти кристаллы и обнаружил, что все химические свойства практически совпадают. Не совпадает только одно, скорее, физическое свойство, а именно: растворы одного типа кристаллов и ему зеркального другого типа кристаллов по-разному вращали плоскость поляризации света, проходящего через них.
Рис. 6. Модели молекулы метана
Для того чтобы объяснить результаты экспериментов Пастера, Вант-Гофф предположил, что атом углерода находится всегда в неплоском окружении, причем это не плоское окружение не имеет ни центра, ни плоскости симметрии. Тогда атом углерода, соединенный с 4 другими различными фрагментами молекулы, не одинаковыми между собой, должен обладать зеркальной симметрией. Именно тогда Вант-Гофф предположил тетраэдрическое строение атома углерода. Оптическая изомерия следовала из этого предположения. В результате удалось объяснить пространственное строение органических соединений. Рис. 6.
Но ученые столкнулись с еще одной загадкой, которую не удалось разрешить до сих пор. Дело в том, что в природе органические соединения, которые образуются действительно в органической живой материи, как правило, содержат левовращающие, имеется в виду плоскость поляризации проходящего света, аминокислоты и правовращающие сахара. В то время как при любом органическом синтезе обязательно получается смесь таких изомеров.
Причина такой избирательности живой природы не ясна до сих пор. Но это не мешает ученым продолжать синтезировать все новые органические соединения и изучать их свойства.
В нарисованных на плоскости формулах не отражается пространственное расположение атомов относительно друг друга. Однако тетраэдрическое строение атома углерода в молекулах с одинарными связями приводит к существованию оптической изомерии
Ковалентная химическая связь. Типы химической связи: ковалентная связь
Ковалентная химическая связь является одним из видов связи, благодаря которой образуются молекулы неорганических и органических веществ. Химическая связь появляется при взаимодействии электрических полей, которые создаются ядрами и электронами атомов. Следовательно, образование ковалентной химической связи связано с электрической природой.
Что такое связь
Под этим термином подразумевают результат действия двух либо более атомов, которые приводят к формированию прочной многоатомной системы. Основные виды химической связи образуются при уменьшении энергии реагирующих атомов. В процессе формирования связи атомы стараются завершить свою электронную оболочку.
Виды связи

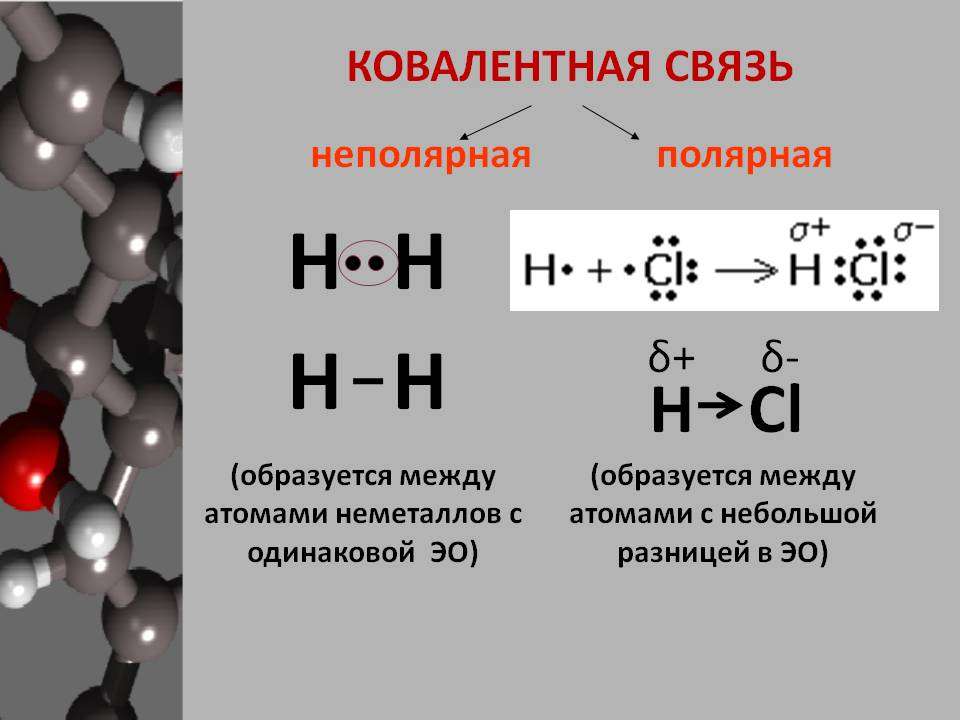
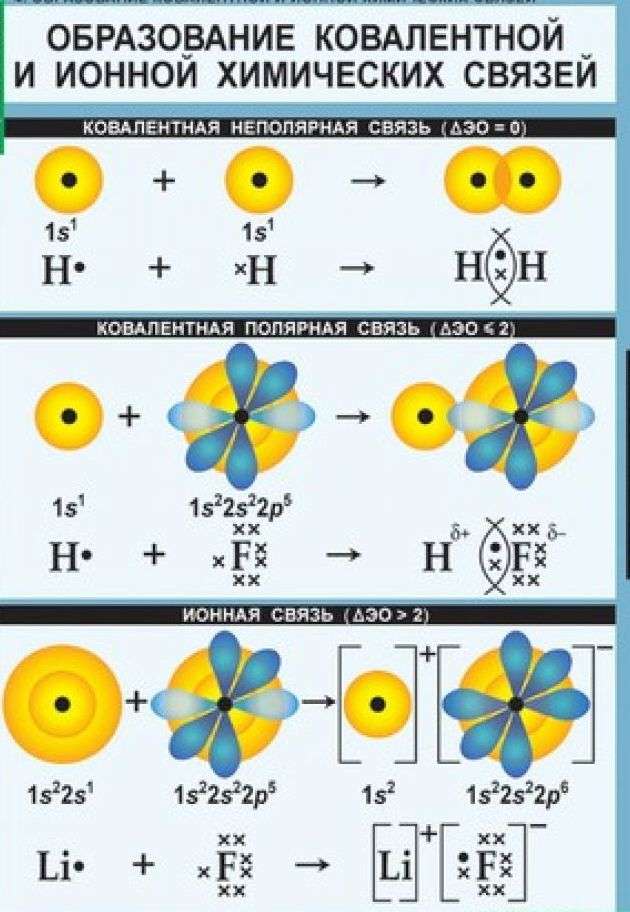
В химии выделяют несколько видов связи: ионной, ковалентной, металлической. Ковалентная химическая связь имеет две разновидности: полярная, неполярная.
Каков механизм ее создания? Ковалентная неполярная химическая связь образуется между атомами одинаковых неметаллов, имеющих одну электроотрицательность. При этом образуются общие электронные пары.
Неполярная связь

Среди примеров молекул, у которых ковалентная химическая связь неполярного вида, можно назвать галогены, водород, азот, кислород.
Впервые эта связь была обнаружена в 1916 году американским химиком Льюисом. Сначала им была выдвинута гипотеза, а подтверждена она была только после экспериментального подтверждения.
Ковалентная химическая связь связана с электроотрицательностью. У неметаллов она имеет высокое значение. В ходе химического взаимодействия атомов не всегда возможен перенос электронов от одного атома к другому, в результате осуществляется их объединение. Между атомами появляется подлинная ковалентная химическая связь. 8 класс обычной школьной программы предполагает детальное рассмотрение нескольких видов связи.
Типы ковалентной связи
Подробнее остановимся на данном вопросе. Какие выделяют типы химической связи? Ковалентная связь существует в обменном, донорно-акцепторном вариантах.
Первый тип характеризуется отдачей каждым атомом одного неспаренного электрона на образование общей электронной связи.
Электроны, объединяемые в общую связь, должны обладать противоположными спинами. В качестве примера подобного вида ковалентной связи можно рассмотреть водород. При сближении его атомов наблюдается проникновение их электронных облаков друг в друга, именуемое в науке перекрыванием электронных облаков. В результате увеличивается электронная плотность между ядрами, а энергия системы понижается.
При минимальном расстоянии ядра водорода отталкиваются, в итоге образуется некое оптимальное расстояние.
В случае донорно-акцепторного типа ковалентной связи у одной частицы есть электроны, ее называют донором. Вторая частица имеет свободную ячейку, в которой будет размещаться пара электронов.
Полярные молекулы
Как образуются ковалентные полярные химические связи? Они возникают в тех ситуациях, когда у связываемых атомов неметаллов различная электроотрицательность. В подобных случаях обобществленные электроны размещаются ближе к тому атому, у которого значение электроотрицательности выше. В качестве примера ковалентной полярной связи могут рассматриваться связи, которые возникают в молекуле бромоводорода. Здесь общественные электроны, которые отвечают за формирование ковалентной связи, ближе находятся к брому, чем к водороду. Причина подобного явления в том, что у брома электроотрицательность выше, чем у водорода.
Способы определения ковалентной связи
Как определить ковалентные полярные химические связи? Для этого необходимо знать состав молекул. Если в ней присутствуют атомы разных элементов, в молекуле существует ковалентная полярная связь. В неполярных молекулах присутствуют атомы одного химического элемента. Среди тех заданий, которые предлагаются в рамках школьного курса химии, есть и такие, которые предполагают выявление вида связи. Задания подобного типа включены в задания итоговой аттестации по химии в 9 классе, а также в тесты единого государственного экзамена по химии в 11 классе.
Ионная связь
Чем отличается ковалентная и ионная химическая связь? Если ковалентная связь характерна для неметаллов, то ионная связь образуется между атомами, имеющими существенные отличия по электроотрицательности. К примеру, это характерно для соединений элементов первой и второй групп главных подгрупп ПС (щелочных и щелочноземельных металлов) и элементов 6 и 7 групп главных подгрупп таблицы Менделеева (халькогенов и галогенов).
Она формируется в результате электростатического притяжения ионов, обладающих противоположными зарядами.
Особенности ионной связи
Так как силовые поля противоположно заряженных ионов распределяются равномерно во всех направлениях, каждый из них способен притягивать к себе противоположные по знаку частицы. Это и характеризует ненаправленность ионной связи.
Взаимодействие двух ионов, обладающих противоположными знаками, не предполагает полной взаимной компенсации индивидуальных силовых полей. Это способствует сохранению способности притягивать по остальным направлениям ионы, следовательно, наблюдается ненасыщенность ионной связи.
В ионном соединении у каждого иона есть возможность притягивать к себе некое число других, обладающих противоположных знаком, чтобы сформировать кристаллическую решетку ионного характера. В таком кристалле не существует молекул. Каждый ион окружается в веществе неким конкретным числом ионов иного знака.
Металлическая связь
Данный вид химической связи обладает определенными индивидуальными особенностями. Металлы имеют избыточное количество валентных орбиталей при недостатке электронов.
При сближении отдельных атомов происходит перекрывание их валентных орбиталей, что способствует свободному перемещению электронов из одной орбитали в другую, осуществляя между всеми атомами металла связь. Эти свободные электроны и являются основным признаком металлической связи. Она не обладает насыщенностью и направленностью, поскольку валентные электроны распределяются по кристаллу равномерно. Присутствие в металлах свободных электронов объясняет их некоторые физические свойства: металлический блеск, пластичность, ковкость, теплопроводность, непрозрачность.
Разновидность ковалентной связи
Она образуется между атомом водорода и элементом, который имеет высокую электроотрицательность. Существуют внутри- и межмолекулярные водородные связи. Эта разновидность ковалентной связи является самой непрочной, она появляется благодаря действию электростатических сил. У атома водорода небольшой радиус, и при смещении либо отдаче этого одного электрона водород становится положительным ионом, действующим на атом с большой электроотрицательностью.
Среди характерных свойств ковалентной связи выделяют: насыщаемость, направленность, поляризуемость, полярность. Каждый из этих показателей имеет определенное значение для образуемого соединения. К примеру, направленность обуславливается геометрической формой молекулы.
За счет чего образуется ковалентная связь в органических соединениях
2. ХИМИЧЕСКАЯ СВЯЗЬ. ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Остановимся на одном из важнейших вопросов химии, как осуществляется связь атомов в молекулах? Используя знания, полученные в курсе неорганической химии, рассмотрим вопросы природы химической связи между атомами или типы химических связей.
Современная теория химической связи базируется на квантово-механических представлениях о строении молекулы. Впервые электронную теорию химической связи, предложили в 1916 г. немецкий ученый В. Коссель и американский ученый Дж. Н. Льюис. Авторы электронной теории выдвинули идею о том, что химическая связь – результат взаимодействия внешних электронных оболочек атомов. Образуя химическую связь, каждый атом стремится заполнить внешнюю электронную оболочку до конфигурации, присущей инертным газам. При этом он принимает участие в образовании обшей электронной пары, отдает или принимает электроны. Принцип заполнения валентных оболочек до конфигурации инертных газов получил название октетное правило.
ТИПЫ ХИМИЧЕСКИХ СВЯЗЕЙ
Согласно принятой в настоящее время классификации существует несколько типов химической связи: ионная, ковалентная, водородная, металлическая и др. По способу образования химической связи различают две основные: ионную и ковалентную.
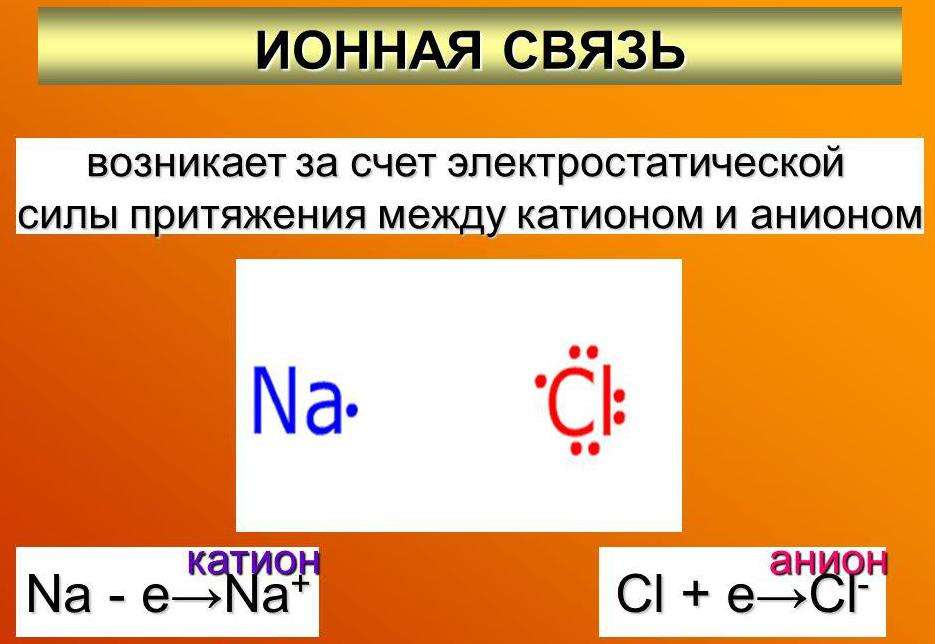
Ионная связь – характерна для атомов значительно отличающихся по электроотрицательности. Ионный тип связи характерен для неорганических соединений.
Рассмотрим, как осуществляется связь в хлориде натрия:
Хлор по сравнению с натрием обладает большей электроотрицательностью, то есть большим сродством к электрону. Вследствие этого электрон переходит с внешней оболочки натрия на внешнюю оболочку хлора, при этом образуются положительный и отрицательный заряды, между которыми действуют силы электростатического притяжения. Ион натрия приобретает электронную конфигурацию неона, а ион хлора – конфигурацию аргона.
Соединения с ионной связью характеризуются относительно большим дипольным моментом, хорошей электропроводимостью, высокими температурами плавления.
Ковалентная связь – основной тип связи в органических соединениях, характеризующийся увеличением электронной плотности между химически связанными атомами в молекуле по сравнению с распределением электронной плотности в свободных атомах.
Ковалентная связь возникает между атомами, имеющими одинаковую или близкую по значению электроотрицательность. Для образования ковалентной связи каждый из атомов предоставляет по одному электрону, при этом образуется общая пара электронов, которая в равной степени принадлежит обоим атомам. На письме ковалентная связь изображается черточкой между атомами.
Классическим примером ковалентной связи является молекула метана:
Атом углерода содержит на внешнем электронном уровне четыре валентных электрона и, чтобы доукомплектовать этот слой до октетной конфигурации, он образует четыре общие электронные пары с четырьмя атомами водорода.
В зависимости от электроотрицательности атомов между которыми образовалась ковалентная связь, она может быть полярной или неполярной.
Если электроотрицательность атомов одинакова, то общая электронная пара находится на одинаковом расстоянии от ядра каждого из атомов. Такая связь называется ковалентной неполярной:
При возникновении ковалентной связи между атомами с различной электроотрицательностью общая электронная пара смещается к более электроотрицательному атому. В этом случае образуется ковалентная полярная связь.
Стрелка в формуле указывает на полярность ковалентной связи. С помощью греческой буквы δ («дельта») обозначают частичные заряды на атомах: δ + – пониженную, δ – – повышенную электронную плотность.
По числу электронных пар, образующих ковалентную связь, различают связи простые – с одной парой электронов и кратные – с двумя или тремя парами.
Основные характеристики ковалентной связи: длина связи (расстояние между центрами атомов в молекуле); энергия связи (энергия, которую необходимо затратить на разрыв связи); полярность связи (неравномерное распределение электронной плотности между атомами, обусловленное различной электроотрицательностью); поляризуемость (легкость, с которой смещается электронная плотность связи к одному из атомов под влиянием внешних факторов); направленность (ковалентная связь, направленная до линии, соединяющей центры атомов).
Атомы некоторых элементов (кислорода, азота, серы, галогенов и др.) расходуют не все внешние электроны для формирования октетной оболочки. Такие электроны называют неподеленные, необобществленные или n-электроны.
Донорно-акцепторная связь или координационная – разновидность ковалентной связи, которая отличается способом образования.
Донор – атом, который должен иметь пару неподеленных электронов, а акцептором может быть любой атом (в том числе и протон), у которого не хватает до образования октета двух электронов.
Например, образование иона аммония протекает по донорно-акцепторному механизму. Ковалентная связь образуется за счет того, что атом азота (донор электронов) отдает неподеленную пару электронов на образование ковалентной связи протону (акцептору электронов):
Вновь образовавшаяся связь Н–N ничем не отличается от остальных связей Н–N, которые имелись у аммиака. Такая связь называется еще координационной.
Семиполярная связь – частный случай донорно-акцепторной связи. Она образуется между атомами, один из которых имеет неподеленную пару электронов, а другой содержит на внешнем энергетическом уровне шесть электронов (секстет), то есть имеет вакантную атомную орбиталь.
Рассмотрим образование семиполярной связи в молекуле оксида триметиламина:
В результате образования связи атом кислорода (акцептор) приобретает отрицательный заряд, а атом азота (донор) – положительный. Такой вид связи обозначают следующим образом:
Соединения с семиполярной связью не проводят электрический ток, несмотря на наличие наряду с ковалентной связью и ионного взаимодействия.
Водородная связь образуется в результате электростатического взаимодействия между атомом водорода, несущим дробный положительный заряд, и неподеленной парой электронов другого атома. Обычно такие атомы водорода называют активными.
Водородную связь графически изображают тремя точками:
Водородная связь бывает внутримолекулярная и межмолекулярная.
Примером соединений с внутримолекулярной водородной связью могут быть салициловый альдегид и о-хлорфенол.
Межмолекулярные водородные связи (МВС) возникают между двумя или большим числом молекул с образованием димеров или ассоциатов:
Прежде чем говорить о строении молекулы и о свойствах различных классов соединений, остановимся на строении атома с точки зрения квантово-механических представлений.
Как уже отмечалось, современная теория химической связи основана на квантово-механическом рассмотрении молекулы как системы из электронов и атомных ядер.
Из курса неорганической химии и физики известно, что электроны представляют собой вид материи, обладающий одновременно свойствами частицы и электромагнитной волны.
Согласно квантовой теории состояние электронов в атоме описывается с помощью четырех квантовых чисел: п – главное квантовое число, l – азимутальное квантовое число, т – магнитное квантовое число и s – спиновое квантовое число.
Электрон в атоме находится на определенной атомной орбитали. Атомная орбиталь – это область пространства внутри которой наиболее вероятно нахождение электрона.
Состояние электрона определяется расстоянием электронного облака от ядра, его формой, ориентацией в пространстве и вращением электрона вокруг собственной оси.
Для атомных орбиталей s-типа характерна сферическая симметрия, для электронов р-типа существуют три одинаковых по энергии гантелеобразной формы орбитали, которые отличаются друг от друга лишь ориентацией в пространстве: рx, рy рz-атомные орбитали. В каждой из них существует узловая область р-орбитали. где вероятность нахождения электрона равна нулю. Для f-атомных орбиталей существуют пять более сложных геометрических форм.
Атомная орбиталь. не занятая электронами, называется вакантной и условно обозначается как □.
ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ
Согласно квантово-механическим представлениям о химической связи число образуемых атомом ковалентных связей определяется количеством одноэлектронных атомных орбиталей, то есть количеством неспаренных электронов. Однако в действительности атомы элементов образуют большее число ковалентных связей, чем содержат неспаренных электронов на внешнем энергетическом уровне. Например, атом углерода в основном состоянии имеет два неспаренных электрона (1s2 2s2 2р2), а образует четыре ковалентных связи. Это можно объяснить возможностью перехода 2s-электрона на 2p-подуровень (1s2 2s1 2р1).
Таким образом, на внешнем энергетическом уровне атома углерода находятся четыре неспаренных электрона: один s и три р. Поскольку химические связи образуются валентными электронами, то связи, например, в молекуле метана СН4 должны были бы быть неравноценными: одна связь С–Н образована s-электроном, а три остальные – р. В действительности в молекуле метана все связи совершенно равноценны. Для объяснения этого факта в квантовой механике вводится понятие о гибридизации атомных орбиталей (АО). Слово гибридизация означает взаимодействие, перекрывание, перемешивание. При взаимодействии одного s-электронного облака с тремя р-электронны-ми облаками образуются четыре качественно новых гибридизированных электронных облака или атомные орбитали: 1s + 3р = 4sp3
Таким образом, из нескольких различных по форме и близких по энергии АО путем комбинирования (смешивания, сочетания) образуется такое же количество одинаковых по форме и равных по энергии гибридизованных атомных орбиталей.
Гибридизованные орбитали по сравнению с негибридизованными более выгодны геометрически, т. к. позволяют увеличить площадь перекрывания с орбиталями других атомов, что ведет к образованию более прочных связей. Результатом перекрывания большей доли гибридной орбитали с орбиталями других атомов является ковалентная связь.
Атом углерода характеризуется тремя видами гибридизации с участием s- и p-орбиталей, каждому из которых соответствует определенное валентное состояние атома.
Состояние sр3-гибридизаиии – результат взаимодействия одной s- и трех р-атомных орбиталей.
Четыре равноценные орбитали между собой образуют угол 109°28′ и ориентированы в пространстве от центра правильного тетраэдра к его вершинам. Такое размещение связано со стремлением АО к максимальному удалению друг от друга за счет взаимного электростатического отталкивания. Расположение атомных орбиталей определяет название состояния sp3 гибридизации как тетраэдрическое.
Состояние sp2-гибридизации – результат взаимодействия одной s- и двух р-орбиталей (рх, pv).\
Образованные три эквивалентные sр2-гибридные орбитали находятся в одной плоскости под углом 120°, поэтому sр2-гибридизация называется тригональной Негибридизованная р-орбиталь расположена в плоскости, которая перпендикулярна плоскости расположения гибридных орбиталей. Условно доля s-облака в каждой из трех sp2-гибридных орбиталей равна 1/3. Такая гибридизация характерна для соединений с двойными связями, например, для этилена.
Третье валентное состояние (sp-гибридизация)
Состояние sp-гибридизации – результат взаимодействия одной s- и одной р-орбитали (рх).
Для описания химической связи с позиций квантовой механики пользуются двумя основными методами: валентных связей (ВС) и молекулярных орбиталей (МО).
Метод валентных связей был предложен в 1927 году В. Гайтлером и Ф. Лондоном. Основные положения метода заключаются в следующем. Химическая связь представлена в виде пары электронов с противоположными спинами. Она образуется в результате перекрывания атомных орбиталей.
При образовании молекулы атомные орбитали остаются без изменений, а пара связывающих электронов локализована между двумя атомами.
В отличие от метода валентных связей метод молекулярных орбиталей рассматривает молекулу не как совокупность атомов, сохраняющих свою индивидуальность, а как единое целое. Предполагается, что каждый электрон в молекуле движется в суммарном поле, создаваемом остальными электронами и всеми ядрами атомов. Иначе говоря, в молекуле различные АО взаимодействуют между собой с образованием нового типа орбиталей, называемых молекулярными орбиталями (МО).
Перекрывание двух атомных орбиталей приводит к образованию двух молекулярных орбиталей.
Одна из них имеет более низкую энергию, чем исходные АО, и называется связывающей орбиталью, другая обладает более высокой энергией, чем образующая ее АО, и называется разрыхляющей или антисвязывающей орбиталью. Заполнение молекулярных орбиталей электронами происходит аналогично заполнению атомных, то есть по принципу Паули и в соответствии с правилом Гунда. Молекулярная разрыхляющая орбиталь в основном состоянии остается вакантной. Ее заполнение электронами происходит при возбуждении молекулы, что ведет к разрыхлению связи и распаду молекулы на атомы.
ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Согласно современным представлениям, природа и механизм взаимного влияния атомов определяется характером распределения электронной плотности в молекуле и поляризуемостью ковалентных связей.
Поляризация одной связи углерод-галоген вызывает поляризацию молекулы в целом и следовательно появление дипольного момента.
По направлению электронного влияния заместителей различают положительный +I и отрицательный –I индуктивный эффект.
Отрицательный индуктивный эффект, как правило, увеличивается с ростом электроотрицательности атомов. Он сильнее выражен для заместителя с тройной связью, т. к. в его составе находится более электроотрицательный sp-гибридизованный атом углерода. В свою очередь атом углерода в sp3-гибридизации, как менее электроотрицательный, в составе заместителя проявляет +I по отношению к атомам углерода в sp и sp2-гибридизации:
Суммируя вышеизложенное, кратко остановимся на основных свойствах индуктивного эффекта:
Сопряженной называется система, в которой имеет место чередование простых и кратных связей, либо соседство атома, имеющего вакантную р-орбиталь или неподеленную пару р-электронов. Сопряженные системы бывают с открытой и замкнутой цепью:
Сопряжение – энергетически выгодный процесс, происходящий с выделением энергии. Сопряженные системы характеризуются повышенной термодинамической устойчивостью.
Дав определение сопряжению и сопряженным системам, рассмотрим электронные эффекты, которые наблюдаются при введении в такие системы различного рода заместителей.
Мезомерный эффект обозначают буквой М, а смещение электронной плотности в сопряженной системе – изогнутой стрелкой. По направляющему действию заместителя мезомерный эффект делится на положительный (+М) и отрицательный (-М).
Положительный мезомерный эффект проявляют заместители (электронодонорные атомы или атомные группы), предоставляющих электроны в сопряженную систему, т. е. имеющие неподеленные пары электронов или отрицательный заряд:
Максимальный +М у атомов с отрицательным зарядом. Заместители, содержащие неподеленные пары электронов, имеют тем больше +М, чем меньше в пределах периода электроотрицательность атомов, содержащих неподеленные пары электронов.
Отрицательный мезомерный эффект проявляют заместители, смещающие на себя электронную плотность сопряженной системы:
Максимальный –М проявляют заместители, несущие положительный заряд. В ненасыщенных группировках –М- эффект возрастает с увеличением разности электроотрицательности атомов кратной связи.
Рассмотрим несколько примеров проявления мезомерного эффекта:
Мезомерный эффект по сравнению с индуктивным вызывает более сильное смещение электронной плотности и практически не затухает.
Совместное проявление индуктивного и мезомерного эффектов заместителя
Мезомерный и индуктивный эффекты одного заместителя могут совпадать и не совпадать по направлению. Например, в молекуле акролеина альдегидная группа – С проявляет –I и –М, а гидроксильная группа в молекуле фенола обладает –I, но +М- эффектом.
Как видно из приведенного примера, в молекуле фенола противоположное электронное смешение приводит к тому, что эти два эффекта как бы «гасят» друг друга. А в молекуле акролеина индуктивный и мезомерный эффекты усиливают друг друга. Мезомерный эффект заместителя обычно больше, чем индуктивный, так как л-связи поляризуются легче, чем о-связи.
В молекулах с открытой цепью сопряжения обычно указывают частичные заряды, которые сосредоточены на концах сопряженной системы:
Величина эффекта гиперконъюгации тем выше, чем больше атомов водорода при углероде, связанном с ненасыщенной системой. Понятие о сверхсопряжении объясняет повышенную реакционную способность, подвижность а-водородных атомов в молекулах альдегидов, кетонов, кислот и их производных. Иногда сверхсопряжение называют по имени открывших его ученых эффектом Натана – Бекера.