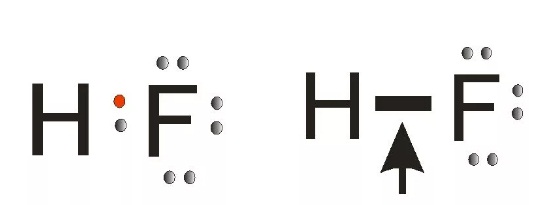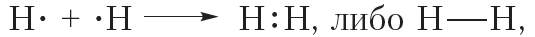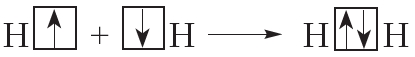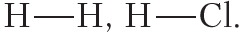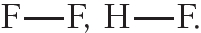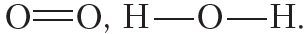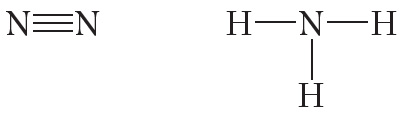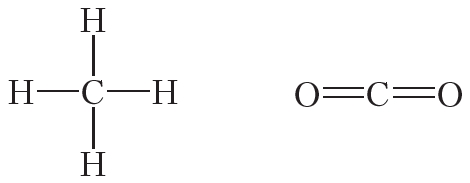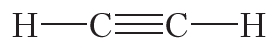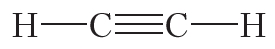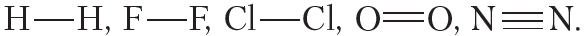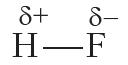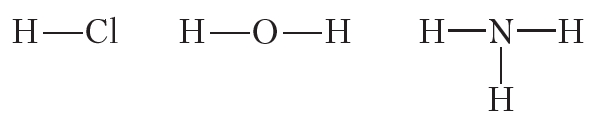за счет чего осуществляется ковалентная связь
Урок №64. Ковалентная связь. Полярная и неполярная ковалентные связи
Сущность и виды химической связи
Атомы стремятся завершить свой внешний уровень (до 8 электронов, исключение водород, гелий до 2 электронов)
В образовании химической связи участвуют валентные электроны. Число валентных электронов определяется по номеру группы, в которой находится атом, образующий химическую связь. Число неспаренных валентных электронов Nе — =8-N группы
Классификация химических связей
1. По способу достижения завершенной электронной оболочки
2. По механизму образования химической связи
3. По способу перекрывания электронных орбиталей
I. По способу достижения завершенной электронной оболочки
КОВАЛЕНТНАЯ СВЯЗЬ
КОВАЛЕНТНАЯ СВЯЗЬ — это связь, возникающая между атомами за счет образования общих электронных пар: H 2 , HCl, H 2 O, O 2
ИОННАЯ СВЯЗЬ
ИОННАЯ СВЯЗЬ – образуется между атомами металлов и неметаллов, т.е. между атомами, резко отличающимися друг от друга по значениям электроотрицательности: NaCl, K 2 O, LiF.
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке.
II. По механизму образования химической связи (только для ковалентной связи)
III. По способу перекрывания электронных орбиталей (только для ковалентной связи)
По степени смещения общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
Каждый атом неметалла отдает в общее пользование другому атому наружные не спаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Образующиеся общие электронные пары смещены в сторону более электроотрицательного элемента согласно ряду электроотрицательности элементов, предложенному американским химиком Л. Полингом.
В результате на более электроотрицательном элементе образуется избыток электронной плотности ( частичный отрицательный заряд δ- ), а на менее электроотрицательном элементе образуется недостаток электронной плотности ( частичный положительный заряд δ+ ).
Самый электроотрицательный элемент – фтор F.
Встречаются исключения, когда ковалентную связь образуют атом неметалла и металла!
AlCl 3 , разница в электроотрицательности ∆ Э.О.
Ковалентная связь. Разбираем задачи, закрепляем тему
История
С момента открытия атомов и молекул исследователи долгое время задумывались над вопросом, какие силы объединяют микрочастицы в молекуле.
В 1897 году Джозеф Джон Томсон выдвинул теорию, что атомы удерживаются рядом благодаря переносу электронов от одного атома к другому и образованию электронных связей. И был прав. Вклад Томсона в науку был отмечен Нобелевской премией в 1906 году за «изучение прохождения электрического тока через газы».
Исследования продолжились, и в 1916 году американский физико-химик Гильберт Ньютон Льюис объяснил это явление, предложив теорию электронной химической связи. В своих опытах ученый заметил, что наиболее устойчивы при взаимодействии электронные оболочки атомов благородных газов. А атомы других веществ стремятся сделать свою энергетическую оболочку похожей на оболочку благородного газа, расположенного в том же периоде. И для этого присоединяют или отдают электроны. Познакомиться с биографией ученого можно в учебнике Химия 8 класс под редакцией В.В. Еремина на странице 218.
Исследователь предложил графическую модель структуры молекулы, в которой электроны обозначены точками, а связи черточками.
Правило октета
Льюис сформулировал принцип «октета». Согласно этому правилу, при создании молекулы атомы стараются достигнуть восьмиэлектронной валентной оболочки, попарно объединяя электроны, находящиеся на внешней орбитали. По важности это открытие сопоставимо с открытием периодического закона Д.И. Менделеевым.
Заглянем в Периодическую таблицу. В первом периоде находятся водород и гелий. Общее у этих двух газов — одна орбиталь. А вот количество электронов различно: у водорода один, у гелия два. Как мы помним, на первой орбитали у любого элемента могут поместиться всего лишь два электрона. И поскольку орбиталь гелия максимально заполнена — это инертный газ, который не вступает в химические реакции. А вот водород ищет себе пару и объединяется в двухатомные молекулы H2 или образует соединения с другими элементами. В остальных периодах на внешней орбитали могут разместиться восемь электронов.
Механизмы образования связи
Взаимодействие, возникающее при образовании общих электронных пар, называется ковалентная химическая связь. При образовании химической связи выделяется энергия в количестве, необходимом для разъединения атомов на расстояние, при котором взаимодействие стало бы невозможным. Такой тип связи характерен для большинства соединений.
Взаимодействие между атомами различных веществ может происходить двумя способами.
От электроотрицательности атомов и их способности притягивать электроны зависит, какая ковалентная связь образуется в молекуле.
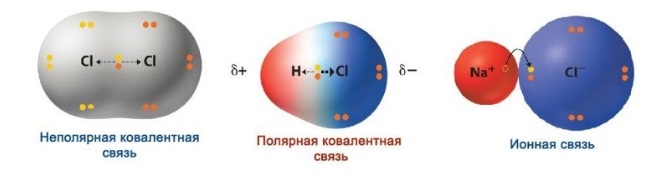
В месте перекрывания электронных облаков создается зона повышенной электронной плотности. Если электроотрицательность элементов равна, электронное облако находится на одинаковом расстоянии от центров атомов, входящих в электронную пару, и образуется ковалентная неполярная связь.
Если электроотрицательность различна, происходит сдвиг электронного облака в сторону центра с большей электроотрицательностью, то есть образуются молекула с двумя полюсами (диполь). Самый простой пример диполя — молекула воды. Данный тип связи и есть ковалентная полярная связь.
Ионная связь — вариант крайне полярной ковалентной связи.
Помимо полярности, ковалентная связь соединения характеризуется и другими параметрами:
Ковалентная связь. Метод валентных связей.
В основе метода валентных связей лежат следующие положения:
1. Ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
2. Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака.
Ковалентная связь – вид химической связи, осуществляемый за счёт образования электронной пары, которая принадлежит обоим атомам. Обозначается «:» или « – ».
По механизму образования ковалентная связь разделяется на:
Обменная ковалентная связь возникает между атомами. Где каждый атом отдаёт по одному неспаренному электрону в общую электронную пару.
Донорно-акцепторная ковалентная связь заключается в том, что один атом (донор) отдаёт электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.
Кроме одинарных связей, может образовываться двойная и тройная ковалентная связь.
Свойства ковалентной связи.
Насыщаемость – способность к образованию строго определённого количества ковалентных связей (от 1 до 6), которая определяет максимально возможную валентность элемента.
Направленность – стремление атомов к образованию наибольшей электронной плотности между ядрами.
Поляризуемость – смещение электронов под влиянием внешнего электрического поля.
Электроотрицательность – это способность атомов оттягивать к себе общую электронную пару.
Химическая связь. Типы химической связи
Диссоциация хлорида натрия в воде
Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Основные типы химических связей — ковалентная, ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь
Основные свойства ковалентных связей
Эти свойства связи влияют на химические и физические свойства веществ.
Насыщаемость — это способность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется валентностью.
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.
Ковалентная неполярная химическая связь
Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
2. Донорно-акцепторный механизм образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В
При этом один из атомов предоставляет неподеленную электронную пару ( донор ), а другой атом предоставляет вакантную орбиталь для этой пары ( акцептор ). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;
– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например , в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Ионная химическая связь
Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов.
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.
+11 Na ) 2 ) 8 ) 1 — 1e = +11 Na + ) 2 ) 8
+17 Cl ) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Обратите внимание:
Наглядно обобщим различие между ковалентными и ионным типами связи:
Металлическая химическая связь
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Межмолекулярные взаимодействия
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение температуры кипения.
§ 4. Ковалентная связь
| Сайт: | Профильное обучение |
| Курс: | Химия. 10 класс |
| Книга: | § 4. Ковалентная связь |
| Напечатано:: | Гость |
| Дата: | Пятница, 12 Ноябрь 2021, 07:01 |
Оглавление
Ковалентная связь
Основным типом химических связей в органических соединениях является ковалентная связь. Рассмотрим механизм её образования и основные характеристики.
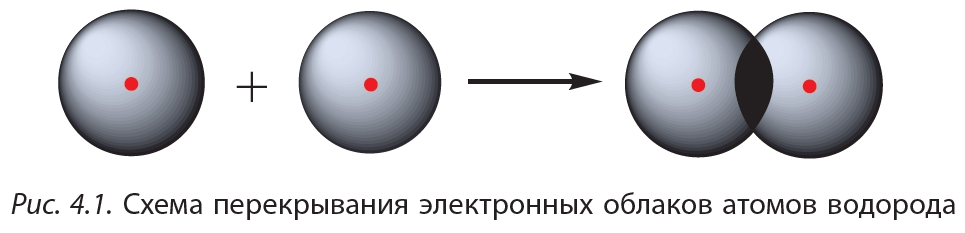
Простейший пример соединения с ковалентной связью — молекула водорода Н2. Атом водорода состоит из положительно заряженного ядра и одного неспаренного электрона, занимающего 1s-орбиталь. При сближении двух атомов водорода происходит перекрывание их электронных облаков:
В результате в пространстве между ядрами происходит увеличение электронной плотности, то есть в этой области концентрируется отрицательный заряд. Этот отрицательный заряд притягивает положительно заряженные ядра, и между атомами формируется химическая связь. Образуется молекула водорода 
Схему образования ковалентной связи между атомами водорода можно представить следующим образом:
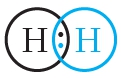
Из представленной схемы видно, что ковалентная связь осуществляется посредством общей электронной пары. В электронных формулах электронную пару обычно обозначают двумя точками, расположенными между атомами. Если вокруг таких атомов описать окружности, видно, что каждый атом водорода в молекуле имеет завершённую электронную оболочку, как у атома гелия:
В структурных формулах ковалентная связь обозначается чёрточкой:
Используя понятие общей электронной пары, можно дать краткое определение ковалентной связи.
| Ковалентная связь — химическая связь, образованная посредством общих электронных пар. |
В молекуле водорода общая электронная пара формируется за счёт неспаренных электронов двух атомов водорода. Следовательно, можно заключить, что число ковалентных связей, которое может образовать элемент, равно числу неспаренных электронов в его атоме.
Например, в атоме водорода один неспаренный электрон, поэтому водород может образовать только одну ковалентную связь. Число ковалентных связей, которое образует данный атом в химическом соединении, называется его валентностью. Например, поскольку валентность водорода равна единице, то в структурных формулах от символа H следует рисовать одну чёрточку:
Рассмотрим основные характеристики ковалентной связи.
Кратность ковалентной связи
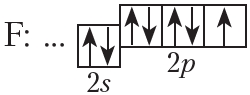
На внешнем слое атома фтора имеется один неспаренный электрон, поэтому валентность фтора в соединениях равна единице.
От символа F в структурных формулах следует рисовать одну чёрточку:
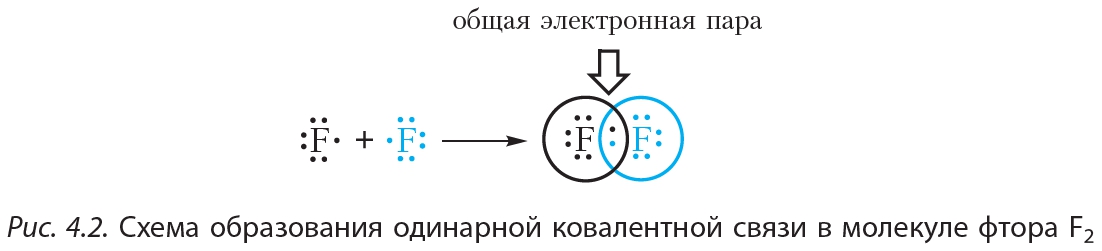
На рисунке 4.2. показана схема образования ковалентной связи в молекуле фтора:
В молекуле фтора атомы связывает одна общая электронная пара. Такая связь называется одинарной.
На внешнем слое атома кислорода имеется два неспаренных электрона, поэтому валентность кислорода в соединениях равна двум.
От символа O в структурных формулах следует рисовать две чёрточки:
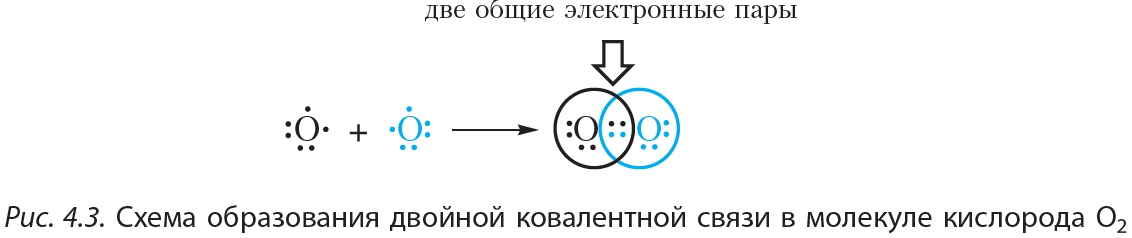
На рисунке 4.3 показана схема образования ковалентной связи в молекуле кислорода:
В молекуле кислорода атомы связывают две электронные пары. Такая связь называется двойной. Двойная связь прочнее одинарной.
На внешнем слое атома азота имеется три неспаренных электрона, поэтому валентность азота в соединениях равна трём.
От символа N в структурных формулах следует рисовать три чёрточки:
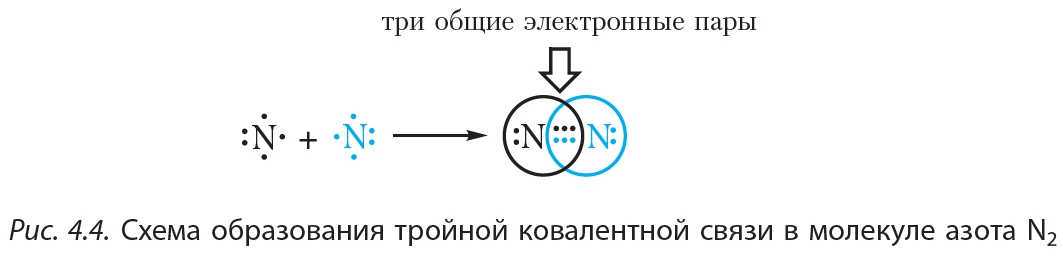
На рисунке 4.4. показана схема образования ковалентной связи в молекуле азота:
В молекуле азота атомы связывают три электронные пары. Такая связь называется тройной. Тройная связь прочнее одинарной и двойной.
Двойные и тройные связи имеют общее название кратные.
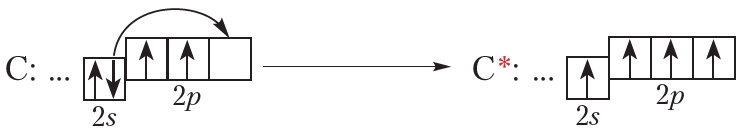
В основном состоянии на внешнем слое атома углерода имеется два неспаренных электрона. Однако, атом углерода легко переходит в возбуждённое состояние, в котором имеется четыре неспаренных электрона:
В связи с этим валентность углерода может быть равна четырём. В большинстве соединений углерод четырёхвалентен. Поэтому в структурных формулах от символа C следует рисовать четыре чёрточки:
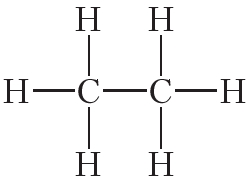
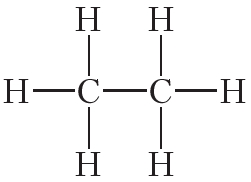
Атомы углерода могут связываться между собой как одинарными, так и кратными связями. Например, в молекуле этана, имеющего состав С2Н6, атомы углерода образуют только одинарные связи:
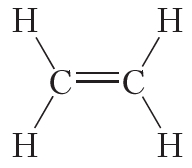
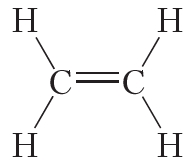
Двойной ковалентной связью атомы углерода соединены между собой в молекуле этилена (С2Н4):
Энергия и длина ковалентной связи
Важнейшими характеристиками ковалентной связи являются её энергия и длина.
Энергия, которую необходимо затратить для разрыва химической связи, называется энергией связи. Энергия связи измеряется в кДж/моль. Чем прочнее связь, тем больше энергии необходимо затратить на её разрыв, следовательно, тем больше энергия связи.
Энергия кратных связей больше, чем одинарных (табл. 4.1). Это вполне понятно, так как для разрушения двух или трёх связей требуется затратить больше энергии, чем для разрыва одной связи.
Атомы, соединённые химической связью, находятся на определённом расстоянии друг от друга. Расстояние между ядрами атомов, образующих связь, называется длиной связи.
Из данных таблицы 1.4 видно, что в ряду этан — этилен — ацетилен с ростом кратности длина связи углерод-углерод уменьшается. То есть при образовании кратных связей атомы сильнее притягиваются друг к другу.
Таблица 4.1. Энергия и длина связи углерод-углерод в некоторых молекулах
Энергия связи углерод-углерод, кДж/моль
Длина связи углерод-углерод, нм
Полярность ковалентной связи
В молекуле водорода H2 ковалентная связь образуется между атомами одного элемента, поэтому общая электронная пара располагается симметрично (посередине) между ядрами атомов. Такая связь называется ковалентной неполярной.
Пример 1. Ковалентной неполярной связью соединяются между собой атомы неметаллов в простых веществах
Кроме того, ковалентная неполярная связь образуется между атомами углерода в этане 
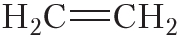

При образовании ковалентной связи между атомами разных химических элементов общая электронная пара смещается к более электроотрицательному атому. Такая связь называется ковалентной полярной.
Напомним, что электроотрицательность — это способность атома в химическом соединении притягивать к себе электроны других атомов. Самый электроотрицательный элемент — фтор (ЭО — 4,1).
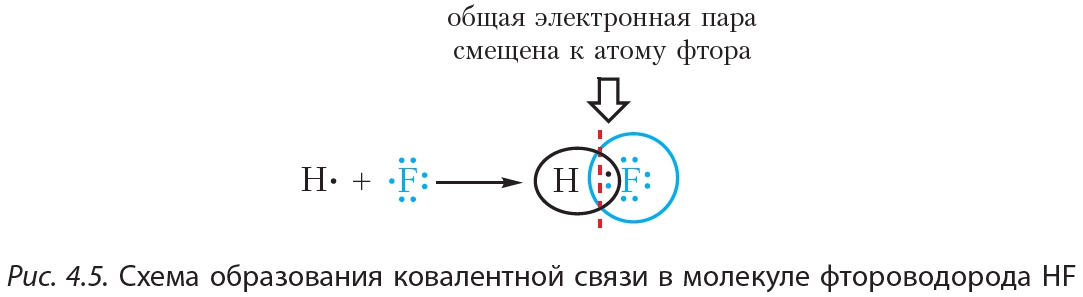
Пример 2. Ковалентная полярная связь в молекуле фтороводорода HF. Молекула 
В результате на атоме фтора возникает частичный отрицательный заряд, на атоме водорода — частичный положительный. Частичные, а не полные заряды возникают вследствие того, что общая электронная пара смещается к атому фтора, но полного перехода электрона от одного атома к другому не происходит. Частичный заряд обозначается греческой буквой δ (дельта):
Связь между атомами водорода и фтора является ковалентной полярной.
Ковалентная полярная связь возникает между атомами неметаллов с различной электроотрицательностью, например в молекулах хлороводорода, воды, аммиака:
Чем сильнее различаются между собой электроотрицательности атомов, образующих ковалентную связь, тем больше будут частичные заряды на атомах и тем более полярной будет связь.
Пример 3. Ковалентные полярные связи в молекулах фтороводорода HF и хлороводорода HCl.
Таблица 4.2. Электроотрицательности и частичные заряды на атомах в молекулах HF и HCl
Частичные заряды на атомах
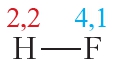
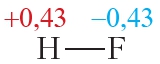
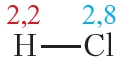
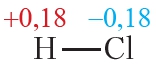
Из таблицы 4.2 видно, что частичные заряды на атомах в молекуле HF значительно больше, чем в молекуле HCl. Следовательно, связь в молекуле HF более полярна, чем в HCl.
Ковалентная связь осуществляется посредством общих электронных пар. В электронных формулах общую электронную пару обозначают двумя точками, расположенными между атомами. В структурных формулах ковалентную связь обозначают чёрточкой.
Ковалентная связь образуется между атомами неметаллов. Между атомами одного и того же неметалла возникает ковалентная неполярная связь. Между атомами разных неметаллов — ковалентная полярная.
Ковалентная связь бывает одинарной, двойной и тройной. Двойная и тройная связи называются кратными.
Чем прочнее связь, тем больше энергия связи. Энергия кратных связей выше энергии одинарных связей. Кратные связи короче одинарных связей.
Вопросы и задания
1. При помощи электронных формул изобразите образование ковалентных связей в молекулах HCl, H2O, NH3, CH4. Укажите валентности элементов в этих веществах.
2. Учитывая, что валентность водорода и хлора равна единице, углерода — четырём, а кислорода — двум, напишите структурные формулы молекул: CCl4, CO2, CH3Cl, C2H6, C2H4, C2H2, C2H5Cl.
3. В какой молекуле, H2O или NH3, ковалентные связи более полярные? Составьте структурные формулы этих молекул и укажите знаки частичных зарядов на атомах.
4. Напишите структурную формулу пероксида водорода H2O2. Укажите полярные и неполярные связи.
5. В какой молекуле, O2 или H2O2, энергия связи кислород-кислород больше?
6. При сильном нагревании может происходить разрыв связей в молекулах. При этом молекулы распадаются на атомы. Какое вещество, Cl2 или N2, будет более устойчиво к нагреванию (термически устойчиво)?