Аутофагия что это такое простыми словами
Аутофагия что это такое простыми словами
Аутофагия как стимулятор омоложения организма
Держи голову в холоде, живот в голоде, а ноги – в тепле. Голод – лучшее лекарство. Чем больше удобств, тем меньше храбрости.
Этой формулой знаменитый русский полководец поделился с миром более 200 лет назад. За всю свою военную карьеру этот человек не проиграл ни одного сражения, напротив – он одерживал победу зачастую над сильно превосходящим по численности противником. Это ли не повод прислушаться к его мудрому наставлению?
И всё-таки, давайте разберемся, в чём кроется секрет великой силы голода, и как пищевая пауза влияет на укрепление физического и ментального здоровья.
В этой статье речь пойдёт не о вынужденном отказе от еды или пищевой изоляции ввиду экстремальных условий. Мы поговорим о процессе в организме, который запускается голоданием – аутофагии [1].
Аутофагия – естественный процесс регенерации и очищения организма на внутриклеточном уровне, посредством которого лизосомы способны перерабатывать ненужные, дисфункциональные компоненты наших клеток. В процессе аутофагии органоиды утилизируют внутриклеточный мусор – поврежденные белки и органеллы; предотвращают и замедляют развитие инфекций и внутренних воспалительных процессов.
В начале 60-х это явление впервые обнаружил биохимик Кристиан Де Дюв, а в 90-х японский ученый Ёсинори Осуми доказал, что аутофагия протекает в человеческом организме тоже. В 2016 году он стал обладателем Нобелевской премии «за открытие механизмов аутофагии». Осуми выяснил, что в период голодания благодаря ферментам в кислой среде лизосомы внутри клетки – начинает перерабатываться аутофагосома (мусор). Она распадается на более мелкие элементы, которыми впоследствии питается обновленная, «очищенная» клетка. Такой механизм после инфекции способен утилизировать внутриклеточные бактерии и вирусы. Поэтому этот процесс необходимо поддерживать для сохранения защитных сил организма – особенно в периоды эпидемий.
Вскоре в 2017 году японский ученый был награжден Премией за прорыв в области медицины. Это неудивительно, поскольку процесс аутофагии положительно влияет на здоровье человека. К примеру, аутофагия способна подавить развитие опухолей на их ранней стадии развития и утилизировать поврежденные белки, которые вызывают болезнь Альцгеймера или Паркинсона. Это можно сравнить с программой, которая чистит жесткий диск от ненужных и спамовых файлов, которые могут засорить процессор и замедлить работу всего компьютера.
Кроме того, термин «аутофагия» обрел особую популярность в диетологии. В результате исследования за 2018 год, опубликованное в журнале «BMJ Case Reports» была установлена взаимосвязь между периодами голодания и нормализацией уровня инсулина в организме, который при нарушенном функционировании влияет на накопление жировой ткани.
[1] В переводе с греческого языка «ауто» – сам, «фагин» – есть.
В каких условиях протекает естественная регенерация?
Наш организм давно знаком с аутофагией. Она необходима для сбалансированной работы всех живых клеток. Простыми словами – этот процесс запускается каждый раз, когда запасы поступающих питательных веществ извне заканчиваются. Тогда клетки вынуждены делиться своими органеллами и макромолекулами, которые впоследствии перерабатываются на элементы, из которых организм синтезирует белки, липиды, углеводы и нуклеиновые кислоты. Тем самым наше тело в качестве «топлива» и строительного материала использует уже «нефункционирующие» частицы, находящиеся в цитоплазме. Именно благодаря такому механизму наши предки могли обходиться без еды в течение большого количества времени.
Но в нынешних условиях процесс аутофагии у современного человека запускается редко из-за постоянного потребления некачественной пищи и синтетических напитков в больших количествах. Такое бездумное и даже опасное питание приводит к чрезмерному накоплению шлаков и токсинов, которые организм не успевает вывести естественным путем – чаще всего во сне за 10-12-часовую пищевую паузу. А если учесть, что мы нередко наедаемся под вечер, нагружая свой желудок мучной, жирной, солёной и сладкой пищей – вредные вещества вместе с ужином вовсе не успевают перевариться, что впоследствии приводит к замедлению пищеварения, воспалениям и снижению иммунитета.
Как запустить процесс аутофагии? Это может быть опасно?
Наше тело работает по «циркадным ритмам» – внутреннему расписанию, которое определяет время выработки кортизола и мелатонина.
Утром вырабатывается кортизол – гормон, отвечающий за энергию и аппетит. А вечером выбрасывается мелатонин, который вызывает чувство сонливости, замедляет внутренние процессы, снижает аппетит – готовит организм ко сну. Поэтому важно перестать есть перед сном, чтобы не нагружать желудок и не сбивать циклы. Иначе ваше замедленное под вечер пищеварение не очень обрадуется дополнительной нагрузке в виде позднего ужина, что плюсом повлияет на снижение качества сна.
Рекомендуется питаться на протяжении 6-8 часов в день – этот период называется пищевым окном. К примеру, ваш завтрак был в 12, следовательно – ужин должен прийтись на 6-8 вечера. Так вы успеете переварить съеденное, разгрузить желудок и подготовить организм ко сну, создав идеальные условия для саморегенерации и других восстановительных процессов – в том числе и расщеплению жировой ткани.
В первые несколько дней голодания перед сном вы, вероятно, будете чувствовать голод. Но вскоре (2-3 дня) вечерний аппетит уменьшается из-за снижения кислотности в желудке. Организм отвыкает перегружаться на ночь и начинает активизировать восстановительные процессы намного быстрее и качественнее.
Однако голодание на более длительный период могут вызвать чрезмерную аутофагию – обильную клеточную гибель (некроптоз и апоптоз). Поэтому следует отслеживать свое самочувствие и сбалансировано питаться в период пищевого окна для получения всех необходимых питательных веществ (суточную норму витаминов).
Что такое аутофагия и действительно ли это путь к вечной молодости
Любовь Карась
У клеток организма есть способность к самовосстановлению, или регенерации. Этот процесс называется аутофагией, и он необходим для адаптации и очищения от «мусора». После открытия этого механизма фармацевтические компании и ученые стремятся разработать лекарства, которые могли бы стимулировать аутофагию. Многие пытаются достичь этой цели посредством голодания. Диетологи из «интернета» обещают легкие способы похудения и омоложения. Но так ли это? Объясняем, как работает процесс аутофагии и связан ли он с голоданием.
Значение для медицины
Аутофагия — естественный процесс регенерации, который происходит на клеточном уровне. Таким образом клетка адаптируется к тяжелым условиям. Например, когда она получает недостаточно питательных веществ извне, она жертвует частью собственных макромолекул и органелл, чтобы получить элементы, из которых могут быть синтезированы необходимые для дальнейшего существования вещества.
Аутофагия позволяет избавиться от поврежденных белков и органелл и тем самым бороться с последствиями старения организма
Аутофагия играет важную роль при ряде заболеваний, включая канцерогенез ❓ Многоэтапный процесс, ведущий к глубокой опухолевой реорганизации нормальных клеток организма. и нейродегенеративные болезни (болезнь Паркинсона и деменцию). Хотя роль аутофагии в канцерогенезе противоречива, отмечает доктор химических наук Александра Евстафьева. С одной стороны, процесс аутофагии способствует выживанию опухолевых клеток, с другой — может стать супрессором развития новообразований (иными словами, предотвращает их).
Напротив, в случае нарушения процессов аутофагии клетки разрушаются, на их месте появляется соединительная ткань. Это часто ведет к развитию сердечной недостаточности, а также к воспалительным процессам, так как часть мертвых клеток не удаляется.
Аутофагия и голодание
Биохакеры и некоторые ученые считают, что один из способов ускорить процесс аутофагии — делать паузы в питании, или, иными словами, начать голодать. Тогда клетка сталкивается с недостатком энергии и самостоятельно начинает вырабатывать необходимые ей вещества. Старый белок уничтожается и становится источником энергии для клеток.
В Кремниевой долине биохакеры создали онлайн-сообщество, где делятся советами и опытом голодания. Участники придерживаются метода «Пост монаха» — 36 часов голодания на воде. По мнению адептов интервального голодания, голод укрепляет иммунную систему, замедляет процесс старения организма и, кроме того, способствует продуктивности.
Однако единого мнения насчет этого нет: ученые до сих пор спорят о плюсах и минусах такого подхода. Сам по себе человек адаптирован к вынужденному голоданию, однако в современном мире это кажется крайне непривычным.
Сам же Осуми не утверждал, что голодание способствует процессу аутофагии. Кроме того, стоит учитывать, что ученый изучал гены аутофагии не людей, а дрожжей
Гарвардская медицинская школа опубликовала гайд, посвященный интервальному голоданию. Эксперты утверждают, что этот способ помогает снизить вес. Это происходит потому, что уровень инсулина снижается, жировые клетки организма начинают расходовать запасенную в них глюкозу и жировая масса уменьшается. Все же длительное или частое голодание может нанести вред здоровью. Перед тем как приступить к подобным практикам, необходимо проконсультироваться с врачом.
Аутофагия
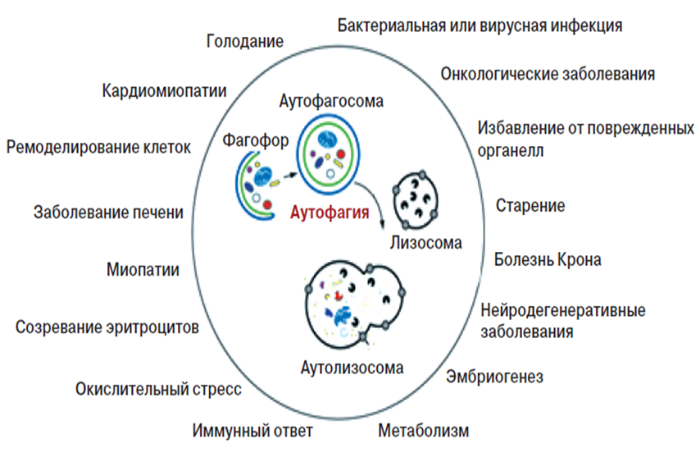
Аутофагия — это процесс прижизненной деградации с помощью лизосом измененного метаболитами содержимого цитоплазмы для поддержания клеточного и энергетического гомеостаза [1]. Аутофагия считается «программируемой» гибелью всей клетки или отдельных ее частей. У млекопитающих аутофагия наблюдается во многих физиологических процессах: реакции на голодание, контролировании роста клеток, процессах врожденного иммунитета и защите от старения, избавлении от долгоживущих белков и поврежденных органелл, при дифференцировке и трансформации клеток (Рис. 1). Это играет важную роль в поиске решений лечения ряда заболеваний, включая канцерогенез и нейродегенеративные болезни [2].
Рисунок 1 | Некоторые физиологические процессы, которые сопровождаются участием аутофагии
Процесс «самопоедания» впервые был отмечен Портером К.Р. и его учеником в 1962 году, когда они сообщили о увеличении числа лизосом в клетках печени крыс после добавления глюкагона и о том, что некоторые лизосомы содержали в себе митохондрии. Термин «аутофагия» ввели в 1963 г. Кристиан де Дюв и Новиков А.Б., описывая его как процесс доставки цитоплазматического материала клетки в лизосомы с целью последующей деградации [3]. О «программируемой» гибели клетки или ее частей заговорили еще в 1990-х годах, когда впервые поступили данные о том, что некоторые группы ученых обнаружили гены, связанные с процессом аутофагии.
Однако только в 2016 году Есинори Осуми получил Нобелевскую премию по медицине и физиологии за исследование аутофагии в дрожжевых клетках и обнаружение с помощью генетического подхода полутора десятков генов, которые отвечают за образование аутофагосом. В дальнейшем исследование функционирования белковых продуктов этих генов привело к выяснению молекулярных механизмов индукции, протекания и регуляции аутофагии [4].
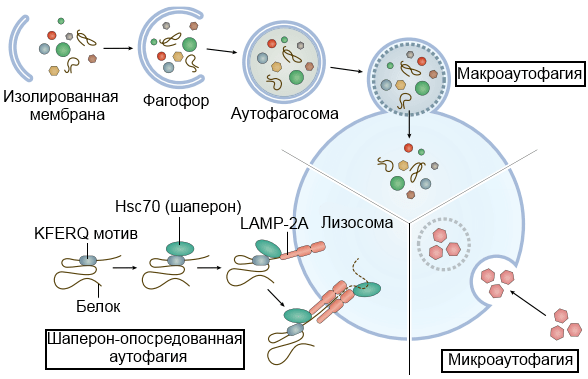
Согласно современным данным, аутофагия подразделяется на три типа: микроаутофагия, шаперон-зависимая аутофагия, макроаутофагия (Рис. 2).
Рисунок 2 | Типы аутофагии
Микроаутофагия. Макромолекулы и обломки клеточных мембран попадают в лизосому путем инвагинации ее мембраны. Благодаря этому клетка может расщеплять белки при нехватке энергии или «строительного материала». Данный тип аутофагии подробно описан и наблюдается у дрожжей, однако слабо охарактеризован у млекопитающих.
Шаперон-зависимая аутофагия. При данном типе аутофагии не требуется реорганизация лизосомальной мембраны или формирование дополнительных везикул. Данный процесс происходит при участии цитоплазматических белков-шаперонов семейства Heat shock protein 70 (Hsp 70), вспомогательных белков и Lysosome-associated membrane protein type 2A (LAMP-2). При участии белков происходит направленный транспорт частично денатурированных белков из цитоплазмы сквозь мембрану лизосомы в ее полость, где они подвергаются деградации.
Макроаутофагия. При данном типе из участка цитоплазмы, окруженного мембранным компартментом, формируются аутофагосомы, которые потом соединяются с лизосомами, образуя аутофаголизисомы. Именно в них и происходит дальнейшая деградация органелл и остального содержимого аутофаголизосомы. При этом процесс аутофагии можно разделить на несколько основных стадий: инициацию, элонгацию, формирование аутофагосомы и формирование аутофаголизосомы. Все стадии процесса контролируются специфическими генами Autophagy-related Genes (ATG). Именно при данном типе аутофагии происходит деградация митохондрий, эндоплазматического ретикулума, пероксисом, рибосом, белков, липидов и РНК.
Существуют и механизмы регуляции процессов аутофагии: сигнальный путь PI3K класса I, активируемый в ответ на ростовые факторы; сигнальный путь PI3K класса III, регулирующий количество аминокислот в клетке, и сигнальный путь LKB1/AMPK, который чувствителен к уровню АТФ. Основным компонентом вышеуказанных путей регуляции является киназа mTOR, которая ингибирует процесс аутофагии в клетках.
Есинори Осуми при изучении белка LC3 млекопитающий, гомолога дрожжевого белка ATG8, обнаружил укороченную и липидированную формы данного белка — LC3-I и LC3-II соответственно. Именно эти формы в настоящее время считаются маркерами аутофагосом и индикаторами аутофагии.
Роль аутофагии в гемопоэзе. Недавние исследования показали, что ген Atg7 является важнейшим регулятором гемопоэтических стволовых клеток, при его отсутствии происходит усиление пролиферации и повреждение ДНК. Также основные белки регуляторы аутофагии (Atg5, LC3, Beclin-1) обнаруживаются в лимфоцитах CD4+ и CD8+, и их содержание повышается в активированных Т-клетках [5]. Кроме того, Atg5 участвует в развитии В-клеток, а его отсутствие приводит к патологиям данного типа клеток.
Аутофагия значительно влияет и на окончательную дифференцировку ретикулоцитов, избавляя их от митохондрий. При ингибировании mTOR процесс аутофагии позволяет уменьшить размер мегакариоцитов и вызывает задержку их дифференцировки. Кроме того, имеются данные, что активация аутофагии является непосредственным участников в формировании иммунного ответа [6].
Роль аутофагии в канцерогенезе. Известно, что неопластические клетки имеют свойство подавлять в себе процессы апоптоза, в связи с этим возможность запустить аутофагию считается более перспективным выходом для супрессии неопластического процесса. Однако по литературным данным указывается, что запуск аутофагии данного типа клеток на разных стадиях канцерогенеза может дать и отрицательные результаты, наоборот ингибируя перерождение нормальных клеток в опухолевые [6]. Кроме этого, аутофагия важна и в процессах опухолевой прогрессии, а именно инвазии и метастазирования.
Роль аутофагии в нейродегенеративных заболеваниях. Возможность клеток самим избавляться от дефектных белков и органелл особенно актуальна для неделящихся долгоживущих клеток, таких как нервные клетки. Так, при болезни Альцгеймера в клетках накапливается агрегаты неправильно свернутого белка бета-амилоида, а при болезни Паркинсона — альфа-синуклеина. Удаление данных частиц может помочь в достижении положительной динамики в вышеуказанных заболеваниях и, как следствие, замедлению их прогрессирования. Однако мутации в ATG-генах, нарушение баланса между образованием аутофагосом и их деградацией в лизосомах приводят к гибели нервных клеток.
Аутофагия вовлечена во многие процессы жизнедеятельности всех клеток организма. И нарушение данного процесса влечет за собой развитие многих патологий. Остаются еще нерешенные вопросы влияния аутофагии на дифференцировку и развитие большинства клеток организма. До сих пор не полностью понятны механизмы ингибирования и супрессии аутофагии и последствия к которым приведет то или иное состояние в отдельных системах организма. Кроме того, остаются споры о влиянии аутофагии на канцерогенез и изменение этого процесса при взаимодействии с различными лекарственными препаратами, но в настоящее время активно продолжаются клинические исследования ингибиторов аутофагии, использование которых представляется перспективным в терапии злокачественных новообразований.
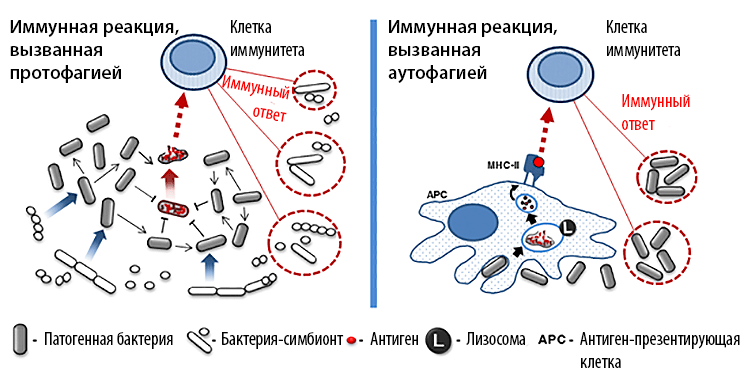
Аутофагия, протофагия и остальные
Протофагия концептуально является аналогом аутофагии в мире микробов
Автор
Редакторы
Аутофагия — это процесс, с помощью которого эукариотические клетки утилизируют свои внутренние компоненты, «переваривая» их ферментами лизосом. Это непрерывный процесс, поддерживающий баланс между синтезом и деградацией и обеспечивающий необходимые условия для нормального клеточного роста, развития и смерти. В этой статье мы обобщаем понятие аутофагии до общего принципа работы живых систем и предлагаем термин протофагия для обозначения прокариотических процессов, подобных аутофагии.
Аутофагия (от греч. αυτος — «само» и φαγειν — «есть»: самопоедание) является клеточным механизмом утилизации избыточных или поврежденных белков, белковых комплексов и клеточных органелл, осуществляемый лизосомами той же клетки. Такая утилизация выполняет несколько важных функций, в том числе — получение питательных веществ при голодании, поддержку клеточного гомеостаза и клеточного иммунитета, осуществление апоптоза и т.п. [1].
Как правило, термин аутофагия применяется для описания внутриклеточных процессов. Однако в определенном смысле ее можно рассматривать и как общий принцип, работающий не только на уровне клеток эукариот, но и в биосистемах других уровней, таких как организм, популяция или даже биосфера в целом. И на всех уровнях организации живого с принципом аутофагии можно соотнести многие известные процессы, — в частности, регуляцию жизнедеятельности бактериальных колоний. Здесь же мы рассмотрим аутофагию в более широком смысле — как процесс поглощения биологической системой своей части для поддержания собственной структуры и жизнедеятельности. Действительно: процессы, аналогичные аутофагии, появляются на разных «этажах» живой материи (см. примеры в таблице 1):
Например, на уровне организма одним из проявлений аутофагии является метаболизм подкожного жира, когда организм при голодании потребляет свою часть (жировую ткань) с перераспределением высвобожденной энергии. Другим примером служит апоптоз — регулируемое «самоубийство» клеток, необходимое для правильного развития любого растительного или животного организма [2].
Аутофагия присутствует и на уровне экосистем. Так же, как эукариотическая клетка постоянно утилизирует старые или дефектные органеллы, в экосистемах одни организмы «поглощаются» и служат источником энергии для других. Такой круговорот энергии и вещества в биосфере известен под термином «трофические цепи», которые можно определить как постоянное перераспределение биологического материала внутри экосистем.
Приведенные выше примеры аналогичны аутофагии в том, что в них для поддержания стабильности целого в жертву приносится часть системы. Так же, как аутофагия требуется эукариотической клетке для поддержания жизнедеятельности во время нехватки питательных веществ, сжигание жира организмом и экосистемные трофические цепи необходимы для адаптации к периодической нехватке энергии и стабилизации энергетического обмена.
Еще одна принципиальная функция процессов, подобных аутофагии, — обновление частей системы с целью поддержания ее стабильности как целого (гомеостаза). Время существования любого дифференцированного сообщества намного больше, нежели время жизни отдельных его частей, — вот тут-то и требуется механизм поддержания стабильности. Стабильность биосистем достигается путем постоянного обновления компонентов через аутофагию. Непрерывная утилизация старых компонентов обновляет биосистему, а также позволяет пополнить энергетические запасы. Этот же принцип используется и на других уровнях: в эукариотической клетке отработавшие свой ресурс органеллы перевариваются лизосомами, уступая место новым. На уровне организма поврежденные клетки элиминируются апоптозом или иммунной системой. В экосистемах отношения хищник–жертва не только поддерживают численность хищных видов, но и регулируют гомеостаз всей экосистемы, очищая ее от слабых и больных животных и предохраняя виды от вырождения.
Аутофагия является распространенным механизмом, используемым на различных уровнях биосферы. Почти любая живая система использует процессы, аналогичные аутофагии, для выживания и саморегуляции. Здесь мы использовали слово «почти», так как аутофагия до сих пор не была описана у прокариот [3]. Принимая во внимание роль аутофагии во всех других биосистемах, отсутствие ее у прокариот выглядит, по меньшей мере, странным. В этой статье мы попытаемся показать, что прокариоты не являются исключением, и аналог аутофагии у них также присутствует, — но обнаружить его можно лишь, если рассматривать прокариотические сообщества не как единичные клетки, а как мультиклеточные «организмы».
Прокариоты как многоклеточные организмы
На сегодня собрано достаточно данных о том, что в природе прокариоты существуют не в виде изолированных клеток, а в виде сложных микробных сообществ [4]. Впервые эта смелая идея была выдвинуты в 80-х годах ХХ века, а сегодня она подкреплена солидной экспериментальной базой. Природные колонии прокариот имеют аналог эндокринной сигнализации внутри сообщества (например, чувство кворума [5]), дифференциацию клеток на специализированные подвиды, а также сложные паттерны коллективного поведения (совместная охота, коллективное переваривание добычи, коллективная устойчивость к антибиотикам [4] и т.п.). Аутофагия как характеристика дифференцированных сообществ вполне может стать еще одним пунктом в этом списке.
«Аутофагия» у бактерий
Типичные аутофагические модели описаны на молекулярном уровне у многих бактерий. Например, при нехватке пищи часть бактерий в колонии выделяет в окружающую среду токсин. При этом только некоторые из них способны производить молекулу антитоксина — белка, который обезвреживает токсин при его попадании в клетку. Такие клетки выживают и поглощают остальные, погибшие и лизированные под действием токсина. Это дает оставшимся в живых энергию, необходимую для споруляции [6], [7]. Подобные процессы обнаружены у многих видов бактерий.
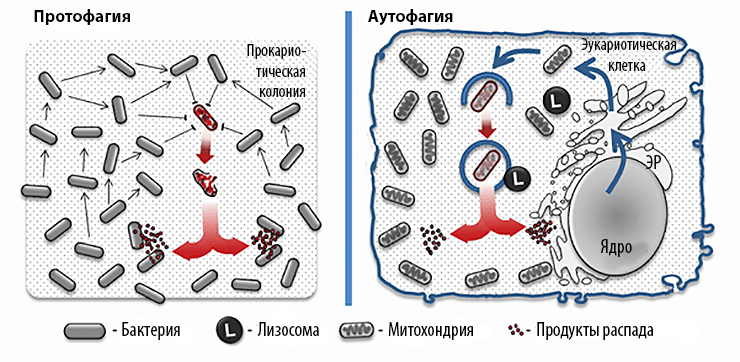
Для простоты описания мы введем термин протофагия как собирательный синоним процессов бактериального каннибализма, альтруизма, аутолиза и запрограммированной клеточной смерти. Прокариотическое сообщество представляет собой целостную биосистему, которая в случае необходимости перерабатывает часть себя для поддержания стабильности. При протофагии аутофагосомой (мембранной везикулы с продуктами деградации) служит сама прокариотическая клетка. Протофагия во многом схожа с аутофагией у эукариот (рис. 1):
Рисунок 1. Принципиальная похожесть протофагии и аутофагии.
Как и эукариотическая аутофагия, протофагия используется не только для получения пищи. Например, протофагия служит патогенным бактериям для инвазии организма-хозяина (рис. 2). Известно, что микрофлора хозяина (симбионты) может эффективно сдерживать рост патогенных микроорганизмов. С целью подавления конкуренции некоторые патогенные бактерии с помощью протофагии активируют антибактериальный иммунный ответ организма-хозяина. Для этого часть патогенной популяции индуцированно самолизируется, высвобождая токсины, что вызывает локальное воспаление. В итоге иммунная система организма уничтожает большую часть бактерий-симбионтов, в то время как патогенные бактерии избегают обнаружения и после окончания воспалительной реакции беспрепятственно размножаются в тканях хозяина [9]. Интересно, что в отсутствие симбионтной микрофлоры (например, при экспериментальном заражении специальных линий стерильных мышей) такие патогенные бактерии заселяют кишечник без индукции воспаления. Это говорит о том, что протофагия тут является специфическим механизмом выживания патогенных организмов, который активируется только при неблагоприятных условиях.
Рисунок 2. Аналогичная роль протофагии и аутофагии в активации иммунного ответа.
Что дает нам концепция протофагии
Введенное понятие протофагии интересно не только как голая теория, но может быть полезно и на практике. Например, в биотехнологии сегодня широко используют бактерии, и манипуляция процессами протофагии может подсказать способ поддержания стабильности бактериальной культуры в промышленных масштабах. Так, активаторы протофагии должны повысить качество культур путем активации естественных механизмов устранения ослабленных и поврежденных микроорганизмов.
Другой важной областью применения протофагии может стать медицина. На сегодняшний день резистентность бактерий к антибиотикам является одной из ключевых фармакологических проблем. Вместо того, чтобы убивать отдельные бактериальные клетки (как это делают сегодня с помощью антибиотиков), можно сконцентрироваться на дезорганизации бактериальных сообществ как единого целого. Такие методы уже разрабатываются — это, например, блокаторы бактериального «чувства кворума», которые нацелены именно на нарушение межклеточной сигнализации в бактериальных колониях, чтобы сделать их уязвимыми для иммунной системы человека [10], [11]. И хотя эта тема только развивается, и вопросов пока больше чем ответов, общий вектор работ показывает, что нарушение коммуникации между отдельными бактериями имеет все шансы стать терапией завтрашнего дня. В этом контексте активаторы протофагии помогут разрушить защитные барьеры бактериальной колонии и сделать ее уязвимой для иммунной системы организма хозяина.
Послесловие
Главный вопрос, который может возникнуть после прочтения этой статьи — а так ли необходимо введение нового термина — протофагия — для описания хорошо известных фактов? На наш взгляд, расширение понятия аутофагии и введение термина «протофагия» необходимо и полезно.
Биосфера в определенном смысле напоминает фрактал, где каждый последующий уровень повторяет предыдущий. Аналогичные процессы похожи между собой не только внешне — все они имеют сходные причины и принципы регуляции. Понятие протофагии, объединяющее разрозненные процессы прокариот вместе, позволяет обобщить и лучше понять глубинные механизмы, регулирующие жизнь прокариотических колоний. Это дает несомненные выгоды для биотехнологии и медицины завтрашнего дня.
Приживется ли термин «протофагия» и найдут ли его полезным другие ученые — покажет время. То, что нам показалось важным, мы изложили в статье, вышедшей в журнале Autophagy [12]. Если микробиологи воспримут эти обобщения и найдут их полезными для себя — нам будет очень приятно. Если же цитируемость нашей статьи не будет бить рекордов — значит, мы ударились в средневековую схоластику и переоценили значимость собственных измышлений. В любом случае, представить данную работу на суд почтенной публике стоило — ведь протофагия является частным случаем аутофагии в бактериальном мире и следует тем же законам, что и остальные ее проявления — будь то аутофагия в эукариотической клетке, трофические цепи в биосфере или голодание по модной методике перед пляжным сезоном, который, кстати, уже на носу.
Написано по материалам оригинального эссе в Autophagy [12].
Аутофагия и её роль в сохранении молодости
Аутофагия: что это такое?
В переводе c греческого “аутофагия” означает “самопоедание”. Причем исключительно в хорошем смысле. Ведь так организм очищается от поврежденных клеток и токсинов.
Тело человека содержит триллионы клеток. Со временем в наших тканях накапливаются различные мертвые органеллы, поврежденные белки и окисленные частицы, которые мешают нормальной работе организма. Это ускоряет эффекты старения и возрастных заболеваний.
Этот механизм регенерации клеток имеет решающее значение для состояния здоровья в целом. Например, дисфункцию аутофагии связывают с несколькими нейродегенеративными расстройствами, включая болезнь Альцгеймера.
Аутофагия – это регулируемый процесс, с помощью которого клетка разрушает свои дисфункциональные или чужеродные компоненты. Затем она может перерабатывать полезные химические компоненты для других целей.
Это позволяет аутофагии регулировать баланс белкового состава в клетке, предотвращать накопление токсичных продуктов жизнедеятельности, поддерживать функцию клеточных органелл, удалять вторгшиеся патогены и поддерживать клетки в периоды низкого энергопотребления из-за голодания.
ВАЖНО: Аутофагию не следует путать с апоптозом, который представляет собой запрограммированную гибель клеток. Это процесс, отличный от устранения дегенерации внутри клеток.
О научной важности понимания аутофагии говорит тот факт, что в 2016 году японский ученый Ёсинори Осуми получил Нобелевскую премию по физиологии и медицине за открытие механизмов аутофагии.
Механизм действия
По сути, аутофагия – это создание «мусорного мешка» (аутофагосома), который собирает клеточные компоненты, а затем доставляет их в «центр переработки» клетки (лизосомы), где они делятся на части и могут быть переработаны в новые компоненты.
Аутофагия обычно запускается недостатком питательных веществ в клетке. Считается, что инсулин подавляет аутофагию, а глюкагон может активировать этот процесс.
После еды тело человека вырабатывает инсулин, а голодание вызывает высвобождение гормона глюкагона, поскольку уровень сахара в крови начинает снижаться. Глюкагон сигнализирует организму о необходимости использования гликогена в печени для повышения уровня сахара в крови.
После активации аутофагии процесс происходит в четыре этапа:
Четвертый и последний этап аутофагии в конечном итоге связан с недостатком клеточных питательных веществ. Использование продуктов распада в конечном итоге необходимо для обеспечения аминокислотами для глюконеогенеза (процесса, при котором организм синтезирует глюкозу из неуглеводных источников).
Аминокислоты служат источником энергии для цикла трикарбоновых кислот (цикла Кребса), и эти аминокислоты могут быть переработаны для синтеза новых белков.
Все процессы аутофагии важны для поддержания баланса или гомеостаза в организме.
Изучайте тонкости антивозрастной медицины из любой точки мира. Для удобства врачей мы создали обучающую онлайн-платформу Anti-Age Expert: Здесь последовательно выкладываются лекции наших образовательных программ, к которым открыт доступ 24/7. Врачи могут изучать материалы необходимое количество раз, задавать вопросы и обсуждать интересные клинические случаи с коллегами в специальных чатах
Как запустить процесс аутофагии
Есть несколько способов активизировать процесс аутофагии в организме. Это поможет очистить свои клетки и снизить уровень воспаления, а также поддерживать тело в отличной форме в целом.
Что может вызвать аутофагию?
Запустить этот процесс может не только голодание в чистом виде, но и так называемое интервальное голодание, когда пища употребляется, например, трижды в день в течение 16 часов, а 8 часов организм отдыхает от процессов пищеварения.
Это говорит о том, что люди могут использовать физнагрузки для запуска процесса самоочищения организма. Уже есть доказательства того, что упражнения усиливают аутофагию в скелетных мышцах человека.
Куркумин – это природное химическое вещество, которое содержится в корне куркумы, популярной во всем мире специи.
Другое исследование на мышах показало, что куркумин помогает бороться с когнитивными нарушениями из-за химиотерапии, вызывая аутофагию в определенных областях мозга.
Хотя эти предварительные результаты обнадеживают, важно отметить, что необходимы дополнительные исследования, прежде чем ученые смогут сделать конкретные выводы относительно воздействия на организм человека.
Роль аутофагии в сохранении молодости
Когда в клетке все работает нормально, аутофагия идет в “фоновом режиме”, помогая перерабатывать изношенные клеточные компоненты.
Но если клетка подвергается стрессу (недостаток питательных веществ или энергии, дисфункциональные компоненты или вторжение микробов), включается аутофагия.
Но как именно она может помочь в продлении молодости?
Активация аутофагии противодействует возрастному накоплению поврежденных клеточных компонентов и повышает метаболическую эффективность клеток. Так они становятся более устойчивыми, помогая противостоять процессам старения.
В частности, аутофагия может быть активирована для удаления дисфункциональных митохондрий, которые производят множество вредных для клеток активных форм кислорода (АФК).
Исследователи предполагают, что эти процессы важны для нескольких состояний и их предупреждения:
Психические расстройства.П Посмертные исследования мозга людей с депрессией и шизофренией выявили дефицит основных путей аутофагии.
Нейродегенерация. Многие нейродегенеративные расстройства возникают из-за накопления деформированных белков в нейронах и вокруг них, вызывая постепенную гибель клеток мозга и последующую потерю умственных способностей. Процесс аутофагии защищает нас, устраняя эти белки.
Прямое удаление микробов изнутри клеток (ксенофагия);
Удаление токсинов, созданных инфекциями;
Модуляция иммунного ответа на инфекции.
Инфекционные микробы (такие как Mycobacterium tuberculosis и Streptococcus группы A), вирусы, такие как ВИЧ, и простейшие удаляются посредством процессов аутофагии.
Это лишь некоторые из известных на сегодняшний день эффектов аутофагии. Она также играет важную роль для работы иммунной системы, очищая тело от токсинов и инфекционных агентов.
А в 2019 году было проведено исследование, посвященное взаимосвязи “самопоедания” и рака. Было обнаружено, что, хотя аутофагия может помочь остановить развитие раковых клеток, она также может способствовать и их росту, в зависимости от стадии опухоли.
Несмотря на то, что существует множество исследований о влиянии аутофагии на клетки, исследователи все еще не уверены в том, может ли усиление этого процесса быть новым способом лечения различных состояний.
Получайте знания, основанные на доказательной медицине из первых уст ведущих мировых специалистов. В рамках Модульной Школы Anti-Age Expert каждый месяц проходят очные двухдневные семинары, где раскрываются тонкости anti-age медицины для врачей более 25 специальностей
Краткие выводы
Хотя исследования показали, что ограничение в питании, физические упражнения и употребление куркумина могут влиять на аутофагию, большинство исследований проводилось на животных.
На сегодняшний день ученые не имеют полного представления о последствиях аутофагии для здоровья и того, как именно люди могут ее вызывать.
Поэтому тем, кто серьезно подумывает об изменении своего образа жизни, чтобы активировать аутофагию, следует заранее проконсультироваться с врачом.
Список использованной литературы
Takeshige, K., Baba, M., Tsuboi, S., Noda, T. and Ohsumi, Y. (1992). Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. Journal of Cell Biology 119, 301-311
Аутофагия
Аутофагия (от др.-греч. αὐτός — сам и φαγεῖν — «есть») — это процесс, при котором внутренние компоненты клетки доставляются внутрь её лизосом и подвергаются в них деградации.
Содержание
Типы и механизмы аутофагии
Сейчас различают три типа аутофагии — микроаутофагию, макроаутофагию и шаперон-зависимую аутофагию. При микроаутофагии макромолекулы и обломки клеточных мембран просто захватываются лизосомой. Таким путем клетка может переваривать белки при нехватке энергии или строительного материала (например, при голодании). Но процессы микроаутофагии происходят и при нормальных условиях и в целом неизбирательны. Иногда в ходе микроаутофагии перевариваются и органоиды; так, у дрожжей описана микроаутофагия пероксисом и частичная микроаутофагия ядер, при которой клетка сохраняет жизнеспособность.
При макроаутофагии участок цитоплазмы (часто содержащий какие-либо органоиды) окружается мембранным компартментом, похожим на цистерну эндоплазматической сети. В результате этот участок отделяется от остальной цитоплазмы двумя мембранами. Такие двухмембранные органеллы, окружающие удаляемые органеллы и цитоплазму, называются аутофагосомы. Аутофагосомы соединяются с лизосомами, образуя аутофаголизосомы, в которых органеллы и остальное содержимое аутофагосом перевариваются.
Видимо, макроаутофагия также неизбирательна, хотя часто подчеркивается, что с помощью нее клетка может избавляться от «отслуживших свой срок» органоидов (митохондрий. рибосом и др.).
Третий тип аутофагии — шаперон-опосредованная. При этом способе происходит направленный транспорт частично денатурировавших белков из цитоплазмы сквозь мембрану лизосомы в ее полость, где они перевариваются. Этот тип аутофагии, описанный только для млекопитающих, индуцируется стрессом. Она происходит при участии цитоплазматических белков-шаперонов семейства hsc-70, вспомогательных белков и LAMP-2, который служит мембранным рецептором комплекса шаперона и белка, подлежащего транспорту в лизосому.
При аутофагическом типе клеточной гибели перевариваются все органеллы клетки, оставляя лишь клеточный дебрис, поглощаемый макрофагами.
Регуляция аутофагии
Аутофагия сопровождает жизнедеятельность любой нормальной клетки в обычных условиях. Основными стимулами к усилению процессов аутофагии в клетках могут служить
Кроме голодания, аутофагия может индуцироваться окислительным или токсическим стрессом.
В настоящее время на дрожжах детально изучаются генетические механизмы, регулирующие аутофагию. Так, для образования аутофагосом необходима активность многочисленных белков Atg-семейства (autophagosome-related proteins). Гомологи этих белков найдены у млекопитающих (в том числе и человека) и растений.
Значение аутофагии при нормальных и патологических процессах
Аутофагия — один из способов избавления клеток от ненужных органелл, а также и организма от ненужных клеток.
Особенно важна аутофагия в процессе эмбриогенеза, при так называемой самопрограммируемой клеточной гибели. Сейчас этот вариант аутофагии чаще называют каспаза-независимым апоптозом. Если эти процессы нарушаются, а разрушенные клетки не удаляются, то эмбрион чаще всего становится нежизнеспособным.
Иногда благодаря аутофагии клетка может восполнить недостаток питательных веществ и энергии и вернуться к нормальной жизнедеятельности. Напротив, в случае интенсификации процессов аутофагии клетки разрушаются, а их место во многих случаях занимает соединительная ткань. Подобные нарушения являются одной из причин развития сердечной недостаточности.
Нарушения в процессе аутофагии могут приводить к воспалительным процессам, если части мёртвых клеток не удаляются.
Особенно большую (хотя и не до конца понятную) роль нарушения аутофагии играют в развитии миопатий и нейродегенеративных болезней. Так, при болезни Альцгеймера в отростках нейронов пораженных участков мозга наблюдается накопление незрелых аутофагосом, которые не транспортируются к телу клетки и не сливаются с лизосомами. Мутантные хантингтин и альфа-синуклеин — белки, накопление которых в нейронах вызывает, соответственно, болезнь Хантингтона и болезнь Паркинсона — поглощаются и перевариваются при шаперон-зависимой аутофагии, и активация этого процесса предотвращает образование их агрегатов в нейронах.
Что такое аутофагия и как ее активировать в собственном теле (2022-04-27 17:21:01)
Что такое аутофагия и как ее активировать в собственном теле
На самом деле за «страшным» термином скрывается очень полезный процесс в организме, который фактически отменяет старение (или по крайней мере его замедляет)
Представьте: где-то в вашем организме есть тайная опция по уничтожению «клеточного мусора», который провоцирует старость. Нажимая определенную «кнопку», вы запускаете антиэйдж-процесс — ликвидацию чужеродных элементов внутри клеток вашего организма. Нет, это не утопия из рекламной брошюры, а научное явление под названием аутофагия. И рычаги по ее запуску в теле можно найти.
Слово «аутофагия» берет корни из древнегреческого языка. «Ауто» переводится как «сам», «фагеин» — «есть», «поедать». А само явление можно описать как поглощение клеткой ненужных ей компонентов практически без остатка. Иными словами, клетки нашего организма могут сами переваривать и утилизировать определенные элементы.
Хорошо это или плохо — вопрос в научном сообществе спорный. Ведь процесс аутофагии, к примеру, способствует выживанию канцерогенных клеток. Однако по этому же принципу здоровая клетка может избавляться и от дефектных белков и органелл. Рассмотрим эту сторону медали: что может помочь запустить процесс уничтожения вредоносных компонентов?
Бельгийский ученый Кристиан Де Дюв, исследуя инсулин, обнаружил интересное поведение органелл, которые назвал лизосомами. Он предположил, что они умеют получать энергию из «мусора», содержащегося в клетках, — но не работают, пока в последних накоплено достаточно энергии. «Просыпаются» лизосомы тогда, когда заканчивается инсулин. Образно говоря, они начинают работать, только сильно проголодавшись. Именно в этот момент лизосомы начинают активно уничтожать ненужные организму «отходы» — плоды наших вредных привычек. Ну а один из лучших способов опустошить энергетические запасы клеток и запустить аутофагический процесс — провести хорошую тренировку.
Пользу интервального голодания подтверждают как минимум эндокринологи: по их словам, многочасовые перерывы между приемами пищи понижают уровень инсулина и стимулируют выработку лептина — гормона, стимулирующего использование жировых запасов. Кроме того, периодическое воздержание от пищи снижает риск сердечно-сосудистых заболеваний, а также уровень сахара и холестерина. Однако прямая взаимосвязь интервального голодания и аутофагии биологами не подтверждается. Японский ученый Ёсинори Осуми (последователь вышеупомянутого Де Дюва), получивший Нобелевскую премию за исследование аутофагии, на одной из конференций лишь предположил, что «диета» поможет запустить процесс. «Я никогда не заявлял о том, что голодание способствует аутофагии. Может, я поменяю свое мнение и пойму, что голодание очень полезно для здоровья», — скромно высказался Осуми.
Некоторые ЗОЖ-энтузиасты утверждают, что процедуры с перепадом температур (баня, сауна, контрастный душ) также стимулируют процесс аутофагии. Однако, вполне вероятно, поклонники «парилки» видят пользу, которую дает не аутофагия, а элементарное закаливание организма, повышающее сопротивляемость бактериям и вирусам. Кроме того, банные ритуалы способствуют усилению кровообращения и выводу токсинов. «Включается» ли при этом аутофагия, ученым только предстоит доказать.
Почему мы исцеляемся, если делаем перерыв в еде на 16 часов. Все подробности об аутофагии (2020-12-04 10:05:42)
Почему мы исцеляемся, если делаем перерыв в еде на 16 часов. Все подробности об аутофагии
Интервальный стиль питания, разработанный на основе открытия нобелевского лауреата 2016 года Есинори Осуми, бьет все рекорды популярности. Он прост, логичен, не требует отказа от привычного и продлевает жизнь.
В середине 60-х шестидесятых годов прошлого века ученые открыли интересное явление – оказывается, клетки способны разрушать и перерабатывать до молекулярного состояния свои собственные неисправные компоненты, шлаки и токсины. Из полученного материала они добывают энергию и строят нужные «детали». А если клетка совсем уж дефектная и ремонту не подлежит, то через этот процесс она самоуничтожается.
Это явление назвали аутофагией – самопожиранием (греч.). Ученый мир пришел к выводу, что это отличный механизм клеточного обновления. И после этого про аутофагию забыли почти на тридцать лет.
Открытие Есинори Осуми
В начале 90-х японский ученый Есинори Осуми вернулся к аутофагии, изучая ее на примере дрожжевых грибков. Он сделал важнейшее открытие: обнаружил гены, ответственные за аутофагию, и выяснил, что они одинаковы и у человека, и у животных, и у дрожжей. Он доказал, насколько этот процесс важен для нашей жизни.
Клеточное «самоедство» дает энергию, если мы голодны, уничтожает вирусы и бактерии, если те попадают в клетку, защищает нас от преждевременного старения и множества болезней.
Если процессы аутофагии в нейронах головного мозга замедлены, в них накапливается вредный белок. Нейроны выходят из строя, и у человека развивается болезнь Паркинсона или Альцгеймера.
А вот с онкологическими болезнями все не так просто. Аутофагия на ранних этапах помогает уничтожению раковых клеток, но делает опухоли более устойчивыми к химиотерапии и облучению на поздних.
А при чем тут голодание?
Есинори Осуми установил, что периоды голодания стимулируют аутофагию и обновление клеток и помогают замедлить процессы старения. Если человек голоден, у него в крови снижается уровень глюкозы и падает производство инсулина, отвечающего за ее доставку в клетки. В ответ на падение инсулина повышается производство гормона глюкагона. Этот гормон приказывает клеткам использовать не внешние «стройматериалы», а внутренние – разбирать самих себя «на запчасти», выбрасывать хлам, а из годного строить свой обновленный вариант. В итоге уничтожается старое и вредное, производится новое, ускоряется обмен веществ. Человек становится бодрее, стройнее и выглядит моложе. Именно этот принцип лег в основу модных интервальных диет.
Начинается активное обновления клеток, если голодать от 12 часов до трех дней. Если голодать меньше, то для восстановления хватает питательных веществ из еды. Если голодать дольше трех дней, обмен веществ замедляется, ткани начинают разрушаться.
Сейчас очень популярно интервальное голодание по двум схемам.
* 16/8. Ты ничего не ешь и пьешь только воду в течение 16 часов. В оставшиеся 8 часов ешь все, что хочешь, – они называются «окном для еды». Если трудно выдержать 16 часов голода, можно остановиться на 14. Меньше нет смысла, аутофагия не запустится.
Совершенно никакой роли не играет, в какой период суток ты отказываешься от еды. Допустимо поужинать в десять вечера и поесть потом впервые на ланче в два дня. Или ничего не есть после четырех и позавтракать в восемь. Главное – выдержать время голодания, чтобы вся еда покинула пищеварительный тракт и клетки организма восполняли затраты энергии, утилизируя все сломанное или старое.
Рекомендуется на «завтрак» приготовить что-то углеводное, чтобы глюкоза побыстрее поступила в кровь. Второй прием пищи – через четыре часа, третий – еще через четыре. Количество еды – как обычно, не меньше. Вес сбрасывается за счет того, что во время голодания запасы жира тоже подчистятся.
В «окне» очень важно трехразовое питание. Если есть реже, потребуются большие порции, чтобы восполнить потребность в питательных веществах. А отсюда возможна дискенезия желчных путей – чтобы выбросить сразу много желчи, спазмы в кишечнике – чтобы всю эту пищу разом на выход направить.
* 5/2. Выбираешь любые два дня в неделю, чтобы голодать и пить только воду. Если только воду не получается, можно что-то до 500 ккал. Кстати, это не так уж мало – например, 400 г 5 % творога, или 300 г постной ветчины, или полплитки шоколада.
Важные детали
Аутофагию замедляет частое дробное питание и избыток сладкого. Если есть слишком часто, непрерывное поступление питательных веществ «расслабляет» ответственные за аутофагию лизосомы, и они долгое время ею вообще не занимаются: «А зачем, вдруг нас опять накормят!» Точно так же действует сладкое, поэтому его можно есть утром, когда нам требуется много энергии, но не перед сном.
Ускоряют аутофагию небольшие и кратковременные стрессы. Причем неважно, какого вида – эмоциональное потрясение или физическая перегрузка. Так что смотри триллеры и ужастики или бегай по парку.
А еще ее стимулируют: кофе, темный виноград, малина, гранаты, клубника, грейпфрут, куркума.
Плюсы интервальной диеты
Не надо готовить особую еду, можно оставить в рационе все привычное, кроме чипсов (жира и соли много) и сладостей (аутофагию тормозят).
Она предупреждает развитие диабета второго типа, некоторых вариантов старческой деменции и неврологических заболеваний, снижает артериальное давление.
Смягчается течение бронхиальной астмы, экземы и псориаза.
Иммунная система гармонизируется и укрепляется.
Из-за повышения концентрации гормона голода прелина улучшается память.
Полно энергии и отличное настроение.
В чем минусы
Длительные периоды голода могут провоцировать булимию – человек начинает есть непрерывно на протяжении всего пищевого окна.
Противопоказания
Беременность.
Диабет первого типа.
Сердечная аритмия – неизвестно, как на голоде сердце себя поведет.
Заболевания желудка и кишечника.
На интервальном питании сидят Дженнифер Анистон, Бейонсе, Филипп Киркоров, Хью Джекман, Екатерина Андреева.
Певец Моби тоже сторонник «голодовок». У него есть свой ресторан, где он часто сидит с друзьями за ужином, и при этом ничего не ест.
Бенедикт Камбербэтч придерживается системы 5/2.
У Холи Берри сахарный диабет первого типа, при котором не рекомендуют интервальные диеты. А ей на практике отлично помогает.
Витамины и другие БАДы в этом случае тоже еда, и в «голодные» 16 часов их принимать нельзя.
Нобелевская премия по медицине и физиологии 2016: за самоедство
03 октября 2016
Нобелевская премия по медицине и физиологии 2016: за самоедство
Аутофагия в переводе с греческого означает «поедание себя» или «самоедство». В каком-то смысле эта собака тоже достойна премии за самоедство.
Автор
Редакторы
В 2016 году Нобелевскую премию по физиологии и медицине присудили профессору Токийского технологического института Ёсинори Осуми. Японский ученый удостоился ее за свои фундаментальные работы, объяснившие миру, как происходит аутофагия — ключевой процесс переработки и реутилизации клеточных компонентов.
Рисунок 1. Дрожжи Saccharomyces cerevisiae — главные герои Нобелевской премии после самого лауреата.
Аутофагия, за изучение которой вручена премия в этом году, — это совокупность процессов, позволяющих клетке при помощи лизосом избавляться от скоплений внутриклеточного «мусора» и пришедших в негодность органелл [3]. В ходе аутофагии компонент клетки, которому суждено быть уничтоженным, окружается двухслойной мембраной, формируя аутофагосому. На следующем этапе с аутофагосомой сливается лизосома, и лизосомные ферменты начинают расщеплять содержимое аутофагосомы до самых мелких молекул. Так клетка уничтожает старые или дефектные компоненты, а «останки» используются повторно. За открытие лизосом в свое время также была присуждена Нобелевская премия по физиологии и медицине: в 1974 году ее получил бельгиец Кристиан де Дюв [4]. Он же, кстати, и придумал термин «аутофагия» в 1963 году. Так что, в определенном смысле, у премии, врученной в этом году, есть своя «нобелевская» история.
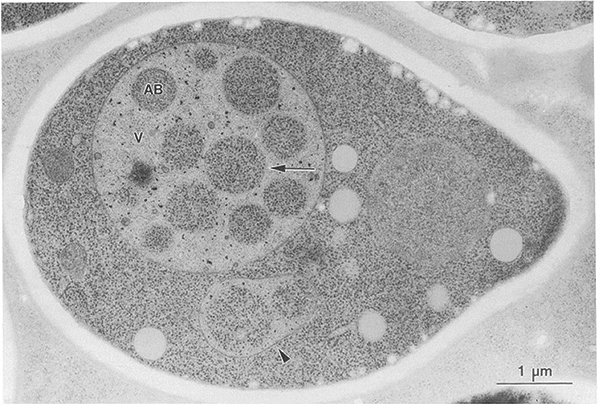
Сам процесс аутофагии был известен с 1960-х годов, но его молекулярные основы оставались для ученых неясными. Чтобы изучить, как протекает аутофагия, Осуми выбрал обычные пекарские дрожжи Saccharomyces cerevisiae (рис. 1). В эксперименте он использовал не простые, а мутантные клетки дрожжей: они были лишены нескольких протеолитических ферментов. Кроме этого ученые дополнительно простимулировали аутофагию, поместив клетки в среду, бедную питательными веществами (а считалось, что клетка начинает заниматься «самоедством» именно в условиях голодания). В цитоплазме клетки стали возникать аутофагосомы, и через три часа вакуоли дрожжей целиком ими заполнились (рис. 2). Ученые исследовали образовавшиеся органеллы, и оказалось, что они по составу и химической активности не отличались от окружавшей их цитоплазмы. Это означало, что процесс аутофагии был приостановлен за счет недостатка протеолитических ферментов [5]. Они должны были поступать из лизосом, но вследствие генетического дефекта ферменты не были синтезированы клеткой.
Рисунок 2. Дрожжевая клетка с вакуолью, заполненной аутофагосомами, в которых не происходит расщепления содержимого. Буквой V обозначена вакуоль, а буквами AB — аутофагосомы, которые не слились с лизосомами.
В этой же работе были опубликованы данные о том, что ключевую роль для блокирования аутофагии у дрожжей сыграло отсутствие фермента протеиназы B, закодированного в гене PRB1. Еще через год были опубликованы данные о 15 ключевых генах, задействованных в аутофагии [6]. Дальнейшие исследования, которые с коллегами проводил Ёсинори Осуми, открыли сложный каскад биохимических реакций, позволяющий дрожжевым клеткам запускать процесс аутофагии [7].
Благодаря работам Ёсинори Осуми другие ученые получили инструменты для изучения аутофагии не только у дрожжей, но и у других живых существ, включая человека. В ходе дальнейших исследований было установлено, что аутофагия — это консервативный процесс, и у людей он происходит приблизительно так же. При помощи аутофагии клетки нашего тела получают недостающие энергетические и строительные ресурсы, мобилизуя внутренние резервы. Аутофагия задействована при удалении поврежденных клеточных структур, что важно для поддержания нормальной работы клетки. Также этот процесс — один из механизмов программируемой клеточной смерти. Нарушения аутофагии могут лежать в основе рака и болезни Паркинсона. Кроме этого, аутофагия направлена на борьбу с внутриклеточными инфекционными агентами, например, с возбудителем туберкулеза. Возможно, благодаря тому, что когда-то дрожжи открыли нам секрет аутофагии, мы получим лекарство от этих и других заболеваний.
Аутофагия что это такое простыми словами
Аутофагия является эволюционным процессом, который направлен на поддержание клеточного гомеостаза путем уменьшения содержания поврежденных органелл и белков, поддержания баланса энергии внутри клетки в стрессовых условиях, которыми являются голодание, гипоксия, гормональная стимуляция, инфекция и другие факторы. При длительном воздействии повреждающих факторов аутофагия, как и апоптоз, может привести клетку к гибели. Представлен обзор роли аутофагии при таких состояниях в репродуктивной системе, как эмбриогенез, имплантация, преждевременная недостаточность яичников, преэклампсия, эндометриоз.
Кафедра репродуктивной медицины и хирургии факультета дополнительного профессионального образования ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, Москва, Россия
Кафедра репродуктивной медицины и хирургии факультета последипломного образования Московского государственного медико-стоматологического университета им. А.И. Евдокимова Минздрава России, Москва, Россия, 127473
Одним из важнейших достижений в репродуктивной медицине за последние три десятилетия явилось лечение бесплодия с помощью вспомогательных репродуктивных технологий (ВРТ), и прежде всего экстракорпорального оплодотворения (ЭКО) с последующим переносом эмбрионов в полость матки. Несмотря на развитие ВРТ, частота наступления беременности остается ниже ожидаемой и составляет 33—35%. Согласно мнению ряда специалистов [1, 2], низкий уровень успешных попыток ЭКО связан с эмбриональными и эндометриальными факторами.
Необходимыми условиями для успешной имплантации и поддержания беременности являются рецептивный эндометрий, функционально нормальная, жизнеспособная бластоциста и тонкий «молекулярный диалог» между бластоцистой и эндометрием.
При переносе эмбрионов высокого качества по морфологическим и хромосомным критериям показатели имплантации остаются на низком уровне, достигая 25—35%. В ретроспективном когортном исследовании, проведенном с 2011 по 2015 г. в США, изучали 998 циклов с преимплантационным генетическим исследованием плода. Установлено, что частота имплантации оставалась ниже 60% после генетического скрининга [3].
Известно, что функциональной единицей яичников являются фолликулы, поддерживающие развитие и созревание ооцитов, которые затем подвергаются овуляции и оплодотворению. Залогом жизнеспособного эмбриона является морфологически и функционально нормальный ооцит. В наше время многие женщины стремятся к материнству в возрасте 35—40 лет, когда начинает снижаться овариальный резерв яичников, а у 1—12% женщин в популяции высок риск развития преждевременной недостаточности яичников (ПНЯ), которая обычно диагностируется поздно и приводит к бесплодию [4]. У данной категории пациенток для реализации репродуктивных планов на первом месте стоит ЭКО с донацией ооцитов, но ее эффективность не превышает 6% [5]. Однако большинство пациенток с ПНЯ желают иметь генетически родного ребенка. Таким образом, проблема ПНЯ на сегодняшний день чрезвычайно актуальна и важна, поэтому продолжается научный поиск инновационных методов ранней диагностики и лечения данного заболевания.
Впервые в России в 2019 г. под руководством Л.В. Адамян проведена операция, направленная на активацию функции яичников у пациенток с ПНЯ. Суть метода состоит в том, что после забора коркового слоя овариальной ткани проводят его фрагментацию, а затем производят его реимплантацию. Важным моментом является одноэтапное выполнение данной операции. Благодаря этой технологии активизируется рост первичных фолликулов, повышается уровень эстрадиола, что дает возможность в дальнейшем провести стимуляцию суперовуляции в программе ЭКО и иметь генетически родное потомство. Данный метод также приводит к улучшению качества жизни у данной категории пациенток [5].
Следует отметить, что описаны различные этиологические факторы развития ПНЯ, но этиопатогенез остается неясным на молекулярно-генетическом уровне, и большинство случаев являются идиопатическими.
Считается также, что причина низких показателей беременности в циклах ЭКО во многом обусловлена нарушением восприимчивости эндометрия. Для успешного наступления имплантации и дальнейшего поддержания беременности развитие эндометрия должно быть синхронным с развитием эмбриона. Улучшение восприимчивости эндометрия может повысить результаты ЭКО и переноса эмбрионов (ПЭ) [1, 6, 7].
Рецептивность эндометрия представляет собой физиологическое состояние, при котором возможна имплантация бластоцисты. Этот период восприимчивости эндометрия, также известный как «окно имплантации» («window of implantation» — WOI), длится ограниченное время, в течение которого эпителий эндометрия благоприятен для адгезии эмбриона, последующей инвазии в эндометрий и плацентации. Предполагаемое «окно имплантации» человека теоретически совпадает с 20—24-м днем 28-дневного менструального цикла [1, 6] или 6—10-м днем после пика уровня лютеинизирующего гормона (ЛГ) в крови [8].
Эндометрий является достаточно динамичной тканью, которая подвергается циклической пролиферации, дифференцировке, транспорту клеток, особенно клеток иммунной системы, дегенерации и регенерации под воздействием эстрогенов и прогестерона в соответствии с циклическими изменениями их концентрации в течение менструального цикла. Основная цель этого сложного процесса — успешная адгезия, инвазия и плацентация плода с последующей послеродовой регенерацией [9]. Перед имплантацией в тканях железистого и покровного эпителия эндометрия, стромальных клетках и сосудах, внеклеточном матриксе происходят различные межклеточные, молекулярные и морфологические взаимодействия, экспрессия молекул адгезии, матриксных металлопротеиназ, факторов роста и цитокинов, осуществляющих паракринную, аутокринную, интракринную, юкстакринную регуляцию, необходимую для успешной имплантации [9].
«Молекулярный диалог», который происходит между эмбрионом и эндометрием до и в процессе имплантации, приводит к синтезу и высвобождению молекул в эндометрий. Экспрессия этих молекул временно связана с фазой развития эндометрия. В период секреторной фазы менструального цикла эндометриальный секрет богат углеводами, гликопротеинами, липидами, связывающими и питательными транспортными белками, ионами, глюкозой, цитокинами, ферментами, гормонами, факторами роста, протеазами и их ингибиторами и другими веществами [10]. Состав секрета эндометрия меняется в течение менструального цикла в результате изменений концентрации стероидов яичника в сыворотке крови. Все эти субстраты являются важными источниками питательных веществ, необходимых для протекания метаболических процессов в фетоплацентарной системе, регулируют развитие плаценты, а также модулируют материнские иммунологические реакции к тканям плаценты [9].
Однако роль эндометрия не ограничивается имплантацией эмбрионов. В постимплантационном периоде он создает адекватную «среду обитания» для дальнейшего развития эмбриона на основе сигнальных молекул и обеспечения непрерывного источника питательных веществ растущего эмбриона. Таким образом, ученые пришли к выводу, что микроокружение эмбриона в эндометрии необходимо для успешной имплантации, адекватного питания эмбриона и обеспечения его развития [11].
Важной проблемой остается идентификация периода максимального соответствия развития эмбриона и восприимчивости эндометрия. В последнее десятилетие проведено много исследований, направленных на выявление биомаркеров рецептивности эндометрия. Такие маркеры, как морфология биоптата эндометрия или субэндотелиальный кровоток, широко используются в практике, но, как оказалось, имеют низкую прогностическую значимость [12].
В настоящее время для оценки рецептивности эндометрия используют как инвазивные, так и неинвазивные методы исследования. В качестве инвазивных методов проводится оценка биоптата эндометрия. К неинвазивным методам относятся исследования цервикальной слизи, секрета эндометрия, полученных путем аспирации и/или лаважа. Для исследования материалов используются следующие методы: иммуногистохимический с определением экспрессии рецепторов эстрогена и прогестерона и пиноподий [13], тонкослойная хроматография секрета матки [14], ДНК-микрочип [15], исследования микроРНК [16] и протеомный анализ секреции эндометрия или слизи шейки матки с помощью масс-спектрометрии [17], изучение секретомики эндометрия [16].
С помощью этих методов исследования определяют следующие молекулярные маркеры: интегрин ανβ3 [18, 19]; фактор, ингибирующий лейкемию (LIF) [19]; фактор роста эндотелия сосудов (VEGF) [3]; гепаринсвязывающий эпидермальный фактор роста (HB-EGF) [13, 20]; интерлейкины IL-1, IL-6, IL-11 [18]; матриксные металлопротеиназы (ММРs) и их тканевые ингибиторы (ТIMPs) [21]; гликоделин A [22]; кадгерины и MUC1 [7] и др.
В настоящее время также используют Endometrial Receptive Array (ERA), который позволяет определить экспрессию генов, представленных в микрочипе. Каждый из этих генов имеет диагностическую значимость для определения рецептивности эндометрия [23]. Ограничением теста являются необходимость проведения биопсии эндометрия, потенциальная вариабельность экспрессии генов, вызванная сбором небольшого образца ткани эндометрия из конкретной локальной области, что, вероятно, не сможет характеризовать общее состояние восприимчивости эндометрия, а также отсутствие целесообразности переноса эмбриона в этом же цикле. С развитием технологии альтернативой диагностике восприимчивости эндометрия стало использование протеомных методов исследования секрета эндометрия или слизи цервикального канала шейки матки [12].
Таким образом, высокотехнологичные достижения дали возможность ученым провести исследования в области протеомики, эпигенетики, микроматрицы ДНК для мРНК и микроРНК, а также получить данные, основанные на иммунологических факторах, для выявления потенциальных «кандидатов» в биомаркеры восприимчивости эндометрия. Однако сами ученые, которые занимаются этой проблемой, отмечают, что рост числа биомаркеров еще более усложнил понимание состояния рецептивности эндометрия, так как ни одно исследование не подтверждает высокую специфичность биомаркера и не представляет четких данных о факторах, обеспечивающих гомеостаз в эндометриальных клетках и бластоцисте, и об их взаимодействии [1].
Обязательно нужно отметить, что в циклах ЭКО при проведении суперовуляции яичников из-за высоких концентраций гормонов изменяются состав и экспрессия перечисленных факторов, которые приводят к нарушению гомеостаза в клетках эндометрия и эмбрионов. И есть данные, что частота имплантации намного выше в естественных циклах с переносом криоэмбрионов, чем в непосредственно стимулированных циклах при проведении ЭКО [1].
Известно, что инвазия эмбриона в базальную мембрану эндометрия опосредуется через апоптоз, в результате чего происходит тесный контакт трофоэктодермы с эпителием эндометрия. Спонтанный периодический апоптоз в нормальном эндометрии в менструальном цикле является ключевым фактором в поддержании нормальной структуры и функции эндометрия, в то время как в апоптозе клеток эндометрия в различных фазах эндометриального цикла решающую роль играет клеточная аутофагия [24].
Апоптоз — это запрограммированная гибель клетки. Однако одним из альтернативных механизмов, способствующих деградации и гибели клеток под влиянием ряда неблагоприятных факторов, является аутофагия. Термин «аутофагия» означает «самоедение». Хотя аутофагию изучают в течение 50 лет, прогресс в понимании данного процесса на молекулярном уровне значительно ускорился за последние два десятилетия [25].
Аутофагия является эволюционным процессом, который направлен на поддержание клеточного гомеостаза путем деградации крупных белковых агрегатов, рециркуляции аминокислот, уменьшения количества поврежденных белков или посторонних органелл, переработки питательных веществ и регулирования уровня белка в ответ на внеклеточные сигналы, что способствует выживанию клеток в стрессовых условиях [26]. Индукторами аутофагии могут быть голодание, гипоксия, окислительный стресс, патогенная инфекция, гормональная стимуляция и пр. [27].
Известны три основных типа аутофагии: макроаутофагия, микроаутофагия и аутофагия, опосредованная шаперонами [19]. Макроаутофагия — это путь, который приводит к массовой деградации цитоплазматических компонентов, таких как белки и органеллы, через лизосому. Индукция аутофагии приводит к образованию двухмембранной структуры, известной как изолирующая мембрана (фагофор), которая развивается и поглощает цитоплазматические компоненты, по мере ее удлинения образуя структуру, называемую аутофагосомой. Внешняя мембрана аутофагосомы затем сливается с лизосомой, образуя аутолизосому, а лизосомальные ферменты разрушают цитоплазматические компоненты, выделенные аутофагосомой. В отличие от других органелл жизнь аутофагосомы короткая. Аминокислоты, образующиеся при разложении цитозольных компонентов, могут повторно использоваться клеткой. Аутофагосомы участвуют во многих процессах независимо от лизосомальной деградации, включая фагоцитоз, экзоцитоз, секрецию, презентацию антигена, индукцию и модуляцию воспалительной реакции [28]. При микроаутофагии лизосома поглощает поврежденные макромолекулы и органеллы путем инвагинации мембраны лизосомы [29]. Аутофагия, опосредованная шаперонами, способствует транспортировке цитозольных белков в лизосомы. Интенсивность аутофагии, опосредованной шаперонами, и макроаутофагическая активность с возрастом снижаются [30].
Таким образом, аутофагия, как и апоптоз, является механизмом гибели клеток. При нарушении механизмов индукции апоптоза происходит индукция аутофагии. Однако механизмы взаимодействия этих двух процессов изучены недостаточно. В условиях «голодания» клетки гомеостаз внутри нее в первое время поддерживается аутофагией, но при расходе белков и органелл происходит запуск необратимой гибели клетки посредством апоптоза [17].
В процессе аутофагии участвуют фосфатидилинозитол-3-киназа (PI3K)/Akt, AMP-зависимая протеинкиназа (AMPK), митоген-активируемые протеинкиназы, инозитолтрифосфаты и кальций [27].
Наиболее известным молекулярным путем — регулятором аутофагии является путь mTOR (Target of Rapamycin), который находится в комплексе mTOR 1 (mTORC1) и ингибирует аутофагию в условиях повышенного питания для обеспечения гомеостаза. Путь mTOR образует ядро двух различных сигнальных комплексов — mTORC1 и mTORC2 [31]. mTORC1 может способствовать биогенезу липидов и энергетическому метаболизму путем индукции факторов транскрипции и подавления аутофагии [31]. Однако в условиях голодания активность mTOR снижается, что приводит к активации UNC-51-подобной киназы 1 (ULK1), это является начальной стадией аутофагии. Беклин 1, состоящий из комплекса беклина 1, семейства Bcl-2, класса III PI3K (везикулярный белок 34, VPS34) и ATG14L, также играет роль в регуляции аутофагии [32]. Стимуляция этого комплекса увеличивает выработку фосфатидилинозитол-3-фосфата, который регулирует образование аутофагосом. Между тем сигнальный путь PI3K/Akt негативно регулирует комплекс беклина 1 и стимулирует mTOR, тем самым ингибируя аутофагию. Элонгация аутофагосом происходит через две убиквитин-подобные системы конъюгации: систему конъюгации Atg5-Atg12 и систему конъюгации LC3. LC3-II, который образуется путем конъюгирования фосфатидилэтаноламина из LC3-I, включается в аутофагосомы и таким образом распознается как маркер образования аутофагосом [33].
Аутофагия играет важную роль в менструальном цикле, эмбриогенезе, имплантации и развитии беременности [34, 35].
Недавно проведенные исследования выявили наличие апоптоза и аутофагии в эпителиальных клетках эндометрия во время поздней секреторной фазы и в менструальном эндометрии, тогда как низкая активность этих процессов обнаружена во время пролиферативной фазы и в начале секреторной фазы. В исследовании в качестве биомаркера аутофагии клеток эндометрия оценивали уровень экспрессии MAP1LC3A-II (Microtubule associated protein 1 light chain 3), который играет важную роль во время этапа элонгации аутофагосомы. Экспрессия MAP1LC3A-II увеличивалась и достигала максимального уровня в железистых клетках эндометрия во время поздней секреторной фазы менструального цикла. Кроме того, в MAP1LC3A-позитивных железистых клетках секреторного эндометрия наблюдалась интенсивная иммунореактивность расщепленной каспазы 3, маркера апоптоза [36]. Согласно данным исследований, апоптоз эндометриальных желез и стромальных клеток во время менструального цикла контролируется стероидами яичников — эстрогеном и прогестероном. В пролиферативную фазу происходят эстроген-индуцированная активация антиапоптотических генов и ингибирование проапоптотических генов. С другой стороны, прогестерон ингибирует вызванные эстрогеном антиапоптотические эффекты в эпителии эндометрия [22]. Если не развивается беременность, наступает менструация, которая характеризуется активацией проапоптотических факторов и индукцией апоптоза. Следовательно, аутофагия клеток эндометрия может быть непосредственно вовлечена в регуляцию цикла эндометрия и тесно связана с индукцией апоптоза [37].
В течение I триместра беременности плацента развивается в условиях физиологической гипоксии, при которой кислородное напряжение составляет примерно 2%, и низкого уровня глюкозы [38]. Гипоксия и низкое содержание питательных веществ, которые обычно вредны для других клеток, для трофобластов оказались предпочтительными на ранних сроках беременности (до 11 нед гестации), в результате чего экстравиллярные трофобласты проникают в эндометрий до 1/3 миометрия матки и мигрируют вдоль просвета спиральных артериол [35]. Таким образом, трофобласты эволюционно получают механизмы приспособления к стрессу, которые основаны на аутофагии. Трофобластная инвазия и ремоделирование сосудов необходимы для правильной перфузии плаценты и поддержания роста плода [35]. Это подтверждено в исследовании с использованием мышиной модели, в которой ген Atg7, необходимый для аутофагии, удален в клетках трофобласта. Плаценты, нокаутированные по Atg7, характеризовались меньшими размерами, степенью инвазии трофобласта и недостаточностью ремоделирования сосудов по сравнению с контрольной группой. Это указывает на нарушение плацентации в отсутствие индукции аутофагии, которое характерно также для беременности, осложненной преэклампсией. Таким образом, авторы [39] показали, что физиологическая гипоксия вызывает аутофагию, регулируя инвазию первичных трофобластов и обеспечивая тем самым адекватную плацентацию.
Существует гипотеза относительно этиологии преэклампсии, которая объясняет ее развитие недостаточной инвазией трофобласта и нарушением ремоделирования сосудов [20]. В некоторых исследованиях проведена оценка инвазии трофобласта в зависимости от активности аутофагии, которая показала несколько противоречивые результаты. Согласно результатам исследования, растворимый эндоглин, который в достаточных концентрациях присутствует в сыворотке беременных с преэклампсией, подавляет активность аутофагии, вызывая недостаточную инвазию в экстравиллезных трофобластах. Экспрессия маркера ингибирования аутофагии p62 в экстравиллезных трофобластах у decidua basalis значительно увеличена у беременных с преэклампсией по сравнению с беременными с нормотензией [40].
При преимплантационном развитии эмбриона активируется аутофагия, которая приводит к массовой деградации материнских белков, а продукты распада становятся питательными веществами и сырьем для последующего эмбрионального развития. Существует две системы деградации: убиквитин-протеасомный путь и система аутофагии—лизосомы. Считается, что эти системы поддерживают раннее эмбриональное развитие [41].
Протеасомная деградация избирательно распознает убиквитинсвязанные белки, которые живут недолго. Лизосомально-опосредованная деградация направлена на долгоживущие белки. Цитозольные компоненты, поврежденные органеллы, а также убиквитин-положительные белки доставляются в лизосомы через аутофагосомы, тогда как внеклеточные материалы доставляются через эндоцитоз [42].
Беременные женщины с донорскими ооцитами подвержены большему риску преэклампсии и гестационной гипертонии, чем беременные женщины с собственными ооцитами. Накопление p62 в экстравиллезном трофобласте значительно выше у беременных с донорскими ооцитами, это означает, что ингибирование аутофагии коррелирует с преэклампсией [40]. Но есть и противоречивые данные, в которых авторы предполагают высокую активность аутофагии в преэкламптических плацентах. Электронно-микроскопическое исследование показало наличие аутофагических вакуолей как в синцитиальных слоях, так и в эндотелии в плацентах беременных с преэклампсией [43]. Увеличение MAP1LC3-II и снижение p62 зарегистрированы в плацентах женщин с гипертонической болезнью по сравнению с таковыми при нормотензивной беременности, что указывает на активацию аутофагии [44].
Нарушения в процессе аутофагии приводят к накоплению амилоидных белковых агрегатов, которые способствуют также развитию нейродегенеративных заболеваний [45]. Недавно высказано предположение о важной роли амилоидных белков в развитии преэклампсии. Амилоидные белковые агрегаты обнаружены в более высоких уровнях в моче женщин с преэклампсией, чем у здоровых беременных женщин [46]. Таким образом, аутофагия предотвращает агрегацию белка в трофобластах. Эти белки могут нарушать развитие плаценты через индукцию апоптоза и клеточного старения. Известно, что клеточное старение вызывается апоптозом или подавлением аутофагии в трофобластах и приводит к укорочению или дисфункции теломер. Этот процесс наблюдается при преэклампсии и связан со старением плаценты. Стареющие клетки также изменяют свое микроокружение путем секреции провоспалительных цитокинов, хемокинов, факторов роста и протеаз, известных под общим названием «секреторный фенотип, ассоциированный со старением» [47].
S. Tsukamoto и соавт. [48] в 2008 г. провели исследование и предположили, что аутофагия не играет важной роли в фолликулогенезе или оогенезе, так как ооциты без Atg5 оплодотворяются in vivo. После оплодотворения материнские белки в ооцитах разлагаются и синтезируются новые белки, кодируемые зиготическим геномом. Аутофагия быстро активируется в течение первых 3—4 ч после оплодотворения и продолжается в течение короткого периода времени, затем происходит снижение ее активности, начиная от одноклеточной стадии до ранней двуклеточной стадии. Возможным объяснением снижения аутофагической активности на этом этапе является необходимость избежать случайного расщепления ядерных факторов, имеющих решающее значение для эмбрионального развития. Аутофагия реактивируется в середине двуклеточной стадии и поддерживает высокий уровень активности от 4- до 8-клеточной стадии, прежде чем ее активность опять уменьшается на последующих стадиях. Основные качественные изменения в характере синтеза белка происходят на 4—8-клеточной стадии у мышей. Белки, полученные от матери, хранящиеся в ооците, могут быстро распадаться и заменяться белками, происходящими из эмбрионального генома [48].
В 2013 г. E. Latz и соавт. [49], проведя исследование, пришли к выводу, что эмбрионы с дефицитом аутофагии, полученные из ооцитов без Atg5, останавливаются на стадиях от 4 до 8 клеток при оплодотворении сперматозоидами без Atg5, но эмбрионы, полученные из ооцитов без Atg5 со сперматозоидами Atg5+, переходят к фазе бластоцисты. Эти результаты показывают, что полный дефицит аутофагии может иметь летальный исход для эмбрионов. Кроме того, в эмбрионах с дефицитом аутофагии отмечается снижение скорости синтеза белка из-за накопления материнских белков в ооцитах. Таким образом, аутофагия разлагает материнские факторы, необходимые для преимплантационного развития.
В другом исследовании авторы [4] показали, что дефицит гена индукции аутофагии Atg7, специфический для половых клеток, приводил к уменьшению числа первичных фолликулов яичников на 79% по сравнению с контрольной группой, обусловливая развитие преждевременного истощения яичников. Продемонстрировано также, что дефицит Atg7 приводил к избыточной потере фолликулов в 49% случаев и ооцитов в 52% случаев в неонатальном периоде. Авторы пришли к выводу, что аутофагия может защитить фолликулы и ооциты от чрезмерной атрезии в результате апоптоза в яичниках новорожденных в условиях голодания, которое наблюдается после рождения, т. е. аутофагия необходима для выживания половых клеток во время неонатального периода. Авторы также показали, что сразу после рождения и в течение первых 3—6 ч после рождения происходила немедленная индукция аутофагии, которая подтверждена высокой экспрессией маркера аутофагии LC3 при иммунном окрашивании. А при ингибировании аутофагии в яичниках новорожденных мышей, культивируемых in vitro, наблюдалась потеря зародышевых клеток в условиях голодания. Следовательно, половые клетки весьма чувствительны к состоянию голода, а во время неонатального периода происходит массовая потеря половых клеток. Во время перехода от жизни плода к жизни новорожденного клеткам грозит сильное голодание до тех пор, пока питание не будет восстановлено с помощью питательных веществ молока. Большинство органов приспосабливается к этому послеродовому голоданию путем аутофагии, которое может производить аминокислоты для поддержания энергетического гомеостаза путем аутофагической деградации «собственных» белков.
Относительно недавно обнаружена селективная аутофагия [19]. В определенных условиях аутофагосомы могут избирательно изолировать и разлагать митохондрии, эндоплазматический ретикулум, эндосомы, липидные капли, секреторные гранулы, цитоплазматические агрегаты, рибосомы, патогенные микроорганизмы и вирусы. Например, известно, что аутофагия, включая ксенофагию (селективная аутофагическая деградация микробов), является механизмом уничтожения патогенных микроорганизмов, которые проникли в клетку, что позволяет предположить, что индукторы аутофагии могут быть новым классом антибактериальной терапии [50].
После оплодотворения у большинства видов эукариот рецепторы аутофагии p62 и белок, ассоциированный с рецептором гамма-аминомасляной кислоты (GABARAP), удаляют митохондрии сперматозоидов через митофагию. Митохондриальные белки сперматозоидов разлагаются в основном системой убиквитин—протеасома, но также в этом процессе участвует и селективная аутофагия [51].
Экспериментальная отсроченная имплантация бластоцисты на мышиной модели с помощью овариэктомии показала, что аутофагия в бластоцистах активируется 17β-эстрадиолом (E2), который обеспечивает длительное выживание «спящих бластоцист» [52].
В другом исследовании впервые обнаружено значительное увеличение экспрессии белка LC3-II, связанного с аутофагией, в эндометрии пациенток с рецидивирующей недостаточностью имплантации в сочетании с хроническим эндометритом по сравнению с контрольной группой. Увеличение количества LC3 указывает на активное образование аутофагосом. У пациенток с хроническим эндометрием аутофагия в основном присутствовала в строме эндометрия, где находятся лимфоциты, но не в железах эндометрия. Эти данные могут свидетельствовать о том, что аутофагия оказывает важное влияние на индукцию воспалительной реакции при хроническом эндометрите и последующие изменения в местной цитокиновой среде [53].
Маркеры аутофагии присутствуют в цитотрофобласте, синцитиотрофобласте, экстравиллезном трофобласте и децидуальных клетках стромы и физиологически участвуют в течении ранней беременности. Значительное снижение экспрессии mTORC1 обнаружено у пациенток с хроническим эндометритом, также отмечена аномальная экспрессия IL-10, TGF-β (transforming growth factor-β) и IL-17 у женщин с рецидивирующей недостаточностью имплантации в сочетании с хроническим эндометритом. Сообщалось, что mTOR модифицирует воспалительные реакции путем модулирования иммунопротеасомной деградации [54]. Следовательно, снижение mTORC1 при хроническом эндометрите вызывает усиление аутофагии и местных провоспалительных иммунных реакций, опосредованных цитокинами [49].
В заключение следует отметить, что аномальная экспрессия IL-10, TGF-β и IL-17 у женщин с рецидивирующей недостаточностью имплантации, с хроническим эндометритом в сочетании со сниженным уровнем аутофагии демонстрирует наличие провоспалительных иммунных реакций эндометрия, что связано со снижением восприимчивости эндометрия и частоты наступления беременности [49].
В последнее время начали изучать роль аутофагии в развитии эндометриоза [55, 56]. В исследованиях, проведенных Л.В. Адамян и соавт. [57, 58], обнаружено, что при эндометриозе в клетках наблюдается нарушение антиоксидантных защитных механизмов вследствие окислительного стресса, что приводит к повреждению клеток. Эти данные подтверждаются исследованием, проведенным H. Liu и соавт.[56], которые установили, что в эктопическом эндометрии отмечается экспрессия гипоксия-индуцибельного фактора-1α (hypoxiainducible factor 1-alpha — HIF-1α) и маркера аутофагии белка LC3.
Оценивая полученные результаты, исследователи [56] пришли к выводу, что выраженность процесса аутофагии влияет на механизм образования эндометриоидных гетеротопий, а подавление механизмов аутофагии может стать новой терапевтической мишенью в лечении эндометриоза.
Заключение
Таким образом, изложенные данные позволяют предположить, что аутофагия играет важную роль в обеспечении гомеостаза в репродуктивной системе и организме в целом. Современные данные об этиологии многих заболеваний репродуктивной системы в настоящее время до конца не ясны, а, как известно, лечение должно быть этиопатогенетическим для профилактики рецидивов заболеваний. На сегодняшний день используемые биохимические и морфологические маркеры недостаточно специфичны и являются показателями «поломок» в репродуктивной системе. Дальнейшее изучение аутофагии, более глубокое понимание этиопатогенетических механизмов нарушений откроют новые возможности для разработки методов диагностики, терапии и профилактики многих заболеваний репродуктивной системы человека.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of onterest.
Научное сообщество по изучению
микробиома человека
Термин «аутофагия», в переводе с греческого означающий «самопоглощение», отражает один из важнейших процессов саморегуляции, в ходе которого из функционирующей клетки удаляются как собственные дефектные органеллы и цитозольные белки, так и инородные, патогенные структуры.
В 1960-х годах исследователи впервые обнаружили, что клетка, находящаяся в состоянии энергетической недостаточности или окислительного стресса может разрушать свое собственное содержимое, заключая его в мембраны (фагофоры), постепенно сливающиеся и образующие везикулы (аутофагосомы), которые затем транспортируются в лизосомы для деградации. Этот процесс позже будет назван макроаутофагией.
3 октября 2016 года Нобелевская премия по физиологии и медицине была присуждена Yoshinori Ohsumi за «открытие механизмов аутофагии». Исследователь культивировал мутировавшие дрожжи, лишенные ферментов лизосомальной дегенерации, одновременно лишая их питательного субстрата для стимуляции процессов аутофагии. В лизосомах таких дрожжей были обнаружены крупные скопления аутофагосом, позже Ohsumi выделил ключевые гены, вовлеченные в этот процесс.
Сегодня выделяют три типа аутофагии: макроаутофагия, микроаутофагия и аутофагия, опосредованная белками-шаперонами. Однако именно механизмы макроаутофагии наиболее изучены, а их нарушение ассоциировано с развитием целого ряда заболеваний.
Во многих исследованиях уже продемонстрирована роль механизмов аутофагии в подавлении опухолевой прогрессии, функционировании врожденного и адаптивного иммунитета, регуляции путей системного воспаления, процессах нейродегенерации и старения. Способность клеток к аутофагии может быть скомпрометирована внешними или внутренними факторами, что способствует их преждевременной гибели, и возможно, сокращает продолжительность жизни.
Сегодня способы влияния на генетические и молекулярные механизмы аутофагии рассматриваются как стратегия будущего в терапии и предотвращении развития ряда заболеваний. Наиболее мощными выявленными индукторами процессов аутофагии являются голодание и ограничение количества поступающих с пищей калорий. На этой концепции построены набирающие популярность режимы питания, например такие, как интервальное голодание (intermittent fasting), когда все приемы пищи происходят в течение 8-часового временного окна, за которым следует 16 часов без употребления каких-либо продуктов.
Существуют различные экспериментальные модели интервального голодания, применение которых к лабораторным животным приводило к улучшению когнитивных функций, задержке процессов старения, а также было продемонстрировано вероятное противовоспалительное действие такого типа питания. Отмечалось также увеличение разнообразия состава кишечной микробиоты после соблюдения Рамадана, который можно рассматривать как одну из моделей периодического голодания. Дальнейшие открытия в этой области могут существенно изменить наше представление о здоровом образе жизни.
РОЛЬ АУТОФАГИИ В СОВРЕМЕННОЙ МЕДИЦИНЕ
С середины прошлого столетия научное общество было заинтересовано впервые открытым процессом аутофагии, обнаруженным в 1963 году биохимиком Кристианом Де Дювом (ставшим лауреатом Нобелевской премии по медицине «За открытие, касающиеся структурной и функциональной организации клетки» в 1974 году).
Кристианом Де Дювом были найдены в клетках лизосомы и аутофагосомы, а также то, как они соединялись и разрушали содержимое, пойманное в клетку. Но на этом этапе все открытия завершались.
В 90-х годах произошел прорыв в области научных исканий аутофагии, совершенный Yoshinori Ohsumi, который получил Нобелевскую премию по физиологии и медицине 3 октября 2016 года [1].
Аутофагия (от др.-греч. autos – «сам» и fagos — «есть») — это процесс переработки собственных органелл и макромолекул в клеточных отсеках, которые формируются при слиянии аутофагосом с лизосомами.
Аутофагия является одним из важнейших процессов адаптации как клетки, так и всего организма в целом. Так, в условиях голодания при недостаточности энергетического обеспечения, клетка отдает часть собственных структурных единиц и макромолекул на переработку до мономеров и дальнейшее построение из последних новых белковых структур, нуклеиновых кислот, липидов, углеводов [4].
С другой стороны данный процесс имеет особую роль при повреждении клеточных структур. При этом происходит их захват специализированным компартментом, дальнейшее расщепление до мономеров и постройка новых интактных биологических полимеров и органелл.
История открытия и вклад Yoshinori Ohsumi
Yoshinori Ohsumi начал исследование аутофагии в дрожжевых клетках, в основу которого легла генетическая методика. Он обнаружил 15 генов, кодирующих данный процесс [3]. Осуми установил, что инактивация этих генов ведет к нарушению образования аутофагосом. Ему удалось клонировать и секвенировать эти гены. После чего ученый исследовал функционирование их белковых продуктов, что позволило выяснить молекулярные механизмы запуска, течения и регуляции аутофагии.
Сейчас эти гены называют ATG (Autophagy-related Genes), на данный момент их открыто уже более 30 [1].
Генетику аутофагии легче было изучать на дрожжевых клетках, но наряду с этим проводились исследования на млекопитающих, в ходе которых в их клетках были обнаружены гомологи дрожжевых генов ATG. Следовательно, гены-гомологи дрожжей и млекопитающих довольно-таки похожи. Их белковые структуры различаются лишь малым количеством набора аминокислот, и следовательно белок ATG8 клеток дрожжей гомологичен по своей структуре протеину LC3 млекопитающих.
В настоящее время удалось установить маркёры аутофагосом и индикаторы аутофагии – белки LC3-I и LC3-II. Также в лабораторных условиях выведены мыши с данными белками, связанными с флюоресцентной меткой. Данный факт позволил ученым отследить количественную и качественную стороны аутофагии в различных органах и тканях организма мышей [1].
Помимо того, учеными были выведены трансгенные мыши с удаленным геном, отвечающим за процессы аутофагии в организме. Полученное потомство от таких мышей быстро погибало, что свидетельствует об огромном значении аутофагии в эмбриогенезе и в первые месяцы жизни.
Типы и механизмы аутофагии
Выделяют 3 типа аутофагии: микроаутофагию (она отсутствует у млекопитающих), макроаутофагию (основную и селективную) и шаперон-зависимую аутофагию. При микроаутофагии крупные молекулы и части мембран клеток захватываются лизосомой, где они деградируют до мономеров. Шаперон-зависимая аутофагия опосредована Hsc70 и ко-шаперонами. При данном типе аутофагии белки с поврежденной структурой с шаперонами постпают в лизосомы при помощи специального рецепторного аппарата.
Отдельный механизм лег в основу макроаутофагии. Воздействие специфических сигналов запускает образование фагофора, состоящего из липидной мембраны с включениями белков, кодируемых генами ATG. Далее к фагофору присоединяются и другие ATG-белки, в итоге получаются многокомпонентные комплексы. В результате формируется структура в виде незамкнутой полусферы, окружающей структурные элементы цитоплазмы. Далее мембрана, замыкаясь, формирует фагосому с включенными в нее молекулами и органеллами. При слиянии аутофагосомы с лизосомой образуется аутофаголизосома, под воздействием лизосомальных энзимов в которой происходит расщепление захваченных структур. Именно в данных процессах и принимают участие белковые продукты более 30 генов ATG [1].
Основной активатор аутофагии – белок biclin-1, а главный ингибитор – белок TOR. Белок TOR находится в активном состоянии под влиянием фактора роста, а также в том случае, если в клетке достаточно энергии. Недостаток же энергии блокирует фактор TOR, в результате чего активируется процесс аутофагии. Данный фактор ингибируется рапамицином и ресвератролом (содержится в красном вине) [2].
Значение аутофагии в медицинской практике
В настоящее время ученые всего мира озадачены значением аутофагии и возможностью ее использования в медицинской практике. Аутофагия имеет важное значение при таких заболеваниях, как канцерогенез и нейродегенеративные болезни [5].
Относительно опухолевого роста процесс аутофагии с одной стороны, является ингибитором канцерогенеза в начальных стадиях метаплазии клеток, с другой же стороны, выступает в роли протектора клеток уже сформированной опухоли, создавая их устойчивость к химиопрепаратам, а также повышая способность к регенерации, и как следствие к ускоренному развитию и метестазированию опухолевых клеток.
Сейчас активно ведутся клинические исследования белков-ингибиторов аутофагии, применение которых в лечении рака весьма перспективно. С теоретической точки зрения, к нарушению трофики опухоли, и как следствие, ее деградации и гибели приводит торможение аутофагии в раковых клетках. Понимание механизмов аутофагии и ее регуляции может стать отправной точкой в разработке и внедрении новых лекарственных препаратов [1].
Кодирующие гены белков аутофагии весьма консервативны, поэтому, изучая регуляцию атофогии на дрозофилах, можно прийти к ее пониманию у более высших животных, в том числе у человека [5].
У людей старческого возраста существует ряд нейродегенеративных патологий:
болезнь Альцгеймера, при которой накапливается бета-амилоид,
Возможность вновь запустить аутофагию у людей с подобными нарушениями позволит снизить темп или вообще прекратить накопление в головном мозге дефектных белков. Это было подтверждено в одном из исследований, в ходе которого пациенты с болезнью Паркинсона каждый день принимали лекарственные препараты от лейкемии, активирующие аутофагию. Данное исследование продолжалось 6 месяцев, в течение которых у пациентов улучшались мыслительная деятельность и моторные навыки [5].
Еще одно направление в использовании механизмов аутофагии – борьба с вирусными и бактериальными инфекциями. Необходимо только создать лекарственные препараты, интенсифицирующие процессы аутофагии, и клетки сами смогут без труда избавиться от патогенных возбудителей. Таким образом исчезнет необходимость в синтезировании вакцин против постоянно мутирующих бактерий и вирусов.
Немало важная роль аутофагии заложена в развитие эмбрионов. Она позволяет в быстрые сроки утилизировать отработанные структуры и синтезировать на их основе новые, создавая тем самым благоприятные условия для развития новой жизни. Благодаря интенсификации аутофагии создается возможность регулирования эмбрионального развития.
Чем опасно одно- и двухразовое питание в течение суток?
Многие из нас выросли на трехразовом питании, да еще и с 2-3 перекусами и ночными походами к холодильнику. Но не так давно стала популярной концепция прерывистого голодания, и она стала одной из самых популярных диет в мире.
Суть такой диеты – есть один или два раза в день, а все остальное время – никаких приемов пищи. Но всем ли можно практиковать такой подход? У диетологов есть несколько советов, которым вы можете следовать.
Двухразовый прием пищи – это практика позднего завтрака (например, в 10-11 часов), а затем плотный ужин примерно в 17 или 18 часов. Все остальное время, между этими приемами пищи, допустим только прием жидкости, без перекусов.
Одноразовое питание – это прием пищи вечером, во время ужина, объемом около 1000 ккал, а в течение всего оставшегося дня есть ничего нельзя. Это приводит к достаточно быстрой потере веса. Но насколько полезно есть один или два раза в сутки? Есть ли у такого режима полезные эффекты или такой режим только навредит.
Два приема пищи: за или против?
По мнению ученых, вполне можно комфортно жить, если соблюдать диету, которая включает в себя прерывистое голодание. Но есть и противоположное мнение – для максимального комфорта лучше есть очень небольшими объемами, но каждые два часа, за исключением периода сна. У обеих философий есть свои преимущества и недостатки.
Преимущества прерывистого голодания
Прерывистое голодание и двухразовый прием пищи дают определенные преимущества при правильном соблюдении.
Сейчас проводится все больше и больше исследований – можно ли использовать двухразовое питание в качестве терапевтического инструмента для решения системных проблем и лечения некоторых состояний здоровья.
Тело обладает врожденным интеллектом, чтобы вначале поедать слабые и старые клетки, когда у него нет еды. Это означает, что вы можете инициировать аутофагию как запрограммированную гибель поврежденных и изношенных клеток, что помогает оптимизировать клеточную активность.
В процессе аутофагии возможна и замена клеток, помеченных иммунной системой. Когда ваше тело начинает поглощать старые клетки и имитировать аутофагию, со временем оно также заменяет аутоиммунные клетки, что делает его отличным способом борьбы с аутоиммунными состояниями.
Со временем увеличивается количество стволовых клеток. При относительно длительном голодании тело начинает вырабатывать новые стволовые клетки, и, следовательно, это позволяет повысить клеточную активность, бороться со старением и улучшить энергию в целом.
Производятся кетоны. Эти соединения вырабатываются в печени при голодании или при низкоуглеводной диете, и тело начинает использовать кетоны в качестве источника топлива вместо глюкозы. Мозг любит кетоны.
Недостатки двухразового питания
Длительный период голодания не дает вам права переедать. Избыток пищи после голодания вредит обменным процессам.
Вам необходимо сочетать периодическое голодание со здоровой диетой с низким содержанием сахара и крахмала и высоким содержанием клетчатки, жиров, белков и овощей.
Прерывистое голодание может повысить уровень кортизола в организме, если у вас дисфункция надпочечников. Если вы боретесь со стрессом и проблемами сна, голодать не стоит.
Дисбаланс сахара в крови – периодическая гипергликемия, может ухудшиться.
Если у вас дисбаланс сахара в крови или инсулинорезистентность, прерывистое голодание может быть очень сложной задачей. Чтобы не ухудшить состояние, нужно будет есть больше качественных белков и полезных жиров. Длительное голодание провоцирует симптомы дисбаланса сахара в крови, такие как частый голод или головные боли при позднем приеме пищи.
Поскольку гормоны у женщин очень чувствительны к стрессу, прерывистое голодание не одобряется гинекологами, за исключением некоторых фаз менструального цикла, например, первых дней после менструации. Если у вас есть проблемы с циклом, прерывистое голодание не для вас.
Питание один раз в день
Теория утверждает, что если вы едите всего один раз, значит, вы уделяете больше внимания еде. Это так же, как утверждается адептами, помогает организму использовать накопленный жир, что со временем приводит к потере веса.
Минусы одноразового питания
Врачи с осторожностью относятся к диете OMAD. Некоторые эксперты по фитнесу утверждают, что это потенциально менее вредно, чем экстремальные диеты, которые сокращают потребление калорий или полностью исключают группы продуктов. Но врачи скажут вам, что ни одна крайность не является здоровой даже в краткосрочной перспективе.
Будут наблюдаться резкие спады энергии, усталость, особенно если вы будете придерживаться этого питания более двух недель. Ожидайте раздражительности и нарушения внимания, концентрации. Даже у здоровых взрослых людей, не страдающих диабетом, план OMAD окажет неблагоприятное воздействие на выработку инсулина и секрецию поджелудочной железы. Уровень ЛПНП или плохого холестерина может подскочить.
Идеально, если это будет один прием пищи в день с регулярными небольшими перекусами из фруктов, орехов и сухофруктов. Плюс нужно пить много воды с интервалом в три или четыре часа.
Люди с хроническими заболеваниями должны избегать OMAD и всех радикальных диет. Сюда входят диабетики, люди с дисбалансом щитовидной железы, нестабильным артериальным давлением, жировой болезнью печени, урикемией или подагрой. Люди, принимающие лекарства, пациенты с повышенной кислотностью, кормящие матери и беременные женщины должны избегать этого и других радикальных диетических планов.