Как восстановить дофаминовые рецепторы
Как восстановить дофаминовые рецепторы
Мотивация под санкциями: как восстановить производство дофамина и начать действовать
Привет! На ваших экранах снова Дмитрий Райз, создатель проекта R153, в рамках которого вещаю про эффективное использование ресурсов головного мозга и способы поднять продуктивность при помощи ноотропных веществ.
Сегодня поговорим про компонент нашего мозга, который генерирует мотивацию и желание достигать различные вершины: от похода в «Макдак» до заработка миллиардов каких-либо условных единиц.
Это чудо-вещество называется дофамин — это нейромедиатор и нейрогормон. Вы наверняка слышали о нем, но с той же вероятностью вас ввели заблуждение о его истинной роли.
В этой статье я развею один популярный миф и расскажу о методах, которые помогут взять свой дофамин под контроль.
Как дофамин влияет на ощущение счастья и мотивацию
Дофамин часто называют «гормоном удовольствия» и это очень не правильно, так как на самом деле это нейромедиатор, который отвечает за поощрение. Он вырабатывается в момент предвкушения, преодоления какой-то трудности, которая сулит вам награду.
Когда мозг замечает возможность награды, он выделяет дофамин. Тем самым он приказывает остальному мозгу сосредоточиться на этой награде и во что бы то ни стало получить ее.
Прилив дофамина сам по себе не вызывает счастья — скорее просто возбуждает. Мы резвы, бодры и увлечены. Мы чуем возможность удовольствия и готовы усердно трудиться, чтобы его достичь.
Технически, мы все же получаем удовольствие по достижению желаемого, но дофамин к этому уже не имеет отношения.
В общем, если хотите чувствовать себя счастливыми — у вас должны быть цели и достаточно дофамина, чтобы их достигать. Последнее — крайне важно, так как есть много причин, почему он может быть снижен: от генетики до депрессии.
Хорошая новость в том, что для большинства случаев есть решение в виде веществ и приёмов, которые позволяют исправить все в лучшую сторону.
Пять веществ для повышения уровня дофамина
Для начала о веществах. Это самый простой и довольно действенный способ, но помните про один важный дисклеймер: приём БАДов — это всегда эксперимент. Люди очень разные и невозможно дать какой-то универсальный рецепт, который сработает для всех.
По этой причине важно консультироваться с врачом. Не столько из-за того, что он сможет вас отговорить от потенциальных проблем, сколько из-за того, что он сможет исходя из своего опыта посоветовать, какие факторы надо участь, чтобы ваша ситуация выправилась в правильную сторону.
L-тирозин
Тирозин — незаменимая аминокислота и источник выработки дофамина, эпинефрина и норэпинефрина. Есть ряд обнадёживающих данных, что приём тирозина может влиять на производительность рабочей памяти, особенно при стрессе (исследования 1, 2, 3, 4).
Тирозин также может улучшить креативное мышление. В одном исследовании тирозин даже смягчил когнитивный урон от лишения сна. Однако эффект может быть кратковременным. Некоторые исследования на животных показали, что уровень дофамина быстро возвращается к исходному.
Стандартная доза добавки — 2 грамма на пустой желудок. Если использовать тирозин при стрессе, то нужны более высокие дозы в 100-150 мг на килограмм. Важно: тирозин безопасен, но его нельзя принимать вместе с ингибиторами МАО, диабетикам или раковым больным — проконсультироваться с врачом.
Эндрю Губерман — нейробиолог, популярный стэнфордский профессор, рассказывая в одном из подкастов об «оптимизации мозга и счастье» также упомянул про л-тирозин как помощника в выработке дофамина.
Бакопа монье
Бакопа монье — ползучая трава, которая растет во влажных и болотистых местах (на высоте до 1500 м). Родина этого растения — Индийский субконтинент, но оно распространилось по тропическим регионам. Бакопа также встречается в китайских провинциях Фуцзянь, Тайвань, Гуандун, Юньнань и Сычуань.
Бакопа давно используется в традиционной медицине для продления жизни и повышения когнитивных способностей. Прием добавок может улучшить память, по крайней мере в краткосрочной перспективе. Предположительно, бакопа позитивно влияет на психическое здоровье. Исследований по бакопе пока мало и самые многообещающие длились не более 3 месяцев, зачастую они спонсированы производителями БАДов.
Действующие вещества бакопы монье: бакозиды A и B (улучшают передачу импульсов между нейронами), сапонины A, B и C, тритерпеноидные сапонины, алкалоид брамин, никотинин, герпестин, стигмастанол, β-ситостерин, бетулиновая кислота, D-маннит, стигмастерин, α-аланин, аспаргиновая кислота, глутаминовая кислота, серин и гликозид псевдоююбогенина.
Зафиксировано прямое влияние добавки на дофамин, как раз благодаря Бакозиду-A. По мнению ученых он предотвращает дисфункцию дофаминовых рецепторов и сглаживает его колебания.
Т.е бакопа не увеличивает, а скорее регулирует дофамин, что тоже неплохо, особенно в период восстановления, а не интенсивной работы.
«Майндбустер»: комбинация Л-Тирозна, Бакопы и еще шести веществ
Отдельного упоминания в этом списке требует не отдельного вещества, а комплекса, который содержит в своём составе двух предыдущих «героев», а еще DMAE (ДМАЭ), Кофеин, L-Теанин, Биоперин, Витамин B12, Витамин B3, Витамин B5 и Родиолу Розовую.
Состав «Бустера» — это пример того, как можно кратно увеличить положительный эффект на мозг, если воздействовать не только дофамино-серотониновую систему, но еще подкинуть немного питательных веществ, стимуляторов и «расслябляторов». Выливается это в три основных эффекта:
Энергия и мотивация. У вас появляется больше сил, усталость отступает на второй план. Появляется желание «делать», пассивность меняется на проактивность.
Стрессоустойчивость и качество отдыха. «Серое вещество» становится «прочнее» выдерживает более высокую нагрузку. Переключаться с работы на отдых, в том числе и на сон, становится проще.
Память. Она просто становится лучше. Как в плане качества, так и в плане «скорости». Т.е вы не только хорошо вспоминаете, но и лучше комбинируете информацию.
Естественно, все это имеет место быть только в том случае, если вы прилагаете немало усилий со свой стороны, вливаясь в работу или учебу. Это как жидкость для розжига костра. Если не будет достаточного количества дров и спички, которая зажжет пламя, то никакого огнища не случится.
Это, к слову, относится почти к любым ноотропам и веществам, которые как-то влияют на продуктивность.
Mucuna Pruriens (Мукуна жгучая, Капикачху)
Mucuna pruriens (L.) — природный источник L-DOPA, предшественника нейротрансмиттера дофамина. Двойное слепое исследование показало, что у пациентов с болезнью Паркинсона вдвое быстрее повысилась концентрация L-DOPA и наступил эффект, сравнимый с классическими лекарствами. Напомню, что эта болезнь напрямую связана с дофамином.
Мукуна дала многообещающий результат в ряде испытаний. По сравнению с синтетическими источниками L-DOPA, у мукуны меньше побочек, она принимается более долгое время. А эффект наблюдается после одной дозы.
Стандартный приём добавки — от 12 до 17.5 мг на килограмм веса. Также нельзя принимать вместе с ингибиторами МАО, диабетикам или раковым больным — проконсультироваться с врачом.
L-депренил
L-депренил (селегилин) — это мощный ингибитор МАО-В для лечения болезни Паркинсона, действуя на повышение уровня дофамина и фенетиламина в мозге. В некоторых исследованиях на животных прием L-депренила улучшил обучение. Однако у людей этот эффект более неоднозначный.
Стандартная доза — 5 мг. Будьте готовы к возможным побочкам: сухость во рту, бессонница, эйфория, повышение либидо, повышение артериального давления. И помните, что оральные контрацептивы могут резко увеличить биодоступность L-депренила до опасных значений.
Когда добавки не нужны?
Если у вас появились проблемы со сном, агрессивность или импульсивность — это потенциальный симптом того, что у вас переизбыток дофамина. Лучше прекратить приём веществ. В том числе, если есть серьёзная зависимость.
Как повысить дофамин без добавок
Это более сложный путь, потому что концентрация нужных веществ в еде гораздо ниже. Но здоровое питание — первый шаг к борьбе с любыми проблемами тела:
Ешьте пищу с высоким содержанием магния и продуктов, богатых тирозином. Например, курицу, миндаль, яблоки, авокадо, бананы, свеклу, шоколад, зеленые листовые овощи, зеленый чай, лимскую фасоль, овсянку, апельсины, горох, кунжут и тыквенные семечки, помидоры, куркуму, арбуз и зародыши пшеницы.
Занимайтесь деятельностью, которая приносит вам радость или расслабляет. Тренировки, медитация, йога, массаж, игры с домашним животным, прогулки на природе или чтение книги.
Harvard Health Publishing советует медитации.
Спасибо, что прочитали!
Больше интересного и полезного про то, как настраивать себя на продуктивные будни можно найти на моём телеграм-канале или в группе Вконтакте.
Там выходят посты более короткого формата и анонсы таких больших статей. Подписывайтесь, буду рад увидеть вас среди своих читателей!
Стратегии биомаркеров для дофаминергической терапии
За последние десятилетия разработка методов лечения заболеваний, поражающих центральную нервную систему (ЦНС), столкнулась с многочисленными проблемами, в то время как число людей, страдающих расстройствами ЦНС, значительно выросло, превысив в настоящее время один миллиард людей во всем мире. Проблемы в основном связаны с недостаточным знанием биомолекулярных механизмов, лежащих в основе многих заболеваний ЦНС, а также с плохим пониманием механизмов действия препаратов на ЦНС. Чтобы повысить эффективность лекарств, как фармацевтическая промышленность, так и научное сообщество способствовали внедрению основанных на биомаркерах подходов к трансляционной фармакологии и принятию решений о дозах в клинических условиях.
Анатомия и физиология дафаминергической системы
Дофамин является нейротрансмиттером, который принадлежит к семейству катехоламинов и в основном синтезируется в головном мозге и почках. В головном мозге дофамин вырабатывается в телах дофаминергических нейронов, расположенных в черной субстанции (SN), вентральной области покрышки (VТА) и гипоталамусе. Эти нейроны посылают проекции во многие области мозга, где дофамин хранится и высвобождается, включая полосатое тело (нигростриарный путь), префронтальную кору (PFC) (мезокортикальный путь), прилежащее ядро (NAc) (мезолимбический путь) и гипофиз (тубероинфундибулярный путь). Cледует отметить, что эти пути не представляют все дофаминовые системы в головном мозге. Другие системы, такие как таламическая дофаминовая система, все чаще признаются важными дополнительными компонентами дофаминовых путей мозга.
Присутствие дофамина в мезолимбическом пути связано с положительным подкреплением, вознаграждением и/или удовольствием, в то время как в мезокортикальном пути он участвует в когнитивном контроле поведения. Кроме того, роль дофамина в нигростриарном пути, передаваемом из SN (средний мозг) в скорлупу в дорсальном полосатом теле, заключается в моделировании когнитивных процессов, связанных с вознаграждением, а также психомоторной функции. Тубероинфундибулярный путь проецирует дофаминергические нейроны из гипоталамуса в гипофиз, чтобы модулировать секрецию гормонов, включая пролактин. Дофаминергические пути также проецируются от VTA (средний мозг) к миндалевидному телу, гиппокампу и поясной коре. Таким образом, дофамин одновременно участвует как в эмоциональной обработке, так и в обработке памяти.
Дофаминергические нейроны образуют тесную сеть с рядом других нейронных путей, включая системы холина, глутамата и гамма-аминомасляной кислоты (GABA), что свидетельствует о его возможной роли во множестве сложных процессов. Таким образом, любой препарат, воздействующий на дофаминергические нейроны, может влиять на множественные пути передачи, включая как дофаминергическую, так и другие системы.
Дофаминергические препараты
Дофаминергическая система использовалась для лечения большого количества заболеваний. Из-за его широкого применения в патофизиологии текущие фармакологические усилия в основном сосредоточены на воздействии как на дофаминовые рецепторы, так и на последующие пострецепторные механизмы. К настоящему времени разработаны различные типы дофаминергических препаратов, в первую очередь агонисты дофамина и антагонисты дофамина.
Агонисты дофамина
Антагонисты дофамина
Многие из дофаминергических агентов были открыты с неполным пониманием механизмов их действия, что часто приводило к непредсказуемым побочным эффектам и/или нецелевым эффектам. Только после того, как они были представлены на рынке, были проведены исследования для выяснения способов их действия, которые выявили несколько затронутых ими биохимических путей.
Селективность дофаминергических препаратов
Влияние дофаминергической терапии на уровни эндогенных метаболитов
В опубликованной литературе подчеркивается влияние дофаминергических агентов на всю ЦНС, включая дофаминовый путь, а также норадреналиновый, холинергический, GABA-глутаматный, серотониновый, кинурениновый, оксид азота и эндоканнабиноидный биохимические пути.
Влияние на дофаминовые пути
Биомаркеры дофаминового пути
Влияние на путь норадреналина
Наибольшие концентрации норадреналина в головном мозге обнаруживаются в нейронах голубого пятна. Вне головного мозга он обнаруживается в постганглионарных симпатических волокнах надпочечников и хромаффинных клетках надпочечников. В норадреналиновых нейронах VMAT хранит дофамин в синаптических везикулах, где он превращается в норадреналин с помощью дофамин-бета-гидроксилазы и высвобождается в синаптическую щель. Норадреналин может связываться с альфа- или бета-адренорецепторами, причем первые в основном являются тормозными и расположены пресинаптически, а вторые являются стимулирующими и расположены постсинаптически. Из синаптической щели норадреналин подвергается обратному захвату в пресинаптический нейрон через транспортер норадреналина или метаболизируется до адреналина, дигидроксифенилглицина и метоксигидроксифенилгликоля. В пресинаптических нейронах.
Биомаркеры пути норадреналина
Влияние на путь ацетилхолина
Ацетилхолин (АСh) вырабатывается из холина в пресинаптических нейронах и хранится в везикулах с помощью везикулярного транспортера ацетилхолина. Эти везикулы высвобождают АCh в синаптическую щель, где он связывается с постсинаптическими рецепторами АCh, которые подразделяются на никотиновые рецепторы, модулирующие активность нейронов, и мускариновые рецепторы, вызывающие передачу сигналов, зависимую от G-белка. АCh расщепляется до холина и ацетата, причем первый рециркулируется в пресинаптических нейронах с помощью натрий-зависимого переносчика холина. Интересно, что антихолинергические препараты, как правило, назначают для снижения EPS, сопровождающего антипсихотическое лечение, что позволяет предположить, что дофаминергическая и холинергическая системы тесно связаны. Холинергические интернейроны в стриатуме составляют всего 1-2% всех нейронов, тем самым способствуя стабилизации дофаминергической передачи сигналов в психомоторном контуре (также в корково-базальной ганглиозной системе).
Биомаркеры ацетилхолинового пути
Выводы
Дофаминергические эффекты сильно зависят от состояния. Например, дофаминовые рецепторы присутствуют в иммунных клетках для снижения уровня их активации, но не было обнаружено влияния дофаминергических агентов на иммунные маркеры, такие как С-реактивный белок, интерлейкин-6 или фактор некроза опухоли альфа.
Добавки при дефиците нейромедиаторов. Как восстановить ацетилхолин, серотонин, ГАМК и дофамин. Синдром хронической усталости
Когда товарищ рассказывал о самой болезни, там всё прошло плюс минус легко, как и у его коллег-спортсменов. Но вот потом, началась пост-история с психоэмоциональным состоянием
Знаю как люди не любят читать много букв, сегодня пост-история в которой вы узнаете:
2. Серотониновый декаданс. Сложно заснуть, сны странные, поверхностные и часто просыпаешься в районе 3 утра, в состоянии тревоги
3. Дофаминовый пролапс. Вы не можете найти себе занятие по душе, которое бы «вставляло», так как раньше
4. ГАМКовый абсас. Вы начинаете понимать Киркорова
5. Ацетилхолиновая абберация. Вы перестаете адекватно воспринимать себя и окружающий мир
Консультация интегративного остеопата Виктора Муравенко с выездом на дом доступна москвичамВ прошлом году я летал на Байкал, где проводил группу холотропного дыхания. Поскольку там был сильный часовой сдвиг, я решил полететь бизнес-классом, чтобы немного поспать. Однако, сколько себя помню, каждый раз, когда я планировал выспаться при таких перелетах, когда вылетаешь вечером, а прилетаешь утром реальность подкидывала мне совершенно другие сценарии. Так получилось и в этот раз.
1. Как бухают зам министры в бизнес классе
Рядом со мной летел замминистра культуры одного из регионов и претвориться спящим бревном, познавшим дзен досрочно у меня не получилось. Мы начали пить коньяк или виски, возможно и коньяк с виски, и так как коллега имел высокую резистентность к алкоголю то к концу нашего полета, он побеждал в количестве выпитого в относительных и абсолютных значениях.
Как Вы знаете, когда алкоголь поступает в кровоток, беседы становятся увлекательными и интересными. И среди обсуждений вопросов политики, культуры и спорта – была злободневная тема про модную болезнь ковид 19, а точнее про её последствия. Не помню, как именно вышли на эту тему, но обсуждали мы нейромедиаторную систему – в том числе и дофамин (нейромедиатор мотивации и удовольствия).
Наша клиника специализируется на телемедицине. Все консультации проводятся онлайн. Ехать никуда не надо. Среди наших пациентов русскоговорящие из Боливии, Аргентины, Перу, США, стран Евросоюза, стран СНГ, Юго восточной азии, и разумеется жители всех городов России
Мой товарищ по бизнес-классу поведал мне свою историю болезни и как раз эта беседа, натолкнула меня написать этот пост, ибо он будет полезен многим, кто относится к дофаминовому типу личности («бери от жизни всё»; «ищи на попу приключений», «жизнь одна, давай дружить телами» и др.).
Анна Чичерова, олимпийская чемпионка по прыжкам в высоту, о Авторском Detox туре Антона ПоляковаКогда товарищ рассказывал о самой болезни, там всё прошло плюс минус легко, как и у его коллег-спортсменов. Но вот потом, началась пост-история с психоэмоциональным состоянием.
В частности, звучала фраза – «хотелось выйти пешком в окно».
поражение нервной системы,
поражение рецепторов на клетках (включая рецепторы нейромедиаторов),
поражение сосудов (нарушение обменных процессов в тканях, включая мозг)
и выраженное повреждение печени, как органа детоксикации (именно из-за этого и высокий ферритин).
Все эти факторы напрямую влияют на наше с Вами восприятие мира, настроение и желание жить Цель сегодняшнего поста – помочь всем, кто столкнулся с проблемой «закоротивших нейронов», а как следствие – синдромом хронической усталости.
Традиционная защита от «Де’Bill’OFF – схемы применяются на Ваш страх и риск, это не рекомендация к действию, у всего в этой жизни, включая саму жизнь имеются противопоказания, необходима консультация специалиста. Имеются противопоказания (даже на консультацию со специалистом))).
Советы Биохакерам от интегративного эндокринолога, клинического психолога Антона Полякова2. СЕРОТОНИНОВЫЙ ДЕКАДАНС
У Вас возникла непреодолимая печаль и тоска.
Хочется плакать, жизнь в серо-тёмных тонах, «тебя никто не любит и не ценит», «обязательно, что-то должно случиться с кем-то из близких или с Вами. Чаще всего картинки в голове про онкологию, Альцгеймер, сердечные катастрофы либо авиакатастрофа.
Хочется сладенького, еда не насыщает, приходится «дегустировать» винишко или шампанское каждый день, чтобы оставаться «на плаву». Шоколад или сыр (особенно с вином) улучшают настроение. Также сложно заснуть, сны странные, поверхностные и часто просыпаешься в районе 3 утра, в состоянии тревоги
Что делать в течение 1-2 месяцев:
• Как можно больше находиться на солнце – солнечные лучи обладают хорошим антидепрессивным эффектом, особенно если это район Алушты или Бали
• Регулярные медитации и глубокое спокойное дыхание
• Пить витамин Д3 в дозировке не менее 5000 МЕ – регулятор настроения, через лимбическую систему
• Принимать добавки L-триптофана (1500-2000 мг), либо 5-НТР (50-200 мг) для повышения серотонина
• Много магния (400-600 мг), особенно хорошо заходит магний треонат и глицинат – магний обладает противотревожным эффектом, а также выравнивает баланс нейромедиаторов в ЦНС
• Витамин В6 (25-50 мг), в форме P-5-P – кофактор для синтеза серотонина
• Шафран или Saffron (88-265 мг) – восстанавливает чувствительность нейромедиаторов
• Принимать добавки лития, лучше аспартата или оротата (5-10 мг) – регулятор чувствительности рецепторов, а также регулятор баланса нейромедиаторов
• Селанк или Семакс 0,1% (Интернет-магазин) по 2 капли в носовые ходы 3 раза в день (стрессопротекция и адаптогенный эффект)
• ДГК+ (Health Code) – именно ЭТОТ монокристаллический дигидрокверцитин, принимать по 2 капсулы 2 раза в день после еды https://health-code.ru/?utm_source=fantel (защита сосудов и нервных клеток, мощнейший антиоксидант)
Как восстанавливают нервные клетки
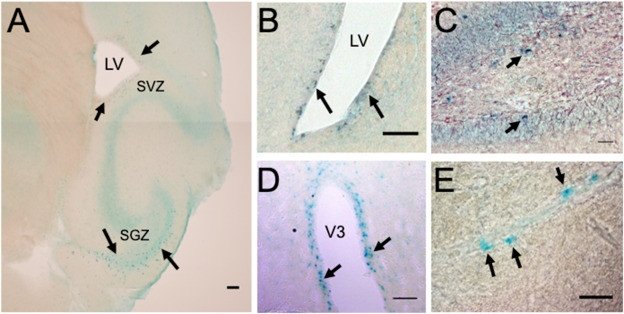
Исследовательская группа под руководством директора Института трансляционной биомедицины, научного руководителя Клиники высоких медицинских технологий СПбГУ профессора Рауля Гайнетдинова выяснила, что недавно открытая нейромедиаторная система на основе рецепторов к следовым аминам TAAR5 способна регулировать число нейронов дофамина и взрослый нейрогенез — образование новых клеток в некоторых структурах мозга у зрелых особей.
Рецептор следовых аминов TAAR5 обнаружен в областях мозга, где образуются новые нейроны во взрослом состоянии
Многие современные лекарства созданы на основе воздействия на нейротрансмиттерные системы, в которых химические вещества передают сигналы между нейронами или от нейронов к другим клеткам. Среди наиболее известных таких систем — дофаминовая, норадреналиновая, серотониновая, гистаминовая, глутаматная и многие другие. Ранее ученым СПбГУ вместе с коллегами из Итальянского технологического института и Первого Санкт-Петербургского государственного медицинского университета имени академика И. П. Павлова благодаря экспериментам на мышах-мутантах удалось показать, что в мозге есть еще одна нейротрансмиттерная система — в ней передача сигналов происходит за счет рецептора к следовым аминам TAAR5.
Большинство из найденных рецепторов к трейс-аминам в мозге до недавнего времени рассматривались как исключительно обонятельные, которые участвуют в восприятии инстинктивных запахов — гнили, феромонов, хищников. Однако исследователи Института трансляционной биомедицины СПбГУ показали, что они представлены также в областях мозга, отвечающих за эмоции. В результате экспериментов с мышами, у которых был «выключен» ген, кодирующий белок TAAR5, ученые выяснили, что такие «нокаутные» грызуны ведут себя так, будто находятся под воздействием антидепрессантов или противотревожных препаратов.
Дальнейшие исследования новой нейротрансмиттерной системы были посвящены изучению влияния TAAR5 на дофаминовую систему, а именно на две области среднего мозга — вентральную область покрышки и черную субстанцию (Substantia nigra). Последняя играет важную роль в развитии многих нейродегенеративных заболеваний, в том числе болезни Паркинсона. Как утверждают исследователи, результаты экспериментов оказались неожиданными.
«При отсутствии TAAR5-рецепторов у взрослых «нокаутных» грызунов число нейронов дофамина в черной субстанции головного мозга увеличилось на 30 %. Такой рост возможен либо в период развития организма, либо во время образования новых нейронов у зрелых особей, так называемого взрослого нейрогенеза. Известно, что небольшое число новых нейронов появляется у млекопитающих и во взрослом состоянии, обычно это происходит в двух зонах головного мозга — субвентрикулярной и субгранулярной. В этих зонах, а также в нервной ткани вокруг желудочков мозга мы и обнаружили эти рецепторы. Было показано, что «взрослый» нейрогенез может регулироваться рецепторами серотонина, дофамина, а также адренорецепторами и в частности повышается при действии антидепрессантов. Мы оценили статус «взрослого» нейрогенеза, и нам удалось установить, что у «мышей-нокаутов» без TAAR5 в этих «нейрогенных» зонах значительно усиливается образование новых нейронов», — отметил профессор.
Ученые предполагают, что рецепторы следовых аминов, детектируя продукты распада аминокислот внутри мозга, являются той сенсорной системой, которая запускает процесс возникновения новых нейронов при разнообразных патологиях мозга. Возможно, что рецепторы следовых аминов не только вовлечены в регуляцию психоэмоционального состояния, но также могут оказывать существенное влияние на «взрослый» нейрогенез, тем самым открывая новые возможности для лечения нейродегенеративных заболеваний мозга, в том числе болезней Паркинсона и Альцгеймера.
Сейчас перед учеными стоит важная задача — найти селективные антагонисты TAAR5, которые будут усиливать нейрогенез. Дальнейшие исследования позволят лучше понять молекулярный механизм увеличения числа дофаминовых нейронов Substantia nigra у «нокаутных» мышей.
Информация и фото предоставлены пресс-службой СПбГУ
Как повысить дофамин и серотонин в организме?
Различные состояния счастья и радости регулируют гормоны дофамин и серотонин. Когда этих нейромедиаторов в организме не хватает, то человек перестает чувствовать эйфорию и чтобы не впасть в апатичное состояние рекомендуется узнать, как повысить уровень дофамина и серотонина в теле.
Описание гормона дофамина
Допамин мотивирует человека прикладывать силы к достижению цели с трудолюбием, желанием и упорством. Научные исследования на крысах показали, что низкий уровень этого гормона в их крови выбирали самое простое решение задачи, не хотели решать проблему с особенным подходом. В итоге лабораторные крысы довольствовались малым количеством пищи. Животные, которые были готовы решать сложные задачи и потрудиться в задании для них имели повышенный уровень допамина.
Информация о серотонине
Изначально серотонин является нейромедиатором, передающим импульсы от мозга к нервным клеткам, а становится он гормоном после попадания в лимфу.
В одном исследовании на мартышках ученые выявили, что повышенный уровень серотонина был у лидирующей особи. Но если лидера стаи отсаживали в другую клетку и он терял власть над другими приматами, то уровень серотонина в его крови резко понижался.
Главные отличия серотонина от дофамина
Этим нейромедиаторам дают разные названия: «молекулы удовольствия» и «гормоны радости». С первого взгляда может показаться, что данные гормоны слишком похожи, но на самом деле активируют они в теле совсем разные эмоции и ощущения:
У этих гормонов существует реципрокная связь: повышенный уровень дофамина понижает уровень серотонина. Точно такая же взаимосвязь возникает в обратном случае, когда серотонин снижает дофамин. На практике это легко увидеть:
Если повысить уровень серотонина в организме, то человек станет чувствовать себя намного увереннее. Как показали результаты опытов над животными, чем выше уровень серотонина у особи, тем более статусные ее социальный ранг. Животные с низкими показателями серотонина находились на самом низу социальной лестницы.
| Название гормона | Серотонин | Дофамин |
| Мысли | Удовлетворение Сотрудничество Уверенность | Поощрение Успех Цель |
| Мотивация | Радость жизни | Желание |
| Вид энергии | Питающая Восстанавливающая силы | Стабильная Саморегулируемая |
| Выработка в организме, чтобы оставаться сосредоточенным | Равномерная | Равномерная |
Не все психологи знают, что в некоторых случаях клиенту может помочь не беседа с ним, а поправка химического гормонального уровня. Если у человека нехватка серотонина, то у него будет:
Такой личности трудно избавиться от навязчивых мыслей, а также от постоянной тревоги. Но если его организм получит должную дозу серотонина, то депрессия пройдет, появится желание что-то делать. У человека, которого уровень серотонина повышен, есть бодрость, энергия и тяга к противоположному полу.
Способы повышения дофамина в организме
Чтобы работать и заниматься делами более продуктивно, нужно повысить уровень этого гормона в крови. Не обязательно покупать антидепрессанты и химические препараты, так как дофамин мозг может вырабатывать самостоятельно. Наши далекие предки повышали уровень этого гормона, когда находили новую добычу на охоте или растения пригодные для пищи. В современном мире достаточно выполнять несколько правил, чтобы повысить дофамин.
Полезные привычки
Чтобы нейромедиатор дофамин задействовал центры удовольствия каждый день нужно делать что-то новое. Это может быть восхождение на вершину горы или сделать отжимания на один раз больше чем вчера. В первом и втором случае организм получит определенную дозу удовольствия.
Если человек проводит мало времени на улице, то дофамин в его организме сильно снижается от недостатка дневного света и свежего воздуха.
Правильное питание
Потреблять в пищу рекомендуется продукты насыщенные тирозином, являющимся главным строительным элементом дофамина. Диета для повышения дофамина состоит из следующих продуктов:
Пищевые добавки
Активную выработку дофамина помогут простимулировать дополнительные биодобавки в пищу. К ним относятся:
Также для поддержания дофамина в норме рекомендуется употреблять в качестве добавок к пище масляной экстракт орегано или приправу с этим растением, рыбий жир, женьшень, спирулину. Результаты исследований показали, что эти добавки снижают негативное воздействие некоторых процессов в организме, влияющих на выработку дофамина.
Спорт и медитация
Даже маленькая нагрузка в качестве ежедневной зарядки поможет выработать дофамин и эндорфин. Для простого спорта подходит:
Наилучшее состояние спокойствия и сортировки мыслей можно ощутить именно в медитативном трансе. В медитации на глубоком подсознательном уровне можно проанализировать все, что происходит в жизни и прийти к правильному решению индивидуальной проблемы. Активная мысленная деятельность и одновременный отдых будет способствовать выработке дофамина.
Травы и минералы
Народными проверенными средствами активировать «гормон счастья» можно за счет ароматерапии. Выработку гормона дофамина провоцируют определенные ароматы, такие как лаванда, ваниль. Можно устраивать ароматерапию с эфирными маслами этих растений. Если носить кулоны с натуральными камнями из розового кварца или малахита на уровне тимуса, то они будут стимулировать выработку гормона дофамина.
Варианты как повысить серотонин
Повышая уровень этого нейромедиатора естественным путем можно улучшить здоровье, душевное самочувствие и избежать серьезных проблем, таких как депрессия и отсутствие мотивации.
Образ жизни
Ученые выяснили, что серьезный блокатор для выработки серотонина является кортизол. Кортизол или гормон стресса появляется, когда человек находится в стрессовой ситуации. Чтобы не допустить блокировку выработки серотонина рекомендуется завести несколько полезных привычек.
Человеку, желающему естественным путем повысить уровень серотонина рекомендуется чаще находиться на солнце. Кожа будет поглощать ультрафиолетовые лучи, форсируя выработку нейромедиатора. На работе или дома днем желательно открывать шторы и жалюзи, чтобы в комнату попадало больше дневного света.
Если во время работы чувствуется усталость и напряжение, то можно позволить себе расслабиться всего на несколько минут. В это время можно подумать о чем-то хорошем и приятном. Также можно подумать о своих достижениях и поступках, которые с благодарностью оценили люди.
Полезная диета
Биосинтез серотонина активирует процесс потребления в пищу продуктов, в которых содержится триптофан. К ним относятся:
Также диетологи советуют потреблять в пищу продукты насыщенные магнием, такие как свежая зелень, бананы, морепродукты. Стоит с осторожностью отнестись к продуктам, содержащим большое количество сахара, который не пойдет на пользу, а вызовет зависимость. Также стоит отказаться от искусственного сахарозаменителя аспартама.
Забота о кишечнике
Многие вещества участвующие в психосоматических процессах организм синтезирует самостоятельно в кишечнике. Именно в этом органе синтезируется серотонин. Если нарушается микрофлора кишечника, то около 80% необходимого гормона перестают вырабатываться. Важно заботиться о здоровье кишечника особенно в зимнее время, чтобы в нем могли синтезироваться нужные «гормоны счастья». Рекомендуется употреблять в пищу:
Серотонин своеобразный антидепрессант, способный вернуть человеку эмоции счастья и радости. Если он не будет синтезироваться в кишечнике, то у человек перестанет испытывать положительные эмоции.
Витамины повышающие серотонин
Витаминные комплексы с правильно подобранными компонентами способствуют выработке серотонина. Рекомендуется употреблять витамины группы В: В12 и В6 особенно стимулируют выработку необходимого нейромедиатора. Существуют также исследования, что именно эти витамины помогают справиться с депрессией. Идеальная дозировка для взрослого человека витамина В от 50 до 100 мг в сутки.
Излишнее количество биологически активного гормона кортизола в организме блокирует выработку серотонина, нужного для здорового психического и физического самочувствия.
Витамин С является антидепрессантом и продукты с его содержанием помогают повысить настроение.
Также по исследованию ученых известно, что те люди которые принимали в течение 14 дней повышенное количество витамина С чувствовали себя более счастливыми.
Спорт и отдых
Следует стараться блокировать гормоны стресса и заботиться о своем психическом здоровье. Но если не получается сохранить позитив, то можно заняться спортом и медитацией. Увеличить показатель серотонина у мужчин и женщин поможет любая активность, которая разгоняет кровь и заставляет сердце биться быстрее. Также занятия спортом помогают повысить настроение благодаря тому, что в теле начинает вырабатываться гормон дофамин.
Во время практики медитации вырабатывается кислота 5-HIAA. Это вещество напрямую связано с выработкой серотонина. Уделяя внимание практике медитации ежедневно можно значительно снизить уровень гормона кортизола, который отвечает за стресс и плохое настроение. Вместо негативного настроения уже за пару сеансов медитации можно почувствовать бодрость духа, уверенность и позитив.
Дофамин и серотонин гормоны счастья
Состояние счастья бывает разным — от буйного эмоционального всплеска до спокойного умиротворения и уверенности в себе, но регулирует его нейромедиаторы серотонин и дофамин. Чтобы поддерживать хорошее эмоциональное состояние важно постоянно поддерживать выработку обоих гормонов в организме.
Как восстановить дофаминовые рецепторы
Изучение организации систем негативной валентности, обеспечивающих адаптивное поведение в условиях наличной (страх) или потенциальной (тревога) угрожающей ситуации, является одной важнейших задач современной нейробиологии. Актуальность проблемы обусловлена высокой распространенностью тревожных и фобических расстройств (6-8% населения), при этом фобии и патологическая тревожность сопровождаются широким кругом психопатологических нарушений как невротического, так и психотического характера [1; 2]. Нейролептики, являющиеся антагонистами Д2 рецепторов дофамина, применяются для терапии тревожных расстройств в случае резистентности последних к препаратам других классов [2]. Однако системные представления о роли Д2 рецепторов различных отделов мозга в механизмах страха и тревоги пока не сформированы.
Цель исследования
Проанализировать результаты научных исследований, посвященных изучению Д2 рецепторов дофамина префронтальной коры головного мозга в нейробиологических механизмах страха и тревоги, а также определить наиболее перспективные для практического использования дальнейшие исследования в этом направлении.
Результаты нейрофизиологических исследований показали, что гипоталамус, миндалевидный комплекс и вентральный стриатум являются ключевыми структурами при формировании оборонительной мотивации [3]. Вместе с тем для обеспечения оптимальной структуры оборонительной составляющей приспособительного поведения особое значение имеет взаимодействие систем негативной валентности с когнитивными доменами [4]. Способность к переключению внимания, устойчивость, пластичность, доступность для воспроизведения и степень избирательности/генерализации ассоциативного следа памяти о негативных воздействиях являются факторами, во многом определяющими степень адаптивности поведения в аверсивных ситуациях и повседневной жизни, а также вероятность развития устойчивых фобических и тревожных расстройств. Многие из перечисленных свойств интегративной деятельности ЦНС зависят от особенностей активности и взаимодействия различных отделов префронтальной коры (ПФК): дорзолатеральной, участвующей в обеспечении процессов внимания, рабочей памяти, исполнительного контроля, а также орбитофронтальная кора и медиальная ПФК, которые получают информацию от амигдалы и прилежащего ядра – структур, играющих ключевую роль в эмоциональных процессах [4; 5]. Индивидуальные особенности активности различных отделов ПФК на уровне нейромедиаторных процессов существенно влияют на эффективность когнитивной терапии [6; 7]. Их исследование принципиально необходимо для формирования подходов к персонализированной фармакотерапии тревожных и фобических расстройств.
Активность ПФК в значительной степени регулируется дофаминергическими терминалями из вентральной покрышки среднего мозга через различные типы дофаминовых рецепторов. Дофаминовые рецепторы относятся к одному из двух больших классов: Д1 (включает Д1 и Д5 подклассы), связанные с G-белками, активирующими аденилатциклазу, и Д2 (включает Д2-Д4 подклассы), связанные с G-белками, ингибирующими аденилатциклазу [8]. Кроме того, активация дофаминовых рецепторов может оказывать влияние на другие сигнальные пути, в частности рецепторы Д3-подкласса, которые при взаимодействии с рецепторами Д2-подкласса, регулируют активность фосфолипазы Д, с последующим изменением уровня фосфорилирования АКТ киназы и киназы гликогенсинтазы-3 [9]. Д2 рецепторы могут быть как пре-, так и постсинаптическими, в то время как Д1 рецепторы локализованы преимущественно (хотя и не исключительно) на постсинаптической мембране нейронов. При изучении мезокортикальной дофаминергической нейротрансмиссии основное внимание уделялось Д1 рецепторам, плотность которых в ПФК существенно выше, чем плотность Д2 и Д4 рецепторов [8]. Вместе с тем показано, что Д2 и Д4 рецепторы также играют существенную роль в модуляции внутрикортикальных взаимодействий, сигналов из подкорковых структур [10], а также активности нисходящих кортикальных проекций [11].
Наряду с данными о возможной структурной специфичности имеются сведения, указывающие на избирательность вовлечения различных подклассов Д2 рецепторов в механизмы обработки эмоционально значимой информации. Так, получены результаты, позволяющие предположить, что при ассоциативном обучении Д2 рецепторы, расположенные на эфферентных пирамидных нейронах V слоя, опосредуют стимулирующий эффект дофаминергических проекций, которые кодируют информацию о свойствах подкрепления. В то же время активация Д4 рецепторов, расположенных на ГАМК-ергических интернейронах и пирамидных клетках III слоя, может как подавлять, так и активировать последние, создавая устойчивый паттерн, кодирующий параметры условного стимула и обеспечивающий стабильность эмоциональной ассоциативной памяти [8; 10]. Эти теоретические построения представляют существенный интерес, однако они нуждаются в дальнейшем экспериментальном подтверждении. Кроме того, в данной модели никак не отражена возможная роль пресинаптических Д2 ауторецепторов.
Основным методом исследования рецепторной активности в отдельных структурах мозга у человека является позитронно-эмиссионная томография. В связи с тем что лиганды, обладающие достаточно высокой степенью специфичности для разных классов и подклассов дофаминовых рецепторов, были созданы относительно недавно, такие работы пока единичны.
В исследовании методом позитронно-эмиссионной томографии показано повышение уровня связывания лиганда Д2 рецепторами в орбитофронтальной и дорзолатеральной коре испытуемых с высоким уровнем социальной тревожности [13].
В более ранней работе повышение связывания лиганда Д2 рецепторами у испытуемых с высоким уровнем тревожности было обнаружено в ПФК в целом (без деления на отделы) и являлось предиктором гиперреактивности амигдалы в ответ на предъявление стимулов негативной валентности [14].
При исследовании пациентов с социальной тревожностью была выявлена положительная корреляция между эффективностью когнитивной терапии и снижением показателя связывания меченого антагониста Д2 рецепторов [15].
Эти сведения, предположительно указывающие на связь между высоким уровнем рецепторной активности Д2 рецепторов и проявлениями тревожности, в определенной степени согласуются с данными генетических исследований. Так, при изучении полиморфизма С957Т гена Д2 дофаминового рецептора обнаружено, что для носителей СС варианта характерно повышение специфичного связывания дофамина в коре и таламусе со снижением его в стриатуме [16; 17] и одновременно более выраженная предрасположенность к развитию посттравматического стрессового синдрома [18] и негативному влиянию раннего стресса на когнитивные функции [19].
При трактовке этих данных следует, однако, учитывать, что значительная часть Д2 рецепторов представлена пресинаптическими Д2С ауторецепторами, стимуляция которых снижает высвобождение дофамина из пресинапса. В экспериментах на животных показано, что введение агонистов Д2 рецепторов в ПФК крыс приводит к снижению высвобождения дофамина в синаптическую щель [20], в то время как инъекции антагонистов вызывают его увеличение [21]. Таким образом, необходимы сведения о соотношении выраженности негативных эмоциональных состояний с экспрессией и аффинностью как пресинаптических, Д2С, так и постсинаптических Д2Л рецепторов ПФК, которые, соответственно, подавляют высвобождение дофамина в синаптическое пространство и модулируют активность аминоацидергических нейронов, однако такие данные практически отсутствуют. В частности, было обнаружено, что соотношение Д2С и Д2Л рецепторов может быть обусловлено альтернативным сплайсингом матричной РНК, который демонстрирует связь с вариантами полиморфизмов rs6275 и rs2242592 гена Д2 рецептора [22], однако исследований взаимосвязи этих полиморфизмов с формированием и устойчивостью состояний страха и тревоги, а также с функциональной активностью различных отделов ПФК не проводилось.
Для дифференцированного изучения Д2С и Д2Л рецепторов перспективным может оказаться использование нейролептика сульпирида, который в низких и умеренных дозах является избирательным антагонистом пресинаптических ауторегуляторных Д2С рецепторов и одновременно оказывает анксиолитическое действие при системном введении [23].
Введение умеренных доз сульпирида в медиальную ПФК мышей перед сеансом экспозиции в крестообразном приподнятом лабиринте снижает уровень тревожности и повышает исследовательскую активность при тестировании через 24 часа, причем аналогичный эффект оказывал агонист Д2 рецепторов квинпирол [24]. Эти данные указывают, что ингибирование пресинаптических Д2С рецепторов в ПФК, предположительно вызывающее повышение высвобождения дофамина, приводит к снижению базового, «врожденного» уровня тревожности. Однако для проверки этого предположения необходимы исследования с прямым измерением уровня внеклеточного дофамина с использованием методов прижизненного микродиализа или вольтамперометрии.
У грызунов связь с выраженностью и пластичностью страха и тревоги достоверно выявлена для двух участков медиальной префронтальной коры: инфралимбической, расположенной в ростро-вентральной области, и более дорзальной прелимбической коры 30. Гомология этих отделов участкам ПФК приматов до конца не установлена: они демонстрируют функциональные свойства, характерные как для медиальных отделов, так и для дорзолатеральной ПФК приматов [31]. Стимуляция активности нейронов инфралимбической коры крыс, находящихся в крестообразном приподнятом лабиринте, приводит к увеличению исследований открытых рукавов, что свидетельствует о снижении базового уровня тревоги [29].
Показано, что инфралимбическая кора избирательно вовлечена в механизмы угашения условного страха [30; 32], в то время как активность нейронов прелимбического отдела демонстрирует положительную корреляцию с устойчивостью условных страха и тревоги.
Исследования с локальным введением умеренных доз сульпирида в инфралимбическую кору крыс показали, что инъекции, осуществленные непосредственно перед сеансом угашения, не оказывают влияния на кратковременное «отрицательное» обучение (динамику проявлений страха во время предъявления неподкрепляемых током условных стимулов). Однако в этих условиях сульпирид устранял эффекты как антагониста, так и агониста глюкокортикоидных рецепторов, инфузия которых в инфралимбическую кору стимулировала кратковременное угашение [35]. Выявленные эффекты можно считать специфичными для Д2 рецепторов, поскольку не наблюдались при инъекциях антагониста Д1 рецепторов SCH23390.
Совокупность этих сведений явилась основанием для предположения о том, что для угашения условного страха необходима координация активности дофаминергических нейронов в ПФК, амигдале и прилежащем ядре, которая обеспечивается нисходящими влияниями из ПФК, регулирующими активность вентральной тегментальной области, общего для этих структур источника дофаминергических проекций [36], и что существенная роль в этих механизмах принадлежит Д2 рецепторам нейронов лобной коры.
Эта концепция также предполагает, что координирующие влияния ПФК в отношении дофаминергической активности эмоцио- и мотивациогенных структур направлены на обеспечение адаптивного уровня пластичности поведения. Наряду с угашением оборонительного поведения существенный интерес представляют механизмы извлечения сформированных ранее положительных ассоциаций на фоне негативных эмоциональных состояний. Их изучение является перспективным для совершенствования психотерапевтических методов фобий и тревожных расстройств. Достаточно простой моделью для изучения механизмов взаимодействия эмоций положительной и отрицательной валентности является модификация акустической стартл-реакции обстановочным стимулом. Стартл-реакция – комплексная реакция, состоящая из ориентировочно-исследовательской и оборонительной компонент; возникает при предъявлении внезапного стимула высокой интенсивности. При повторных предъявлениях стимула амплитуда стартл-реакции снижается, достигая асимптотического уровня, который, однако, отличен от нулевого. Мягкое изменение контекста в этих условиях, например усиление (для грызунов) или снижение (для человека) освещенности и др., вызывает повышение амплитуды реакции, расцениваемое как индикатор возрастания тревоги. В то же время предъявление стимула, для которого ранее была сформирована ассоциативная условная связь с жестким аверсивным воздействием (например, электрошоком), позволяет оценивать уровень страха [37; 38]. Особенный интерес в этой модели представляет исследование влияния стимулов, ассоциированных с положительным подкреплением на проявления оборонительного поведения в модели стартл-реакции, т.е. при относительно мягкой (без непосредственной угрозы жизни и болевых воздействий) аверсивной ситуации.
В проведенных нами исследованиях [39] с использованием модели потенцированной акустической стартл-реакции у крыс было обнаружено, что предварительная ассоциация светового стимула с положительным подкреплением устраняет увеличение амплитуды ответа на звуковой сигнал, наблюдающееся при повышении уровня освещенности у этих животных, ведущих норный образ жизни. Инъекция умеренной дозы сульпирида в инфралимбическую ПФК непосредственно перед изменением освещенности восстанавливала потенцирующее действие света при отсутствии эффектов в отношении базовых показателей реакции на звуковой сигнал.
В то же время введение сульпирида в амигдалу не оказывало влияния на модификацию стартл-реакции по описанной выше схеме. Эти данные указывают на специфичное участие дофаминергической системы префронтальной коры в воспроизведении положительных и отрицательных эмоциональных состояний (а также их взаимодействии при формировании адаптивного поведения), которое реализуется на уровне активации Д2 дофаминовых рецепторов.
Таким образом, модуляция сформированного оборонительного поведения, которая наблюдается при изменении ситуации (отмена подкрепления, гормональные воздействия, предъявление стимулов, ассоциированных с положительным подкреплением), в значительной степени зависит от уровня активации Д2 рецепторов в ПФК. Такая зависимость может быть обусловлена участием дофаминергической системы передней коры в интеграции когнитивных и эмоциональных процессов [40; 41].
Дофаминовые рецепторы Д4 подкласса также представлены в ПФК. Однако исследования их роли в механизмах страха и тревоги немногочисленны, а основное внимание уделяется Д4 рецепторам в прелимбической коре, активация которой соотносится с проявлениями и устойчивостью страха и тревоги. Показано, что инъекции селективного антагониста Д4 рецепторов в прелимбическую кору снижали уровень тревоги в крестообразном приподнятом лабиринте, а также время замирания в ответ на предъявление запаха хищника [42]. Эти немногочисленные пока данные указывают на связь активности Д4 рецепторов в ПФК с экспрессией «врожденных» форм страха и тревоги [43]. В связи с этим планирование валидных исследований пластичности оборонительного поведения возможно только после детальной оценки их вклада в регуляцию базового уровня страха и тревоги.
Заключение
Таким образом, в современной литературе имеются убедительные данные о том, что активация дофаминовых рецепторов Д2 класса в префронтальной коре является существенным звеном нейробиологических механизмов страха и тревоги. Вместе с тем эти сведения достаточно разрозненные и зачастую противоречивые, поэтому на сегодняшний день существует больше вопросов, чем ответов, относительно участия Д2 и Д4 рецепторов в обеспечении адаптивного оборонительного поведения и его патологических нарушениях.
Основные и наиболее перспективные для практического использования дальнейшие исследования в этом направлении включают:
— выявление взаимосвязи генетических полиморфизмов Д2 рецептора с экспрессией пресинаптических Д2С ауторецепторов и постсинаптических Д2Л рецепторов, а также связь этих полиморфизмов с индивидуальными показателями страха и тревожности, эффективностью различных видов когнитивной терапии;
— совершенствование трансляционных моделей страха и тревожности у лабораторных животных, а также расширение спектра современных методов, включая генетические исследования, нейровизуализацию, оценку содержания дофамина с использованием микродиализа или вольтамперометрии in vivo;
— разработка способов направленного избирательного воздействия на активность пре- и постсинаптических Д2 рецепторов дофамина для совершенствования персонализированного подхода к терапии тревожных расстройств.
Роль кишечной микробиоты в регуляции дофаминергической передачи сигналов
ДОФАМИН И МИКРОБИОТА КИШЕЧНИКА
Роль оси микробиота-кишечник-мозг в регуляции дофаминергической передачи сигналов
Резюме
1. Введение
В этом обзоре мы представляем новые данные, демонстрирующие взаимосвязь между микробиотой кишечника и дофаминергическими путями, влияющими на поведение. Таким образом, мы кратко опишем механизмы взаимной связи между периферической и центральной нервной системами через ось кишечник-мозг и роль кишечной микробиоты в этом процессе. Затем мы представляем доказательства, показывающие способность кишечных микробов, принадлежащих к Prevotella, Bacteroides, Lactobacillus, Bifidobacterium, Clostridium, Enterococcus и Ruminococcus, модулировать дофаминергическую активность и то, как последующие изменения способствуют патогенезу связанных с дофамином расстройств. В целом, этот обзор подчеркивает связь между микробиотой кишечника и дофаминергической системой, представляя текущие данные, выявляя пробелы и предлагая направления будущих исследований для выяснения потенциального вклада микробиоты кишечника в нейродегенеративные расстройства, затрагивающие дофаминергические нейроны.
2. Ось микробиота-кишечник-мозг
2.1. Короткоцепочечные жирные кислоты и дофамин
Бутират и дофамин
Кроме того, было показано, что бутират стимулирует выработку гормонов кишечника через энтероэндокринные клетки, такие как глюкагоноподобный пептид 1 ( GLP-1 ) и пептид YY ( PYY ), а также увеличивает экспрессию рецептора GLP-1 ( GLP-1R ) в клетках головного мозга [72]. Увеличение экспрессии GLP-1R смягчало поведенческие нарушения у грызунов. Было показано, что аналоги GLP-1 и агонисты GLP-1R усиливают экспрессию DAT на синаптической мембране в латеральной перегородке переднего мозга [73]. Совсем недавно было обнаружено, что аналоги GLP-1, которые пересекают ГЭБ и связывают GLP-1R головного мозга, такие как лиратуглид, улучшают когнитивные функции и усиливают долговременную потенциацию [74]. В группах, получавших лиратуглид, также наблюдалось значительное повышение концентрации нейротрансмиттеров, включая дофамин, в ткани гиппокампа. Аналогичные положительные результаты были получены с эксенатидом, агонистом GLP-1R, демонстрирующим усиление дофаминовой функции среднего мозга и улучшение поведения [75]. Некоторые виды бутирогенных микробов могут естественным образом повышать уровень GLP-1 и экспрессию GLP-1R в головном мозге, положительно влияя на концентрацию дофамина и улучшая нейроповеденческие расстройства. Недавняя работа по потенциальному использованию синтетических агонистов GLP-1 для лечения наркомании [76,77] еще больше подчеркивает важность микробиоты в регуляции функций дофамина в норме и при заболеваниях через систему GLP-1.
2.2. Цитокины, кишечная микробиота и дофамин
2.3. Гипоталамо-гипофизарно-надпочечниковая ось и микробиота кишечника
3. Влияние кишечных микробов на дофамин
Микробиота кишечника вносит основной вклад в биодоступность дофамина в энтеральной и центральной нервной системах. В следующих подразделах показано, как ключевые кишечные микробы, такие как Prevotella, Bacteroides, Lactobacillus, Bifidobacterium, Clostridium, Enterococcus и Ruminococcus, влияют на дофаминергические пути.
3.1. Превотеллы, бактероиды и дофаминергическая система
Prevotella и Bacteroides — это микробные роды, принадлежащие к типу Bacteroidetes, которые, как было показано, улучшают метаболизм глюкозы, разрушают различные растительные полисахариды и производят благоприятные нейроактивные SCFAs и витамины, которые необходимы для поддержания здоровья кишечника [84,85]. В дополнение к этим симбиотическим эффектам метаболиты, продуцируемые этими микробами, связаны с функционированием дофамина посредством модуляции активности дофаминергической синаптической щели. В недавнем исследовании Hartstra et al. показали, что введение Bacteroides uniformis через трансплантат фекальной микробиоты увеличивало связывание DAT в полосатом теле (стриатуме), в то время как Prevotella copri обратно коррелировала со связыванием транспортера [20]. DAT, белок пресинаптической мембраны, присутствующий в дофаминергических окончаниях для регуляции синаптического и внеклеточного дофамина, является важным модулятором дофаминергического тонуса в ЦНС. Связывание стриарного дофамина с DAT (стриатальное связывание) в синаптической щели дофаминергических нейронов позволяет рециркулировать и хранить дофамин в везикулах в пресинаптических окончаниях для последующего высвобождения. Хотя механизмы, с помощью которых Bacteroides uniformis и Prevotella copri изменяют стриатальное связывание, неясны, нейроактивные метаболиты являются очевидными кандидатами на модуляцию экспрессии DAT в полосатом теле посредством активации вагусных афферентов, проецирующихся на нигростриарный путь в пределах синаптической щели дофаминергических нейронов (рис. 1).
3.2. Лактобактерии, бифидобактерии и дофаминергическая система
3.3. Клостридии и дофаминергическая система
3.4. Энтерококк и дофаминергическая система
3.5. Руминококк и дофаминергическая система
4. Микробиота, дофамин и болезнь Паркинсона
Было показано, что некоторые кишечные микробы оказывают нейропротекторное действие на дофаминергические нейроны, чтобы уменьшить потерю дофамина. С другой стороны, другие микробы могут оказывать негативное воздействие, стимулируя воспалительные реакции посредством эндотоксинов, что приводит к дальнейшему снижению концентрации дофамина. В целом в паркинсоническом кишечнике отмечается снижение полезной микрофлоры и повышение уровня микробов, вызывающих патологические процессы. В литературе выявлены тенденции, отражающие микробный состав кишечника пациентов с БП. Хотя между исследованиями существуют расхождения, было проведено обширное микробное генотипирование кишечника при паркинсонизме, и многие анализы показывают сопоставимые результаты. Все шесть основных типов бактерий так или иначе поражаются болезнью Паркинсона, и изменения видов микробов кишечника могут служить продромальными биомаркерами, которые могут указывать на раннее начало заболевания [85]. Измененные таксоны пациентов с БП включают, но не ограничиваются ими, увеличение количества Akkermansia muciniphilia, Enterobacteriaceae, Eggerthella, Oscillibacter, Catabacter, Escherichia, Shigella, Megomanus, Lachnospiraceae и Streptococcus и снижение содержания Roseburia, Coprococcus, Faecalibacterium и Eubacterium biforme. 116,117,118,119].
Было обнаружено, что из родов, подробно описанных в этом обзоре, уровни Enterococcus, Bifidobacterium и Rumminococcus повышены, а концентрации Prevotella, Bacteroides и Clostridium снижены при БП [120, 121, 122]. Выводы, касающиеся эффектов Lactobacillus, кажутся менее определенными в литературе: некоторые сообщают об увеличении, в то время как другие заявляют об уменьшении этого микробного рода [121, 123, 124]. Вместе эти исследования показывают, что изменения в этих микробных родах кишечника вносят положительный или отрицательный вклад в патофизиологию БП (таблица 1). Возможные механизмы, с помощью которых кишечный микробный дисбиоз и его результирующее влияние на биодоступность дофамина могут привести к патогенезу БП, выделены в следующих разделах (рис. 3).
Таблица 1. Влияние микробов на болезнь Паркинсона
4.1. Кишечные микробы и α-синуклеины при болезни Паркинсона
О’Донован и др. показали, что сверхэкспрессия α-синуклеинов в SNpc приводит к снижению интенсивности подслизистой тирозин-гидроксилазы, снижению плотности подслизистых нейронов и изменениям микробного состава [127]. Это увеличение α-синуклеинов было связано с увеличением фекальных желчных кислот. Урсодезоксихолевая кислота ( UDCA ) и таурохенодезоксихолевая кислота ( TDCA ) представляют собой две конъюгированные желчные кислоты, которые проявляют нейропротекторное действие, предотвращая гибель дофаминергических клеток в моделях на грызунах [139]. Двумя заметными изменениями в микробном составе кишечника, наблюдаемыми в исследовании О’Донована, были роды Rumminococcus и Lactobacillus. Связь между Rumminococcus и желчными кислотами была менее четкой. Однако значительная корреляция была обнаружена с представителями рода Lactobacillus из-за их способности деконъюгировать желчные кислоты в их неконъюгированную форму посредством активности гидролазы солей желчных кислот [140]. Желчные кислоты обычно непрерывно рециркулируют и реабсорбируются в терминальном отделе подвздошной кишки [141]. Колебания концентрации Lactobacillus, наблюдаемые при БП, могут приводить к деконъюгации важных желчных кислот, таких как TCDA, снижая их концентрацию в желудочно-кишечном тракте, что приводит к снижению нейропротекции и гибели дофаминергических клеток.
4.2. Кишечные микробы и нейропротекторные эффекты
Несколько видов кишечных микробов играют важную роль в нейропротекции дофаминергических нейронов. Введение пробиотика, содержащего Lactobacillus rhamnosus, Lactobacillus acidophilus и Bifidobacterium animal, восстанавливало потерю дофаминергических нейронов в нигростриарном пути у крыс, вызванных нейротоксичностью. Из трех видов Lactobacillus rhamnosus является основным видом микробов, который активирует ключевые нейротрофические сигналы и подавляет моноаминоксидазу ( MAO-B ), фермент, который, как известно, расщепляет дофамин [97]. Было показано, что повышенный уровень BDNF и нейротрофического фактора, полученного из глиальных клеток ( GDNF ), регулирует дифференцировку нейротрансмиттеров и защищает от деградации дофаминергических нейронов [53]. Снижение экспрессии мРНК BDNF в черной субстанции также было показано при БП [142]. Введение пробиотиков приводило к увеличению концентрации бутирата в мозгу у крыс, индуцированных нейротоксичностью, что является убедительным доказательством того, что бутират влияет на ослабление потери дофаминергических нейронов.
Лю и др. предложили еще одно интригующее объяснение нейрозащитного механизма бутирата против БП, предполагая, что бутират натрия активирует белки плотных контактов, чтобы ослабить нарушение ГЭБ у мышей, вызванных нейротоксичностью. В том же исследовании также наблюдалась повышенная экспрессия рецепторов GLP-1 толстой кишки и головного мозга [72]. Было показано, что аналоги GLP-1 и агонисты GLP-1R усиливают экспрессию DAT на синаптической мембране в латеральной перегородке переднего мозга [73]. Это, в свою очередь, увеличило бы транспортную способность, рециркуляцию и хранение дофамина в везикулах для последующего высвобождения. В результате возможно, что защитные эффекты против дофаминергической дегенерации, наблюдаемые в исследовании Liu et al., могут быть связаны с повышенной экспрессией GLP-1 и GLP-1R. Точно так же недавнее исследование показало, что пропионовая кислота, полученная из кишечной микробиоты, может опосредовать нейропротекторный эффект остеокальцина в мышиной модели БП, индуцированной 6-гидроксидофамином. Учитывая защитную роль пропионовой кислоты, вполне вероятно, что низкие уровни пропионовой кислоты в фекалиях пациентов с БП могут играть роль в патогенезе БП [143].
4.3. Липополисахариды
4.4. Кишечные микробы, дофамин и нарушение моторики кишечника
Хотя большинство исследований подтверждают идею о том, что уменьшенное содержание Prevotella играет важную роль в развитии болезни кишечника при паркинсонизме, существуют противоречивые исследования. Анализ модели трансгенных грызунов с патофизиологическими компонентами, сходными с БП, показал временное увеличение Prevotella в возрасте 20–24 недель по сравнению с контрольной группой того же возраста. В аналогичные моменты времени наблюдалось снижение выработки дофамина как в среднем мозге, так и в кишечнике [158]. Это коррелировало с ранним появлением желудочно-кишечных симптомов, связанных с БП. Более того, в другом исследовании утверждалось, что унифицированные рейтинговые шкалы болезни Паркинсона ( UPDRS ) не были связаны с Prevotella, в отличие от предыдущей работы [159]. Тем не менее, большинство исследований показывают, что содержание Prevotella обычно снижается в кишечнике при паркинсонизме.
Кроме того, виды родов Lactobacillus и Bifidobacterium, которые обычно используются в пробиотиках для лечения нарушений моторики кишечника, не изменились у пациентов с запорами [153]. Однако введение Lactobacillus и Bifidobacterium в качестве пробиотика улучшило частоту стула и сократило среднее время прохождения через кишечник со 135 до 77 часов у пациентов с БП [160]. Эти эффекты были приписаны SCFAs, которые усиливают моторику ЖКТ посредством регуляции кишечных нейронов. Поскольку SCFAs увеличивают отложение α-синуклеина в нейронах кишечника [122], увеличение численности микроорганизмов, продуцирующих SCFA, со временем ослабляет симптомы запора за счет уменьшения агрегации α-синуклеина. Кроме того, род Lactobacillus деконъюгирует желчные кислоты, такие как TDCA, в желудочно-кишечном тракте, что, как было показано, ингибирует перистальтику кишечника [132] в дополнение к его нейропротекторным эффектам. Таким образом, возможно, что введение Lactobacillus может восстановить моторику ЖКТ за счет деконъюгации TDCA и снятия ее ингибирующего действия. В целом дисбактериоз кишечника, приводящий к снижению концентрации Prevotella, Lactobacillus и Bifidobacterium, является основным фактором нарушения моторики кишечника у пациентов с БП.
5. Выводы и перспективы
Существенные доказательства подтверждают участие передачи сигналов микробиота-кишечник-мозг в высвобождении, синтезе и биодоступности дофамина. В этом обзоре мы сосредоточились на основных микробных родах Prevotella, Bacteroides, Lactobacillus, Bifidobacterium, Clostridium, Enterococcus и Ruminococcus, которые сложным образом переплетаются с дофаминергическими путями посредством бесчисленных воздействий на предшественники дофамина, ферменты, рецепторы, переносчики и метаболиты. Состояния кишечного дисбиоза с участием этих ключевых родов нарушают передачу сигналов микробиота-кишечник-мозг, что приводит к дофаминергическим дефицитам, которые проявляются в невропатологических состояниях, таких как БП. В целом литература продолжает поддерживать представление о том, что патофизиологические эффекты при БП начинаются в желудочно-кишечном тракте. Известные патологические маркеры в желудочно-кишечном тракте, которые связаны с микробными изменениями кишечника, включают усиленное воспаление кишечника, деградацию муцинового слоя, секрецию ЛПС и накопление α-синуклеина, а также снижение синтеза бутирата и продукции нейропротекторных желчных кислот. Пути, опосредованные блуждающим нервом, передают эти патологические проявления в ЦНС, что приводит к нейродегенеративным эффектам на дофаминергические нейроны. Следовательно, на экспрессию BDNF, MAO-B и тирозин-гидроксилазы отрицательно влияет снижение целостности ГЭБ и усиление нейровоспаления за счет активации микроглии и продукции АФК. Хотя были достигнуты значительные успехи в выяснении связей между кишечной микробиотой, дофамином и связанной с ними патофизиологией, многое еще предстоит узнать. Многие исследования были проведены на животных моделях, которые были разработаны для имитации пациентов с паркинсонизмом через MPTP или нейротоксичность, вызванную ротеноном. Этиология БП представляет собой прогрессирующее нейродегенеративное заболевание, включающее образ жизни, генетические и социально-экономические факторы, которые трудно воспроизвести в исследованиях на животных. Потребление пищи и изменчивость окружающей среды связаны с различными микробиомами кишечника во всем мире [161]. Например, потребление западной диеты было связано с определенными микробными энтеротипами, которые могут предрасполагать людей к различным патологиям. Повышенный уровень Ruminococcus в результате западной диеты приводит к провоспалительному поведению, лежащему в основе патофизиологии, наблюдаемой при нейродегенеративных расстройствах, таких как БП [162]. Метагеномное секвенирование микробиоты кишечника после западной диеты также выявило ограниченную распространенность Prevotella, связанную со сниженной аффинностью связывания DAT. Кроме того, результаты исследований близнецов демонстрируют, как состав микробиома кишечника в значительной степени связан с негенетическими факторами [163]. Таким образом, вполне вероятно, что люди из разных сообществ более восприимчивы к развитию патологий, связанных с дофамином, в зависимости от микробного состава их кишечника, сформированного диетой и окружающей средой. Контроль этих переменных в будущих исследованиях имеет решающее значение и поможет нам понять участие кишечной микробиоты в нейродегенеративной этиологии. Кроме того, в некоторых исследованиях на животных не учитывались различные временные точки и прогрессирование паркинсонического состояния при измерении дофаминергических изменений. Ранняя и поздняя стадии БП имеют разные клинические проявления и могут отражать различные эффекты на дофаминергические пути и другие патологические изменения, подробно описанные в этом обзоре. Тем не менее, достигнутый на сегодняшний день прогресс в установлении связи между кишечной микробиотой и нейродегенеративными расстройствами является шагом вперед в нашем понимании сложных механизмов, лежащих в основе этих патологий.
Дополнительная информация
Литература
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ
Причина шизофрении и ее лечение ( дофаминовая гипотеза)
Карбидопа является периферическим ингибитором ДОФА-декарбоксилазы, совместно с леводопой. Карбидопа предотвращает превращение леводопы в дофамин на периферии, что позволяет большему количеству леводопы проходить через гематоэнцефалический барьер, чтобы превратиться в дофамин для получения его терапевтического эффекта.
Метамфетамин увеличивает внеклеточный дофамин, взаимодействуя в везикулярном транспортере-моноамине-2 (VMAT2), чтобы ингибировать поглощение дофамина и стимулировать высвобождение дофамина из синаптических везикул, увеличивая цитозольный допамин, доступный для обратного переноса переносчиком дофамина (DAT).
В литературе имеются убедительные доказательства того, что пресинаптическая дофаминовая дисфункция приводит к увеличению доступности и высвобождению дофамина, которое связано с продромальными симптомами шизофрении. Кроме того, было показано, что способность к синтезу дофамина неуклонно возрастает с началом появления тяжелых психотических симптомов.
Выделяют несколько дофаминергических трактов:
. Мезолимбический тракт
— протекает от вентральной тегментальной области (VTA) до ядра, находящегося в лимбической системе.
— гиперактивность дофамина в мезолимбическом тракте опосредует продуктивные психотические симптомы ( может также опосредовать агрессию).
— антагонизм рецепторов D2 в мезолимбическом пути объясняет позитивные психотические симптомы.
Мезокортикальный тракт
— проекции от VTA до префронтальной коры.
— проекции к дорсолатеральной префронтальной коре регулируют когнитивные процессы и исполнительное функционирование.
— проекции в вентромедиальную префронтальную кору регулируют эмоции
— уровень дофамина от мезокортикальной проекции на дорсолатеральную префронтальную кору считается ответственным за негативные и депрессивные симптомы шизофрении.
— никотин высвобождает дофамин в мезокортикальных путях, облегчая выраженность негативных симптомов (гипотеза о самолечении)
Нигростриальный тракт
— нигростриальный путь опосредует двигательные нарушения.
— блокада дофаминовых D2-рецепторов в этом пути может привести к дистонии, симптомам паркинсонизма и акатизии.
— гиперактивность дофамина в нигростриальном пути является постулированным механизмом при гиперкинетических нарушениях движения, таких как хорея, тики и дискинезии.
— длительная блокада D2 в нигростриальном пути может привести к поздней дискинезии.
Тубероинфундибулярный тракт
— проекции от гипоталамуса до переднего гипофиза.
— тубероинфундибулярный тракт ингибирует высвобождение пролактина.
— блокада рецепторов D2 в этом пути может привести к гиперпролактинемии, которая клинически проявляется как аменорея, галакторея и сексуальная дисфункция.
— долгосрочная гиперпролактинемия может быть связана с остеопорозом.
В клинической практике может внимание врачей непропорционально сосредоточено на позитивных психотических симптомах. Однако, важно признать, что аффективные (например, депрессивные), негативные и когнитивные симптомы являются основной частью шизофрении и их следует всегда уделять большое внимание при лечении.
Баланс терапии достигается путем оптимальной блокады дофамина в мезолимбическом тракте, сохраняя (или усиливая) передачу дофамина в других путях.
Исследования показывают, что треть больных шизофренией не реагируют на классические антипсихотики, несмотря на высокий уровень блокады D2-рецепторов. Кроме того, тетрабеназин, используемый как средство, которое истощает пресинаптический дофамин не показало своей эффективности при шизофрении. Таким образом, для значительного числа пациентов с шизофренией основа симптомов либо не связана с дофаминергической дисфункцией, либо связана с чем-то большим, чем просто избытком дофамина. Это также может означать, что для некоторых пациентов с шизофренией может существовать не дофаминергический подтип шизофрении.
Дофамин, как модулятор иммунной системы
Нейроиммунотрансмиттер
Дофамин является ключевым нейромедиатором, который вызывает важные эффекты в нервной системе и во многих периферических органах через пять дофаминовых рецепторов (DR): D1R-D5R. Дофамин также вызывает множество прямых и очень мощных эффектов на многие иммунные клетки, экспрессирующие рецепторы дофамина (DR_, в первую очередь Т-клетки и дендритные клетки. Дофамин, как основной нейротрансмиттер, заслуживает повышения до уровня «нейроиммунотрансмиттера» из-за его разнообразного, прямого и мощного воздействия на большинство или даже все иммунные клетки. Дофамин сам по себе (в оптимальной концентрации
Факты и гипотезы
10 (-8) M) активирует Teff в состоянии покоя / наивный (CD8 (+) >>> CD4 (+ )), (5) дофамин влияет на дифференцировку Th1 / Th2 / Th17, (6) дофамин ингибирует уже активированные Teff (т.е. Т-клетки, которые уже были активированы антигеном, митогеном, цитокинами анти-CD3 антител или другими молекулами), (7) дофамин подавляет активированные Treg аутокринным / паракринным образом.
Таким образом, дофамин «подавляет супрессоры» и снимает ингибирование, которое они оказывают на Teffs, (8) дофамин влияет на внутриклеточные сигнальные молекулы и каскады в Т-клетках (например, ERK, Lck, Fyn, NF-κB, KLF2), (9) Т-клетки способны продуцировать дофамин (Tregs >>> Teffs), могут высвобождать дофамин, в основном, после активации (антигеном, митогеном, антителами к CD3)
Препараты
Иммунотерапия рака и аутоиммунных заболеваний
Индуцированная дофамином активация Teff в состоянии покоя и подавление Treg кажутся полезными для здоровья, а также могут использоваться для иммунотерапии рака и инфекционных заболеваний. Независимо от этого подавление DR в аутоиммунных и провоспалительных Т-клетках, а также в злокачественных Т-клетках может быть также полезным. Поалагаю, что эта информация может быть актуальной для иммунологов, неврологов, нейроиммунологов, гематологов, психиатров, психологов и фармакологов.
Дофамин и биоактивные липиды при шизофрении
Введение
Один из промежуточных фенотипов ( патогенетических звеньев ) шизофрении может включать нарушения передачи сигналов фосфолипидов, особенно в отношении арахидоновой кислоты (АА). Данные ряда исследований показывают взаимосвязь между уровнями арахидоновой кислоты и результатами тестов когнитивной функции у пациентов с шизофренией, с дефектами передачи сигналов АА, связанными с дефицитом когнитивных функций. Более того, оказалось, что дофамин может смягчать эти отношения между АА и состоянием когнитивной сферы.
Дофамин и шизофрения
Фосфолипиды и шизофрения
Липиды составляют примерно 50% сухой массы человеческого мозга, и большинство липидов (46-70%) составляют фосфолипиды. Основные фосфолипиды в нейронных мембранах состоят из фосфатидилэтаноламина, фосфатидилхолина, фосфатидилсерина, фосфатидилинозитола и сфингомиелина. Изменения в этих основных фосфолипидах достоверно наблюдаются у пациентов с шизофренией.
Полиненасыщенные жирные кислоты и шизофрения
В то время как насыщенные и мононенасыщенные жирные кислоты могут быть синтезированы de novo у млекопитающих, предшественники для ряда n-3 и n-6 полиненасыщенных жирных кислот (PUFA) должны быть получены из пищевых источников. Между рядами n-3 и n-6 существует взаимозависимая связь; дефицит n-3 жирных кислот в рационе приводит к снижению уровня n-3-докозагексаеновой кислоты в мозге и других органах, а также к взаимному увеличению уровня n-6-докозапентановой кислоты.
Исследования влияния полиненасыщенных жирных кислот (ПНЖК) на когнитивные функции проходили по двум основным направлениям: (i) исследования на животных, в которых манипулировали потреблением жирных кислот с пищей, либо вызывая дефицит рациона, либо повышая их содержание в диете, а когнитивные способности оценивали как функция концентрации жирных кислот в тканях мозга; (ii) оценка когнитивных способностей человека как функции пищевых жирных кислот и фосфолипидов в эритроцитах (RBC) и плазме.
Дефицит α-линоленовой кислоты в рационе также приводил к снижению высвобождения дофамина во фронтальной коре после стимуляции тирамином, что свидетельствует о снижении высвобождения дофамина из пула везикулярного хранилища. Более того, количество везикул в досинаптических терминалах дофамина было уменьшено в лобной коре крыс, получавших диету с дефицитом α-линоленовой кислоты. В совокупности эти данные подтверждают связь между изменениями концентрации n-3 ПНЖК и нарушениями структуры и функции в системе дофамина.
Важно отметить, что у крыс с недостаточным уровнем DHA в головном мозге также наблюдалось снижение уровня дофамина в вентральном полосатом теле на 50% и повышение уровня метаболита дофамина DOPAC (3,4-дигидроксифенилуксусная кислота) в лобной коре. Вероятно, на семантическую память при шизофрении влияют изменения в дофаминергической нейротрансмиссии и нарушения в фосфолипидах клеточной мембраны.
Эйкозаноиды
Простагландины и шизофрения
Неблагоприятное влияние дофаминергических агентов на движение также может быть смягчено вызванным нейролептиками окислительным стрессом. Роль PG в качестве эндогенных антидофаминергических агентов подтверждается данными о том, что ингибиторы синтеза PG могут вызывать психотические симптомы у некоторых людей и усиливать психотические симптомы у пациентов с шизофренией.
PsyAndNeuro.ru
Дофамин, психоз и шизофрения
Концепции таких сложных психических расстройств, как шизофрения, требуют постоянного обновления, которое невозможно при проведении фундаментальных исследований отдельно от клинических. Наших знаний о патогенезе шизофрении все еще недостаточно, хотя в последнее время отмечается некоторый прорыв. Использование животных моделей является хорошим вариантом для инвазивного изучения роли нейромедиаторных систем и сетей головного мозга при психических расстройствах, что невозможно сделать в исследованиях на людях. Однако недостаточное взаимодействие между клиницистами и учеными приводит к тому, что полученные клинические данные редко используются для моделирования симптомов шизофрении на животных. Авторы данной статьи обсуждают проблемы в понимании механизмов развития позитивных симптомов при шизофрении,с которыми сталкиваются как ученые, так и врачи.
Нейробиология психоза: центральная роль дофамина
Дофаминовые системы: анатомия и функция
При использовании животных моделей необходимо помнить об анатомических особенностях дофаминовой системы у грызунов и приматов. Например, у приматов по сравнению с грызунами более выражен объем черного вещества, но меньше – зона вентральной покрышки. Однако в контексте данной статьи наиболее уместно рассматривать подотделы стриатума, которые были изучены как у грызунов, так и у приматов.
Рис.1 Функциональные подотделы дофаминовой системы
Особенности дофаминовых систем при психозе
Использование стимуляторов дофамина (таких как амфетамин) у здоровых людей может спровоцировать развитие психотических симптомов. Однако люди с шизофренией более чувствительны к подобным веществам. Так, изучение дофаминовых систем с использованием позитронно-эмиссионной терапии (ПЭТ) выявило следующие отличия у больных с шизофренией по сравнению со здоровыми людьми:
По мере увеличения разрешения изображений, получаемых при ПЭТ, также была выявлена еще одна особенность: изменения дофаминовой системы наиболее выражены в ассоциативном стриатуме, а не в лимбическом, как считалось раньше.
Наличие позитивной симптоматики часто связывают с увлечением объема синтеза и высвобождения дофамина. Проводимые клинические исследования продемонстрировали наличие аномалий дофаминовой системы ещё до развития психоза. Например, у лиц с крайне высоким риском развития психоза были выявлены такие же аномалии, что и при шизофрении. Кроме того, степень увеличения синтеза дофамина напрямую коррелирует с вероятностью развития психоза. Таким образом, дофаминовые аномалии не могут являться следствием психозов или приема антипсихотиков.
Было предложено несколько гипотез, которые могут объяснить такие изменения функции дофаминовой системы:
При проведении исследований предлагается использование следующей парадигмы: важным фактором развития психотической симптоматики при шизофрении является нарушение взаимодействия структур головного мозга – стриатума, префронтальной коры (ПФК) и таламуса. Но при этом не стоит исключать влияние и других структур на данную сеть.
Психоз, как следствие нарушения работы сетей головного мозга
На данный момент у ученых мало информации о механизмах, лежащих в основе развития психоза. Но изучение очаговых повреждений головного мозга позволяет лучше понять работу его систем:
Также было выявлено, что поражение базальных ганглиев или хвостатого ядра может проявляться как галлюцинациями, так и формированием бредовой симптоматики.
При изучении же тематического религиозного бреда у пациента с височной эпилепсией была выявлена гиперактивность ПФК. Дисфункция связи ПФК с ассоциативным стриатумом может быть ключевым фактором для формирования бредовой симптоматики при шизофрении.
Таламус является центральной частью систем, участвующих в патогенезе психоза и шизофрении. Исследования с применением методов нейровизуализации показали значительное уменьшение объема таламуса и хвостатого ядра у пациентов с шизофренией, не получавших медикаментозного лечения. Такие же изменения таламуса были обнаружены у субъектов с крайне высоким риском развития психоза.
Рис 2. Сети, которые вовлечены в развитие психотических симптомов и шизофрении. Главная сеть, вовлеченная в развитие психоза, включает в себя таламус и ПФК (выделено желтым), которые стимулируют ассоциативный стриатум. Повреждения этих структур способствует развитию галлюцинаций и бредовых расстройств. Выраженность психотических симптомов во многих случаях зависит от степени усиления активности ассоциативного стриатума, и, особенно, избыточной стимуляции D2-рецепторов (выделено красным). Остальные регионы лимбической системы, такие как гиппокамп и амигдала (выделено зеленым), могут оказывать воздействие на эту сеть, способствуя изменению чувствительного восприятия и эмоциональной окраски.
Таламус имеет большое количество связей с ассоциативным стриатумом и ПФК, и нарушения в любой из этих структур могут повлиять на работу всей сети целиком. Кроме того, гиппокамп и амигдала также могут опосредованно влиять на эту сеть.
Несмотря на значительное упрощение данной схемы, она указывает на то, что психотические симптомы могут возникать из различных очагов патологии головного мозга или аномальной связности.
Почему антипсихотики работают?
Избыточная стимуляция D2-рецепторов в ассоциативном стриатуме способствует развитию психотической симптоматики. Антипсихотики могут ослаблять возникновение психотических симптомов, нормализуя избыточную стимуляцию и восстанавливая баланс между D1 и D2 рецепторными путями.
Нарушение поступления информации в стриатум через таламус, ПФК или другие регионы может как отдельно спровоцировать дисфункцию ассоциативного стриатума, так и дополнить её. В таком случае для восстановления нормальной функции блокада D2-рецепторов может оказаться недостаточной, что обусловливает резистентность некоторых больных к действию антипсихотиков.
У пациентов, получающих лечение, у которых остается позитивная симптоматика, обнаружено увеличение активности таламуса, стриатума и гиппокампа. У пациентов, положительно реагирующих на прием клозапина, наблюдаются изменения кровотока во фронто-стрио-таламическом пути. Данное наблюдение может указывать на то, что прием клозапина способен устранить дисбаланс в указанных системах.
Рис 3. Психоз, как следствие нарушения работы сетей головного мозга
В некоторых случаях психоз может представлять собой сумму обширных нарушений головного мозга, включая дисфункцию различных нейронных сетей (Рис 3). Однако выраженность позитивной симптоматики различается в каждом клиническом случае и определяется преимущественно опросом. Невозможность провести опрос у животных приводит к тому, что наилучшим способом изучить позитивную симптоматику на животных моделях является использование тестов, чувствительных к воздействию на механизмы, которые лежат в основе развития психоза. Учитывая действие антипсихотических препаратов, областью, представляющей наибольший интерес, является ассоциативный стриатум.
Моделирование психоза: использование животных моделей
Амфетамин-индуцированная локомоция
Однако было выявлено несоответствие между поведенческим проявлениям у животных и результатами клинических исследований у людей: усиление локомоции у животных было вызвано высвобождением «лимбического» дофамина, а у людей обнаружена гиперактивность ассоциативного стриатума. Кроме того, такая активность оказалась более специфичной для биполярного-аффективного расстройства, чем для шизофрении.
Данное несоответствие показывает необходимость смены парадигмы для исследования позитивной симптоматики при шизофрении.
Дефицит преимпульсного ингибирования
Преимпульсное ингибирование — снижение моторной реакции организма на сильный резкий стимул, обычно звуковой, при наличии слабого предварительного стимула. Преимпульсное ингибирование является индикатором сенсомоторной фильтрации, отражающим способность центральной нервной системы фильтровать сенсорную информацию.
В силу того, что имеется возможность оценить дефицит преимпульсного ингибирования как у людей, так и у грызунов, он является наиболее изученным явлением при шизофрении. Он отражает нарушение возможности исключать стимулы меньшей значимости (неуместные) из обработки, но при этом не является специфичным симптомом шизофрении. Было выяснено, что в процессах преимпульсного ингибирования участвует как лимбический, так и ассоциативный стриатум. Таким образом, дефицит преимпульсного ингибирования не имеет специфики по отношению к избыточной дофаминовой стимуляции, которая наблюдается при шизофрении.
Возможно ли объективно оценить позитивную симптоматику у грызунов?
В свете недавних исследований с использованием ПЭТ появилась необходимость для пересмотра значимости моделей животных для оценки позитивной симптоматики при шизофрении.
Для улучшения эффективности лечения позитивных и негативных симптомов при шизофрении необходимо использовать более надежные поведенческие тесты. Важно, чтобы данные тесты можно было выполнять как у людей, так и грызунов.
Также нужно понимать, что ни один из данных тестов отдельно не может оценить позитивную симптоматику, но в комбинации они способны изолированно изучить функцию ассоциативного стриатума.
Рис 4. Сравнение когнитивных тестов для людей и для грызунов. И люди, и грызуны способны решать когнитивные задачи, требующие выполнения определенных действий для получения наград (а). Важное отличие в тестировании заключается в том, что люди получают денежные вознаграждения в то время как грызунам дается награда в виде еды; и грызунам требуется лучшая начальная подготовка для выполнения действия (нажатие на рычаг или тыкание носом). Для проведения тестирования целенаправленной деятельности (b) люди и грызуны обучаются ассоциациям двух действий с двумя отдельными наградами. Одна из наград затем обесценивается: демонстрацией видео с тараканами на одной из наград (для людей) и кормление до полного насыщения (для грызунов). Серийное реверсивное обучение (c) требует от субъекта способности различать два варианта действий, один из которых будет связан с наградой. Как только определенные критерии выбора будут выполняться, они меняются на противоположные. То действие, что раньше не приносило награду, будет вознаграждаться, а другое действие, наоборот, не будет вознаграждаться. Такое переключение повторяется до завершения теста.
Оценка целенаправленности действий: чувствительность к обесцениванию награды
Изучение целенаправленного поведения важно для понимания того, как происходит формирование связи между совершенными действиями и результатами этих действий. Кроме того, установлено, что функция ассоциативного стриатума задействована в реализации целенаправленного поведения. Оценить ее можно как у людей, так и у грызунов, используя идентичные тесты (рис 4b).
Обесценивание награды – эффективный способ оценить правильность формирования поведенческих связей типа «действие-результат». После формирования нескольких пар ассоциаций определенного действия с полученной наградой происходит обесценивание одной из наград. Здоровые люди довольно быстро выявляют ухудшение награды, и отдают предпочтение другому варианту действия. Это демонстрирует способность адаптировать свою деятельность, основываясь на полученной информацию.
Чувствительность к обесцениванию награды, зависит от функции ПФК и ассоциативного стриатума. (рис. 5a). Что важно, отсутствие чувствительности к обесцениванию награды, наблюдаемая у людей с шизофренией, представляла скорее неспособность использования полученной информации, чем нарушение механизмов вознаграждения.
Рис 5. Структуры головного мозга, задействованные в поведенческих тестах.
Оценка поведенческой гибкости: серийное реверсивное обучение
При проведении тестов с обесцениванием наград имеется недостаток: невозможно разграничить функциональный дефицит ПФК и функциональный дефицит ассоциативного стриатума. Это значит, что необходимо дополнить данный тест другим, который позволит выявить дисфункцию именно ассоциативного стриатума.
Базальные ганглии также задействованы в процессах принятия решений и, что важно, в реверсивном обучении – способности адаптировать свои решения при возникновении случайно изменяемых результатов. Обширные исследования у людей, приматов и у грызунов показали зависимость реверсивного обучения от функции орбитофронтальной коры и ассоциативного стриатума (рис 5b).
Подход к изучению позитивной симптоматики на животных моделях на уровне нейросетей.
Текущие успехи поведенческой нейронауки позволили определить структуры и системы головного мозга, участвующие в формировании сложного поведения. Используя такие техники, как оптогенетика или хемогенетика, стало возможным изучение конкретно интересующихзон головного мозга, например, ассоциативного стриатума.
Таким образом, было выявлено, что:
Однако, как и психоз, данные нарушения могут возникать не только при шизофрении, но и при многих других психических расстройствах. В таком случае необходимо также проводить тесты, оценивающие когнитивные и другие функции. Это позволит создавать более эффективные животные модели, исследование которых позволит более подробно изучить этиологию шизофрении.
Заключение
Клозапин, разработанный в 1960-е, в настоящее время остается наиболее эффективным антипсихотическим препаратом, однако его использование ограничено побочными эффектами. Подобный застой в разработке препаратов для лечения больных с шизофренией подчеркивает главную слабость текущих исследований – недостаток эффективного сотрудничества между учеными и клиницистами.
Клинические исследования необходимы для разъяснения всех особенностей формирования и развития психоза и непосредственно шизофрении. Полученные результаты помогут в создании животных моделей, которые будут основаны на более актуальных данных, чем сейчас.
Использование таких моделей позволит разработать более совершенные и объективные методы оценки поведенческих особенностей, возникающих при шизофрении. Также на животных моделях возможно проведение инвазивных манипуляций, которые помогут подробнее изучить нейробиологические процессы, лежащие в основе развития психоза при шизофрении.
Материал подготовлен в рамках проекта ProШизофрению — специализированного раздела официального сайта Российского Общества Психиатров, посвященного шизофрении, современным подходам к её диагностике и лечению.
PsyAndNeuro.ru
Интервью с Арвидом Карлссоном: дофаминовая нейротрансмиссия
Третье интервью из книги Дэвида Хили “Психофармакологи” (D. Healy “The Psychopharmacologists” 1996, Chapman & Hall) – с Арвидом Карлссоном – записано в 1994 г. в Пуэрто-Рико.
Арвид Карлссон (1923-2018) – шведский психофармаколог, получивший в 2000 г. Нобелевскую премию за открытие химической нейротрансмиссии. Карлссон занимался дофамином и стал одним из первых ученых, доказавшим связь дефицита дофамина с болезнью Паркинсона, а также показавшим, как антипсихотики влияют на дофаминовую систему. Его работы сыграли важнейшую роль в истории появления антидепрессантов нового поколения. Первый СИОЗС зимелидин (снятый с производства из-за сообщений о серьезных побочных эффектах) был разработан при его участии.
Беседы, опубликованные в книге Дэвида Хили, представляют двойной интерес. С одной стороны, это рассказы вождей психофармакологической революции, лично создававших в 1950-70 гг. психиатрию в том виде, в котором она существует сейчас. С другой стороны, в интервью отражаются проблемы актуальные для того времени, когда они записывались – для 1990 гг. Таким образом, это исторические документы, рассказывающие сразу о двух важнейших периодах в истории науки.
Как вы оказались в Национальных Институтах Здравоохранения США?
В Швеции я занимался в основном метаболизмом кальция. Нашел вакансию, но члены экспертной комиссии, которые отдали это место моему единственному конкуренту, объяснили, что метаболизм кальция на самом деле не является центральной проблемой в фармакологии – ситуация изменилась в последнее время, но в те времена так оно и было. Поскольку я хотел остаться в фармакологии, я решил перейти в другую область, и обратился к своему другу Суне Бергстрёму – он был профессором физиологической химии в Лунде, и часто мне помогал. Позже он получил Нобелевскую премию за свою работу по простагландинам. Я сказал ему, что хотел бы сменить сферу деятельности; я знал, что у него есть связи в США, поэтому попросил его найти лабораторию в США, где занимались биохимической фармакологией, что меня в то время особенно сильно интересовало.
Он написал своему другу Бернарду Виткопу, очень умному химику – он был родом из Австрии – который многое сделал для синтетической химии. Он стоял за очень важными достижениями в органической химии и биохимии. Виткоп передал письмо Сиднею Уденфренду. Уденфренд не мог тогда самостоятельно принимать решения, он должен был посоветоваться со своим боссом, Бернардом Броди. Броди написал мне: “Мы были бы более чем счастливы работать с тобой, но у нас нет денег”. Мне удалось собрать небольшую сумму денег, чтобы я мог поехать. Когда я приехал туда в конце августа 1955 г., первое, что они сделали, это пригласили меня в столовую пообедать. Броди и Уденфренд были там, и я понял, что именно тогда он решал, возьмет он меня на работу или отдаст Уденфренду. Он решил взять меня к себе.
Но ведь вы пришли из другой научной области и мало чем могли их впечатлить.
Я вообще ничего не знал о сфере их исследований. Мои первые работы в области фармакологии касались лекарств и центральной нервной системы, а оттуда я перешел к метаболизму кальция. Я немного работал над конвульсантами и над тем, что в то время называлось центральными аналептиками, метразолом – препаратом, который мог будить усыпленных барбитуратами животных, да и людей тоже. Но это было единственное исследование, которое я провел в области фармакологии ЦНС.
Что из себя представляли Национальные Институты Здравоохранения в то время?
Забавно, что лаборатория Броуди относилась к Национальному институту сердца, и это говорит о том, как мало значат вывески. Она называлась Лаборатория химической фармакологии, а здание, где я работал, 10-й корпус, было самым большим. В то время считалось, что количество кирпичей в этом здании самое большое в мире. Я не знаю, правда ли это, но это было огромное здание, конечно, оно немного расширилось, но сейчас оно не так уж сильно отличается от того, каким оно было раньше. Тогда его только построили, и для лаборатории химической фармакологии все еще покупали оборудование, там стояли большие коробки с нераспакованным оборудованием. Это было самое начало того периода, которому суждено было стать столь значительным в истории развития нейропсихофармакологии.
Постоянно приходили гости. Почти каждый день приезжали люди со всего мира, чтобы побеседовать с Броди и узнать последние новости. Откуда столько внимания? Я думаю, было три причины. Во-первых, Броди был настоящим первопроходцем в области измерения уровня лекарств. Фармакокинетика возникла, благодаря той работе, которую Броди начал в Нью-Йорке, а затем в Национальных Институтах Здравоохранения. Они проделали большую работу, эта тема была модной и, конечно, то, что они сделали, было очень важно.
Во-вторых, они находились в процессе разработки спектрофотофлюориметра, который в наши дни не так часто используется, но он играл важнейшую роль в течение двух или трех десятилетий. Единственным аппаратом в мире, когда я приехал туда, была модель, которую построил Боумен. Это был прототип, несобранный в единое целое. Он состоял из разрозненных частей, разбросанных по всей комнате. Нужно было тушить свет, чтобы работать с ним. В общем это было очень важное изобретение.
В-третьих, они только что сделали открытие – если давать животным резерпин, то серотонин исчезает из тканей, в том числе из головного мозга. Я думаю, что именно эта последняя находка привлекла столько внимания.
Можно сказать, что это было первое настоящее нейрохимическое открытие?
Все же это был первый раз, когда было показано, что изменение в мозге коррелирует с изменением поведения.
Вы изучали тромбоцитарный серотонин. Как вы это делали? Сбор тромбоцитов – это довольно непросто.
Я до сих пор не понимаю, в чем там сложность. Когда я приехал в конце августа, мне сразу же поручили заниматься этим. У них было готово оборудование, очень хорошее оборудование, и они точно сказали мне, что именно надо делать. Я взялся за работу, выделял тромбоциты. Это совсем не трудно.
Но если использовать неправильный антикоагулянт и неправильное центробежное ускорение…
Да, тогда ничего не получится. Но в данном случае, с этилендиаминтетрауксусной кислотой, не было никаких проблем. По какой-то смешной причине, мне сказали, что я должен использовать силиконизированную лабораторную посуду, что, как мы выяснили, было совершенно не обязательно.
Я работал над этим, кажется, больше месяца – выделял тромбоциты, вводил резерпин, измерял серотонин в супернатанте и тромбоцитах – и ничего не нашел. Это было неприятно потому что, как вы отметили, я был новичком в этой области, и надо мной могли посмеяться. Но потом получилось так, что у меня закончился резерпин, мне дали новый, и, как только я его получил, он прекрасно сработал. Я думаю, что-то было не так с первой партией резерпина.
Наточив зубы на серотонине, вы захотели изучать не только серотонин, но и катехоламины, несмотря на сильную увлеченность Броди серотонином. Это была ересь, с его точки зрения.
Да, так оно и было. Я к тому времени уже проделал кое-какую работу с тромбоцитами самостоятельно. По какой-то причине, вероятно, потому, что Хилларп в Университете Лунда обнаружил, что в коре надпочечников содержится много АТФ, я задался вопросом, есть ли АТФ в тромбоцитах. Я выполнил кое-какие анализы по этому поводу. Не думаю, что они были очень качественными, но, по крайней мере, они убедили меня, что в тромбоцитах есть АТФ и в довольно больших количествах.
Я думал, что разумно предположить, что механизм хранения серотонина и катехоламинов может быть в основном одинаковым, и поэтому введение резерпина каким-то образом повлияет и на катехоламины.
Я рассказал об этом Броди, и он ответил: “Нет, это будет пустой тратой времени, важно заниматься серотонином, а не этим”. Он настаивал на важности серотонина в течение неоправданно долгого периода времени. Почему? Отчасти, возможно, из-за особенностей характера, но, возможно, он тоже сначала имел некую гипотезу, а этот эксперимент с резерпином и серотонином подтвердил его гипотезу.
И тогда они предположили, что резерпин высвобождает серотонин. Вот почему был проведен тот эксперимент, который показал именно те результаты, которые они ожидали. Свои выводы они сделали на основе довольно простых экспериментов, которые все-таки были неправильно интерпретированы, потому что серотонин не попадает в мозг. Интерпретация была в основе своей неправильной.
Тем не менее, они думали, что, когда вы вводите резерпин, увеличивается количество свободного серотонина, и именно этот свободный серотонин успокаивает животных. Такова была их идея, и они твердо стояли на своем.
Но с другой стороны, должен сказать, что Броди был очень добр со мной. Когда рассматривалась моя кандидатура в Университете Лунда, на факультете потребовали рекомендации, и Броди был очень великодушен, он написал, что я потряс мир, показав, что катехоламины тоже истощаются резерпином. С другой стороны, конечно, наши споры время от времени становились несколько резкими. Не столько с самим Броди, сколько с некоторыми из его молодых коллег.
Самым запоминающимся был спор с Мимо Костой. В 1961 г. проводилась конференция в Стокгольме. Это был фактически первый международный фармакологический конгресс. Коста рассказывал об исследованиях, которые доказали, что резерпин действует на серотонин, а катехоламины не имеют никакого значения. Я оспорил его тезисы и показал, что они неверно истолковали свои данные. Наш спор в какой-то момент стал, скажем так, очень энергичным. Броли – его там не было с самого начала – сказал позже: “Повезло Карлссону, что у Косты не было ножа”, потому что Коста действительно был в бешенстве. Об этом даже написали в шведских газетах на следующий день. 25 лет спустя в Стокгольме состоялся Международный симпозиум по клинической фармакологии, на котором председательствовал Шёквист, который видел наш диспут, который ему так запомнился, что он захотел повторить его через 25 лет. Он пригласил меня и Косту… но на этот раз все прошло довольно мирно.
Как вы оцениваете Броди?
Думаю, он был действительно лучшим. Нельзя оценить его по обычным академическим стандартам, потому что он не во всем был хорош. Часть его научной работы была очень крепкой, но он брался рассуждать в тех областях, в которых он был невежественен.
Он не был традиционным ученым – думаю, это можно сказать совершенно точно – но в некотором смысле это было его сильным качеством. Возможно, самые выдающиеся люди, самые творческие люди не соответствуют общепринятым стандартам. Но это также причина, по которой некоторые люди думали, что он был чокнутым, и, если посмотреть на него с определенной точки зрения, то он действительно был чокнутым. Обычно человеку достаточно иметь одну или две великие идеи, которые он может развивать и доказывать. Тогда он внесет свой вклад, даже если он безумен в других сферах.
Стоило присудить ему Нобелевскую премию вместе с Аксельродом?
По-моему, он заслужил Нобелевскую премию. Но все зависит от того, как вы понимаете смысл завещания Альфреда Нобеля. Конечно, в том, что касается вклада в нейронауку или фармакологию, если уж на то пошло, Броди намного выше всех остальных. Проблема в том, что он был химиком-органиком и его знания о физиологии и медицине слабо обременяли его. Он мало что понимал в этих сферах, и я думаю, что это была одна из его сильных сторон – его невежество, да. Он не имел ни малейшего представления о том, насколько сложен мозг, поэтому он мог придумывать очень простые концепции.
О Броди можно сказать многое, и одно из его качеств – это сочетание невежественности в физиологии со способностью формулировать простые концепции, которые можно было проверить, что было весьма удивительно. Много раз бывало так, что он сидел и слушал очень сложный доклад, а затем вставал и задавал какой-нибудь очень простой вопрос, в котором было много смысла, хотя его идею и не принимали. Но он брался за эту идею и работал с ней. Так что это было его сильным качеством, вместе со способностью разрабатывать методы и собирать вокруг себя таких умных людей как Уденфренд, Боумен и Аксельрод.
Он был потрясающим парнем, но когда дело доходило до интерпретации данных, когда дело доходило до стадии, на которой нужно продвинуться дальше, он терпел неудачу. Это была его сила и его слабость. Он мог совершить прорыв, но не мог развить концепцию дальше, потому что ему не хватало знаний. Он был химиком-органиком, и от него нельзя было требовать понимания функций мозга.
Итак, вы вернулись в Швецию и принялись изучать катехоламины вместе с Хилларпом. Расскажите о нем.
Он был очень интересной личностью. Думаю, можно сказать, что он был гением. Он начал с гистологии, но его очень интересовали функции организма, так что он был физиологом и гистологом одновременно. Он был очень умен и обладал прекрасными экспериментальными навыками. В то время он владел целым рядом методов, которые были очень важны, такими как гомогенизация, дифференциальное центрифугирование для выделения различных органелл в клетках и т. д. Он разработал методы анализа катехоламинов и АТФ – на самом деле он был также очень хорошим биохимиком.
В Бетесде я решил, что должен спросить Хилларпа, не хочет ли он поработать со мной, и, к счастью, он сказал “Да”. Мы работали над связыванием катехоламинов с АТФ, и еще вводили резерпин и анализировали кору надпочечников на наличие катехоламинов.
На меня произвел большое впечатление спектрофотофлюорометр, с которым я работал в лаборатории Броди. В то время только начали производить и продавать спектрофотофлюорометр Аминко-Боумена. Вернувшись домой в Лунд, я первым делом заказал его. Он был очень дорогим. У меня не было денег. Тогда я обратился за деньгами в Шведский Медицинский Исследовательский Совет и получил их, но когда мы проводили первые эксперименты, у меня еще не было этого аппарата.
Хилларп придумал колориметрический метод, который хорошо работал – добавляете окислитель, он превращает адреналин в красноватое соединение, адренохром, который можно измерить колориметрически. Конечно, когда мы проводили этот эксперимент, мы поняли, что нам не нужен никакой колориметр, потому что после введения резерпина не было никакого цвета вообще. Все можно было увидеть невооруженным глазом. Это было очень впечатляюще.
В тот момент вы не думали о том, что изменять мир из Лунда – это как-то необычно, люди просто не обратят на вас никакого внимания? Вы работали не в Институтах Здравоохранения США, не в Оксфорде или Кембридже.
Конечно, думал и особенно четко понял это через пару лет, когда мы с Хилларпом поехали в Лондон на конференцию по адренергическим механизмам и там…
Да, я как раз хотел спросить об этом… Я читал труды этой конференции. Вы до сегодняшнего дня удивляетесь тому, что в Великобритании тогда не понимали последствия вашего открытия.
Да, это было своего рода разочарование. Но, с другой стороны, у меня появилось чувство протеста и даже в какой-то мере агрессии из-за того что люди не поняли, насколько это было важно.
Удивительно, но участниками конференции были как раз те люди, кто долгое время убеждали всех в важности химической нейротрансмиссии.
Первопроходцы, они все были там. Дейл, Гаддум, Марта Фогт, Фельдберг, Блашко – все были там. Бернс, Заимис, Бюльбринг, все, кто работал в этой сфере, были там. Дискуссия опубликована, так что вы можете узнать, что было сказано. Мало, что опущено, но есть один момент, который опущен, – когда они выразили свой скептицизм в отношении того, что эти амины могут быть настолько важны для мозга. Блашко, который повторил некоторые из наших наиболее важных экспериментов, рассердился и сказал: “Думаю, нужно признать, что Карлссон сделал великое открытие”. Он имел в виду эффект леводопы на животное, которому ввели резерпин…
Мы вернемся к этой теме, а сейчас не могли бы вы рассказать о Дейле?
Может быть, я встречался с ним пару раз в других ситуациях, но на том симпозиуме мы виделись каждый день. Это был замечательный человек, было забавно наблюдать, как он вел себя с более молодыми ребятами. Молодым ребятам, конечно, было за 50 или за 60, но они вели себя с этим человеком совсем как школьники. Сэр Генри! Он был великолепен, но, в то же время было ясно, что нужно быть осторожным, чтобы не сказать что-нибудь такое, что не понравится сэру Генри Дейлу.
Так, например, возвращаясь к словам Блашко о том, что Карлссон сделал великое открытие, – он подошел ко мне позже наедине и сказал, что ему жаль, что он, рассердившись сказал это. Его замечание было опущено при публикации трудов симпозиума. Думаю, это говорит о том, что рядом с Дейлом люди чувствовали, что им нужно вести себя осторожно. Если утверждение не было одобрено им, его следовало исключить, а он, очевидно, сильно сомневался во всей этой истории с леводопой, дофамином и т. д. Один из его комментариев на конференции был таким: “Не странно ли то, что аминокислота, допа, токсична?”
Токсична? Почему токсична?
Он сказал так, из-за экспериментов с леводопой, который провел Вайль-Малербе. Он давал животным большие дозы допы в сочетании с ингибиторами МАО, в результате чего животным становилось очень плохо и они умирали. А он был парнем из Британии и поэтому то, что он видел, было важнее, чем то, что видели мы, Блашко или поляк Хрусьцель, который работал с Блашко. Вайль-Малербе был “настоящим человеком”, а слова тех, кто приезжал в Британию из Лунда, Польши или еще откуда-то, чтобы рассказать там свою историю, конечно же не могли быть приняты сразу.
Тогда вы с Хилларпом начали работать над гистофлуорисцентными методами и картированием процессов головного мозга, что тоже было очень важно.
Это было связано с той конференцией в Лондоне, потому что мы тогда оба очень расстроились. Одна из вещей, которая была сказана на той конференции об адренергических механизмах, – возможно, эти амины присутствуют только в глиальных клетках – об этом сказано в трудах конференции. Поэтому мы считали, что очень важно продемонстрировать присутствие этих аминов в нейронах.
Мы с Хилларпом решили попробовать. Меня только что назначили на кафедру фармакологии в Гетеборге, у него была должность адъюнкт-профессора в Лунде, и мы решили, что должны обратиться в Шведский Медицинский Исследовательский Совет с просьбой освободить его от преподавательской должности, чтобы он вместе со мной перешел на новую кафедру. Мы получили деньги и приступили к работе.
На первом этапе мы попытались применить ту же самую флуориметрическую процедуру, которую мы использовали для катехоламинов ранее, адаптированную для гистологического препарата, и это сработало, но сработало только для коры надпочечников. Тем не менее, Хилларп был очень воодушевлен этим и сказал, что мы должны пойти немного другим путем.
Он применил другой аналитический метод, разработанный Уденфрендом – добавлял формальдегид к серотонину и преобразовывал серотонин в флуоресцентное соединение, количество которого можно измерить. Хилларп начал работать с формальдегидом. У него был техник Тием, который приехал с ним в Гетеборг. Что они делали – они брали раствор с серотонином и белком, помещали его на предметное стекло, давали ему высохнуть, так что у них получалась пленка, помещали предметное стекло в формальдегид и смотрели на него в флуоресцентный микроскоп. Им приходилось изменять условия, но в конце концов все прекрасно сработало.
Однажды в августе 1961 г., когда Хилларп отправился в Лунд, он и Бенгт Фальк, его бывший ученик, решили попробовать препарат, с которым Хилларп работал, когда писал диссертацию – препарат сальника, растянутый на предметном стекле. Вы просто берете сальник у крысы, помещаете его на предметное стекло, даете ему высохнуть на воздухе, а затем помещаете ее в формальдегид. Это произошло, когда Хилларп приехал на выходные в Лунд. И у них получилось. Они смотрели в флуоресцентный микроскоп и вдруг увидели ту же сеточку, которую Хилларп описал в своей диссертации, когда он использовал метиленовый синий. Значит, там были адренергические нервы.
Им потребовалось еще два или три месяца, чтобы повторить это. У них не получалось, поэтому им пришлось подбирать условия – менять влажность или что-то еще – и в итоге все опять получилось, после чего они могли применять метод к гистологическим препаратам. Вот так было сделано открытие, хотя модельные эксперименты Тием с Хилларпом провели уж в Гетеборге.
Когда они занялись картированием мозга?
Довольно скоро. Хилларпу нравилось делать большой объем работы, а затем публиковать все в очень обширном формате, который обычно не принимался журналами. Приходилось прибавлять дополнения к статьям. Так в Acta Physiologica Scandinavica 1962 и 1963 гг. было несколько важных дополнений, о которых никто не знает.
Он не стремился к тому, чтобы его имя стало известным.
Не стремился. Не думаю, что он вообще думал об этом. Он был довольно застенчивым человеком. За всю свою жизнь он был только на одной международной конференции. Это была та самая конференция в Лондоне. Так что он мало что знал о мире. Еще он был на одной конференции в Хельсинки. Как нужно распространять информацию, ему была не очень понятно.
Кроме того, у него была идея, принятая в Acta Physiologica Scandinavica, о том, что авторы всегда должны помещаться в алфавитном порядке. Вы можете видеть это во всех его публикациях. Я не возражал, потому что первая буква моей фамилии стоит выше чем первая буква его фамилии. Так что авторы первой публикации, демонстрирующей нейроклеточную локализацию моноаминов в головном мозге, указаны так – Carlsson, Falck, Hillarp.
Каковы были последствия публикаций о картировании?
Огромные. Я думаю, что, вероятно, были две вещи, которые привели к общему признанию моноаминов в качестве нейромедиаторов. Во-первых, гистохимия и вся работа, которую мы проводили с фармакологическими манипуляциями с резерпином и прекурсорами, наблюдая, как изменяется уровень моноамина. Во-вторых, я думаю, то, что Горникевич открыл, что при болезни Паркинсона происходит истощение дофамина.
Мы, конечно, делали такое предположение на основе данных о животных, но именно Горникевич продемонстрировал низкий уровень дофамина в посмертных анализах.
Другой большой спор в этой области в то время велся вокруг вопроса, есть ли у везикул функциональное значение. Одна из сторон в споре, Аксельрод, говорил: “Нет, значение имеют только нейротрансмиттеры в цитоплазме”.
Я связываю разные вопросы с разными встречами. В 1965 г. проходила конференция в Стокгольме, труды который были изданы в книге “Механизмы высвобождения биогенных аминов” (Mechanisms of Release of Biogenic Amines. ed. by U. S. Von Euler S. Rosell B. Uvnäs. 1966). Фон Эйлер, Аксельрод и Уденфренд говорили, что важен цитозольный пул, а везикулы, как сказал Уденфренд, это мусорные баки. Мы активно спорили с этим. К тому времени мы собрали фармакологические данные с помощью гистохимического флуоресцентного метода и могли продемонстрировать состояние, при котором в цитоплазме был избыток аминов, но они не отвечали на стимуляцию нервов потому что их не было в гранулах.
Конференция 1965 г. была хороша тем, что там велась дискуссия, и ее участники могли высказать то, что думали. Мы рассказали там о нашей моноаминергической модели, которую мы предложили за пару лет до этого.
То, что леводопа реверсировала индуцированное резерпином поведение, доказывало, что задействованы катехоламины, а не серотонин. Серотонин ничего не изменял, как к этому отнесся Броди?
У него была свое объяснение. В 1957 г. он приехал в Лунд и мы провели эксперимент, чтобы он сам все увидел и не сомневался в открытии, но он вернулся к идее, восходящей к швейцарскому физиологу Гессу, который учил о трофотропной и эрготропной системах.
По мнению Броди, трофотропная система – это серотонин, а эрготропная – катехоламины. Он сказал тогда: “То, что вы видите здесь, это именно то, о чем я говорю – усиление функции эрготропной системы противодействует эффекту трофотропной системы, которая чрезмерно стимулируется непрерывным высвобождением серотонина”. В общем он легко справился.
Эта идея вернулась через 10 лет, когда вы предположили, что катехоламины вовлечены в моторную активность, а серотонин больше связан с настроением, и это предположение привело к созданию ингибиторов обратного захвата серотонина.
Ну, вообще-то нет. Я предположил это на основании данных Кильхольца, у которого была прекрасная картинка со всеми трицикликами, где с одной стороны у него были эффекты, связанные с подъемом настроения, а с другой стороны эффекты, связанные с восстановлением физической активности. На схеме Кильхольца, которая была основана на его клиническом опыте, было видно, что вторичные амины активируют, а третичные амины поднимают настроение.
Мы обнаружили, что антидепрессанты подавляют захват серотонина, и что это в большей степени характерно для третичных, а не вторичных аминов, и мы просто сложили все это вместе и сказали: смотрите, норадреналин активирует, а серотонин поднимает настроение. Кажется, это было в 1969 г.
С этой идеи, началась история ингибиторов обратного захвата серотонина…
Да, и особенно сильно повлияли наши данные о влиянии кломипрамина на обратный захват серотонина. Я поехал в Базель, в фармкомпанию Geigy, она тогда еще не объединилась с Ciba, и поговорил там с фармакологами. Я показал им данные о том, что кломипрамин действует преимущественно на обратный захват серотонина, но их это не заинтересовало.
После имипрамина у них был альтернативный вариант для разработки, но, по-видимому, у этого препарата были какие-то проблемы с токсичностью, и они в конце концов взялись за кломипрамин. А потом, оказалось, что у кломипрамина совсем не такой клинический профиль, как у имипрамина. Исследования кломипрамина нас сильно воодушевили, и мы предположили, что, исходя из схемы Кильхольца, имипрамин и амитриптилин, третичные амины, возможно, поднимают настроение лучше, чем вторичные амины. На нас сильно влиял тот факт, что третичные амины использовались чаще других; вторичные амины, кроме нортриптилина, применялись редко.
В США это не так. Дезипрамин очень хорошо там продается.
Верно, и причиной тому Броди. Он провел хороший эксперимент – просто давал дезипрамин, а затем резерпин, и отмечал, что резерпин в таких условиях производит стимулирующее действие. Поэтому он решил, что имипрамин действует посредством своего метаболита, дезипрамина, и именно дезипрамин является антидепрессантом.
В этом есть смысл, и к тому же Броуди был в то время крупной фигурой. Но в Европе дезипрамин никогда особенно хорошо не продавался. Нортриптилин продавался немного лучше, но он действует относительно сильнее на серотонин. Тем не менее, все продуманные, хорошо контролируемые клинические исследования всегда показывают одно и то же – когда сравнивается действие любых двух трициклических препаратов при лечении депрессии, не обнаруживается никакой разницы. Поэтому был сделан вывод, что они одинаковы.
У Кильхольца была другая точка зрения, основанная на клиническом опыте, в то время как все так называемые надежные данные не показывали никакой разницы. Я думаю, причина в том, что инструмент, который используется, настолько груб, что невозможно заметить какие-либо тонкие различия.
Мы считали, что популярность третичных аминов связана с их серотонинергической активностью. Затем мы обнаружили, что некоторые антигистаминные препараты также обладают ингибирующими свойствами в отношении захвата серотонина, хотя их действие и не отличалось особой избирательностью. Они также действовали на норадреналин.
Мы работали с бромфенирамином и хлорфенамином. Это были самые мощные ингибиторы захвата серотонина среди антигистаминных препаратов. Отталкиваясь от этого, Ганс Корроди, очень умный швейцарский химик-органик, работавший в Hassle, дочерней компании Astra, с которым я тесно сотрудничал в течение нескольких лет, пришел к зимелидину, который очень близок к бромфенирамину с точки зрения химической структуры.
Известно, что зимелидин был первым ингибитором обратного захвата серотонина, который появился в продаже, но был ли он первым ингибитором обратного захвата серотонина? Есть некоторые разногласия по этому поводу. У Ciba был один довольно давно, у Lundbeck – циталопрам.
Я знаю об этом, потому что я приезжал в компанию Lundbeck, проводил там семинар и рассказал им все, что мы тогда знали, а также я сказал им, что если добавить галоген или что-то подобное к молекуле ингибитора обратного захвата норадреналина, вы измените его, и он станет сильнее ингибировать захват серотонина.
Там был химик, Богесо, у которого было много ингибиторов захвата норадреналина, и, когда он вернулся в лабораторию, он модифицировал молекулы, чтобы сделать их серотонинергическими, и именно так они получили циталопрам, что – и я в этом уверен – произошло не раньше чем появился зимелидин.
Очевидно, что флуоксетин появился после зимелидина. Первое доклиническое лабораторное испытание способности флуоксетина ингибировать захват серотонина было проведено в компании Lilly в мае 1972 г., через два месяца после публикации первого патента. утверждающего, что зимелидин действует как ингибитор обратного захвата серотонина.
Алек Коппен говорит, что даже после завершения разработки флуоксетина в компании не думали о том, что его можно использовать при депрессии.
Зимелидин появился первым как доклинически, так и клинически. Я полагаю, что демонстрация антидепрессивной эффективности зимелидина повлияла на другие фармацевтические компании. Не уверен, что они стали бы разрабатывать флуоксетин, если бы не была доказана клиническая активность зимелидина.
Мы пошли по пути производства лекарств, которые более избирательно действуют на обратный захват серотонина. Это был важный шаг вперед, но в литературе встречается намек на то, что хотя это и хорошие антидепрессанты, но они не так сильны, как некоторые из более старых третичных аминов. Может, нам вернуться от производства чистых лекарств к производству грязных лекарств?
Если мы это сделаем, то лекарства уже не будут грязными в том же смысле, что и раньше, потому что тогда просто так получилось, что они оказались грязными. Своего рода рациональная загрязненность, можно ведь так сказать?
Рациональная загрязненность? Разве такое бывает?
Думаю, да. Думаю, что именно такой должна быть идеальная разработка лекарств. Начинается все с интуиции. Вы на что-то натыкаетесь. У вас получается довольно грязное лекарство, которое производит некий эффект. На следующем этапе вы пытаетесь понять, как оно работает, и в некоторых случаях находите один основной участок действия, в других случаях вы находите пару вероятных участков действия.
Потом вы разрабатываете чистые соединения, которые нужно проверить в клинике. Тогда мы можем сказать, что, например, ингибирование захвата серотонина – это принцип действия антидепрессантов, так же как и ингибирование обратного захвата норадреналина. Итак, у вас как минимум два варианта. На следующем этапе нужно создать молекулу, которая делает и то, и другое. Это не то же самое, что возвращение к трицикликам.
Будет сложно убедить людей в том, что это не то же самое.
Ну как сказать. Если получится разработать препарат, который является ингибитором поглощения серотонина и ингибитором поглощения норадреналина, и он не будет влиять на сердце, то это будет то, что нужно.
Не уверен насчет антихолинергического действия, будет ли оно у такого препарата. Обычно это относят к побочным эффектам. Но я в этом не уверен. Главный аргумент заключается в том, что антихолинергические средства не производят антидепрессивный эффект, и я думаю, что это верно. Но это не значит, что если вы добавите антихолинергический компонент к серотонинергическому или норадренергическому компоненту, то это ничего не даст.
У нас есть много экспериментальных данных, показывающих, что препарат, который сам по себе ничего не делает, может сделать очень много в сочетании с другим препаратом, воздействующим на другой участок. Поэтому я не думаю, что можно пренебречь такой возможностью…
Не могли бы вы привести пример?
Есть множество примеров. Это та область, в которой мы сейчас очень много работаем. Возьмем клонидин, довольно яркий пример. Если животному с пониженным уровнем моноаминов дать клонидин, вы практически ничего не увидите с точки зрения психомоторной активности. Много лет назад Анден в нашей лаборатории обнаружил, что если животным, получающим резерпин, давать апоморфин в умеренной дозе, то можно заметить стимулирующее действие, а если добавить клонидин, то действие значительно усилится. Так клонидин, который сам по себе ничего не делает, в присутствии агониста дофаминовых рецепторов становится очень мощным психомоторным стимулятором.
Вспоминается работа Ханны Стейнберг о том, как амфетамины вместе с барбитуратами вызывают более сильное возбуждение по сравнению с одними амфетаминами, что довольно интересно. Одновременное применение препаратов различных классов – эта тема совершенно не изучена.
Да, это так. Моя дочь Мария сейчас много занимается этой темой. На постсинаптической стороне наблюдается взаимодействие колоссального масштаба. Это показали эксперименты Андена, а теперь у нас есть очень много примеров.
Вот еще один – с атропином. Если животному с пониженным уровнем моноаминов дать атропин, вы мало что заметите. Но если вы дадите атропин в сочетании с клонидином или с подпороговой дозой антагониста NMDA-рецепторов, который ничего не делает в такой дозе, то вы увидите сильное психомоторное возбуждение.
Существует очень много примеров такого взаимодействия. Я думаю, что это очень важная область для исследований. В сфере исследований шизофрении, как я думаю, в наши дни все движется в направлении поиска взаимодействий и поиска паттернов отклонений, которые включают в себя более одного нейротрансмиттера.
Крайне сложно представить, как лечение, предусматривающее одновременное назначение двух или более препаратов, получит одобрение FDA (Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США), потому что FDA может рассматривать только одно вещество за раз.
Это правда. Я думаю, что им придется перевоспитываться, и, возможно, нам придется подождать смены поколений в FDA. Но я думаю, что концепция мощных взаимодействий между нейротрансмиттерами дождется своего дня. Уверен, что это произойдет, пусть и не в ближайшие несколько лет.
Одна из любопытных идей, которые появились вместе с ингибиторами обратного захвата серотонина, – мысль о том, что чем чище соединения, тем специфичнее быстрое воздействие на определенные аспекты поведения. Очевидный пример – низкая доза ингибитора обратного захвата серотонина влияет на сексуальную активность в течение нескольких часов после его приема. Это противоречит старому представлению о том, что лекарствам требуется время, чтобы попасть в мозг, и вообще они ужасно медленно воздействуют на рецепторы и т. д., и т. п., и по этой причине антидепрессантам нужно время, чтобы сработать. Но эффект этих препаратов на сексуальную сферу доказывает, что все не совсем так. И как нам теперь объяснить двух-, трех-, четырехнедельную задержку ответа на антидепрессанты?
Некоторые терапевтические действия проявляются быстро, взять, к примеру, предменструальное напряжение. Первый, кто занялся этой темой, был один из наших сотрудников, Элиас Эрикссон. Он лечил пациенток с предменструальным синдромом ингибиторами обратного захвата серотонина и результат был весьма впечатляющим. Был очень высокий процент ответа на лечения. Не только пациентки были очень благодарны, но и их мужья тоже.
Дело вот в чем – лечили на протяжении всего цикла, а потом обнаружили, что можно лечить в течение очень короткого периода времени. Просто начните за несколько дней до появления симптомов, и будет результат. Здесь мы видим еще один случай почти мгновенного ответа на лечение, и, следовательно, мы остаемся с проблемой, как же так получается, что реакцию на антидепрессанты приходится так долго ждать, несколько недель.
У меня нет объяснения этому. Я представляю себе это примерно так – для того, чтобы у пациента развилась депрессия, нужно много времени. Что бы ни было первичным механизмом, происходит ряд вторичных событий и в итоге пациент оказывается в конечной стадии развития депрессии. В таком случае, если вам удалось исправить те проблемы, которые были на ранней стадии цепочки событий, вам придется ждать, пока не нормализуется все остальное, а это не происходит сразу, потому что нужно время для синтеза белка, для трофических эффектов в сложных цепях, для того чтобы сложные схемы начать работать снова.
Задержка получается более или менее одинаковая и с ингибиторами серотонина, и с ингибиторами МАО, и с ЭСТ. Поэтому скорее можно предположить, что именно болезнь является причиной такого медленного лечения, а теперь, когда мы видим, что другие симптомы, не сама депрессия, улучшаются очень быстро, можно внимательнее рассмотреть расстройство как таковое.
Если все так, как я сказал, то из этого вытекают некоторые важные последствия, а именно: возможно, никогда не будет лекарства, которое будет действовать на депрессию без промедления, потому что это невозможно. Хотя нельзя быть уверенным – однажды, может быть, кто-нибудь что-нибудь придумает.
Возвращаясь к дофамину и Горникевичу. Идея о том, что дофамин может быть нейротрансмиттером, возникла задолго до Горникевича. Не могли бы вы рассказать об этом?
Все началось с эксперимента, когда мы обнаружили, что введение резерпина приводит к падению катехоламинов. В то время дофамином вообще не интересовались. Не было доказано, что он есть в мозге. Увидев падение катехоламинов, мы стимулировали адренергические нервы и обнаружили, что они больше не реагируют, что опровергало идею Броди об избыточном высвобождении. Поэтому нам хотелось посмотреть, сможем ли мы пополнить запасы в мозге.
Мы не могли просто ввести амины потому что знали, что они не попадают в мозг, зато попадали их прекурсоры. Уденфренд давал 5-гидрокситриптофан животным, получавшим резерпин, и я думаю, что он также давал леводопу, но, вероятно, в недостаточных дозах. Он мало что увидел и никогда об этом не писал. Когда мы сделали это, нам повезло больше.
Мы наблюдали очень сильный эффект леводопы на животных, получавших резерпин, – через 10 минут после приема леводопы они уже были на ногах и бегали. У нас была публикация об этом в журнале Nature в 1957 г., но в то время, когда мы представили статью, мы еще не проанализировали мозг. Когда мы это сделали, мы были очень разочарованы, потому что в мозге этих животных не было норадреналина.
Должно быть, это вас сильно озадачило.
Так оно и было. Мы были вынуждены искать дофамин, потому что у нас были доказательства того, что это и был тот амин, который мы должны были искать. Когда мы давали ингибитор МАО, он сильно потенцировал действие леводопы. Поэтому нам пришлось разработать метод для дофамина, и мы обнаружили, что дофамин прекрасно связывается; он может быть соотнесен по времени с возбуждением.
Затем мы поискали дофамин в мозге в нормальных условиях и обнаружили, что он присутствует там в количествах, превышающих количество норадреналина, поэтому он не может быть просто прекурсором.
Говорят, что мы не были первыми, кто открыл дофамин в мозге. Отчасти это верно, потому что была статья Монтегю, где она показала на бумажной хроматограмме соединение, которое она назвала Х. Она сказала, что у Х такая же миграция, как у дофамина, но она не говорила, что это дофамин, и не говорила, в каком количестве он присутствует, и вообще ничего больше не говорила. В ее публикации не было ничего, что указывало бы на то, что она считает, что это имеет какое-то особое значение.
Видите ли, все верили, благодаря работам Блашко и других ученых о синтезе катехоламинов, что дофамин находится в мозге, – дофамин должен был быть в мозге, потому что в мозге есть норадреналин. Мы продемонстрировали, что дофамин находится в мозге, что резерпин снижает его уровень, а леводопа возвращает его уровень обратно, и в статье для Science в 1958 г. мы предположили, что дофамин сам по себе является агонистом.
Вскоре после этого ко мне подошли два моих студента, Бертлер и Розенгрен, и спросили, не могут ли они немного поработать с этой темой. Я сказал: “Хорошо, вы можете разобраться с распределением”, и они обнаружили, что его распределение сильно отличается от норадреналина. Наибольшая часть находится в базальных ганглиях, и на основании этого мы предположили, что дофамин важен для экстрапирамидных функций, потому что базальные ганглии уже давно были признаны вовлеченными в контроль моторных функций. И, конечно же, было известно, что резерпин может вызывать признаки болезни Паркинсона, поэтому мы предположили, что падение уровня дофамина приводит к синдрому Паркинсона.
Очень часто единственные работы, на которые ссылаются, это работы Горникевича.
Да, но все было очень четко изложено как в трудах Первого Международного Симпозиума по Катехоламинам в Бетесде в 1959 г., так и в статье Бергера и Розенгрена 1959 г., и еще в статье в Pharmacological Reviews.
Получается, что Горникевич пришел к этой же идее совершенно независимо?
Нет, он знал о нашей работе. Он знал, хотя и не особо подчеркивает это, скажем так. Что он подчеркивает, так это то, что, после года работы с Блашко, очевидно, последнее, что Блашко сказал ему, когда тот уходил, было: “Пожалуйста, помни о дофамине”.
И как все это привело к появлению лекарств от болезни Паркинсона?
Есть две версии – версия Биркмайера и версия Горникевича. Биркмайер говорит: “Я пришел к Горникевичу и сказал ему, что мы должны давать леводопу пациентам с болезнью Паркинсона”, но если вы спросите Горникевича, то он скажет: “Я пришел к Биркмайеру и сказал ему, когда же вы начнете давать леводопу пациентам с болезнью Паркинсона”. Я не знаю. Видимо, они помнят это по-разному, но в любом случае именно эти два парня занялись этим. Биркмайер работал врачом в нейрогериатрической клинике и у него было много пациентов с болезнью Паркинсона, которым они делали инъекции.
Конечно, были проблемы. Они видели какие-то результаты, но не все, кто пытался повторить такие инъекции, тоже их видели, хотя были и те, кто видел. Я убежден, что результаты были, и Биркмайер не останавливался.
В 1966 г. Горникевич выразил сомнение в терапевтической полезности леводопы. Но Биркмайер настаивал, и доказательством того, что он был на правильном пути, было применение ингибитора декарбоксилазы, который разработали в Roche – бенсеразид. Компания Roche поставляла препарат Биркмайеру довольно неохотно. Они не верили в успех испытаний леводопы, которые проводил Биркмайер. Я не знаю, кто был инициатором, опять-таки здесь много версий, но в любом случае, он начал использовать его. Люди из Roche сказали, что вы заблокируете эффект леводопы ингибитором декарбоксилазы, но он дал их вместе и получилось наоборот. Действие леводопы усилилось.
Затем Roche пришлось заняться тем, что Биркмайер называл ретроградной фармакологией, они обнаружили, что этот препарат не попадает в мозг, факт, который они не заметили ранее. Вот так появился первый периферический ингибитор декарбоксилазы. Думаю, это доказывает, что Биркмайер сделал важное открытие, и если бы не Котциас, то оно получило бы дальнейшее развитие в Вене.
Но тут появился Котциас, грек, который довольно молодым человеком приехал в США и выучился на врача. У него был доступ к пациентам с болезнью Паркинсона. У него были какие-то идеи о нейромеланине, которые я никогда не понимал, ясно, что нейромеланин исчезает при болезни Паркинсона – в этом нет никаких сомнений – и он думал, что это важно.
Он решил давать допу перорально в возрастающих дозах, используя рацемат, и увидел гораздо более сильный эффект на симптоматику, чем то, что видел Биркмайер, по крайней мере, до того, как тот начал использовать ингибитор декарбоксилазы. Потом он перешел на леводопу. Дозы леводопы были шокирующе высокими – до 6, 7 или 8 г в день, и Биркмайер считает, что то, что обнаружил Котциас, это побочные эффекты. Конечно, это правда – он обнаружил побочные эффекты, но не только их. Биркмайер не видел дискинезий.
Впервые я услышал об этом на конференции в Канаде в 1967 г. Котциас показывал фильм о том, как впечатляюще меняется состояние его пациентов с болезнью Паркинсона. Я помню, что там был Дювуазен, невролог, который специализировался на болезни Паркинсона. И я спросил его, что он думает обо всем этом. Он сказал: “Да, это реально, и я так думаю из-за дискинезий. Это никак нельзя было подделать”. Я поехал домой и рассказал об этом неврологам в Гетеборге, и они приступили к работе. Исследования стали проводить по всему миру – за несколько лет собрали много наблюдений этого эффекта.
Именно это в сочетании с картированием Фалька и Хилларпа многое изменило.
Да, на конференции по адренергическим механизмам утверждалось, что вопрос о том, делают ли эти амины что-нибудь в мозге, сводится к вопросу о том, как вы манипулируете ими, какие дозы лекарств вы используете – все было представлено так, будто это своего рода манипуляция системой, которая не имеет физиологического смысла. Кроме того, спорили о том есть ли амины в глие.
Это удивительно, ведь те же самые люди были в состоянии войны с Экклзом.
Может быть, что Экклз негативно влиял, хотя, вы же знаете, что Экклз позднее скажет, что он был одним из первых, кто заговорил о химической трансмиссии в мозге. После долгих лет борьбы с Дейлом он вдруг провел эксперимент, который, как мне кажется, не был особенно убедительным, но по его результатам он сказал: “Смотрите, я обнаружил, что в мозге есть химическая трансмиссия”. Я думаю, что его критика Дейла сделала Дейла очень осторожным. Он не хотел портить солидную историю, которую он и его коллеги построили в отношении периферической системы, каким-либо утверждением о ЦНС.
Были веские аргументы – синаптическая задержка в мозге была действительно очень короткой в отличие от того, что наблюдалось в периферической системе. Примерно в то время появилась электронная микроскопия, которая показала, как все плотно упаковано в мозге, из чего можно было предположить, что электрический импульс может легко перемещаться непосредственно без какого-либо химического вмешательства. Еще в 1963 г. вышла хорошая книга канадца МакЛеннана о синаптической трансмиссии, в которой он утверждал, что на самом деле нет никаких доказательств даже того, что ацетилхолин функционирует как нейромедиатор.
От разговоров о дофамине и болезни Паркинсона перейдем к дофамину, шизофрении и нейролептикам. Не могли бы вы рассказать мне, как вы начали работать над механизмом действия хлорпромазина.
Мы были озадачены тем фактом, что фармакологический профиль резерпина и хлорпромазина очень схож у животных, а также в клинике, но при этом один из них снижает моноамины, а другой – нет. Мы думали, что, возможно, хлорпромазин что-то делает с метаболизмом катехоламинов.
Аксельрод открыл катехол-0-метилтрансферазу и нас это заинтересовало. Мы искали метаболит дофамина, 3-метокситирамин, и нашли его в мозге в нормальных условиях. Для того чтобы увидеть образование 3-метокситирамина, нам нужно было блокировать моноаминоксидазу, потому что тогда у нас получалось как бы замкнутая система.
Мы думали, что так у нас получится увидеть высвобождение, потому что у нас были некоторые данные, подсказывавшие нам, что образование 3-метокситирамина связано с высвобождением. Это была одна из тех вещей, о которых я рассказал на конференции по адренергическим механизмам, но Гаддум в это совсем не верил. Мы обнаружили, что для того, чтобы быть 0-метилированным, амин должен быть высвобожден, и поэтому образование 3-метокситирамина будет показателем высвобождения. Сейчас это общепринятое представление.
На тот момент рецепторы все еще оставались теоретическими сущностями. Для них не придумали названия, и даже не было уверенности, что они существуют.
Это верно, но теория рецепторов в фармакологии уходит в прошлое на десятилетия. Она была давно принята в фармакологии задолго до того, как биохимики начали думать о ней. Таким образом, не было проблемой предположить существование рецептора, который был заблокирован, хотя мы и не могли сказать, что это был за рецептор.
Мы провели эксперименты с феноксибензамином, и он ничего не сделал с 3-метокситирамином, в чем был легкий намек на то, что, возможно, существуют разные рецепторы, но мы этого не утверждали – мы говорили о катехоламиновых рецепторах. В той статье мы даже не исключали влияния на рецепторы серотонина. Так часто бывает с патентными заявками – вы пытаетесь максимально расширить заявку, поэтому мы включили серотонин. Серотониновые рецепторы сейчас очень часто обсуждаются в связи с антипсихотической активностью.
Нас поняли так, будто мы имеем в виду дофамин. Я не спорю с этим; конечно, подразумевался дофамин. Вскоре после этого Анден с коллегами из моей лаборатории, а также Найбек и Седвалл в Стокгольме изучили довольно большое количество антипсихотических препаратов и обнаружили, что общим для них является влияние на дофамин, в итоге все сузилось до дофамина.
Время от времени, в статьях о дофаминовой гипотезе, упоминается ван Россум.
В нашей статье 1963 г. мы ничего не говорили о патогенезе шизофрении. Эта статья посвящена способу действия антипсихотических агентов, а ван Россум заявил: “Шизофрения связана с дофамином”. Может быть он прав, а, может, и неправ, мы до сих пор не знаем. Мы знаем, что нейролептические препараты оказывают влияние на дофамин, и это важно для их эффекта.
Ван Россум был одним из учеников Ариенса, который внес большой вклад, как я считаю. Ариенс был одним из тех, кто ввел понятие внутренней активности, что было очень важно. Это пример того, как далеко зашла фармакология к тому времени, когда был выявлен первый рецептор. Существовало целое учение о рецепторах, аффинности, внутренней активности и т. д. Он был учителем ван Россума и они много работали вместе.
Вероятно, это не так, в строгом смысле, потому что мы теперь знаем, что у пациентов с болезнью Паркинсона леводопа может вызывать сильную дискинезию, не вызывая никаких психотических симптомов, хотя леводопа способна вызывать психотические симптомы. Тем не менее, это может быть правдой в несколько ином смысле – если бы тот же самый тип дезорганизации, который наблюдается в двигательной системе, и который приводит к дискинезии, произошел в тех частях системы, которые вовлечены в психические функции, это могло бы привести к психозу. Это совершенно здравая идея.
Впервые слышу об этом.
Неужели? Уверен, что об этом есть литература, это была поразительная история. Все произошло в течение короткого периода времени и была такая четкая связь между этими складами с метамфетамином и болезнью, что, наверное, американцам не очень нравится писать об этом.
Но ведь было также много публикаций из других частей мира, с меньшим количеством случаев, показывающих, что картина параноидной шизофрении очень точно воспроизводится амфетаминами, ну и, конечно, с леводопой и непосредственно действующими агонистами дофамина можно увидеть аналогичные результаты. Более того, эксперименты на здоровых и психически больных добровольцах подтверждают это действие.
Вы правы. Эффект фенциклидина тоже выглядит убедительно. Адриенна Лахти и Кэрол Тамминга давали кетамин шизофреникам и пациенты говорили им после введения вещества “Вот теперь я чувствую точно то же самое, что я чувствовал, когда заболел”.
Интересно, что когда кетамин используется в хирургии, для контроля над послеоперационными реакциями используются малые транквилизаторы.
Да, препараты выбора – бензодиазепины. Это еще один момент, который сложно вписать в модель.
Весьма сложно. Вы не думаете, что мы допустили ошибку, когда от утверждения о том, что нейролептики воздействуют на дофаминовую систему, перешли к дофаминовой гипотезе шизофрении?
Да, возможно, нам следовало бы назвать это дофаминовой гипотезой психоза. Это было бы ближе к реальности, но даже это может быть не совсем адекватно ввиду того факта, что нейролептики действуют на несколько состояний, все из которых, вероятно, связаны с гипервозбуждением. Возможно, эти различные состояния объединяет гипервозбуждение – возможно, надо было сначала говорить о дофаминовой гипотезе возбуждения.
Вы, кажется, в последнее время перешли от рассуждений о нейротрансмиттерах к рассуждениям о сложных цепях?
Мы начали с очень упрощенной концепции, стремясь объяснить, почему нейролептики оказывают такое воздействие на кору, хотя их основной мишенью, вероятно, являются дофаминовые D-2 рецепторы, которых очень мало в коре головного мозга. Те немногие D-2 рецепторы, которые там есть, все еще могут быть теми, которые объясняют все, но мне кажется более вероятным, что основное действие антипсихотических препаратов разворачивается в той те области, где D-2 рецепторов много. Если это так, то мы должны объяснить, как изменения в базальных ганглиях оказывают такое воздействие на кору головного мозга.
В стриатуме, в самом широком смысле, включая вентральный стриатум, есть два основных входа – глутамат из коры и дофамин из ствола мозга. Стриатум влияет в основном на таламус. Мы предположили, что если стриатум производит ингибирующий эффект на таламус, это должно влиять на количество сенсорной информации, передаваемой дальше в кору, и если вы откроете этот “фильтр” слишком широко, то вы перегрузите кору сенсорной информацией, что приведет к бреду, спутанности сознания, гипервозбуждению и, возможно, психозу.
Если считать, что дофамин оказывает ингибирующее действие на стриатум, то он будет ингибировать ингибирующий механизм, и, следовательно, дофамин открывает этот фильтр, что приводит к гипервозбуждению. С другой стороны, если глутамат действует противоположно дофамину, его дефицит на входе в стриатум приведет к тому же самому. Фенциклидин индуцирует психоз, ослабляя глутаматергическое воздействие на стриатум.
Если рассматривать психомоторную активность в широком смысле, то, убирая дофамин из мозга, вы добьетесь практически полной неподвижности. Эта неподвижность, согласно простой модели, обусловлена активной доминацией глутаматергического воздействия на стриатум. Поэтому можно провести простой эксперимент – опустошить запас дофамина в мозге с помощью резерпина и ингибитора синтеза катехоламинов, получить в результате практически полную неподвижность, а затем ввести антагонист глутамата, и тогда должно начаться движение. Так и получилось.
Конечно, это была упрощенная модель, и, конечно же, мы имеем дело не с одной отрицательной обратной связью, но и с положительной обратной связью. Получается, что, чем дальше, тем сложнее, но все же я думаю, что самым мощным механизмом в этой сложной системе является петля отрицательной обратной связи, где дофамин и глутамат регулируют друг друга в стриатуме.
Вот над этим мы и работаем вместе с Марией Карлссон и другими учеными. Важное отличие от того, что делалось раньше в этой сфере, в том, что люди, работавшие с таким антагонистом NMDA-рецептора как MK-801, открыли, что он является психомоторным стимулятором, и предположили, что этот эффект обусловлен усилением высвобождения дофамина. Предполагается, что все опосредовано дофамином.
Но эта модель говорит, что можно контролировать психомоторную активность независимо от дофамина, контролируя передачу импульсов по глутаминергическим путям от коры до базальных ганглиев. Теперь у нас есть доказательства того, что это верно не только для глутамата, но и для ацетилхолина, норадреналина и серотонина – особенно через 5-НТ-2 рецепторы. Они также могут работать независимо от дофамина.
Есть много различных путей, которые ведут в стриатум, и которые могут работать в противоположных направлениях. Некоторые из них усиливают возбуждение, а другие будут производить обратный эффект.
Таким образом, много нейротрансмиттеров взаимодействуют друг с другом, и не нужно искать один самый важный нейротрансмиттер. Может быть, таких несколько. Может быть, мы имеем дело со сложным дисбалансом.
Тогда я вынужден поинтересоваться, насколько сильно вас разочаровывают клиницисты. Ведь клинически существует целый ряд психозов.
Я расскажу о том, что мы нашли. Это довольно странная история, и я хотел бы, для начала получить подтверждения, прежде чем поверю в это. Мы проводили посмертные исследования шизофреников и контрольной группы, измеряли уровни моноаминов, их прекурсоров и метаболитов в различных участках мозга.
Оценка проводилась по 60 параметрам. Чтобы справиться с этим массивом данных, нужен многомерный анализ, и у нас в группе есть очень умный парень, который может это сделать, Ларс Ханссон. До его прихода мы ничего не могли извлечь из этого материала. Обычная статистика нам не показала ничего интересного. Благодаря Ханссону мы увидели, что шизофреники группируются в два разных кластера, расположенных по обе стороны от контрольной группы. Самым удивительным было то, что на одной стороне были параноидальные шизофреники, а на другой – не-параноидальные шизофреники.
Это понятно. Если посмотреть на гены, то можно увидеть, что наследственность шизотипии и наследственность паранойи не совпадают.
В семейной истории мы тоже кое-что нашли, а именно то, что у не-параноиков наследственный фактор сильнее, чем у параноиков. Еще интересные момент – из первоначальных 30 пациентов с шизофренией 10 пациентов были отброшены психиатром, применявшим строгие критерии Блейлера. Оказалось, что некоторые из них оказались в итоге в контрольной группе, некоторые из них среди не-параноиков, а некоторые среди параноиков. У тех, кто оказался в контрольной группе, не было семейной истории. У тех, кто оказался среди не-параноиков, была самая тяжелая наследственность, а параноики были где-то между ними.
Можно ли придумать модель, работающую только для одной из этих групп, а не со всеми? На следующем этапе мы провели обычное статистическое сравнение параноиков с контрольной группой и не-параноиков с контрольной группой, и нашли статистические различия. Мы не замечали этого раньше, потому что я не обращал внимания на различие между параноиками, гебефрениками и кататониками. Я просто думал, что это ерунда; это психиатрия – нет, не хочу в это вникать.
Мы обнаружили, что у параноиков более высокие уровни серотонинергических метаболитов, таких как 5-HIAA, в то время как у не-параноиков эти уровни понижены. Таким образом, существует паттерн изменений, связанных с дофамином, норадреналином и серотонином, который отличает эти группы.
Затем мы дали крысам МК-801 и проанализировали их мозг так же, как мы анализировали мозг шизофреников, провели многофакторный анализ, и увидели, что паттерн отклонений, связанных с дофамином, серотонином и норадреналином, похож на тот, что был у параноидальных шизофреников. Мы думаем, что этой стратегией можно пользоваться – попробуйте воспроизвести паттерн отклонений с помощью препарата с известным участком воздействия. Если у вас получится, вы можете сформулировать гипотезу о том, что именно в этом участке есть нарушения при том расстройстве, которое вы изучаете. Думаю, это интересный метод.
Нас несколько удивляют некоторые из наших открытий. Можно было подумать, что параноики будут в числе тех, чье состояние в основном связано с дофамином, потому что нейролептики хорошо на них действуют, но оказалось, что это не так. У параноидальных шизофреников наблюдается тенденция к снижению уровня дофамина, и мы думаем, что это компенсаторное явление.
Предположим, что первичный дефицит находится в глутаматергической системе, тогда, если мозг умен, он будет снижать уровень дофамина, чтобы попытаться восстановить баланс, и если он не может этого сделать, тогда помогут нейролептики.
Это прямо противоположно общепринятой дофаминовой гипотезе. Как это примирить с историей о чистом воздействии на рецептор D2? Под влиянием дофаминовой гипотезы о шизофрении фармкомпании пошли по пути производства все более чистых соединений, и Astra произвела, наверное, самое чистое вещество, ремоксиприд, возможно, не самое мощное, но, хорошее средство без побочных эффектов. Теперь со всей этой суетой вокруг клозапина мы вернулись к старой идее, что нам нужны грязные препараты, действующие на D1, D2, D3, D5, еще на 5-HT-2 и т. д.
Дофаминовая гипотеза, казалось, соответствовала более старой идее, которая восходит к Жану Деле и Полю Янссену, о том, что нейролептик должен производить экстрапирамидные симптомы. Ганс Гиппиус и клозапин, кажется, опровергли это, но никто не обращал на это внимание, пока клозапин снова не появился на рынке, и все вдруг заговорили: “Нет, антипсихотический препарат не обязан вызывать экстрапирамидные симптомы”.
В истории с ремоксипридом есть эпизод о том, как одну и ту же фармкомпанию дважды бьет молния. Astra, кажется, была компанией, которая больше всего руководствовалась рациональными принципами в разработке лекарств, но после неудачи с зимелидином, казалось, что это будет жестоким поворотом судьбы, если и у ремоксиприда тоже будут проблемы. Бог не хочет, чтобы мы были рациональными!
Вот именно. Такова мораль этой истории, и я был в какой-то степени вовлечен в оба сюжета, с зимелидином и ремоксипридом. Так что, может быть, это все из-за меня. Идея была в том, чтобы разделить локомоцию и стереотипию. Они использовали апоморфин и искали препараты, которые противодействовали бы его эффекту на локомоцию, а не стереотипию, и, следовательно, не имели бы экстрапирамидных побочных эффектов. Это была очень простая концепция.
Больше они с вами не советовались!
Не совсем так. После истории с зимелидином серотонин был запрещенным словом в Astra. Это было ругательное слово. Но даже после зимелидина они оставались в чрезвычайно удачном положении. У них были все ноу-хау. Они точно знали, как сделать еще один СИОЗС за короткое время, и они все еще могли быть лидерами в области СИОЗС, но они все бросили. Босс компании хотел прекратить исследования и превратить Astra в производителя дженериков.
Это было бы ужасно.
Это было бы катастрофой, но вскоре он умер от рака. Ну, а ремоксиприд, да, это было действительно очень грустно. Возможно, у ремоксиприда такие незначительные экстрапирамидные эффекты, оттого что он является антагонистом ауторецепторов. Такие соединения не вызывают экстрапирамидную симптоматику. У них очень интересная фармакология, потому что они являются тем, что мы называем стабилизаторами. Это означает, что при высокой базовой активности, они будут ингибировать поведение, а если базовая активность низкая, они работают как стимуляторы. Это очень интересные препараты.
Почему Скандинавия дала миру столько нейроученых и психиатров? Лангфельдт, Стромгрен, Готфриc, Хилларп, вы сами, Хокфельт и другие – бесконечный список людей, которые внесли значительный вклад, и я уверен, что это не пропорционально населению Скандинавии. К тому же у вас была одна из первых психофармакологических ассоциаций.
Да, она давно появилась. Я был в числе основателей Скандинавского Общества Психофармакологии – это было в 1959 г. Я думаю, что это случайный феномен, его нельзя связать с какой-то конкретной школой или индивидуумом. Например, фон Эйлер, давно пришедший в эту область науки, не был ни с кем связан. У него было несколько очень успешных учеников. Ученики Хилларпа были очень сильными, потому что он умел собирать вокруг себя талантливых людей. И это было в некотором смысле везение, то, что он начинал в Лунде, затем переехал в Гетеборг, а затем на кафедру гистологии в Стокгольме. Когда он начинал в Лунде, там работал Фальк, на основе гистохимической флуоресцентной технологии там можно было сформировать группу, точно так же, как и в Стокгольме.
Что касается Общества, то у его истоков стояла датская фармкомпания Lundbeck. Lundbeck добились успеха с антипсихотиками и антидепрессантами, благодаря умному медицинскому химику П. В. Петерсену. Еще был один врач – Йорген, который приехал в Лунд к Дэвиду Ингвару. Мы втроем основали Общество в 1959 г., а Lundbeck был щедрым спонсором.
Но нейронаукой интересуются не только в Дании и Швеции. В Норвегии и Финляндии есть такие люди как Линггарде и Тумисто – и вообще кажется, что в Скандинавии работают особенно методично и систематично.
Спасибо. Может быть, у нас больше сумасшедших, и поэтому у нас есть большая потребность в такого рода исследованиях, я не знаю. У меня нет статистики, подтверждающей это, но есть несколько очень интересных семей на севере Швеции с генетическими нарушениями, порфирией и различными шизофреническими расстройствами.
Что касается методичности, то, рассуждая философски, возможно, чем более суровый климат, тем важнее осторожность. В теплых странах на экваторе можно быть немного легкомысленным. Но на Крайнем Севере приходится планировать, чтобы выжить, потому что зима здесь бывает грозной. Так что вполне возможно, что произошел отбор людей, которые умеют планировать.
Несколько лет назад в Human Psychopharmacology вы написали статью, в которой говорилось, что мы находимся на пороге новой эры, когда мы не просто будем лечить психические заболевания, а будем проектировать личности и человеческие способности. Это было еще до всей этой шумихи вокруг косметической психофармакологии. Вы все еще так думаете, или…
Да, я думаю, так и будет. Я уверен, что из-за этой тенденции будет много эмоциональных споров, но все так и будет. Уверен, что когда у нас появится лекарство, которое улучшит память стариков, не вызывая при этом сильных побочных эффектов – оно будет использоваться. Даже если врач говорит: “Не беспокойтесь о том, что вы становитесь немного забывчивым, когда челоек стареет, это нормально”. Люди будут принимать такое лекарство, несмотря ни на что.
Людям не интересна клиническая диагностика. Если они чувствуют себя лучше, когда принимают лекарство и даже если они знают, что длительное использование вызывает серьезные проблемы, они все равно будут принимать его, пользуясь его преимуществами.
Это происходит в наши дни с флуоксетином и другими подобными лекарствами. Есть люди, которые чувствуют себя намного лучше, хотя на самом деле у них не было никакого диагноза. Например, если вам трудно быть среди людей, если у вас так называемая социофобия, которая в общем-то нормальное явление, и если вы избавитесь от нее, то это будет колоссальной, драматической переменой в вашей жизни, так ведь? Человек был очень застенчив и был лишен столь многого, и вдруг все меняется – конечно, он будет принимать такое лекарство.
Я помню, как во времена зимелидина, были люди, чьи доходы выросли, после того как они начали принимать это лекарство. Если будут настолько поразительные результаты, то человек скажет, что его это устраивает, он готов пойти на риск: ”Я чувствую себя достаточно хорошо, и побочные эффекты не так уж велики”.
По мере развития в этой области у нас будет все больше и больше лекарств, которые будут давать такой эффект, и люди будут принимать все больше и больше лекарств. Это станет естественной частью жизни – да, уже стало – мы как-то забываем, что мы постоянно принимаем кофеин в виде кофе и чая, принимаем как лекарство. Мы добиваемся большей стимуляции, чтобы поработать еще пару часов – это и есть фармакология, разве нет?
Мы занимаемся этим давно – возьмите, например, алкоголь. Алкоголь принес человечеству больше пользы, чем вреда. Я убежден в этом. Так много всего происходит, благодаря усилению взаимодействия между людьми из-за алкоголя. Некоторым людям пришлось очень дорого заплатить за это, но я думаю, что человечество в целом выиграло.
Дальше все так и будет, я уверен. Прозак, пожалуй, самый яркий пример, но до этого у нас были такие вещи, как бета-адреноблокаторы для борьбы со страхом сцены. Скрипачи, которые начали выступать намного лучше, благодаря бета-адреноблокаторам, о них же нельзя сказать, что они больны. Они просто улучшили собственную производительность.
Фармкомпании перестают искать лекарства, которые действуют на классические нейротрансмиттеры, и обращаются к нейродегенеративным расстройствам, что, как мне кажется, открывает простор для более радикальной инженерии.
О, да. Думаю, что молекулярная биология очень многое даст. Она уже многое сделала, хотя и не оказала пока большого влияния на клиническую медицину. Вы упомянули нейродегенерацию, и вполне возможно, что в вещах, о которых мы не так часто думаем с точки зрения нейродегенерации, обнаружится компонент нейродегенерации.
К примеру, киндлинг, возникающий в самых разных контекстах. Если у вас есть такие изменения, может быть, это связано с нейродегенерацией? Я думаю, хотя это опять же очень упрощенно, что во многих случаях есть два глутаматергических входа, один прямо в нейрон, а другой косвенно через ГАМКергический вставочный нейрон – если они функционируют на умеренном уровне, будет баланс и небольшой уровень на выходе. Допустим, что ГАМКергический нейрон особенно чувствителен к цитотоксичности: нет его, и внезапно у вас останется только педаль газа, а педаль тормоза исчезнет, и вы получите гигантское повышение уровня на выходе, которое останется навсегда, потому что нет ГАМКергического нейрона. И я не удивлюсь, если этот механизм вовлечен в киндлинг, а также в некоторые аспекты памяти и обучения. Когда мы учимся, убиваем ли мы нейроны, чтобы информация передавалась эффективнее, как вы думаете? Сюда же можно отнести зависимости, которые длятся вечно – однажды став алкоголиком, вы уже никогда не будете прежним – позднюю дискинезию и киндлинг.
Есть ли какая-либо связь между этим и принципом избыточности в природе?
Это чрезвычайно интересный вопрос. Думаю, что здесь многое может сказать молекулярная биология. Различные случайные явления, такие как дупликация генов и последующие мутации иногда могут приводить к образованию белков без какой-либо функции.
Еще одна тема, поднятая К. У. Бауэрсом в недавней статье в TINS (1994) под названием “Лишние нейротрансмиттеры?”, касается регуляции генов. Существуют механизмы, которые определяют, будет ли ген экспрессироваться в данной клетке, и эти механизмы не всегда очень точны. Это означает, белки могут экспрессироваться в клетках, где они не функционируют. Геном одинаков во всех клетках, поэтому в принципе, все клетки могут производить все различные белки, но экспрессия в каких-то клетках ограничена.
Регуляция экспрессии неточна – это означает, что белок оказывается в тех местах, где у него нет никакой функции. Нужно быть особенно внимательным, когда вы видите появление определенного белка, фермента или рецептора там, где его нет, у родственного вида. Например, если он есть у крысы, но нет у мыши или у морской свинки, это повод задуматься. Действительно ли этот белок необходим крысе в то время как он не нужен мыши или морской свинке? Так пришли к мысли о лишних нейротрансмиттерах, и ряд примеров приведен в статье Бауэрса.
В 1988 г. я опубликовал похожие рассуждения. Я назвал свою статью “Пептидные нейротрансмиттеры – ненужные пережитки?” Я пришел к аналогичному выводу с фармакологической точки зрения, начав с налтрексона или налоксона – когда наблюдается так мало функциональных потерь, даже если заблокирован рецептор. Есть и другие примеры того, как антагонисты пептидных нейромедиаторов ничего не делают.
Мои рассуждения основывались на эволюционных соображениях. Пептиды чрезвычайно сильны как сигнальные молекулы, потому что они обладают потрясающей идентичностью. Изменение только одной аминокислоты приводит к появлению совершенно другой идентичности. И они необычайно сильны из-за очень высокой аффинности. Они легко производятся клеткой, потому что, грубо говоря, клетка – это машина для производства пептидов. Все это делает пептиды подходящими для роли гормонов или нейрогормонов.
Когда-то давно одна из эндокринных клеток начала превращаться в нейрон. Возникла сложность, связанная с тем, что процесс должен был разворачиваться вокруг ядра, а трансмиттер нужно было транспортировать к нервному окончанию. Если нужно, чтобы все работало быстро, то пептид в качестве нейротрансмиттера не подходит.
В процессе эволюции эти проблемы были решены. Природа производит ферменты, механизмы и остальное, это транспортируется по нерву и там, на окончании нерва, создается нейротрансмиттер – маленькая молекула. А как же нейропептиды? Они производятся в очень небольших количествах. Отрицательный отбор почти не действует на такие малые количества, так что они могут оставаться вечно, потому что они не приносят никакого вреда, и именно поэтому у нас такой огромный ассортимент нейропептидов.
Если эволюция шла именно таким образом, то неудивительно, что существуют огромные видовые различия, потому что если происходит мутация и пептид больше не функционирует у определенного вида, то эта разница не имеет никакого значения.
Эта идея открывает совершенно новое видение химической нейротрансмиссии. В настоящее время такие люди как Сол Снайдер пишут статьи об оркестре нейромедиаторов, о том, что их сотни. Вы высказываете совсем другую идею.
Да, и стоит добавить одну вещь, которую я считаю важной, – уровень чувствительности аналитических методов, которого мы достигли, находится ниже уровней фонового шума. Мы можем засечь практически все. В 1950 гг., когда я начинал работать в этой области с техникой того времени, вероятность того, что найденное вещество, является функционально значимым, была намного выше чем сегодня.
Еще одна интересная возможность заключается в следующем. Предположим, что мы неправы, когда говорим, что разные гены экспрессируются в разных клетках. Предположим, что все гены экспрессируются во всех клетках. Тогда получается, что экспрессия подавляется, но природа не берет на себя труд подавить ее полностью, до нуля. В этом просто нет необходимости – я имею в виду, что экспрессия уже опустилась до уровня, на котором она не имеет значения.
Если это так, то, когда наши методы станут достаточно чувствительными, мы обнаружим, что все клетки производят все белки, которые может произвести геном. Я задумался об этом, когда пришел к коллеге в Гетеборге, который продемонстрировал чрезвычайно чувствительный капиллярный электрофорез. Он мог поместить один единственный лейкоцит в маленькую воронку на конце трубки и сделать электрофорез. Он обнаружил в лейкоците дофамин, тирозин-гидроксилазу и моноаминоксидазу.
Можно сделать вывод, что дофамин является важным соединением в иммунологии, но предположим, что он увидел всего лишь фоновые значения. Просто природе не хочется тратить силы на то, чтобы подавить геном на 100 %. Что-то всегда остается. Если это так, то об этом важно помнить, чтобы не тратить понапрасну много ресурсов вместо того, чтобы направить их на что-то другое.