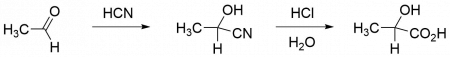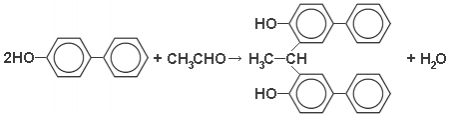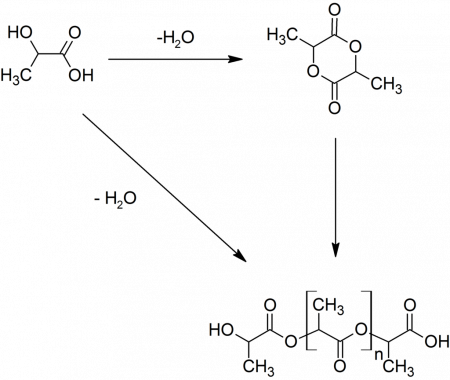какую концентрацию имеет товарная форма молочной кислоты
Молочная кислота

Молочная кислота — международное непатентованное наименование лекарственного средства
Молочная кислота в желудочно-кишечном тракте
В норме в желудочном соке молочная кислота отсутствует. Молочная кислота образуется в желудке человека в большом количестве при различных патологических процессах: стенозе привратника с задержкой эвакуации пищи из желудка, отсутствии соляной кислоты, раковом процессе (Рапопорт С.И. и др.).
Молочную кислоту продуцируют многие анаэробные бактерии, обитающие в кишечнике человека, в частности, представители родов Bifidobacterium, Lactobacillus, Actinomyces, Ruminococcus (Ардатская М.Д., Минушкин О.Н.), Collinsella. В свою очередь, пропионовокислые и другие бактерии — представители нормальной микрофлоры кишечника, используют молочную кислоту в качестве исходного вещества и в процессе своей жизнедеятельности превращает её в пропионовую и уксусную кислоты, углекислый газ и другие метаболиты.
Молочная кислота в ротовой полости
Молочная кислота во влагалище
Оптические изомеры молочной кислоты
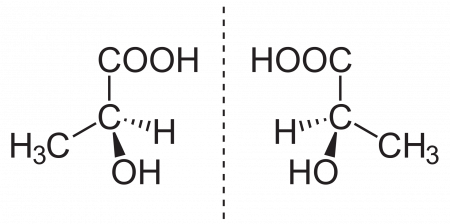
Молекула молочной кислоты ассиметрична и поэтому может существовать в двух оптически изомерных формах: правовращающаяся (L-молочная) и левовращающаяся (D-молочная). Смесь двух оптических изомеров одного вещества в равных количествах называют рацематом.
Получаемая в результате молочнокислого брожения чаще всего содержит равное количество обоих стереоизомеров и представляет собой густую жидкость. Такая молочная кислота иногда называется «молочной кислотой брожения». По химическим свойствам она отличается от L- и D-молочных кислот и является не простым рацематом, а рацемическим соединением двух изомеров молочной кислоты.
Правовращающаяся молочная кислота иногда называется парамолочная или мясомолочная кислота, так как она всегда присутствует в мышцах млекопитающих.
Исследование уровня молочной кислоты в организме человека
Качественное определение молочной кислоты в желудочном соке проводят с помощью реакции Уффельмана (пробы с карболовой кислотой). Проба основана на изменении окраски раствора за счет образования молочнокислого железа желтого цвета. К 2–3 мл однопроцентного раствора карболовой кислоты приливают 1 каплю 10 % раствора хлорного железа. Раствор приобретает фиолетовый цвет. Затем по каплям добавляют профильтрованный желудочный сок. В присутствии молочной кислоты появляется желтое окрашивание.
Молочная кислота — ингридиент косметических средств, вспомогательное вещество ряда лекарств и пищевая добавка

Молочная кислота, L–, D– и DL–, как пищевая добавка, имеет код Е270 и является согласно СанПиН 2.3.2.1293-03 регулятором кислотности. В этом качестве она используется при приготовлении нектаров, джемов, мармеладов и других подобных продуктов, включая низкокалорийные, неэмульгированных растительных и животных масел и жиров (кроме масел, полученных прессованием и оливкового масла), специально предназначенных для кулинарных целей, сыров сывороточных, консервированных фруктов и овощей, хлеба, макаронных изделий и пива.
Молочная кислота
| Молочная кислота | |||
|---|---|---|---|
| |||
| Систематическое наименование | 2-гидроксипропановая кислота | ||
| Хим. формула | CH3CH(OH)COOH | ||
| Рац. формула | C3H6O3 | ||
| Молярная масса | 90,08 г/моль | ||
| Плотность | 1,225 г/см³ | ||
| Температура | |||
| • плавления | 18 °C | ||
| • кипения | 122 °C | ||
| Константа диссоциации кислоты pKa | 3,86 (при 25 °C) | ||
| ГОСТ | ГОСТ 490-2006 ГОСТ 490-79 | ||
| Рег. номер CAS | 50-21-5 | ||
| PubChem | 612 | ||
| Рег. номер EINECS | 200-018-0 | ||
| SMILES | |||
| Кодекс Алиментариус | E270 | ||
| ChEBI | 78320 | ||
| ChemSpider | 592 | ||
| Сигнальное слово | Опасно | ||
| Пиктограммы СГС |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
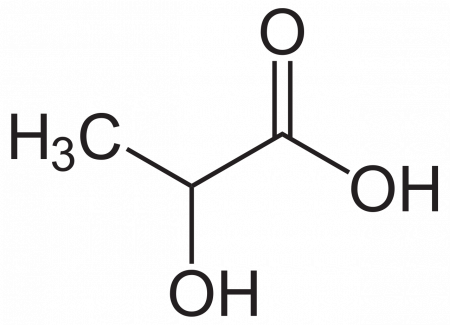
Молочная кислота (α-оксипропионовая, 2-гидроксипропановая кислота) CH3CH(OH)COOH — одноосновная карбоновая кислота с тремя атомами углерода, содержащая гидроксильную группу. Соли и эфиры молочной кислоты называются лактатами. Молочная кислота образуется при молочнокислом брожении сахаров и играет важную роль в метаболизме.
Содержание
История
Молочную кислоту открыл шведский химик Карл Шееле. В 1780 году он выделил её из прокисшего молока в виде коричневого сиропа. Французский химик Анри Браконно обнаружил, что она образуется при молочнокислом брожении.
В 1807 году Йенс Якоб Берцелиус выделил из мышц цинковую соль молочной кислоты.
Физические свойства
Молочная кислота является простейшей хиральной карбоновой кислотой и может существовать в виде двух энантиомеров: L-(+)-молочной кислоты, D-(-)-молочной кислоты или их рацемической смеси — DL-молочной кислоты. Если в смеси энантиомеров один находится в избытке, его можно выделить дробными перекристаллизациями из смеси диэтилового эфира и диизопропилового эфира. Чистые энантиомеры имеют температуру плавления 52,7-52,8 °С.
Молочная кислота очень гигроскопична и обычно существует в виде водного раствора с концентрацией до 90 мас. %. В связи с этим очень сложно установить её температуру плавления; литература приводит значения от 18 до 33 °С. Кроме того, в таких растворах присутствует значительное количество лактоилмолочной кислоты и других олигомеров молочной кислоты.
Молочная кислота растворима в воде, этаноле, диэтиловом эфире и других органических растворителях, смешивающихся с водой. Она практически нерастворима в бензоле и хлороформе.
Химические свойства
При взаимодействии с окислителями молочная кислота разлагается. При окислении кислородом воздуха или азотной кислотой в присутствии железа или меди она превращается в муравьиную кислоту, уксусную кислоту, щавелевую кислоту, уксусный альдегид, углекислый газ и пировиноградную кислоту. Молочную кислоту можно восстановить до пропионовой кислоты действием иодоводорода
Промышленный интерес представляет дегидратация молочной кислоты до акриловой кислоты и её восстановление до пропиленгликоля.
Поскольку молочная кислота является одновременно карбоновой кислотой и спиртом, она вступает в межмолекулярную этерификацию, давая лактоилмолочную кислоту. При дальнейшей конденсации образуется лактид — циклический сложный эфир. Также при конденсации могут образовываться линейные полилактиды. Эти соединения являются примесями в молочной кислоте. Так, в 6,5%-й молочной кислоте содержится около 0,2 % лактоилмолочной кислоты, 88%-я молочная кислота содержит меньше 60 % свободной молочной кислоты, а 100%-я — только 32 %.
Получение
Ферментативное получение
В промышленности молочную кислоту получают либо ферментативным способом, либо синтетическим. Первый из них имеет преимущество, поскольку приводит к молочной кислоте с более высокой стереохимической чистотой, поэтому новые производства, открывавшиеся с 1995 года, пользуются этим способом.
Во время процесса вырабатывается кислота, поэтому необходимо поддерживать pH в области 5,0–6,5: для этого используют гидроксид кальция, карбонат кальция, аммиак и гидроксид натрия. Из-за этого в процессе ферментации образуются соответствующие соли молочной кислоты. Разработка новых подходов к ферментации связана с выведением бактерий, способных работать в области низких pH: это позволило бы получать саму молочную кислоту, а не её соли, снизило бы затраты на подщелачивающие реагенты и на серную кислоту, используемую для выделения молочной кислоты из солей.
После ферментации молочную кислоту подвергают очистке. Микроорганизмы отделяют флокуляцией в щелочной среде либо ультрафильтрацией. Образовавшиеся соли молочной кислоты переводят в саму кислоту под действием серной кислоты. При этом образуется также малополезный сульфат кальция. Ведётся поиск других методов очистки, при которых образование это побочной соли не происходило бы. Для некоторых пищевых целей смесь пропускают через активированный уголь и ионообменную колонну.
Для фармацевтической промышленности и получения полимеров необходима более глубокая очистка. Интерес представляет экстракция молочной кислоты в органическую фазу длинноцепными третичными аминами, а затем обратная экстракция в воду. Этот метод позволяет эффективно очистить продукт от остаточных углеводов и белков. Также возможна перегонка молочной кислоты, если предпринимаются меры против её олигомеризации.
Выход молочной кислоты в процессе ферментации составляет 85–95 %. Побочными продуктами являются муравьиная и уксусная кислота.
Синтетическое получение
С 1960-х гг. рацемическую молочную кислоту производят в промышленности также синтетически. Подход основан на реакции ацетальдегида с циановодородом и последующем гидролизе образовавшегося лактонитрила. Недостатком синтетического подхода является то, что получаемая молочная кислота является рацемической, а подходящий и дешёвый хиральный катализатор пока не найден. Последним крупным производителем синтетической молочной кислоты является фирма «Musashino».
Экономические аспекты
Годовая потребность в молочной кислоте составляет примерно 450 тыс. тонн. Крупнейшим производителем молочной кислоты является компания NatureWorks LLC: её завод, размещённый в штате Небраска (США), имеет приблизительную мощность 180 тыс. тонн в год. Это в 3-4 раза больше, чем у следующего завода по порядку. Рынок молочной кислоты очень чувствителен к потребности в полилактиде, поскольку его производство является либо вскоре станет крупнейшим направлением использования молочной кислоты.
Молочная кислота в организме человека и животных
Молочная кислота формируется при распаде глюкозы. Иногда называемая «кровяным сахаром» глюкоза является главным источником углеводов в нашем организме. Это основной источник энергии для мозга и нервной системы, так же как и для мышц во время физической нагрузки. Когда расщепляется глюкоза, клетки производят АТФ (аденозинтрифосфат), который обеспечивает энергией большинство химических реакций в организме. Уровень АТФ определяет, как быстро и как долго мышцы смогут сокращаться при физической нагрузке.
Производство молочной кислоты не требует присутствия кислорода, поэтому этот процесс её синтеза часто называют «анаэробным метаболизмом» (см. Анаэробная тренировка). Ранее считалось, что мышцы производят молочную кислоту при нехватке кислорода в крови. Другими словами, организм находится в анаэробном состоянии. Однако современные исследования показывают, что молочная кислота образуется и в мышцах, получающих достаточно кислорода. Увеличение количества молочной кислоты в кровотоке свидетельствует лишь о том, что уровень её поступления превышает уровень удаления. Резкое увеличение (в 2—3 раза) уровня лактата в сыворотке крови наблюдается при тяжёлых расстройствах кровообращения, таких как геморрагический шок, острая левожелудочковая недостаточность и др., когда одновременно страдает и поступление кислорода в ткани, и печёночный кровоток.
Зависимое от лактата производство АТФ очень незначительно, но имеет большую скорость. Это обстоятельство делает идеальным его использование в качестве источника энергии, когда нагрузка превышает 50 % от максимальной. При отдыхе и умеренной нагрузке организм предпочитает расщеплять жиры для получения энергии. При нагрузках в 50 % от максимума (порог интенсивности для большинства тренировочных программ) организм перестраивается на преимущественное потребление углеводов. Чем больше углеводов человек использует в качестве топлива, тем больше производство молочной кислоты.
Исследования показали, что у престарелых людей в головном мозге количество солей кислоты (лактатов) имеет повышенный уровень.
Регулятор обмена
Чтобы глюкоза могла проходить через клеточные мембраны, ей необходим инсулин. Молекула же молочной кислоты в два раза меньше молекулы глюкозы, и гормональная поддержка ей не нужна — она с лёгкостью сама проходит через клеточные мембраны.
Анализ
Количественный анализ молочной кислоты обычно проводят титрованием гидроксидом натрия в присутствии фенолфталеина. Этот способ не подходит для концентрированных растворов, потому что в них молочная кислота частично находится в виде лактоилмолочной кислоты. Если такой раствор нужно оттитровать, используют приём обратного титрования: молочную кислоту обрабатывают избытком щёлочи (лактоилмолочная кислота при этом гидролизуется), а затем остаток щёлочи оттитровывают соляной кислотой.
В промышленности и исследовательских лабораториях молочную кислоту анализируют методом ВЭЖХ. Содержание энантиомерных форм в молочной кислоте можно определить ферментативным методом либо ВЭЖХ на хиральной колонке. Такие колонки, как и образцы высокочистых энантиомеров молочной кислоты коммерчески доступны.
Молочную кислоту можно обнаружить по следующим качественным реакциям:
При осторожном нагревании молочной кислоты с концентрированной серной кислотой она вначале образует уксусный альдегид и муравьиную кислоту; последняя немедленно разлагается:
CH3CH(OH)COOH → CH3CHO + HCOOH (→ H2O + CO)
Уксусный альдегид взаимодействует с n-оксидифенилом, причём, по-видимому, происходит конденсация в o-положении к OH-группе с образованием 1,1-ди(оксидифенил)этана:
В растворе серной кислоты медленно окисляется в фиолетовый продукт неизвестного состава. Поэтому, как и при обнаружении гликолевой кислоты с помощью 2,7-диоксинафталина, в данном случае происходит взаимодействие альдегида с фенолом, при котором концентрированная серная кислота действует как конденсирующий агент и окислитель. Такую же цветную реакцию дают α-оксимасляная и пировиноградная кислоты.
Выполнение реакции: В сухой пробирке нагревают в течение 2 минут на водяной бане при 85 °C каплю исследуемого раствора с 1 мл концентрированной серной кислоты. После этого охлаждают под краном до 28 °C, добавляют небольшое количество твёрдого n-оксидифенила и, перемешав несколько раз, дают постоять 10-30 минут. Фиолетовое окрашивание появляется постепенно и через некоторое время становится более глубоким. Открываемый минимум: 1,5⋅10 −6 г молочной кислоты.
Выполнение реакции: В пробирку прилить 1 мл молочной кислоты, а затем немного подкисленного серной кислотой раствора перманганата калия. Нагревать в течение 2 минут на слабом огне. Ощущается запах уксусной кислоты. C3H6O3 + [O] = C3H4O3 + H2O↑ Продуктом данной реакции может быть пировиноградная кислота C3H4O3, которая тоже имеет запах уксусной кислоты. C 3H6O3 + [O] = C3H4O3 + H2O↑ Однако пировиноградная кислота при обычных условиях неустойчива и быстро окисляется до уксусной кислоты, поэтому реакция протекает согласно суммарному уравнению: C 3H6O3 + 2[O] = CH3COOH + CO2↑ + H2O
Описание реакции: Эта реакция называется реакцией Уффельмана и используется, например, в клинической медицине для определения присутствия молочной кислоты в желудочном соке, открыта Юлиусом Уффельманом в 1880-х гг. Для проведения реакции нужно растворить одну каплю хлорида железа и 0,4 грамма фенола в 50 см 3 воды. Затем добавить тестируемую жидкость, если в ней есть молочная кислота, то синий цвет раствора сменится жёлтым, поскольку образуется лактат железа.
Применение
Молочная кислота используется преимущественно в трёх сферах: пищевой промышленности, производстве полимеров и других промышленных целях.
В пищевой промышленности молочная кислота используется как консервант и подкислитель. Благодаря тому, что её соли хорошо растворимы в воде, их также можно использовать в тех продуктах, где важно значение pH. Молочная кислота и её соли используются в напитках, конфетах, мясных изделиях и соусах. Лактат кальция добавляется в продукты как источник кальция.
В полимерной промышленности из молочной кислоты получают полилактид. Производится он из лактида полимеризацией с раскрытием цикла. Сам же лактид получают конденсацией молочной кислоты.
Также молочная кислота используется в покрытии металлов, косметике, текстильной и кожевенной промышленности. Её эфиры находят применение в производстве красок и чернил, электроники и чистке металлов.
Безопасность
Молочная кислота — это органическая карбоновая кислота, которая присутствует во многих организмах и является безопасной для окружающей среды. Увеличение производства молочной кислоты и, соответственно, полилактида оказывает положительное влияние тем, что вытесняет использование полимеров, производимых из нефти, снижает выбросы углекислого газа и предоставляет более широкие возможности по утилизации отходов.
Молочная кислота также используется в пищевой промышленности и не является токсичной. Тем не менее при попадании в глаза или на повреждённую кожу она вызывает раздражение. Полулетальная доза для крыс при оральном приёме составляет 3,73 г/кг.
Производство молочной кислоты
Пищевые органические кислоты и их применение. Технологическая схема производства молочной кислоты. Кинетика молочнокислого брожения. Роль молочной кислоты в организме человека. Требования к готовой продукции. Отходы производства и их использование.
| Рубрика | Производство и технологии |
| Вид | курсовая работа |
| Язык | русский |
| Дата добавления | 24.02.2014 |
| Размер файла | 1,1 M |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
1. Молочная кислота
1.1 Пищевые органические кислоты. Молочная кислота
1.2 Применение пищевых кислот
1.3 Получение молочной кислоты
1.4 Кисломолочное брожение
2. Молочнокислое брожение
2.1 Молочнокислое брожение
2.2 Кинетика молочнокислого брожения
3. Описание технологической схемы производства молочной кислоты
4. Молочная кислота в организме человека
5. Основы синтеза молочной кислоты
6. Отходы и их использование
Список использованных источников
Кисломолочные продукты человек использует в питании с древнейших времен. После того как в XVIII в. шведский химик и фармацевт Карл Вильгельм Шесле открыл в лимонах, осадке вина (винном камне) и скисшем молоке соответственно лимонную, винную и молочную кислоты, а позже было создано промышленное производство их, эти кислоты стали вводить в пищу для придания ей кислого вкуса. Таким образом, практика добавления кислот в пищевые продукты исходит из существования натуральных кислых продуктов, а сами тривиальные названия кислот этимологически связаны с ними.
Пищевая молочная кислота представляет собой водный раствор молочной кислоты, который получают ферментацией углеводсодержащего сырья молочнокислыми бактериями Lactobacillus delbrueckii.
Молочная кислота принадлежит к классу ациклических оксикислот, т.е. соединений, содержащих одновременно спиртовый гидроксил и карбоксильную группу. Её можно рассматривать как гидроксильную производную карбоновой кислоты. Так, при замещении водорода в радикале пропионовой кислоты спиртовым гидроксилом получается оксипропионовая, или молочная кислота.
Кисломолочное брожение известно с незапамятных времен. Этот вид брожения впервые изучил Л. Пастер в 1857г.
Сырьем для производства молочной кислоты служит смесь тростникового сахара-сырца, рафинадной патоки и свекловичной мелассы.
В России в промышленных масштабах молочную кислоту впервые получили в 1923 году на московском химико-фармацевтическом заводе им. Л.Я. Карпова по ферментативному способу, предложенному В.Н. Шапошниковым и А.Я. Мантейфель. В 1928 г. организовано производство также в Москве на Хамовническом заводе «Пищепродукт».
Молочную кислоту используют в качестве добавки к безалкогольным напиткам, эссенциям, фруктовым сокам, джемам и сиропам, для декальцификации кож в дубильной промышленности, а также при производстве пластмасс, когда форму полимеризуют в полилактат, применяемый, для производства пластиковых оберток. Соли молочной кислоты используются в медицине.
кислота молочная брожение технологический
1. МОЛОЧНАЯ КИСЛОТА
1.1 Пищевые органические кислоты. Молочная кислота
1.2 Применение пищевых кислот
Роль молочной и других оксикислот в питании человека недостаточно ясна, хотя и признана их полезность для организма. Введение этих кислот с фруктами, кисломолочными продуктами, безалкогольными напитками и др. стимулирует секреторные функции поджелудочной железы, усиливая выделение желудочного сока, повышая аппетит и способствуя лучшему усвоению пищи. Кислоты после всасывания из кишечника полностью сгорают.
Молочная кислота вездесуща, она присутствует везде, где есть жизнь и, возможно, появилась на земле раньше, чем кислород в атмосфере. В организме животного и человека она образуется из глюкозы или гликогена в результате гликолиза (гликогенолиза). При достаточном снабжении организма кислородом образования молочной кислоты не происходит. Молочная кислота накапливается в мышцах при интенсивной работе и понижении их энергетических запасов. Она подвергается дальнейшему окислению, выделяясь с мочой и потом, или используется печенью для ресинтеза гликогена.
Молочная кислота используются в разнообразных продуктах питания, в различных отраслях промышленности, в сельском хозяйстве и медицине. Чтобы составить некоторое представление о чрезвычайном разнообразии и роли этой кислоты в народном хозяйстве, целесообразнее исходить из проявления ими следующих свойств: 1) подкисления и регулирования рН; 2) бактериостатичности действия; 3) образования комплексов с металлами; 4) пластифицирования белков и эмульгирования.
— Подкисление и регулирование рН.
Молочная кислота за рубежом завоевала признание, как пищевая, сравнительно недавно—около 35 лет тому назад; до этого она находила лишь техническое применение (в кожевенной промышленности).
Молочную кислоту добавляют в затор или сырцовый солод в пивоварении, для снижения жесткости воды и рН до величины, близкой к оптимальной для действия амилолитических и протеолитических ферментов. При этом увеличивается выход экстрактивных веществ из солода, улучшается физиологическое состояние дрожжей, устраняется опасность инфицирования и повышается качество готового пива. Молочную кислоту применяют в производстве хлебопекарных дрожжей для очистки засевных дрожжей от посторонней микрофлоры, в том числе и от лактобацилл, а также для очистки мелассы, стимулируя размножение дрожжей. Подкисление мелассной среды в спиртовом производстве, с дальнейшим использованием спиртовых дрожжей в качестве хлебопекарных приводит к повышению активности, выхода дрожжей и улучшению качества выпеченного на них хлеба.
Молочной кислоте часто приписывают свойство консерванта, но она не обладает каким-либо специфическим бактериостатическим действием, кроме действия, обусловленного кислотностью, и в этом отношении уступает уксусной кислоте. Подкисление предотвращает рост микроорганизмов, и, так как жизнь их не продолжительна, то при прекращении размножения они погибают.
Умеренно кислый вкус молочной кислоты при относительно высокой кислотности делает ее употребление, наряду с уксусом, предпочтительным в производстве таких продуктов, как консервированная рыба в кислом соке, маринованные столовая свекла, цветная капуста, огурцы, оливы, лук, в производстве майонеза и майонезных приправ. Молочную кислоту добавляют в тесто главным образом в летний период для предотвращения развития в хлебе картофельной палочки (очень чувствительной к кислотности).
Эту кислоту издавна используют в ветеринарии для подавления вредных кишечных микробов у поросят, только что отнятых от материнского молока, при воспалении желудка и кишечника, при гинекологических заболеваниях, язвенных поражениях кожи.
— Пластификация белков и эмульгирование.
Хорошо известно, что при забое животных мясо получается вкуснее, если они находятся в спокойном и неизнуренном состоянии. Это объясняется тем, что в мышцах животных содержится больше гликогена, который после смерти диссимилирует в молочную кислоту, пластифицируя белок.
Известно также, что при изготовлении хлеба молочную кислоту добавляют или получают при брожении теста, воздействуя на клейковину.
Молочную кислоту можно использовать для ускорения получения молочно-белкового сгустка при производстве творога.
Сказанным выше не ограничиваются возможные пути использования оксикислот в различных отраслях народного хозяйства. С углублением наших знаний о свойствах этих кислот и их производных следует ожидать новых достижений в данной области.
1.3 Получение молочной кислоты
СН3СОСНО (метилглиоксаль) + Н2О СН3СНОНСООН (молочная кислота).
Второй путь, гетероферментный, включает распад глюкозы до пировиноградной кислоты и восстановление последней до молочной кислоты:
Применяют молочную кислоту в пищевой промышленности для получения напитков, мармеладов, в процессах консервирования, а также в кормопроизводстве. Соли молочной кислоты используют в фармацевтике.
На стадии получения готового продукта культуральную среду нагревают до 80-90, затем нейтрализуют гашеной известью до слабощелочной реакции. После отстаивания в течение 3-5 ч взвешенные частицы декантируют. После этого раствор лактата кальция подают на фильтр-пресс. Фильтрат упаривают до концентрации 27-30 %, охлаждают до 25-30 и подвергают кристаллизации. Промытый лактат кальция отделяют центрифугированием и подвергают расщеплению серной кислотой при 60-70. Сырую молочную кислоту 18-20 % концентрации упаривают в несколько этапов в вакуум-выпарных аппаратах до 70 % концентрации. Отфильтрованную кислоту после фильтр-пресса подают на розлив с внесением небольших количеств мела, при этом около 10 % кислоты превращается в кристаллический лактат, который связывает молочную кислоту.
2. КИСЛОМОЛОЧНОЕ БРОЖЕНИЕ
2.1 Молочнокислое брожение
В 1857 году Л. Пастер впервые изучил и объяснил биологическую природу молочнокислого брожения.
Гомоферментативное молочнокислое брожение выражается следующей суммарной химической реакцией:
Реакция катализируется ферментом лактатдегидрогеназой. Гомоферментативное молочнокислое брожение может вызываться микроорганизмами различных таксономических групп, но главным образом бактериями и микроскопическими грибами. Среди последних известны некоторые виды ризопуса и мукора. Оптическая активность образующейся молочной кислоты зависит от стереоспецифичности лактатдегидрогеназы, а также от того, обладает ли микроорганизм лактатрацемазой.
L.delbruckii требовательны к азотному питанию. Набор необходимых аминокислот тщательно не изучен, но, как и большинству молочнокислых бактерий, им необходим аргинин, цистеин, глютаминовая кислота, лейцин, фенилаланин, триптофан, тирозин и лизин, а, возможно, еще и некоторые другие (L.casei, например, требуется 16 аминокислот). Из витаминов необходимы рибофлавин, никотиновая или фолиевая кислота; тиамин ингибирует образование молочной кислоты. Потребность в витаминах зависит от температуры культивирования, рН.
Для молочнокислый бактерий нужны натрий, калий, фосфор, медь, железо, сера, магний и особенно марганец. Цинк ускоряет рост бактерий, но подавляет образование молочной кислоты.
К сахарсодержащим средам предложено добавлять: сухие ростки (корешки) ячменного, ржаного и пшеничного солода, солодовый экстракт, осадочные винные и спиртовые дрожжи, дрожжевой автолизат, пшеничные зародыши, молоко, сухой порошок хлореллы и т. д. Обычно пользуются сухими ячменными ростками.
Солодовые ростки содержат до 30% азотистых веществ, около половины которых растворяется в воде. Из свободных аминокислот в ростках найдены: аспарагиновая и глютаминовая кислоты, аргинин, гистидин, лизин, серин, треонин, аланин, валин, метионин, лейцин, изолейцин, р-фенилаланин, пролин. Амиды представлены главным образом аспарагином. Из углеводов, кроме клетчатки и целлюлозы, содержится около 20 % глюкозы и фруктозы, немного мальтозы, В ростках заключена основная масса витаминов и биостимуляторов проросшего зерна (рибофлавин, пиридоксин, цианокобаламин, никотиновая и пантотеновая кислоты, токоферол, инозит, биотин).
Недостатком солодовых ростков является сильное впитывание влаги и набухание, что повышает вязкость культуральной жидкости и ухудшает последующее отделение ростков фильтрованием. Ростки должны быть желтого или коричневого цвета, не подгоревшие, не заплесневевшие, с хлебно-солодовым запахом, горьковатые на вкус. По техническим условиям допускается содержание зерновой примеси 5—6 %, минеральной не более 0,5 %, влажность не выше 10 %.
Молочнокислые бактерии не имеют геминовой системы, водород переносится не на молекулярный кислород, как у аэробов, а на органические соединения, образующиеся в процессе брожения (пировиноградную кислоту, а, возможно, на 4-фосфоглицериновую кислоту).
2.2 Кинетика молочнокислого брожения
Рис.1.1 Кинетика изменения плотности популяции молочнокислых бактерий (1-4) и лактата кальция(1′-2′) в зависимости от количества солодовых ростков на 100г сахара
Брожение продолжается без изменения численности молочнокислых бактерий и даже при некотором их уменьшении за счет лизиса и автолиза. Отмечено, что к концу брожения содержание азота в культуральной жидкости несколько возрастает. При сбраживании среды, приготовленной в основном из сахара-сырца и рафинадной патоки оптимальная норма ростков 15—20% по массе сахара.
Влияние количества засевной культуры при брожении отъёмно-доливным способом изображено на рис. 1.2. Кривая имеет максимум, соответствующий 20—30 % ее.
Рис.1.2 Зависимость среднесуточного образования лактата кальция от количества засевной культуры молочнокислых бактерий при брожении отъёмно-доливным способом
Очень важно, чтобы оптимальная величина рН поддерживалась постоянной с помощью автоматической подачи мелового молока.
3. ОПИСАНИЕ ТЕХНОЛОГИЧЕСКОЙ СХЕМЫ ПРОИЗВОДСТВА МОЛОЧНОЙ КИСЛОТЫ
Рис. 1.3 Принципиальная схема промышленного производства молочной кислоты
Аппарат наполняют на 2/3 рабочей вместимости водопроводной водой или промывными жидкостями и в них растворяют мелассу и рафинадную патоку, исходя из необходимости получения концентрации сахара в растворе 3—4%. Раствор нагревают до 70°С и пастеризуют при этой температуре 1 ч. Затем раствор охлаждают до 48—50 °С, добавляют в него 15% солодовых ростков к суммарной массе вводимого сахара, 20 % по вместимости бродильного аппарата засевной культуры молочнокислых бактерий, отобранной на вторые-третьи сутки из хорошо бродящей питательной среды в предыдущем или другом бродильном аппарате. Аппарат, из которого проведен отъем, доливают свежим сахарным раствором и продолжают брожение. Так как величина отъема довольно значительна, то начинающееся вскоре размножение резко сокращает продолжительность лаг-фазы.
Через 6 ч питательную среду начинают размешивать периодическим барботированием воздуха. Когда кислотность достигнет 0,5—0,6 %, считая на молочную кислоту (примерно через 1 сутки), добавляют меловое молоко. Обычно при ручной дозировке мел подают каждые 1,5—2 ч небольшими порциями. Перед подачей в бродильный аппарат мел должен быть хорошо измельчен, отсеян от комков и стерилизован. Проще стерилизовать меловое молоко острым паром (кипячение 20 мин). Количество воды, которое вводят с меловым молоком, учитывают при приготовлении питательной среды.
При отсутствии на заводе мела нейтрализацию молочной кислоты можно вести известковым молоком, но при этом нужно строго контролировать кислотность, так как раствор легко подщелочить, тогда как при нейтрализации мелом рН раствора устанавливается в слабокислой области независимо от количества заданного мела. При расчете количества добавляемого мела учитывают его чистоту, которая составляет 60—65 %. В результате нейтрализации образуется 120% лактата кальция к массе сброженной гексозы, или 125% к массе сброженного дисахарида.
При нормальном брожении за 1 сутки сбраживается до 2 % сахара. Убыль его компенсируют добавлением в бродильный аппарат в несколько приемов 50%-ного раствора сахара-сырца или с добавкой в него рафинадной патоки, поддерживая концентрацию сахара в бродящей среде на уровне 3—4%. Вводят такое суммарное количество сахара, чтобы содержание лактата в культуральной жидкости в конце брожения было не более 15%, а содержание несброженного сахара 0,2—0,5 %, Брожение продолжается 6—8 суток.
По окончании брожения аппараты моют горячей водой со щеткой, хлорной известью натирают внутреннюю и наружную поверхность аппарата, тщательно моют змеевик, хорошо ополаскивают аппарат холодной водой (несколько раз), затем набирают в него воды, нагревают ее до кипения и оставляют с нагретой водой 2—3 ч, после чего воду спускают. Моют также и коммуникации.
Во время брожения контролируют все основные параметры процесса. Если температура в бродильном аппарате упадет ниже 45 °С, неминуемо разовьется посторонняя микрофлора. В этом случае культуральную жидкость нагревают до 75 °С, пастеризуют 1 ч, снижают температуру до 50 °С и снова задают в нее чистую культуру или отъем из другого бродильного аппарата. При кратковременном повышении температуры сверх 55 °С резко снизится активность молочнокислых бактерий, поэтому в бродящую жидкость необходимо внести дополнительное количество активной культуры.
ПРЕДВАРИТЕЛЬНАЯ ОЧИСТКА КУЛЬТУРАЛЬНОЙ ЖИДКОСТИ.
Меловой осадок заливают горячей водой (1:3) и тщательно перемешивают. После трехчасового отстаивания, не взмучивая осадка, первую промывную жидкость отделяют и добавляют к первому лактатному маточному раствору, К осадку в отстойнике присоединяют гипсовый шлам и также заливают горячей водой. Хорошо перемешанную суспензию фильтруют. Осадок выбрасывают, а вторую промывную жидкость используют для приготовления сахарсодержащей среды.
Фильтрование отстоявшейся культуральной жидкости не полностью освобождает ее от взвешенных примесей. Поэтому сначала на фильтре нарабатывают слой гипсового шлама, а в конце фильтрования оставшийся в нем раствор лактата отмывают водой и вытесняют воздухом.
КРИСТАЛЛИЗАЦИЯ ЛАКТАТА КАЛЬЦИЯ
В кристаллизаторе отфильтрованную культуральную жидкость доводят до температуры 30 о С и вносят затравку в виде кристаллов лактата кальция предыдущей кристаллизации в количестве 6…7% к массе раствора. В процессе образования центров кристаллизации и роста кристаллов смесь постепенно охлаждают. Конечная температура утфеля не должна превышать 10 о С. Продолжительность процесса кристаллизации 10…12ч. При получении молочной кислоты высшего сорта кристаллы лактата кальция обычно не пробеливают. Из маточного раствора после разложения лактата, отделения гипса и осветления раствора активным углем вырабатывают молочную кислоту второго сорта.
РАЗЛОЖЕНИЕ ЛАКТАТА КАЛЬЦИЯ И ОТДЕЛЕНИЕ ГИПСОВОГО ШЛАМА
Лактат, выделенный из культуральной жидкости кристаллизацией или находящийся в ней в растворенном состоянии, разлагают серной кислотой. Разложение идет по реакции:
Сульфат кальция выделяется из раствора в виде бигидрата (гипса). С увеличением концентрации молочной кислоты растворимость гипса возрастает, при 10%-ной концентрации достигает максимума, затем снижается и при концентрации молочной кислоты около 40 % стабилизируется.
После разложения лактата калия серной кислотой образуется растворимый сульфат калия, увеличивающий зольность молочной кислоты на 0,3—0,4%. Кроме того, сульфат калия имеет горький вкус и обладает послабляющим действием. Поэтому осаждение железа рекомендуется вести гексацианоферроатом кальция:
ОСВЕТЛЕНИЕ РАСТВОРА МОЛОЧНОЙ КИСЛОТЫ
Раствор молочной кислоты, полученный без кристаллизации лактата кальция, осветляют после отделения гипсового шлама или в его присутствии.
Если раствор осветляют после отделения гипсового шлама, то оптимальными являются следующие условия: температура 80 °С, продолжительность контакта раствора молочной кислоты с активным углем 30 мин. При отсутствии кристаллизации лактата оптимальной считается доза 3—4 % свежего угля к массе 40%-ной молочной кислоты.
При осветлении раствора молочной кислоты в присутствии гипса в конце разложения лактата в реактор добавляют весь активный уголь, частично отработавший на исправлении выпаренной молочной кислоты, и 0,5 % свежего активного угля (также к массе 40%-ной молочной кислоты). Уголь удаляют вместе с гипсовым шламом.
ИОНИТОВАЯ ОЧИСТКА И ВЫПАРИВАНИЕ РАСТВОРА МОЛОЧНОЙ КИСЛОТЫ
Ионитовую очистку раствора молочной кислоты обычно применяют при отсутствии в схеме производства кристаллизации лактата, а также при получении кислоты, содержащей минимальную примесь минеральных веществ или их отдельных ионов. Для очистки молочной кислоты на отечественных заводах иониты были применены в 1950 г. При фильтрации через катионит в Н-форме и анионит в ОН-форме в результате ионообмена из раствора удаляются не только минеральные вещества, но частично молекулярно сорбируются красящие и азотистые вещества.
Ионирование растворов молочной кислоты и регенерацию ионитов в принципе ведут аналогично обработке растворов лимонной кислоты.
Растворы молочной кислоты концентрируют в горизонтальных вакуум-выпарных аппаратах. По-видимому, лучшим аппаратом: следует признать «Центрнтерм», который очень быстро (за несколько секунд) выпаривает молочную кислоту без увеличения ее цветности. В горизонтальных вакуум-аппаратах выпаривание ведут при разрежении не менее 80 кПа и избыточном давлении греющего пара в пределах 100—150 кПа. Выпаривают кислоту с подкачиванием раствора до концентрации, несколько большей 40%, в течение нескольких часов. При этом удаляется и значительная часть летучих кислот.
ИСПРАВЛЕНИЕ И РОЗЛИВ МОЛОЧНОЙ КИСЛОТЫ
ТРЕБОВАНИЯ К ГОТОВОЙ ПРОДУКЦИИ
По химическим показателям кислота должна соответствовать нормам, указанным в таблице. Для нужд фармацевтической промышленности выпускается небольшое количество кислоты по временным техническим условиям.
В США выпускают молочную кислоту четырех сортов: техническую, пищевую, пластическую и стандартную (по фармакопее США). Особенно высокие требования предъявляют к кислоте для пластмассовой промышленности; она содержит 50—85 % молочной кислоты, 1—2 % летучих кислот, не более 0,01 % золы, отсутствуют обугливаемые вещества, сульфаты и хлориды; бесцветна и содержит только следы меди и железа. В пищевой молочной кислоте допускается содержание золы до 0,5 %, присутствие обугливаемых веществ, хлоридов, следы сульфатов и светло-соломенная окраска. Высший сорт отечественной молочной кислоты по ГОСТ 490—79 находится на уровне лучших образцов зарубежной пищевой кислоты, получаемой путем сбраживания сахаросодержащих отходов.
Исходя из этого можно записать следующее ее уравнение:
По закону действия масс для установившегося динамического равновесия имеем:
С целью упрощения расчетов и приближения их к производственным выразим концентрации молочной кислоты в г на 100 г воды. Разделив числитель и знаменатель дроби, стоящей в левой части уравнения, на [Н2О] 2 и обозначив начальную общую концентрацию молочной кислоты [L]/[H2O] и концентрацию ангидридов [Р]/[Н2О] в процентах к массе воды соответственно через l и p получим К = l 2 / p.
Содержание отдельных форм молочной кислоты при установившемся равновесии показано на рис.4. При этом содержание ангидридов х в общей концентрации молочной кислоты у будет
Так как при прямом титровании определяется только половина карбоксильных групп лактилмолочной кислоты, то содержание ее в пересчете на молочную кислоту будет вдвое больше, чем ангидридов. Содержание ангидридов не пропорционально концентрации молочной кислоты, поэтому простой пересчет количества ангидридов с большей ее концентрации на 40%-ную невозможен. Результат будет завышен.
Рис.4 Соотношение отдельных форм молочной кислоты в зависимости от общей концентрации при установившемся равновесии: 1-прямо титруемая, 2-лактилмолочная, 3-свободная
Для данной обратимой реакции справедливо дифференциальное уравнение скорости:
После интегрирования этого уравнения и на основании экспериментальных данных определены кинетические константы к1 и к2. Поскольку константа равновесия не зависит от общей концентрации молочной кислоты, при прочих равных условиях не зависят от нее и константы к1 и к2, а следовательно, и время достижении равновесия. Найдено, что величина константы скорости гидролиза ангидридов в 2460 раз больше константы скорости их образования.
Рис.5. Образование ангидридов в растворе молочной кислоты 84,95%-ной концентрации при температуре 100 о С
На рис.5 показано образование ангидридов при температуре 100 о С. По сравнению с температурой 20 о С скорость реакции возросла в (70х24):3=560 раз, а конечное (равновесное) содержание ангидридов осталось без изменения. Даже трехчасового выпаривания, особенно до 40-45%-ной концентрации раствора, недостаточно для установления равновесного содержания ангидридов, поэтому процесс их образования будет продолжаться и во время хранения готовой молочной кислоты.
Серная кислота является сильным катализатором реакции образования ангидридов, не влияя на состояние равновесия. Определение ангидридов в присутствии редуцирующих сахаров завышает аналитические данные (каждый 1 % сахара пропорционален 0,9 % ангидридов).
4. МОЛОЧНАЯ КИСЛОТА В ОРГАНИЗМЕ ЧЕЛОВЕКА
Молочная кислота формируется при распаде глюкозы. Иногда называемая «кровяным сахаром», глюкоза является главным источником углеводов в нашем организме. Это основное топливо для мозга и нервной системы, так же как и для мышц во время физической нагрузки. Когда расщепляется глюкоза, клетки производят АТФ (аденозинатрифосфат), который обеспечивает энергией большинство химических реакций в организме. Уровень АТФ определяет, как быстро и как долго наши мышцы смогут сокращаться при физической нагрузке.
Зависимое от лактата производство АТФ очень незначительно, но имеет большую скорость. Это обстоятельство делает идеальным его использование в качестве топлива, когда нагрузка превышает 50 % от максимальной. При отдыхе и умеренной нагрузке организм предпочитает расщеплять жиры для получения энергии. При нагрузках в 50 % от максимума (порог интенсивности для большинства тренировочных программ) организм перестраивается на преимущественное потребление углеводов. Чем больше углеводов вы используете в качестве топлива, тем больше производство молочной кислоты.
Исследования показали, что у престарелых людей в головном мозге количество солей кислоты (лактатов) имеет повышенный уровень
5. ОСНОВЫ СИНТЕЗА МОЛОЧНОЙ КИСЛОТЫ
Молочная кислота СН3—СН(ОН)—СООН (б-оксипропионовая, этилиденмолочная) содержит асимметрический атом углерода и поэтому может существовать, в оптически изомерных формах.
Молочная кислота может быть получена различными синтетическими способами, но при всех этих синтезах кислота получается в виде оптически недеятельной, т. е. всегда получаются равные количества правого и левого изомеров. То же наблюдается и во всех других случаях, когда путем синтетических реакций получаются вещества, содержащие асимметрический атом углерода.
Причина обязательного образования оптически недеятельных соединений при синтетических реакциях может быть показана на следующих примерах:
Как видно из приведенной схемы, при действии цианистоводородной кислоты на уксусный альдегид анион CN- может атаковать р-связь карбонильной группы равновероятно как с одной, так и с другой стороны плоскости, в которой расположены у-связи а, b и с молекулыкетона. В результате должны образоваться равные количества оптически изомерных молекул оксинитрилов.
Точно так же в тех случаях, когда асимметрический атом углерода появляется в результате реакций замещения
или реакций расщепления
вероятности образования молекул оптических антиподов совершенно одинаковы, что и должно вести к образованию оптически недеятельных смесей или рацемических соединений.
Значительные количества молочной кислоты образуются при действии щелочей на водные растворы простейших сахаристых веществ(моноз). Так, например, из смеси глюкозы и фруктозы («инвертный» сахар) можно получить до 60% молочной кислоты. И в этом случае образуется недеятельная молочная кислота.
Наиболее важным источником получения молочной кислоты является процесс молочнокислого брожения, которому легко подвергаютсярастворы многих сахаристых веществ (молочного сахара, тростникового сахара, виноградного сахара и др.). Брожение является результатом жизнедеятельности бактерий молочнокислого брожения, зародыши которых всегда находятся в воздухе. Протеканием этого процесса и объясняется наличие молочной кислоты в кислом молоке, откуда она была впервые выделена Шееле (1780). Молочнокислое брожение сахарных растворов лучше всего протекает под действием чистых культур молочнокислых бактерий (Bacillus Delbrьckii) при температуре 34—45° С, с добавкой необходимых для жизни бактерий минеральных веществ, а также мела или карбоната цинка. Последние добавки вводятся для нейтрализации свободной кислоты, так как при сколько-нибудь значительной концентрациикислоты бактерии погибают и брожение прекращается.
Молочнокислое брожение является одним из процессов, протекающих при изготовлении масла (из скисшего молока), при созревании сыра, квашении капусты, при силосовании кормов и пр. Уравнение процесса молочнокислого брожения имеет вид:
Для молочнокислого брожения, как и для спиртового, доказано существование особого энзима, зимазы молочнокислого брожения,могущего вызывать брожение и без живых бактерий (Бухнер и Мейзенгеймер).
Обычно молочнокислое брожение приводит к образованию оптически недеятельной молочной кислоты, однако часто при этом получается кислота, обладающая слабым правым или левым вращением.
Чистая левовращающая молочная (D-молочная) кислота может быть получена брожением сахаристых веществ при посредстве особого возбудителя брожения
(Bacillus acidi laevolactici). Правовращающий изомер молочной кислоты (L-молочная) был открыт Либихом (1847) в мясном экстракте и получил названиемясомолочной кислоты. Правовращающая молочная кислота всегда содержится в мышцах животных.
Обыкновенная (недеятельная) молочная кислота, часто называемая «молочной кислотой брожения», долгое время была известна лишь в виде густой жидкости. Осторожным выпариванием в высоком вакууме (0,1—0,5 мм рт. ст.) можно получить ее в безводном состоянии в виде кристаллической массы, плавящейся при 18° С. Из солей i-молочной кислоты характерной является хорошо кристаллизующаяся цинковая соль, содержащая три молекулы воды (С3Н5О3)2Zn • 3Н2О.
Различие свойств недеятельной молочной кислоты и оптически деятельных кислот и их солей показывает, что недеятельное веществопредставляет собой не смесь, а рацемическое соединение обеих (D— и L-) кислот или их солей (лактатов).
Правовращающая (L-молочная) и левовращающая (D-молочная) кислоты представляют собой расплывающиеся на воздухе призмы с т. пл. 25—26° С. Они обладают равным, но противоположным оптическим вращением (в 10%-ном растворе [б]D 15°C =±3,82° и в 2,5%-ном [б]D 15°C =±2,67°). При продолжительном нагревании до 130—150°С оптически деятельные изомеры рацемизуются и дают ангидридынедеятельной молочной кислоты. Цинковые соли оптически деятельных изомеров молочной кислоты кристаллизуются только с двумямолекулами воды (C3H5O3)2Zn • 2H2O и обе обладают совершенно одинаковой растворимостью в воде (1 : 175 при 15° С), отличной отрастворимости недеятельной соли (1 : 50 при 10° С).
Реакции молочной кислоты типичны для б-оксикислот.
Особенно легко (даже при высушивании в вакууме) идет выделение воды с превращением в лактид, являющийся гомологом гликолида.