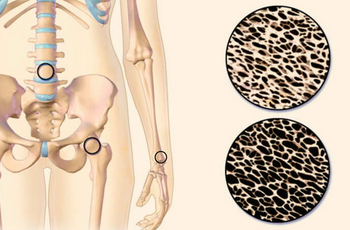
Кортикостероиды что это такое
Кортикостероиды что это такое
Сайт предоставляет справочную информацию исключительно для ознакомления. Диагностику и лечение заболеваний нужно проходить под наблюдением специалиста. У всех препаратов имеются противопоказания. Консультация специалиста обязательна!
Введение (характеристика препаратов)
Природные кортикостероиды
Кортикостероиды выполняют много очень важных функций в организме.
Глюкокортикоиды относятся к стероидам, обладающим противовоспалительным действием, они участвуют в регуляции обмена углеводов, жиров и белков, контролируют половое созревание, функцию почек, реакцию организма на стресс, способствуют нормальному течению беременности. Инактивируются кортикостероиды в печени и выводятся с мочой.
Альдостерон регулирует обмен натрия и калия. Таким образом, под влиянием минералокортикоидов в организме задерживается Na+ и увеличивается выведение из организма ионов К+.
Синтетические кортикостероиды
Практическое применение в медицинской практике нашли синтетические кортикостероиды, обладающие теми же свойствами, что и природные. Они способны на время подавлять воспалительный процесс, но на инфекционное начало, на возбудителей заболевания они действия не оказывают. После прекращения действия кортикостероидного препарата инфекция возобновляется.
Кортикостероиды вызывают в организме напряжение и стресс, а это приводит к снижению иммунитета, так как иммунитет обеспечивается на достаточном уровне только в расслабленном состоянии. Учитывая вышесказанное, можно сказать, что применение кортикостероидов способствует затяжному течению заболевания, блокирует процесс регенерации.
Кроме того, синтетические кортикостероиды подавляют функцию природных гормонов кортикостероидов, что влечет за собой нарушение функции надпочечников в целом. Кортикостероиды оказывают влияние на работу и других желез внутренней секреции, нарушается гормональный баланс организма.
Кортикостероидные препараты, устраняя воспаление, оказывают и обезболивающее действие. К синтетическим кортикостероидным препаратам относятся Дексаметазон, Преднизолон, Синалар, Триамцинолон и другие. Эти препараты обладают более высокой активностью и вызывают меньше побочных явлений, чем природные.
Формы выпуска кортикостероидов
Препараты для внутреннего применения (в таблетках и в капсулах)
Препараты для инъекций
Препараты для местного применения (топические)
Кортикостероиды для ингаляций
Показания к применению
Показания к применению глюкокортикоидов
Показания к применению минералокортикоидов
Противопоказания
Побочные реакции и меры предосторожности
Для снижения риска развития побочных реакций важно своевременно реагировать на их появление, проводить коррекцию доз (применение малых доз по возможности), контролировать массу тела и калорийность потребляемых продуктов, ограничить употребление поваренной соли и жидкости.
Как применять кортикостероиды?
Режим дозирования назначает врач. Таблетированный препарат следует принимать с 6 часов утра (первая доза) и не позже 14 часов последующие. Такие условия приема необходимы для приближения к физиологическому поступлению глюкокортикоидов в кровь при выработке их корой надпочечников.
В некоторых случаях, при больших дозах и в зависимости от характера заболевания, доза распределяется врачом на равномерное поступление в течение суток за 3-4 приема.
Таблетки следует принимать во время еды или сразу после приема пищи, запивая небольшим количеством воды.
Лечение кортикостероидами
Лимитирующую терапию применяют при длительных, хронических процессах – применяются, как правило, таблетированные формы в течение нескольких месяцев или даже лет.
Для профилактики нежелательного воздействия кортикостероидов на желудочно-кишечный тракт перед приемом таблеток можно рекомендовать употребление Алмагеля, киселей. Рекомендуется исключить курение, злоупотребление алкогольными напитками; умеренные занятия физическими упражнениями.
Кортикостероиды детям
Детей с гормональной зависимостью (при бронхиальной астме, например) после внутривенного введения препарата постепенно переводят на поддерживающую дозу преднизолона. При частых рецидивах астмы применяют Бекламетазона дипропионат в виде ингаляций – доза подбирается индивидуально. После получения эффекта доза снижается постепенно до поддерживающей (подобранной индивидуально).
Топические глюкокортикоиды (кремы, мази, лосьоны) применяются в детской практике, но дети имеют более высокую предрасположенность к системному действию препаратов, чем взрослые пациенты (задержка развития и роста, синдром Иценко-Кушинга, угнетение функции желез внутренней секреции). Это связано с тем, что у детей отношение площади поверхности тела к массе тела больше, чем у взрослых.
По этой причине применять топические глюкокортикоиды у детей необходимо только на ограниченных участках и коротким курсом. Особенно это касается новорожденных. Для детей первого года жизни можно применять только мази, содержащие не более 1% гидрокортизона или препарат четвертого поколения – Предникарбат (Дерматол), а в возрасте до 5 лет – Гидрокортизона 17-бутират или мази с препаратами средней силы.
Для лечения детей старше 2 лет может использоваться по назначению врача Мометазон (мазь, имеет пролонгированное действие, наносится 1 р. в сутки).
Существуют и другие препараты для лечения атопического дерматита у детей, с менее выраженным системным действием, например, Адвантан. Он может применяться до 4 недель, но его применение ограничено из-за возможности появления местных побочных реакций (сухость и истончение кожи). В любом случае выбор препарата для лечения ребенка остается за врачом.
Кортикостероиды при беременности и лактации

Это отрицательное влияние глюкокортикоидов усиливается в результате того, что современные препараты длительного действия (Метипред, Дексаметазон) не дезактивируются ферментами плаценты и оказывают длительное действие на плод. Глюкокортикоиды, подавляя систему иммунитета, способствуют снижению сопротивляемости беременной женщины к бактериальным и вирусным инфекциям, которые также могут отрицательно воздействовать на плод.
Глюкокортикоидные препараты могут назначаться беременной только в том случае, когда результат их применения превышает в значительной степени риск возможных отрицательных последствий для плода.
Такими показаниями могут быть:
1. Угроза преждевременных родов (короткий курс гормонов улучшает готовность недоношенного плода к рождению); применение сурфактанта для ребенка после рождения позволило свести до минимума применение гормонов при этом показании.
2. Ревматизм и аутоиммунные заболевания в активной фазе.
3. Наследственная (внутриутробная) гиперплазия у плода коркового слоя надпочечников – трудно диагностируемое заболевание.
Ранее существовала практика назначения глюкокортикоидов для сохранения беременности. Но убедительных данных о эффективности такой методики не получено, поэтому в настоящее время она не применяется.
В акушерской практике чаще применяются Метипред, Преднизолон и Дексаметазон. Через плаценту они проникают по-разному: Преднизолон разрушается ферментами в плаценте в большей степени, а Дексаметазон и Метипред – всего лишь на 50%. Поэтому, если гормональные препараты используются для лечения беременной – предпочтительнее назначать Преднизолон, а если для лечения плода – Дексаметазон или Метипред. В связи с этим Преднизолон и побочные реакции у плода вызывает реже.
В грудное молоко глюкокортикоиды в малых дозах проникают плохо и не представляют для ребенка опасности.
Препараты в более высоких дозах и длительный курс лечения кормящей матери гормонами могут стать причиной задержки роста ребенка и угнетения у него функции желез внутренней секреции (гипофиза, гипоталамуса, надпочечников).
Кортикостероиды при бронхиальной астме

Для купирования приступа доза подбирается индивидуально. В США назначают Метилпреднизолон внутривенно по 40-60 мг через каждые 6 часов. В Великобритании применяют Преднизолон внутрь 30-40 мг 1 р. в сутки. Высокие дозы не более эффективны, чем обычные, а внутренний прием не менее эффективен, чем внутривенное введение.
Действие глюкокортикоидов наступает через 6 часов после приема. При быстром снижении дозы препарата может возобновиться приступ. Оптимальным вариантом является снижение дозы в 2 р. каждые 3-5 дней после купирования приступа.
При необходимости длительного применения глюкокортикоидов лучше использовать альтернативную схему лечения – принимать их через день. Это снизит риск развития побочных эффектов, что особенно важно при лечении детей, т.к. гормоны могут вызвать задержку роста. Глюкокортикоиды длительного действия не следует использовать для лечения бронхиальной астмы, так как они угнетают функцию гипофиз-надпочечниковой системы.
Для лечения бронхиальной астмы широко используются ингаляционные глюкокортикоиды. Они дают максимальный местный эффект и наименьшее число осложнений за счет минимального всасывания. Они применяются для облегчения отмены гормонального препарата после длительного его приема, снижения частоты приступов при физических нагрузках.
Ингаляционные препараты быстрого эффекта не дают – их надо применять несколько недель или даже месяцев. Дозу ингаляционного препарата можно повышать, но при этом возрастает риск возникновения побочных явлений. Их можно комбинировать с приемом глюкокортикоидов внутрь – потребность в препаратах для внутреннего приема при этом снижается.
Растворы глюкокортикоидов для ингаляций можно вводить с помощью распылителей – это обеспечит более глубокое проникновение препарата. При таком способе применения снижается риск развития побочных эффектов – кандидозного стоматита и нарушения голоса. С целью профилактики кандидозного стоматита следует после ингаляции хорошо прополоскать водой рот. После отмены внутреннего приема препарата ингаляционное лечение продолжается в качестве поддерживающей терапии.
Подробнее о бронхиальной астме
Кортикостероиды при аллергии
Глюкокортикоиды широко применяются при лечении аллергических реакций на введение анестетиков для наркоза во время операции. При тяжелых аллергических проявлениях хороший эффект дает внутривенное введение глюкокортикоидов, но начало их действия отсрочено на 2-8 часов. Поэтому, во избежание выраженного бронхоспазма параллельно необходимо немедленно вводить Эпинефрин.
Глюкокортикоиды при тяжелой форме аллергии назначаются и системные (инъекции или таблетки), и местные (мази, гели, капли, ингаляции). Они оказывают мощное противоаллергическое действие. В основном используются такие препараты: Гидрокортизон, Преднизолон, Дексаметазон, Бетаметазон, Беклометазон.
Из топических глюкокортикоидов (для местного лечения) в большинстве случаев применяются интраназальные аэрозоли: при поллинозе, аллергическом рините, заложенности носа (чихании). Обычно они оказывают хороший эффект. Широкое применение нашли Флютиказон, Дипропионат, Пропионат и другие.
При аллергических конъюнктивитах в связи с более высоким риском развития побочных эффектов глюкокортикоиды применяются редко. В любом случае, при аллергических проявлениях применять гормональные лекарственные средства самостоятельно нельзя во избежание нежелательных последствий.
Подробнее об аллергии
Кортикостероиды при псориазе
Глюкокортикоиды для местного применения (мази, кремы) используют обычно 2 р. в день: кремы в течение дня без повязок, а на ночь вместе с каменноугольным дегтем или антралином с использованием окклюзионной повязки. При обширных поражениях на обработку всего тела используется примерно 30 г препарата.
Выбор глюкокортикоидного препарата по степени активности для местного применения зависит от тяжести течения псориаза и его распространенности. По мере уменьшения в процессе лечения очагов псориаза следует менять препарат на менее активный (или реже использовать) для минимизации возникновения побочных эффектов. При получении эффекта примерно через 3 недели лучше заменить гормональный препарат смягчающим средством на 1-2 недели.
Применение глюкокортикоидов на больших площадях в течение длительного периода может усугублять процесс. Рецидив псориаза после прекращения применения препарата наступает раньше, чем при лечении без применения глюкокортикоидов.
Подробнее о псориазе
Лекарственное взаимодействие
Правила отмены кортикостероидов
При длительном приеме глюкокортикоидов отмена препарата должна быть постепенной. Глюкокортикоиды подавляют функцию коры надпочечников, поэтому при быстрой или внезапной отмене препарата может развиться надпочечниковая недостаточность. Унифицированной схемы для отмены кортикостероидов нет. Режим отмены и снижения дозы зависит от длительности предшествующего курса лечения.
Если длительность курса глюкокортикоида до нескольких месяцев, то можно снижать дозу Преднизолона на 2,5 мг (0,5 таблетки) каждые 3-5 дней. При большей продолжительности курса доза снижается более медленно – на 2,5 мг каждые 1-3 недели. С большой осторожностью снижается доза ниже 10 мг – по 0,25 таблетки каждые 3-5-7 дней.
Если исходная доза Преднизолона была высокой, то вначале снижение производят более интенсивно: на 5-10 мг каждые 3 дня. По достижению суточной дозы равной 1/3 исходной дозу снижают на 1,25 мг (1/4 таблетки) каждые 2-3 недели. В результате такого снижения пациент получает поддерживающие дозы в течение года и более.
Режим снижения препарата назначает врач, и нарушение этого режима может привести к обострению заболевания – лечение придется начинать снова с большей дозы.
Местные кортикостероиды в дерматологии
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Кортикостероиды (КС) в виде местных форм широко используются для лечения неинфекционных кожных заболеваний (атопического дерматита, экземы, псориаза, себорейного и контактного дерматита и др.). КС подавляют большинство звеньев кожной воспалительной реакции, обладая антиэкссудативным, противозудным, противоотечным действием. КС показаны для купирования основных кожных проявлений и облегчения зуда, жжения и других субъективных ощущений пациента, когда неэффективны другие, менее агрессивные методы лечения. Местные КС не применяются для лечения крапивницы, вульгарных угрей, а также зуда без выяснения его причины. Топические КС противопоказаны при язвенных поражениях кожи, так как они могут ухудшить течение болезни. Местные КС в зависимости от силы действия делят на классы (табл. 1). Наиболее сильные КС (4 класс) должны применяться в основном при хронической дискоидной красной волчанке, красном плоском лишае, ладонно-подошвенном пустулезе. Сильные КС (с редкими исключениями) не наносят на кожу лица из-за опасности розацеа-подобных высыпаний и атрофии кожи. Инъекции КС в очаги поражения более эффективны, чем даже очень сильные местные КС, и должны использоваться в тяжелых случаях локальных расстройств (келоидные рубцы, гипертрофический плоский лишай) при неудаче местного лечения. Лечебное действие инъекций длится несколько недель или даже месяцев. Лекарство следует вводить точно в очаг во избежание тяжелой атрофии кожи и депигментации. Побочные эффекты Местные КС 1 и 2 класса (слабые и средней силы), в отличие от более сильных КС, редко вызывают побочные эффекты. Препараты 3 и 4 класса при всасывании через кожу могут угнетать гипоталамо-гипофизарно-надпочечниковую систему и приводить к развитию синдрома Кушинга. Эти побочные эффекты зависят от площади, на которую наносится препарат, и длительности лечения. КС лучше всасываются из областей кожных складок, с тонкой или поврежденной (воспаленной) кожи; при использовании окклюзионных повязок. На кожу лица наносят 1% гидрокортизон во избежание перманентных телеангиэктазий. Длительное применение местных КС в периорбитальных областях может привести к глаукоме, особенно у предрасположенных лиц. С осторожностью используют КС на коже живота, груди, плеч, где возможно появление стрий. При исследованиях на здоровых добровольцах истончение кожи появлялось через 6 нед лечения, однако подвергалось полному обратному развитию за 4 нед после отмены КС. Местные побочные эффекты • распространение кожной инфекции при отсутствии лечения • истончение кожи (может быть обратимым через некоторое время) • атрофические стрии или телеангиэктазии • контактный дерматит • периоральный дерматит (папулезный дерматоз у молодых женщин) • акне в месте нанесения • легкая депигментация Выбор препарата и режима терапии Кремы, содержащие воду, применяют на мокнущие очаги, тогда как мази – на сухие, лихенифицированные элементы, или когда требуется окклюзионный эффект. Лосьоны используют, если необходимо нанесение минимальных доз на большую поверхность, или при экссудативных поражениях. Окклюзионные повязки увеличивают всасывание, а параллельно – и риск побочного действия, поэтому их можно накладывать на небольшой срок только под наблюдением, преимущественно на области с толстой кожей. Добавление к кортикостероиду салициловой кислоты или мочевины усиливает проникновение и эффективность КС. При ассоциированной бактериальной или грибковой кожной инфекции применяют комбинации местных КС с антибиотиками (например, белогент: бетаметазон + гентамицин) или противогрибковыми препаратами (например, гидрокортизон с клотримазолом) соответственно. Препараты КС обычно наносят один или два раза в сутки. Нет необходимости использовать их чаще (см. табл. 2). Применение у детей Дети особенно восприимчивы к побочным действиям КС. Сильные КС противопоказаны детям до 1 года, а в старшем возрасте их можно назначать лишь по строгим показаниям и под тщательным наблюдением. Слабые КС (гидрокортизон 1%) используют для лечения пеленочного дерматита и атопического дерматита. Псориаз Местные КС, благодаря быстрому действию, привлекательности для пациентов (высокому комплайенсу) и относительно низкой стоимости, – наиболее широко используемые при псориазе препараты. Сильные КС (бетаметазон и др.) обладают большей или равной эффективностью по сравнению с антралином и другими традиционными препаратами, при этом лучше переносятся, не вызывают раздражения кожи и не оставляют следов на коже и одежде. Сильные местные КС высокоэффективны даже при использовании 1 раз в сутки. Так, бетаметазона дипропионат при нанесении 1 раз в сутки приводил к улучшению у 57% пациентов, по сравнению с 37% при использовании дифлоразона диацетата 2 раза в сутки. При длительном использовании КС чувствительность к ним снижается, поэтому лечение эффективно обычно не более, чем в течение нескольких месяцев. Сильнодействующие местные КС следует использовать лишь под наблюдением специалиста, поскольку после их отмены период улучшения может смениться резким ухудшением вплоть до пустулезного псориаза (“синдром рикошета”). При распространенном псориазе сильные местные КС могут вызывать локальные и системные побочные эффекты. При ограниченных формах рекомендуется назначать слабые КС (гидрокортизон) на срок до месяца, причем при локализации на лице – не сильнее чем 1% гидрокортизон. Если поражена волосистая часть головы, показаны более сильные КС (бетаметазон и др.), в том числе в виде лосьонов. Традиционно применяют кератолитические средства: салициловая кислота способствует отшелушиванию чешуек и усиливает действие КС при совместном их использовании в составе комбинированных препаратов (белосалик: салициловая кислота + бетаметазона дипропионат). Атопический дерматит При атопическом дерматите местные КС – основные препараты (наряду со смягчающими средствами). Контролируемые клинические исследования показали достоверное улучшение при использовании местных КС у большинства больных. В этих исследованиях продолжительностью до месяца не было отмечено серьезных негативных действий местного и системного характера. Незначительные местные побочные действия развились менее чем у 10% больных. У детей обычно достаточно препаратов средней силы (клобетазон), на лицо наносится 1% гидрокортизон (см. табл. 3). При выраженной активности процесса назначают сильные препараты (бетаметазон и др.). У детей хороший эффект получают от влажных повязок с теплой водой, под которые наносят смягчающие средства и/или слабые КС, антисептические средства при необходимости. Взрослым при обострении показаны сильные КС (бетаметазон и др.) без разведения, а в остальное время – КС 2 класса или 3 класса в разведении. Больные атопическим дерматитом предрасположены к стафилококковой инфекции, в этих случаях показаны системные антибиотики или комбинированные мази, сочетающие КС с антибиотиком. Мази предпочтительнее кремов, так как кремы действуют слабее и обычно содержат консерванты, которые могут вызывать сенсибилизацию. Местные КС используют также для лечения себорейного дерматита, контактного аллергического или ирритативного дерматита, экземы (в т.ч. профессиональной) и других дерматозов.
1. British National Formulary, 36th ed. London, UK, 1998.
2. C. Charman. Clinical evidence. Atopic eczema. BMJ 1999; 318:1600-4.
3. P.S. Friedman. Allergy and the skin. II. Contact and atopic eczema. BMJ 1998; 316:1226-9.
4. P.M. McHenry et al. Fortnightly review: management of atopic eczema. BMJ 1995; 310:843-7.
5. A. J. Wood. Treatment of psoriasis. N Engl J Med 1995; 332:581-8.
Бетаметазон – Белодерм (торговое название)
Бетаметазон + гентамицин – Белогент (торговое название) (Belupo)
Бетаметазон + салициловая кислота – Белосалик (торговое название)
Кортикостероиды
Зачем нужны кортикостероиды?
Кортикостероиды представляют собой стероидные гормоны. Они вырабатываются в организме человека корой надпочечников в виде кортизола. К их основным функциям относятся:
В то же время они регулируют обмен калия и натрия в организме.
Как мы видим, невозможно переоценить роль этого гормона в жизни человека. Но случается так, что по каким-то причинам кора надпочечников человека перестает выделять кортизол в нужном количестве либо такая функция, вообще, прекращается. В этом случае на помощь приходят синтетические кортикостероиды. И все бы хорошо. Живи себе всю жизнь на заместительной терапии. Но.… Не все так просто. Под влиянием искусственных кортикостероидов в организме начинают происходить страшнейшие изменения:
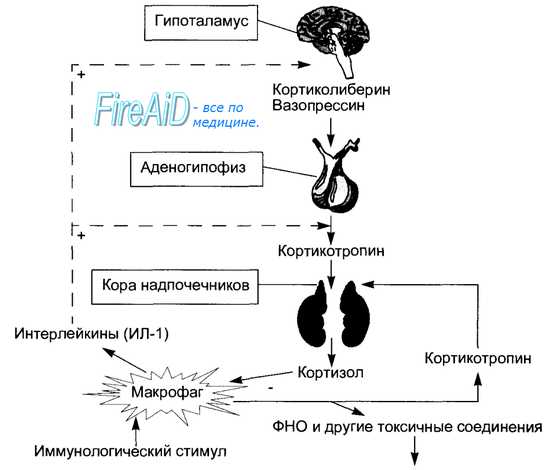
Организм видит, что ему самому не стоит утруждаться, вырабатывая кортизол, и постепенно замолкает. И эти изменения зачастую бывают необратимыми. Так как же заставить кору надпочечников заработать даже в запущенных случаях? Есть несколько медицинских подходов к этой проблеме, как, например, прием кортикотропина (кстати, с которого тоже нужно «слезать»).
Если это дексаметазон, то снижение должно происходить по 0,25 г за одну неделю и вплоть до дозировки в 0,5 г – как минимально эффективной. По ее достижению необходимо сдать анализ на кортизол и делать это каждую неделю в период восстановления, пока не будут достигнуты минимально допустимые показатели. В этот период при такой дозировке начинают параллельно подключаться потихоньку и ваши собственные надпочечники – медленно, но при хорошей терапии верно. Сдавать анализ нужно с утра до приема искусственного кортикостероида.Первым помощником в стимуляции коры надпочечников выступает трава хвощ полевой. Принимать его необходимо в течение всего периода восстановления. Необходимо заваривать две столовые ложки травы литром кипятка в термосе на ночь и пить в течение дня вместо чая.
Еще одним стимулятором, который необходимо подключить через неделю после начала приема хвоща, являются листья черной смородины. Они имеют свойство не только стимулировать, но и восстанавливать (на постоянной основе) функцию коры надпочечников. И это доказано широкими научными исследованиями. Ложку сухих листьев черной смородины заваривают стаканом кипятка и употребляют утром и вечером по полстакана. Не забываем при этом контролировать уровень кортизола (в динамике).
Уровень кортизола
В случае если уровень кортизола с утра ниже вечерней нормы, необходимо подключить еще один важный компонент – череду. Она в своем составе содержит вещества сходные с человеческим кортизолом и прекрасно помогает организму справиться с его нехваткой. Принимать ее достаточно раз в день с утра, заваривая чайную ложку стаканом кипятка и настаивая 15 минут.
По истечении месяца, как показывает практика, уровень кортизола в крови повышается как минимум в 2 раза. В этом случае происходит отмена вышеуказанных средств и подключается сироп корня солодки. Принимают его по чайной ложке утром и вечером. Солодка помогает кортикоподобным веществам справиться с нехваткой собственного гормона и в дополнение стимулирует выработку собственного. Одновременно солодка обладает сильными противовоспалительными и противоаллергическими свойствами. Она восстанавливает иммунитет, который свел на нет прием кортикостероидов. И не забываем еженедельно делать проверку собственного кортизола. И только, когда его уровень будет в рамках нормы, мы можем отменять кортикостероиды полностью.
Процесс этот долгий, кропотливый, а иногда и мучительный. Но это того стоит. Крайне редко в интернете найдутся разумные советы по восстановлению функции коры надпочечников. А это на самом деле глобальная проблема, которая требует широкого освещения. Надеемся, что эта статья кому-то помогла. Желаем вам крепкого здоровья!
Риски, сопряженные с приемом короткого курса кортикостероидов
Актуальность
Кортикостероиды являются мощными противовоспалительными препаратами, которые широко применяются на протяжении 70 лет (впервые применили в 1949 году для лечения ревматоидного артрита).
В клинических рекомендациях говорится о необходимости использования коротких курсов кортикостероидов, так как у пациентов, находящихся на длительной терапии, повышается риск инфекций, венозной тромбоэмболии, аваскулярного некроза, сахарного диабета, гипертонии, остеопороза. Помимо этого, побочные эффекты на фоне длительного приема препаратов являются одной из частых причин госпитализаций.
Риск осложнений, возникающих при приеме коротких курсов кортикостероидов, не так хорошо изучен, хотя препараты часто назначаются лицам с мышечно-скелетными симптомами, аллергическими реакциями.
Целью настоящего исследования было оценить частоту назначения оральных кортикостероидов на короткий период и нежелательные явления, ассоциированные с их приемом (сепсис, переломы, венозная тромбоэмболия).
Дизайн исследования
Выполнено ретроспективное когортное исследование с включением лиц в возрасте 18-64 лет (2012-2014 гг., США). Были использованы данные частных страховых компаний.
Курс кортикотерапии расценивался как короткий, если его продолжительность не превышала 30 дней.
Оценивалась частота побочных эффектов в течение 30 дней и 31-90 дней после начала приема препаратов.
Результаты
Кортикостероиды что это такое
Местные кортикостероиды для лечения болезней кожи
Топические кортикостероидные препараты (КСП) выпускаются во всех лекарственных формах. Они отличаются не только формой, но и силой действия, в зависимости от нее они подразделяются на 8 классов. Врачу полезно знать один или два наименования для каждого класса. Желательно осведомиться о наличии и стоимости этих препаратов в местных аптеках.
С большинством кожных высыпаний у детей, требующих назначения топических кортикостероидных препаратов (КСП), можно быстро справиться посредством применения два раза в день препаратов слабой или средней силы действия. Более того, ряд исследований показал, что препараты средней силы действия можно безопасно применять дважды в день в течение длительных периодов времени.
На лице и в интертригинозных зонах в большинстве случаев следует применять препараты слабой силы действия, поскольку более сильные препараты могут вызвать атрофию, телеангиэктазии и гипопигментацию. Независимо от силы действия препарата, необходимо внимательно следить за появлением вызванных кортикостероидами изменений.
Они встречаются редко, если терапия ограничена 2-4 нед. Пациенты, получающие длительную терапию на чувствительных участках, должны часто делать перерывы в лечении (например, 1 нед. каждый месяц) и постепенно сокращать количество аппликаций препаратов по мере возможности.
Можно, помимо уменьшения частоты аппликаций, снижать дозу, смешивая препарат с нейтральным эмолентом, например, вазелином. Кортикостероидные препараты (КСП) могут замаскировать инфекцию и подавить местный и системный иммунные ответы. Следовательно, они противопоказаны большинству пациентов с вирусными, грибковыми, бактериальными или микобактериальными инфекциями.
Топические кортикостероидные препараты (КСП)
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Натуральные и синтетические кортикостероиды
Натуральные кортикостероиды — это стероидные гормоны, вырабатываемые корой надпочечников и выполняющие ряд физиологических функций. Синтетические продукты являются фармацевтической промышленностью в соответствии с их естественной химической формулой (они реализуют многочисленные фармакофункции). На данном этапе были созданы синтетические производные естественных кортикостероидов, которые усиливают одни фармацевтические свойства и подавляют другие.
Глюкокортикоиды с кортизолом в качестве основного представителя участвуют в регуляции углеводного, жирового и белкового обмена; обладают противовоспалительным воздействием, предотвращая высвобождение фосфолипидов, снижая действие эозинофилов и посредством ряда других механизмов.
Минералокортикоиды с альдостероном в качестве основного представителя участвуют в регуляции уровня воды и электролитов, стимулируя задержку натрия через почки.
Есть несколько типов кортикостероидов, кроме натуральных и синтетических.
Стероиды для местного использования — для местного нанесения на кожу, глаза и слизистые оболочки.
Ингаляционные стероиды — для лечения слизистой оболочки легких, носа, бронхов, носовых пазух и легких.
Оральные средства. Системные медпрепараты — доступны в виде инъекций для внутривенного и парентерального использования. «Пациенты, принимающие ингаляционные кортикостероиды, подвергаются повышенному риску формирования диабета 2 типа. Риск увеличивается с более высокими дозами, особенно у пациентов с хронической обструктивной болезнью легких (ХОБЛ)», — заявили исследователи из Монреальского института медицинских исследований.
Эксперты пришли к тревожным данным, основанным на исследовании с участием почти 400 000 пациентов, лечившихся от ХОБЛ или астмы. Результаты однозначно показали, что ингаляционные кортикостероиды увеличивают количество диабетиков на 34 процента с каждым годом использования. «Эти препараты очень эффективны при астме, поэтому очевидно, что преимущества перевешивают возможные риски для астматиков. Однако их эффективность у больных ХОБЛ сомнительна, поскольку ХОБЛ требует использования повышенных доз кортикостероидов», — пояснили эксперты.
Кортикостероиды что это такое
Глюкокортикоиды: кортизол и кортикостерон. Транскортин. Липокортин. Регуляция секреции и физиологические эффекты глюкокортикоидов.
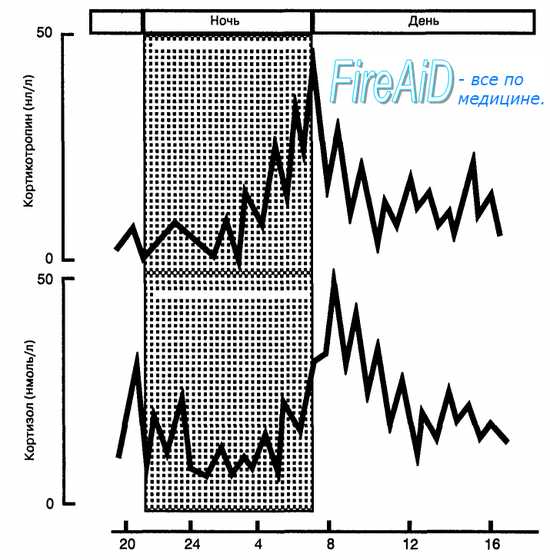
Клетки пучковой зоны секретируют в кровь у здорового человека два основных глюкокортикоида: кортизол и кортикостерон, причем кортизола примерно в 10 раз больше. Секреция глюкокортикоидов регулируется кортикотропином аденогипофиза. Избыток кортизола в крови по механизму обратной связи угнетает секрецию кортиколиберина в гипоталамусе и кортикотропина в гипофизе. Секреция глюкокортикоидов происходит непрерывно с отчетливой суточной ритмикой, повторяющей ритмику секреции кортикотропина: максимальные уровни гормона в крови у человека отмечаются в утренние часы, а минимальные — вечером и ночью (рис. 6.13). Поступающие в кровь гормоны транспортируются к тканям в свободной и связанной (до 95 %) с альфа2-глобулином плазмы (транскортин) формах. Механизм действия глюкокортикоидов на клетки-мишени представлен на рис. 6.14.
Благодаря растворимости в липидах кортизол проникает через мембрану клетки-мишени и взаимодействует с цитоплазматическим рецептором, образуя лиганд-рецепторный комплекс, что обеспечивает транспорт молекулы гормона в ядро, где кортизол связывается с ядерным рецептором, активируя синтез новых белков и ферментов, тем самым обеспечивая метаболические эффекты. Молекула кортизола может образовывать лиганд-рецепторный комплекс и с мембранными рецепторами. Хотя роль этого процесса в реализации эффектов гормона еще изучается, тем не менее известны быстрые негеномные эффекты гормона на возбудимость нервных клеток, связанные с изменением ионного трансмембранного транспорта, обусловливающие изменение поведения.
Среди синтезированных под влиянием кортизола белков в клетке-мишени важнейшую роль для реализации опосредованных эффектов гормона играет семейство липокортинов. Последние, выходя из клетки, связываются со специфическими липокортиновыми рецепторами клеточной мембраны (аутокринный путь влияния), что вызывает подавление активности фосфолипазы-А. Липокортины способны ингибировать фосфолипазу-А и непосредственно, следствием чего является подавление синтеза в клетках простагландинов и лейкотриенов, ослабление их метаболических и регуляторных эффектов. Уменьшение проницаемости клеточных мембран и противовоспалительный эффект кортизола обусловлены ингибированием синтеза лейкотриенов.
Глюкокортикоиды прямо или опосредованно регулируют практически все виды обмена веществ и физиологические функции. Метаболические эффекты глюкокортикоидов проявляются, прежде всего, со стороны углеводного, белкового и жирового обменов. Обобщенно эти сдвиги можно свести к распаду белков и липидов в тканях, после чего метаболиты поступают в печень, где из них синтезируется глюкоза, использующаяся как источник энергии. Эффекты на углеводный обмен в целом противоположны инсулину, поэтому глюкокортикоиды называют контринсулярными гормонами. Гипергликемия под влиянием гормонов возникает за счет усиленного образования глюкозы в печени из аминокислот — глюконеогенеза и подавления утилизации ее тканями. Гипергликемия является причиной активации секреции инсулина. Чувствительность тканей к инсулину глюкокортикоиды снижают, а контр инсулярные метаболические эффекты могут вести к развитию стероидного сахарного диабета.
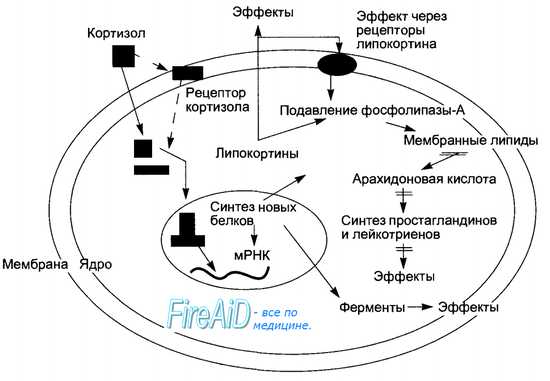
На белковый обмен гормоны оказывают катаболический и антианаболический эффекты, приводя к отрицательному азотистому балансу. Распад белка происходит в мышечной, соединительной и костной тканях, снижается уровень альбумина в крови, уменьшается проницаемость клеточных мембран для аминокислот. Однако синтез некоторых белков в печени, например альфа2-глобулинов, глю-кокортикоиды повышают. Со стороны жирового обмена имеют место липо-литический эффект в тканях, гиперлипидемия и гиперхолестеринемия, активация кетогенеза в печени, угнетение липогенеза в печени, стимуляция липогенеза и перераспределения жира в жировой ткани центральной оси туловища и лица, стимуляция аппетита и потребления жира
Влияние глюкокортикоидов на реактивность тканей проявляется не только в виде подавления чувствительности к инсулину, но и в повышении чувствительности адренорецепторов к катехоламинам. Глюкокортикоиды вызывают снижение в крови количества лимфоцитов, эозинофилов и базофилов, повышение чувствительности сенсорных структур и возбудимости нервной системы, обеспечение оптимальной симпатической регуляции сердечно-сосудистой системы. Почечные эффекты глюкокортикоидов состоят в стимуляции диуреза путем снижения реабсорбции воды и повышении клубочковой фильтрации; подобно минералокортикоидам, они могут вызывать задержку натрия при потере калия. Глюкокортикоиды повышают синтез ангиотензиногена в печени и тем самым способствуют большему образованию в крови ангиотензина II и секреции альдостерона, увеличивают синтез катехоламинов в мозговом веществе надпочечников. Гормоны повышают устойчивость организма к действию чрезмерных раздражителей, подавляют сосудистую проницаемость и воспаление (поэтому их называют адаптивными и противовоспалительными), из-за катаболизма белка в лимфоидной ткани и угнетения иммунных реакций они оказывают антиаллергические эффекты. Физиологическое влияние кортизола на им-мунокомпетентные клетки носит защитный, регуляторный характер (рис. 6.15).
Избыток гормонов в крови вызывает активацию желудочной секреции, выделения НСl, уменьшение числа мукоцитов и продукции слизи, что способствует возникновению язвы желудка — ульцерогенный эффект.
ИНГАЛЯЦИОННЫЕ ГЛЮКОКОРТИКОСТЕРОИДЫ – НАИБОЛЕЕ ЭФФЕКТИВНЫЕ И БЕЗОПАСНЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ АСТМЫ
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
В обзорной форме приводится анализ ингаляционных кортикостероидов – наиболее эффективных противовоспалительных препаратов лечения бронхиальной астмы.
The paper analyzes inhaled glycocorticosteroids, the most effective antiinflammatory drugs in the treatment of asthma, shows the mechanisms of therapeutical action and possible local complications resulting from the dosage, combinations of drugs and routes of their administration.
О. А. Суточникова
НИИ пульмонологии Минздрава РФ, Москва
O. A. Sutochnikova
Research Institute of Pulmonology, Ministry of Health of the Russian Federation, Moscow
Бронхиальная астма (БА) в настоящее время является одним из наиболее распространенных заболеваний человека. Эпидемиологические исследования последних двадцати пяти лет свидетельствуют о том, что заболеваемость астмой достигла уровня 5% среди взрослого населения, а среди детей – 10%, представляя собой серьезную социальную, эпидемиологическую и медицинскую проблему, привлекая пристальное внимание врачебных обществ. Интернациональный консенсус (1995 г.) сформулировал рабочее определение БА, основываясь на патологических изменениях и функциональных расстройствах как следствиях воспаления дыхательных путей.
Основной целью лечения при БА является улучшение качества жизни больного за счет предотвращения обострений, обеспечения нормальной функции легких, поддержания нормального уровня физической активности, исключения побочного действия лекарственных средств, применяющихся при лечении (National Hеart, Lung & Blood Institute, National Institutes of Health. International Consensus Report on diagnosis and management of asthma // Eur Respir J. – 1992). Исходя из ведущей роли воспаления в патогенезе БА, лечение предусматривает использование противовоспалительных средств, наиболее эффективными из которых являются кортикостероиды, уменьшающие сосудистую проницаемость, предотвращающие отек бронхиальной стенки, снижающие выход эффекторных клеток воспаления в бронхоальвеолярное пространство и блокирующие выработку медиаторов воспаления из эффекторных клеток (А. П. Чучалин,1994; Bergner,1994; Fuller и соавт.,1984).
Еще в конце 40-х годов для лечения БА врачи стали использовать системные кортикостероиды (Carryer и соавт., 1950; Gelfand ML, 1951), которые сыграли значительную роль в терапии этого заболевания. Механизм действия кортикостероидов обусловлен их способностью связываться со специфическими глюкокортикоидными рецепторами в цитоплазме клетки. Однако длительный прием системных кортикостероидов приводит к возникновению нежелательных системных эффектов: синдром Иценко – Кушинга, стероидные диабет и остеопороз, артериальная гипертензия, медикаментозные язвы желудка и кишечника, частое возникновение оппортунистической инфекции, миопатий, что ограничивает их клиническое применение.
Фармакокинетика ингаляционных кортикостероидов
В крови кортикостероиды циркулируют в свободном и связанном состоянии. Связываются кортикостероиды с альбумином плазмы и транскортином. Биологически активными являются только свободные кортикостероиды. На количество свободных кортикостероидов, т.е. метаболически активных гормонов, которые поступают в клетки, влияют 3 фактора:
У системных кортикостероидов длительный период полувыведения, в связи с чем увеличивается период их биологического действия. Только 60% системных кортикостероидов связывается с белком плазмы, а 40% циркулирует свободно. Кроме того, при дефиците белка или использовании высокой дозы системных кортикостероидов свободная, биологически активная часть кортикостероидов в крови повышается. Это способствует развитию перечисленных выше системных побочных проявлений (Шимбах и соавт., 1988). Разобщить положительное антиастматическое действие и нежелательные системные проявления таблетированных стероидов сложно, а БА – это заболевание дыхательных путей, в связи с этим было высказано предположение о возможности местного применения кортикостероидов.
Противовоспалительное действие ингаляционных кортикостероидов
В конце 60-х годов были созданы аэрозоли водорастворимого гидрокортизона и преднизолона. Однако попытки лечить астму этими препаратами оказались малоэффективными (Brokbank и соавт., 1956; Langlands и соавт., 1960) в связи с тем, что они оказывали низкое противоастматическое и высокое системное действие, которое может сравниваться с эффектом таблетированных кортикостероидов. В начале 70-х годов была синтезирована группа жирорастворимых кортикостероидов для местного применения аэрозольным путем, которые в отличие от водорастворимых обладали высокой местной противовоспалительной активностью, характеризовались низким системным действием или его отсутствием в пределах терапевтической концентрации. Клиническая эффективность такой формы препаратов была показана в ряде экспериментальных исследований (Clark, 1972; Morrow-B r own и соавт., 1972). Наиболее существенным в местном противовоспалительном действии ингаляционных кортикостероидов является (Borson и соавт., 1991; Cox и соавт., 1991; Venge и соавт., 1992):
Противовоспалительный эффект ингаляционных кортикостероидов связан с воздействием на биологические мембраны и уменьшением проницаемости капилляров. Ингаляционные кортикостероиды стабилизируют лизосомальные мембраны, что приводит к ограничению выхода различных протеолитических энзимов за пределы лизосом и предупреждает деструктивные процессы в стенке бронхиального дерева. Они угнетают пролиферацию фибробластов и уменьшают синтез коллагена, что снижает темпы развития склеротического процесса в стенке бронхов (Burke и соавт., 1992; Jeffery и соавт., 1992), угнетают образование антител и иммунных комплексов, уменьшают чувствительность эффекторных тканей к аллергическим реакциям, способствуют бронхиальному цилиогенезу и восстановлению поврежденного эпителия бронхов (Laitinen и соавт., 1991a,b), снижают неспецифическую бронхиальную гиперреактивность (Juniper и соавт., 1991; Sterk, 1994).
Ингаляционное введение кортикостероидов быстро создает высокую концентрацию лекарственного средства непосредственно в трахеобронхиальном дереве и позволяет избежать развития системных побочных проявлений (Agertoft и соавт., 1993). Такое применение препаратов у пациентов с зависимостью от системных кортикостероидов снижает потребность в постоянном их приеме. Установлено, что ингаляционные кортикостероиды не оказывают побочного действия на мукоцилиарный клиренс (Dechatean и соавт., 1986). Длительное лечение ингаляционными кортикостероидами в средних и промежуточных дозах (до 1,6 мг/сут) не только не приводит к морфологически видимым повреждениям эпителия и соединительной ткани бронхиальной стенки, что подтверждено на световом и электронно-микроскопическом уровнях, но и способствует бронхиальному цилиогенезу и восстановлению поврежденного эпителия (Laursen и соавт.,1988; Lundgren и соавт., 1977; 1988). В экспериментальных исследованиях при анализе бронхобиопсий у пациентов, получающих ингаляционные кортикостероиды, установлено, что соотношение бокаловидных и реснитчатых клеток увеличивается до уровня, аналогичного тому, который наблюдается у здоровых добровольцев (Laitinen, 1994), а при анализе цитограммы бронхоальвеолярной жидкости наблюдается исчезновение специфических воспалительных клеток – эозинофилов (Janson-Bjerklie, 1993).
Системное действие кортикостероидов
Местные побочные проявления ингаляционных кортикостероидов
Современные ингаляционные кортикостероиды
Вопросы дозировки и комбинации препаратов
Ингаляционные и системные кортикостероиды проявляют суммарный эффект, если используются вместе (Toogood и соавт., 1978; Wya и соавт., 1978), но системная кортикостероидная активность комбинированного лечения (ингаляционные + системные кортикостероиды) в несколько раз ниже, чем у преднизолона, применяемого в ежедневной дозе, необходимой для достижения равноценного контроля над симптомами астмы.
Установлено, что степень тяжести астмы коррелирует со степенью чувствительности к ингаляционным кортикостероидам (Toogood и соавт., 1985). Низкие дозы ингаляционных препаратов являются эффективными и надежными у больных легкой астмой, при коротком периоде заболевания и у большинства больных умеренно тяжелой хронической астмой (Lee и соавт., 1991; Reed, 1991). Повышенная доза является необходимой для быстрого достижения контроля над симптомами астмы (Boe, 1994; Toogood, 1977; 1983). Продолжать лечение, если необходимо, высокими дозами ингаляционных кортикостероидов следует до нормализации или улучшения показателей функции внешнего дыхания (Selroos и соавт., 1994; Van Essen-Zandvliet, 1994), что дает возможность части больных прекратить прием системных кортикостероидов или снизить их дозу (Tarlo и соавт., 198 8 ). При клинической необходимости комбинированного использования ингаляционных и системных кортикостероидов дозу каждого препарата следует выбирать минимально эффективной для достижения максимального симптоматического эффекта (Selroos, 1994; Toogood, 1990; Toogood и соавт., 1978). У больных тяжелой астмой, имеющих зависимость от системных кортикостероидов, а также у части больных умеренно тяжелой хронической астмой при отсутствии эффекта от применения низких или средних доз ингаляционных препаратов необходимо использование их высоких доз – до 1,6 – 1,8 мг/сут. У таких больных оправдана их комбинация с системными кортикостероидами. Однако при приеме высоких доз ингаляционных кортикостероидов увеличивается риск орофарингеальных осложнений и снижения уровня утреннего кортизола в плазме (Toogood и соавт., 1977). Для выбора оптимальной дозировки и режима приема ингаляционных препаратов следует использовать показатели функции внешнего дыхания, ежедневный мониторинг пикфлоуметрии. Для длительного поддержания ремиссии заболевания доза ингаляционных кортикостероидов колеблется от 0,2 до 1,8 мг в сутки. В связи с тем что при использовании низких доз отсутствуют системные эффекты, оправдано профилактическое назначение таких доз на ранней стадии БА, что позволяет задержать прогрессирование заболевания (Haahtela и соавт., 1994; Van Essen-Zandvliet, 1994). У больных легкой астмой снижение гиперреактивности бронхов и стабилизация заболевания достигаются в течение 3 мес приема ингаляционных кортикостероидов (И. М. Кахановский и соавт., 1995).
Больным астмой средней тяжести течения, леченным беклометазона дипропионатом и будесонидом, в среднем требуется 9 мес лечения для достижения достоверного снижения показателя гиперреактивности дыхательных путей (Woolcoch и соавт., 1988). В редких наблюдениях такое уменьшение достигалось только через 15 мес лечения. При резкой отмене ингаляционных кортикостероидов у больных астмой средней тяжести течения, которые лечились низкими дозами ингаляционных препаратов, в 50% наблюдений возникают рецидив заболевания через 10 дней и в 100% – через 50 дней (Toogood и соавт., 1990). С другой стороны, длительное и регулярное использование ингаляционных кортикостероидов увеличивает период ремиссии заболевания до 10 лет и более (Boe и соавт.,1989).
Способы введения ингаляционных кортикостероидов
Недостатком ингаляционных кортикостероидов является сама методика введения препарата, требующая специального обучения больного. Эффективность ингаляционного препарата связана с задержкой его активных частиц в дыхательных путях. Однако такое удержание препарата в адекватной дозе часто оказывается трудным из-за нарушения техники ингаляции. Многие пациенты используют аэрозольный ингалятор неправильно, и плохая ингаляционная техника является главным фактором его крайне низкой эффективности (Crompton, 1982). Спейсеры и им подобные насадки для аэрозольных ингаляторов устраняют проблему синхронизации вдоха и освобождения дозы, уменьшают задержку препарата в гортани, увеличивают доставку в легкие (Newman и соавт., 1984), снижают частоту и тяжесть орофарингеального кандидоза (Toogood и соавт., 1981; 1984), гипоталамо-гипофизарно-надпочечниковую супрессию (Prachl и соавт., 1987), повышают противовоспалительную эффективность. Использование спейсера рекомендуется в случае клинической необходимости назначения антибиотиков или дополнительных системных кортикостероидов (Moren, 1978). Однако полностью исключить местные побочные проявления в виде кандидоза ротоглотки, дисфонии, спорадического кашля пока не удается. Для их устранения рекомендуются щадящий голосовой режим, уменьшение суточной дозы кортикостероидов (Moren, 1978).
Более длительная задержка дыхания после вдоха может снизить отложение препарата во время выдоха в ротоглотке (Newman и соавт., 1982). Полоскания полости рта и горла сразу после ингаляции препарата снижают до минимума местную абсорбцию. Наблюдения показали, что 12-часовой интервал между ингаляциями кортикостероида является достаточным для временного восстановления нормальной защитной функции нейтрофилов, макрофагов и Т-лимфоцитов на поверхности слизистой полости рта. В исследованиях с беклометазона дипропионатом и будесонидом было показано, что разделение дневной дозы на два приема предупреждает развитие в ротоглотке колоний гриба рода Candida и устраняет молочницу (Toogood и соавт., 1984). Пароксизмальный кашель или бронхоспазм, который может быть вызван ингаляцией аэрозоля, у больных связан с раздражающим эффектом пропеллентов и задержкой частиц препарата в дыхательных путях, неправильной ингаляционной техникой, обострением сопутствующей инфекции дыхательных путей или недавно перенесенным обострением основного заболевания, после которого сохраняется повышенная гиперреактивность дыхательных путей. При этом большая часть дозы выбрасывается с рефлекторным кашлем и возникает ошибочное мнение о неэффективности препарата (Chim, 1987). Однако полное решение этой проблемы требует более действенных мер по устранению первичных причин: купирование сопутствующего инфекционного процесса, снижение гиперреактивности бронхов, улучшение мукоцилиарного клиренса. В совокупности это позволит ингалированному препарату попасть в периферические дыхательные пути, а не осесть в трахее и крупных бронхах, где отложение частиц вызывает рефлекторный кашель и бронхоспазм.
Учитывая перечисленные побочные проявления и некоторые проблемы в использовании аэрозольных кортикостероидов, были разработаны ингаляционные кортикостероиды в виде сухой пудры. Для ингалирования этой формы препарата сконструированы специальные приспособления: ротохалер, турбохалер, спинхалер, дискхалер. Эти приборы имеют преимущества по сравнению с аэрозольным ингалятором (Selroos и соавт., 1993a; Thorsoon и соавт., 1993), так как активизируются дыханием за счет максимальной скорости вдоха, что устраняет проблему координации вдоха с освобождением дозы препарата, при отсутствии токсического эффекта пропеллента. Ингаляторы с лекарственным веществом в виде сухой пудры экологически безопасны, поскольку не содержат хлорофлюорокарбоны. Кроме того, ингаляционные кортикостероиды в виде сухой пудры оказывают более выраженное местное противовоспалительное действие и имеют преимущества по клинической эффективности (De Graaft и соавт., 1992; Lundback, 1993).
Ингаляционные кортикостероиды – в настоящее время наиболее эффективные противовоспалительные препараты для лечения БА. Исследования показали их эффективность, которая проявлялась в улучшении функции внешнего дыхания, снижении гиперчувствительности бронхов, уменьшении симптомов болезни, уменьшении частоты и тяжести обострений и улучшении качества жизни больных.
Основным правилом кортикостероидной терапии является применение препаратов в минимальной эффективной дозе в течение возможно короткого периода времени, необходимого для достижения максимального симптоматического эффекта. Для лечения астмы тяжелого течения необходимо назначение высоких доз ингаляционных кортикостероидов на длительный период времени, что снизит потребность больных в таблетированных кортикостероидах. Такая терапия оказывает значительно меньшее системное побочное действие. Дозу препаратов следует подбирать индивидуально, так как оптимальная доза варьирует у отдельных больных и может изменяться с течением времени у одного и того же больного. Для выбора оптимальной дозировки и режима приема ингаляционных кортикостероидов следует использовать показатели функции внешнего дыхания, ежедневный мониторинг пикфлоуметрии. Дозу кортикостероидов всегда следует снижать постепенно. Постоянное наблюдение за больными, получающими кортикостероиды, имеет значение для выявления побочных реакций и обеспечения регулярности лечения. Развитие местных побочных проявлений ингаляционных кортикостероидов часто можно предотвратить, если использовать спейсер, полоскать рот после ингаляции. Правильная ингаляционная техника составляет 50% успеха при лечении больных бронхиальной астмой, что требует разработки и внедрения в повседневную практику методов правильного использования ингаляционных устройств для достижения максимальной эффективности действия ингаляционных препаратов. Необходимо помнить, что обострение астмы может свидетельствовать о неэффективности противовоспалительной терапии хронически протекающего заболевания и требует пересмотра проводимой поддерживающей терапии и дозировок используемых препаратов.
1. Кахановский И. М., Соломатин А. С. Беклометазона дипропионат, будесонид и флунизолид в лечении бронхиальной астмы (обзор литературы и собственные исследования). Тер. арх. 1995;3:34–8.
2. Ландышев Ю. С., Мищук В. П. Суточные ритмы уровня АКТГ, кортизола и 17-оксикортикостероидов у больных бронхиальной астмой. Тер. арх. 1994;3:12–5.
3. Чучалин А. Г. Бронхиальная астма: глобальная стратегия. Тер. арх. 1994;3:3–8.
4. Agertoft L, Pedersen S. Importance of the inhalation device on the effect of budesonide. Arch Dis Child 1993;69:130–3.
5. Boe J, Bakke PP, Rodolen T, et al. High-dose inhaled steroid in asthmatics: moderate efficacy gain and suppression of the hypothalamic-pituitary-adrenal (HPA) axis. Eur Respir J 1994;7:2179–84.
6. Brattsand R, Thalen A, Roempke K,Kallstrom L, Gruvstad E. Development of new glucocorticoids with a very high ratio between topical and systemic activities. Eur J Respir Dis 1982;63(Suppl 122):62–73.
7. Broide J,Soferman R, Kivity S, et al. Low-dose adrenocorticotropin test impaired adrenal function in patients taking inhaled corticosteroids. J Clin Endocrinol Metab 1995;80(4):1243–6.
8. Burke C, Power CK, Norris A, et al. Lung function immunopathological changes after inhaled corticosteroid therapy in asthma. Eur Respir J 1992;5:73–9.
9. Chaplin MD, Cooper WC, Segre EJ, Oren J, Jones RE, Nerenberg C. Correlation of flunisolide plasma levels to eosinopenic response in humans. J Allergy Clin Immunol 1980;65:445–53.
10. Cox G, Ohtoshi T, Vancheri C, et al. Promotion of eosinophil survival by human bronchial epithelial cells and its modulation by steroids. Am J Respir Cell Mol Biol 1991;4:525–31.
11. De Graaft CS, van den Bergh JAHM, de Bree AF, Stallaert RALM, Prins J, van Lier AA. A double blind clinical comparison of budesonide and beclomethasone dipropionate (BDP) given as dry powder formulations in asthma. Eur Respir J 1992;5(Suppl 15):359s.
12. Evans PM, O’Connor BJ, Fuller RW, Barnes PJ, Chung KF. Effect of inhaled corticosteroids on peripherial blood eosinophil counts and density profiles in asthma. J Allergy Clin Immunol 1993;91(2):643–50.
13. Fuller RW, Kelsey CR, Cole PJ, Dollery CT, Mac Dermot J. Dexamethasone inhibits the production of thromboxane B-2 and leukotriene B-4 by human alveolar and peritoneal macrophages in culture. Clin Sci 1984;67:653–6.
14. Global Initiative for Asthma. National Institute of Health. National Heart, Lung and Blood Institute. Publ. 95-3659. Bethesda. 1995.
15. Haahtela T, Jarvinen M, Kava T, et al. Effect of reducing or discontinuing inhaled budesonide in patients with mild asthma. N Engl J Med 1994;331(11):700–5.
16. Harding SM. The human pharmacology of fluticasone propionate. Respir Med 1990;84(Suppl A):25–9
17. Janson-Bjerklie S, Fahy J, Geaghan S, Golden J. Disappearance of eosinophils from bronchoalveolar lavage fluid after patient education and high-dose inhaled corticosteroids: a case report. Heart Lung 1993;22(3):235–8.
18. Jeffery PK, Godfrey W, Adelroth E, et al. Effects of treatment on airway inflammation and thickening of basement membrane reticular collagen in asthma. Am Rev Respir Dis 1992;145:890–9.
19. Laitinen LA, Laitinen A, Heino M, Haahtela T. Eosinophilic airway inflammation during exacerbation of asthma and its treatment with inhaled corticosteroid. Am Rev Respir Dis 1991;143:423–7.
20. Laitinen LA, Laitinen A, Haahtela T. Treatment of eosinophilic airway inflammation with inhaled corticosteroid, budesonide, in newly diagnosed asthmatic patients (abstract). Eur Respir J 1991;4(Suppl.14):342S.
21. Lundback B, Alexander M, Day J, et al. Evaluation of fluticasone propionate (500 micrograms day-1) administered either as dry powder via a Diskhaler inhaler or pressurized inhaler and compared with beclomethasone dipropionate (1000 micrograms day-1) administered by pressurized inhaler. Respir Med 1993;87(8):609–20.
22. Selroos O, Halme M. Effect of a volumatic spacer and mouth rinsing on systemic and metered dose inhaler and dry powder inhaler. Thorax 1991;46:891–4.
23. Toogood JH. Complications of topical steroid therapy for asthma. Am Rev Respir Dis 1990;141:89–96.
24. Toogood JH, Lefcoe NM, Haines DSM, et al. Minimum dose requirements of steroid-dependent asthmatic patients for aerosol beclomethasone and oral prednisolone. J Allergy Clin Immunol 1978;61:355–64.
25. Woolcock AJ, Yan K, Salome CM. Effect of therapy on bronchial hyperresponsiveness in the long-term management of asthma. Clin Allergy 1988;18:65.
Полный список использованной литературы имеется в редакции
Глюкокортикостероиды для местного применения в современной стратегии терапии воспалительных дерматозов в педиатрической практике
С.В. БАТЫРШИНА
Казанский государственный медицинский университет, 420012, г. Казань, ул. Бутлерова, д. 49
Батыршина Светлана Васильевна — доктор медицинских наук, профессор кафедры дерматовенерологии, тел. (843) 236-99-92, e-mail: sbkdv@mail.ru
В статье представлена характеристика одной из наиболее востребованных в современной клинической практике для лечения большинства воспалительных дерматозов топических глюкокортикостероидов, обладающих мощным позитивным влиянием на разные звенья патогенеза многих дерматозов и оказывающих свое действие непосредственно в очаге поражения. Указаны варианты их назначения в педиатрической практике, позволяющие снизить или избежать отрицательных эффектов, имеющих место в связи с особенностями строения кожи в раннем возрастном периоде.
Ключевые слова: топические глюкокортикостероиды, механизм действия, классификация, фармакологический ответ, варианты назначения у детей.
S.V. BATYRSHINA
Kazan State Medical University, 49 Butlerov St., Kazan, Russian Federation, 420012
Glucocorticoids for topical application in the modern treatment of inflammatory dermatoses in pediatric practice
Batyrshina S.V. — D. Med. Sc., Professor of the Department of Dermatology and Venerology, tel. (843) 236-99-92, e-mail: sbkdv@mail.ru
The article describes the characteristics of a group of topical corticosteroids which is one of the most popular in modern clinical practice, often used by dermatologists and pediatricians for the treatment of inflammatory dermatoses. It has a strong positive impact on the different links in the pathogenesis of many dermatoses and exerts its effects directly in the lesion. The variants of their prescription in pediatric practice that reduce or eliminate adverse effects connected with the structure of skin in the early age.
Key words: topical glucocorticosteroids, mechanism of action, classification, pharmacological response, options for prescription to children.
Топические глюкокортикостероиды (ТГКС) на современном этапе наиболее часто используемая группа препаратов, включаемая в терапевтические протоколы, формируемые для пациентов с заболеваниями кожи воспалительного неинфекционного характера, в особенности аллергодерматозов, увеличение случаев заболеваемости которыми в последние десятилетия, особенно среди детского населения, продолжается. При этом очень важно, что ТГКС действуют как на раннюю, так и на позднюю фазу аллергического воспаления, способствуют уменьшению вероятности дальнейшей сенсибилизации и смене органов-мишеней атопии. а также препятствуют развитию хронизации болезни. Обладая значимым противовоспалительным, противоаллергическим, сосудосуживающим и противозудным эффектами, они позволяют осуществлять качественный контроль дерматологического статуса с быстрым купированием воспаления и восстановлением нормального дерматологического паспорта пациента в относительно короткие сроки. Это и определило данную группу препаратов как наиболее востребованную, лидирующую с серьезной позицией в дерматологической практике.
Развитие наиболее важных местных биологических эффектов, отмечаемых в результате использования ТГКС, происходит за счет известных их механизмов действия 4:
— механизм противовоспалительного эффекта ТГКС многоплановый, но до настоящего времени все еще недостаточно исследованный на молекулярном уровне. Согласно упрощенной теории, он осуществляется благодаря диффузии свободных кортикостероидов через клеточную мембрану и связыванию их с цитоплазматическими рецепторами, которые транслоцируются в ядро. Комплекс «гормон-рецептор» соединяется с рецепторным участком одной нити ДНК, относящимся к конкретному гену, и активирует транскрипцию данного гена. Специфическая мРНК доставляется из ядра к рибосомам. В результате трансляции РНК на рибосомах синтезируются различные регуляторные белки. Одним из важнейших является липокортин, который ингибирует активность фермента фосфолипазы А2 циклооксигеназы-2 и приводит к угнетению синтеза эйкозаноидов, подавлению синтеза простагландинов, тромбоцитактивирующего фактора и лейкотриенов, играющих ключевую роль в развитии воспалительной реакции. Вместе с тем новейшие исследования показывают, что механизм их действия гораздо более сложен и в нем помимо рецепторов участвуют различные молекулы, передающие сигналы, а также транскрипционные молекулы, например, АР-1, NF-kB и 1-kBx. Кроме того, противовоспалительное действие поддерживается и за счет стабилизации клеточных мембран;
— противоаллергическое действие проявляется в результате подавления синтеза и секреции медиаторов аллергии, дегрануляции тучных клеток, базофилов и эозинофилов;
— иммуносупрессивное действие заключается в индукции апоптоза Т- и В-лимфоцитов, угнетении их пролиферации, снижении продукции антител и ряда цитокинов, супрессии функциональной активности гранулоцитов и макрофагов. Непосредственно иммунодепрессивное воздействие ТКСГ объясняют прежде всего предотвращением миграции лейкоцитов в зону воспаления за счет подавления экспрессии молекул адгезии и транскрипции генов провоспалительных цитокинов с усилением их влияния на экспрессию генов ряда веществ, участвующих в развитии воспаления с подавлением активности прежде всего IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-10, TNF-α, ИНФ-γ;
— антипролиферативное действие выражается в ингибировании синтеза коллагена, мукополисахаридов, снижении миграционной активности клеток, что может быть причиной нежелательной лекарственной реакции, проявляющейся в варианте атрофии кожи.
Упрощенно механизм действия глюкокортикостероидов и их связь с клеточными рецепторами представлен на рис. 1 и 2.
Рисунок 1.
Схема механизма действия глюкокортикостероидов [Snyman J.R., 2006]
Рисунок 2.
Механизм действия ТГКС [4]
Результатом назначения ТГКС является выраженный и длительный ангиоспазм, уменьшение экссудативного компонента, что клинически проявляется в снижении и исчезновении воспалительной реакции, то есть они ослабляют ранние проявления реакции воспаления (отек, расширение капилляров, отложение фибрина, уменьшение активности фагоцитов), влияя и угнетая и поздние ее проявления (отложения коллагена, формирование келоида).
Начало глюкокортикоидной эры связано с открытием в середине 30-х годов 20-го века гормонов коры надпочечников, обладавших противовоспалительным действием, стало настоящей революцией в медицине, сравнимой по значимости с открытием антибиотиков. Прошло немногим более 50 лет с момента присуждения Нобелевской премии Hench, Kendall и Reichstein за внедрение глюкокортикостероидных гормонов в клиническую практику. Основным и наиболее активным глюкокортикоидом, образующимся в организме человека, является гидрокортизон (кортизол), другие, менее активные, представлены кортизоном, кортикостероном, 11-дезоксикортизолом, 11-дегидрокортикостероном. Первым стероидом, используемым в дерматологической практике в 1952 г., был гидрокортизон. Получены существенные позитивные клинические результаты его использования в дерматологической практике, которые в дальнейшем благодаря модификации структуры как самого стероидного кольца гидрокортизона, так и боковых его цепей путем введения атомов фтора или хлора (галогенов), позволили значительно повысить активность наружных стероидов, используемых в современном этапе (рис. 3.)
Рисунок 3.
Базовая модель стероида и основные модификации структуры топических ГКС [1, 2, 6]
В настоящее время имеется несколько классификаций, в соответствии с которыми кортикостероиды для наружного применения подразделяются на различные группы и классы. Прежде всего они делятся на: аналоги естественных гормонов (Кортизон, Гидрокортизон (кортизол); синтезированные аналоги (Преднизолон) и их производные (галогенизированные, фторированные). Из нефторированных ТГКС для наружного применения имеются Гидрокортизона ацетат (Акортин, Гидрокортизоновая мазь, Гидрокортизон никомед, Гидрокорт, Кортейд), Гидрокортизона бутират (Локоид), Преднизолон (Преднизолоновая мазь), производные преднизолона: мометазона фуроат, мазипредон, метилпреднизолона ацепонат (Элоком, Деперзолон, Адвантан). Из числа фторированных ГКС: Дексаметазон (Эсперзон), Бетаметазон (Целестодерм, Бетновейт, Кутерид, Белодерм, Валодерм, Дипролен, Персиват), Флуцинолон (Синалар, Синафлан, Синодерм, Флуцинар, Флукорт, Эзацион), Флуметазон (Локакортен, Лоринден, Флувейт), Флутиказон (Кутивейт), Триамцинолон (Кеналог, Полькортолон, Фторокорт, Триакорт), Клобетазол (Дермовейт).
Классификация активности топических стероидов может основываться на данных вазоконстрикторного теста, который оценивает степень сужения кожных сосудов («эффект побледнения») у здоровых людей. Определено 7 групп активности топических кортикостероидов, согласно которой они располагаются от ультравысокой (группа 1) до низкой активности (группа 7).
Наиболее востребованной является Европейская классификация, основанная на клинической эффективности ТГКС, согласно которой они распределяются на 4 класса: слабые, умеренные, сильные и очень сильные, представленные в таблице 1 [1].
Таблица 1.
Европейская классификация топических ГКС в зависимости от силы действия [1]
| Препарат | Торговое название, форма выпуска | Фирма-производитель | |
| Класс I (cлабый) | |||
| Гидрокортизона ацетат | Гидрокортизоновая мазь (мазь 1%) | Акрихин, «Нижфарм», Россия | |
| Гидрокортизон | Хайтон (мазь 3,5%, крем 1 и 2,5%, лосьон 1 и 2,5%) | Aventis, США — Франция — Германия | |
| Мазипредона гидрохлорид | Деперзолон (мазь эмульсионная 0,25%) | Gedeon Richter, Венгрия | |
| Преднизолон | Преднизолон (мазь 0,5%) | Jelfa, Польша | |
| Преднизолоновая мазь (мазь 0,5%) | Акрихин, «Нижфарм», Россия | ||
| Класс II (умеренный) | |||
| Флуметазона пивалат | Локакортен (мазь 0,02%) | Novartis, Швейцария | |
| Флуокортолон | Ультралан (мазь 0,5%) | Schering, Германия | |
| Предникарбат | Дерматоп (крем и мазь 0,25%) | Aventis, США, Франц, Германия | |
| Алклометазона дипропионат | Афлодерм (крем, мазь 0,05%) | Belupo, Хорватия | |
| Класс III (сильный) | |||
| Бетаметазона валерат | Бетновейт (крем и мазь 0,1%) | GlaxoSmithKline, Великобритания | |
| Целестодерм-В (крем и мазь 0,1%) | Schering-Plough, США | ||
| Бетаметазона дипропионат | Белодерм (крем и мазь 0,05%) | Belupo, Хорватия | |
| Будезонид | Апулеин (крем и мазь 0,025%) | Gedeon Richter, Венгрия | |
| Галометазона моногидрат | Сикортен (крем и мазь 0,05%) | Novartis, Швейцария | |
| Гидрокортизона 17-бутират | Латикорт (крем, мазь и лосьон 0,1%) | Jelfa, Польша | |
| Локоид (крем, мазь, липокрем, крело 0,1%) | Astellas Pharma Europe B.V., Нидерланды | ||
| Метилпреднизолона ацепонат | Адвантан (крем, мазь, жирная мазь, эмульсия 0,1%) | Schering, Германия | |
| Мометазона фуроат | Элоком (крем, мазь, лосьон 0,1%) | Schering-Plough, США | |
| Триамцинолона ацетонид | Кеналог (крем, мазь 0,1%) | Bristol-Myers Squibb, США | |
| Фторокорт (мазь 0,1%) | Gedeon Richter, Венгрия | ||
| Полькортолон (крем, мазь 0,1%) | Jelfa, Польша | ||
| Флуоциналона ацетонид | Флуцинар (мазь, гель 0,025%) | Jelfa, Польша | |
| Синафлан (мазь 0,025%) | Jelfa, Польша | ||
| Синалар (крем, мазь, гель 0,025%) | Astra-Zeneca, Швеция — Великобритания | ||
| Флутиказона пропионат | Кутивейт (крем 0,05%, мазь 0,005%) | GlaxoSmithKline, Великобритания | |
| Класс IV (очень сильный) | |||
| Клобетазола пропионат | Дермовейт (крем, мазь 0,05%) | GlaxoSmithKline, Великобритания | |
Американская академия дерматологии предпочитает классификацию в обратном порядке от сверхсильного 1-го класса до самого слабоактивного 7-го класса [2].
Следующей вехой в создании и использовании ТГКС стали комбинированные препараты, содержащие глюкокортикостероид в комбинации с антибиотиками, антисептиками или антимикотиками, удобные для назначения при осложненных вариантах дерматитов, обусловленных убиквитарного характера инфекциями, количество которых нарастает из года в год, определяя сложности стратегий терапии, представленные в табл. 2-5.
Таблица 2.
Препараты, содержащие ГКС и антибиотики
| Бетаметазон + гентамицин | Целестодерм-В с гарамицином Кутерид Г |
| Флуоцинолон + неомицин | Синалар Н Флукорт-Н |
| Гидрокортизон + хлорамфеникол | Кортомицетин |
| Гидрокортизон + окситетрациклин | Геокортон Оксикорт |
| Преднизолон + окситетрациклин | Оксициклозоль |
| Триамцинолон + тетрациклин | Полькортолон |
| Гидрокортизона ацетат + фузидиевая кислота | Фуцидин Г |
| Бетаметазон + фузидиевая кислота | Фуцикорт |
Таблица 3.
Препараты, содержащие ГКС и антисептики
| Гидрокортизон + хлоргексидин | Сибикорт |
| Галометазон + триклозан | Сикортен Плюс |
| Флуметазон + клиохинол | Лоринден С |
| Флуоцинолон + клиохинол | Синалар К Флукорт Ц |
| Преднизолон + клиохинол | Дермозолон |
Таблица 4.
Препараты, содержащие ГКС и противогрибковые средства
| Бетаметазон + клотримазол | Лотридерм |
| Беклометазон + клотримазол | Кандид Б |
| Мазипредон + миконазол | Микозолон |
| Дифлукортолон + изоконазол | Травокорт |
Таблица 5.
Препараты, содержащие ГКС, противомикробные и противогрибковые средства
| Бетаметазон + гентамицин + клотримазол | Тридерм |
| Гидрокортизон + неомицин + натамицин | Пимафукорт |
| Гидрокортизон +клиохинол + нистатин | Нистаформ |
Эффективность наружных дерматологических средств вообще и ТГКС в частности зависит от многих причин и прежде всего от скорости их проникновения в эпидермис и дерму. Топические ГКС могут проникать в кожу двумя путями: непосредственно через эпидермис или же через открытые волосяные фолликулы, сальные и потовые железы. Основным путем проникновения ТГКС является трансэпидермальный. Проникновение ТГКС через кожу зависит от шести основных факторов: места нанесения препарата, возраста пациента, свойств активных компонентов, основы препарата, метода его наложения, стадии заболевания (состояния кожи).
Фармакологический ответ на ТГКС определяется четырьмя главными переменными [7]:
Высокая чувствительность характерна для сгибов и других крупных складок, а также паховой области, где проникновение препарата происходит в десятки раз быстрее, чем через кожу предплечья.
Таблица 6.
Всасываемость наружных средств на разных участках кожи [8]
| Участок | Всасываемость |
| Подошва | 0,14 |
| Ладони | 0,83 |
| Предплечье | 1,0 |
| Спина | 1,7 |
| Волосистая часть головы | 3,5 |
| Лицо | 13 |
| Веки | 42 |
Как известно, всасываемость препаратов различна у детей и взрослых. У детей имеются свои особенности строения кожи, которые не могут игнорироваться. Они заключаются в ее малой толщине, не вполне сформированном липидном барьере, быстром обновлении клеток эпидермиса, нейтральной или слабощелочной среде (pH варьирует от 6,1 до 6,7), активных митотических процессах в базальном и шиповатом слоях, недостаточном развитии коллагеновых и эластиновых волокон, рыхлости расположения ороговевающих клеток, обильной васкуляризации дермы, функциональной незрелости нервно-рецепторного аппарата, возможности отсутствия зернистого и блестящего слоев, а также большего соотношения площади кожи к массе тела у пациентов раннего возраста, что предполагает и более деликатного отношения к ней.
Терапевтическому успеху способствует не только правильно подобранный препарат, но и его лекарственная форма в зависимости от стадии воспаления, что определяет глубину проникновения препарата в кожу (рис. 4, 5). Степень этого проникновения максимальна при применении ТГКС в форме мази, значительно меньше в форме крема и совсем незначительна в форме раствора (лосьона). Сухая кожа малодоступна для проникновения наружного кортикостероида, но мацерация и увлажнение рогового слоя эпидермиса мазевой основой в несколько раз увеличивают проницаемость кожи. Поэтому при хронических дерматозах, сопровождающихся сухостью, шелушением, лихенизацией, целесообразнее применять мази и жирные мази. При острых процессах с отеком, везикуляцией, мокнутием предпочтение отдается лосьонам, аэрозолям, крело, кремам и липокремам.
Рисунок 4.
Рациональный алгоритм назначения ТГКС
Рисунок 5.
Проникающая способность ТГКС в зависимости от лекарственной формы
Основа лекарственного средства, как правило, выбирается в зависимости от топики воспалительного процесса. На волосистую часть головы, лицо, складки желательно наносить лосьоны, аэрозоли, гели и кремы, не содержащие жировой основы. При сильно инфильтрированных процессах увеличение концентрации и глубины проникновения препарата в кожу можно достигнуть путем нанесения КС в виде компресса (под окклюзионную повязку).
Рисунок 6.
Выбор основы лекарственного средства в зависимости от локализации и особенностей кожи [9]
Наличие значительного количества ТГКС с усиленной местной активностью и их широкое внедрение в практику привело также и к накоплению достаточного количества данных о побочных эффектах топической стероидной терапии, что в какой-то период поубавило энтузиазма в отношении этих лекарств. Готовые лекарственные формы стали рекомендовать к назначению лишь в случае их разбавления в различных соотношениях от 1:10 до 1:1, что в последнее время категорически отрицается. Кроме того, начинать наружную терапию рекомендовали ранее со слабых ТГКС, что в дальнейшем утратило свою силу. Из ставших традиционными технологиями использования ТГКС следует указать на: тандем-терапию (чередование ТГКС с индифферентными средствами), ступенчатое лечение различных зон, штриховой метод нанесения и использование методом примочки по Мещерскому.
Одним из эффективных алгоритмов назначения ТГКС считается степ-даун терапия, определяемая как терапия на понижение, которая подразумевает короткий мощный старт с использованием высокоактивных препаратов с переходом на интермитирующие методики его назначения по достижении эффекта (стадии стабилизации), после чего использованием их из класса менее сильных до перехода в состояние ремиссии. Удержание эффекта осуществляют продолжением топической терапии корнеопротекторами, которую называют как адьювантной, дополнительной терапией. Такой терапевтический алгоритм позволяет значимо повысить эффективность терапии и уменьшить число нежелательных побочных явлений, которые могут наблюдаться в результате назначения ТГКС.
С целью стандартизации количества нанесенного препарата на пораженный участок кожи было предложено его дозировать, что позволит избежать ситуаций, при которых лечение может оказаться неэффективным в результате использования слишком малых доз препарата либо привести к развитию побочных эффектов при избыточном его нанесении. За одну единицу принимают количество препарата, нанесенное на концевую фалангу указательного пальца (ЕКП) взрослого человека, что составляет 0,5 г мази или крема (рис. 7). Нанесение ТГКС производится из расчета количества единиц в зависимости от локализации поражения: на лицо и шею; одну руку и кисть; одну ногу и стопу; туловище спереди; туловище сзади, включая ягодицы, для ребенка 3-6 месяцев рекомендуется 1; 1; 1,5; 1 и 1,5 ЕКП соответственно. В возрасте 1-2 года — 1,5; 1,5; 2; 2; 3; от 3 до 5 лет — 1,5; 2; 3; 3 и 3,5; от 6 до 10 — 2; 2,5; 4,5; 3,5; 5 ЕПК соответственно. Старше 10 лет ЕКП на лицо и шею, одну руку, одну кисть, одну ногу, одну стопу, туловище спереди; туловище сзади, соответственно, составит: 2,5; 3; 1; 6; 2; 7 и 7 ЕПК.
Рисунок 7. Дозировка препарата: 1 единица (концевая фаланга указательного пальца взрослого человека) = 0,5 г мази или крема при размере выходного отверстия тубы 5 мм
К сожалению, самые активные препараты потенциально продолжают оставаться наиболее опасными с точки зрения развития осложнений. Из побочных эффектов назначения топических ГКС могут регистрироваться: атрофия кожи (стрии, сглаженность фолликулярного рисунка); телеангиоэктазии; задержка регенерации; активация вирусной, бактериальной, грибковой инфекций; периоральный/периорбитальный дерматит, розацеоподобный дерматит; изменение функции сальных желез (стероидные угри); нарушение трофики кожи; гипертрихоз; реактивный дерматит, обусловленный «синдромом отмены»; замедление репаративных процессов; тахифилаксия (привыкание) и так называемый «эффект отдачи» или «рикошет-синдром» [5, 9]. При длительном применении высокоактивных глюкокортикостероидов на обширные поверхности кожи, в особенности у маленьких детей, может развиться и нежелательное системное действие. Вместе с тем при тщательном следовании правилам и режимам назначения ТГКС развитие вышеуказанных нежелательных явлений в результате их использования можно свести к минимуму.
В заключение следует отметить, что группа топических глюкокортикостероидных препаратов на настоящее время продолжает быть основной в терапии большого числа дерматозов, воспалительного генеза, в силу своей высокой эффективности, возможности качественного управления дерматологическим здоровьем, быстрого восстановления качества жизни пациентов и приверженности лечению. Вместе с тем разработки комплаентных методов терапии ими продолжают быть актуальными.
1. Camarasa J.G., Gimenez-Arnau A. Глюкокортикоиды местные / В кн.: Европейское руководство по лечению дерматологических заболеваний / Под ред. А.Д. Кацамбаса, Т.М. Лотти. — М.: МЕДпресс-информ. — 2009. — С. 638-651.
2. Дерматология Фицпатрика в клинической практике: В 3 т. / К. Вольф, Л.А. Голдсмит, С.И. Кац и др.; пер с анг. / Под ред. А.А. Кубановой. — М.: Изд-во Панфилова «Бином». — 2013. — Т. 3. — С. 2291-2296.
3. Brazzini B., Pimpineli N. New and established corticosteroids in dermatology // Am. J. Clin. Dermatol. — 2002. — Vol. 3. — P. 47-49.
4. Carrol C.L., Balkrishnan R., Feldman S.R. et al. The burden of atopic dermatitis: impact on the patients, family and society // Pediatr. Dermatol. — 2005. — Vol. 22 (3). — Р. 192-199.
5. Короткий Н.Г., Куликова О.Д., Петрунин Д.Д. Дифференцированный подход к назначению комбинированных топических стероидов — минимизация риска нежелательных лекарственных реакций // Consilium medicum. — 2009. — 3. — C. 3-6.
6. Middleton E., Reed C., Ellis E. Allergy: Principles and Practice. — St. Louis: Mosby. — 1978. — 321 p.
7. Кочергин Н.Г., Смирнова Л.М., Траксель Л.В. Выбор наружного стероидного средства — где истина? // Клиническая дерматология и венерология. — 2003. — № 3. — С. 74-79.
8. Белоусова Т.А., Горячкина М.В. Место наружной кортикостероидной терапии в практике врача-дерматолога // Consilium medicum. — 2009. — № 1. — C. 3-6.
9. Ревякина В.А. Атопический дерматит у детей: современные возможности применения новых форм наружных противовоспалительных средств / Фарматека. Спец. вып.: Аллергология/Дерматология. — 2013. — С. 35-39.
2. Vol’f K., Goldsmit L.A., Kats S.I. et al. Dermatologiya Fitspatrika v klinicheskoy praktike [Dermatology in clinical practice: In 3 vol.]. Moscow: Izd-vo Panfilova “Binom”, 2013. Vol. 3. Pp. 2291-2296.
3. Brazzini B., Pimpineli N. New and established corticosteroids in dermatology. Am. J. Clin. Dermatol., 2002, vol. 3, pp. 47-49.
4. Carrol C.L., Balkrishnan R., Feldman S.R. et al. The burden of atopic dermatitis: impact on the patients, family and society. Pediatr. Dermatol., 2005, vol. 22 (3), rr. 192-199.
5. Korotkiy N.G., Kulikova O.D., Petrunin D.D. Differentiated approach to the appointment of combined topical steroids — minimizing the risk of adverse drug reactions. Consilium medicum, 2009, 3, pp. 3-6 (in Russ.).
6. Middleton E., Reed C., Ellis E. Allergy: Principles and Practice. St. Louis: Mosby. 1978. 321 p.








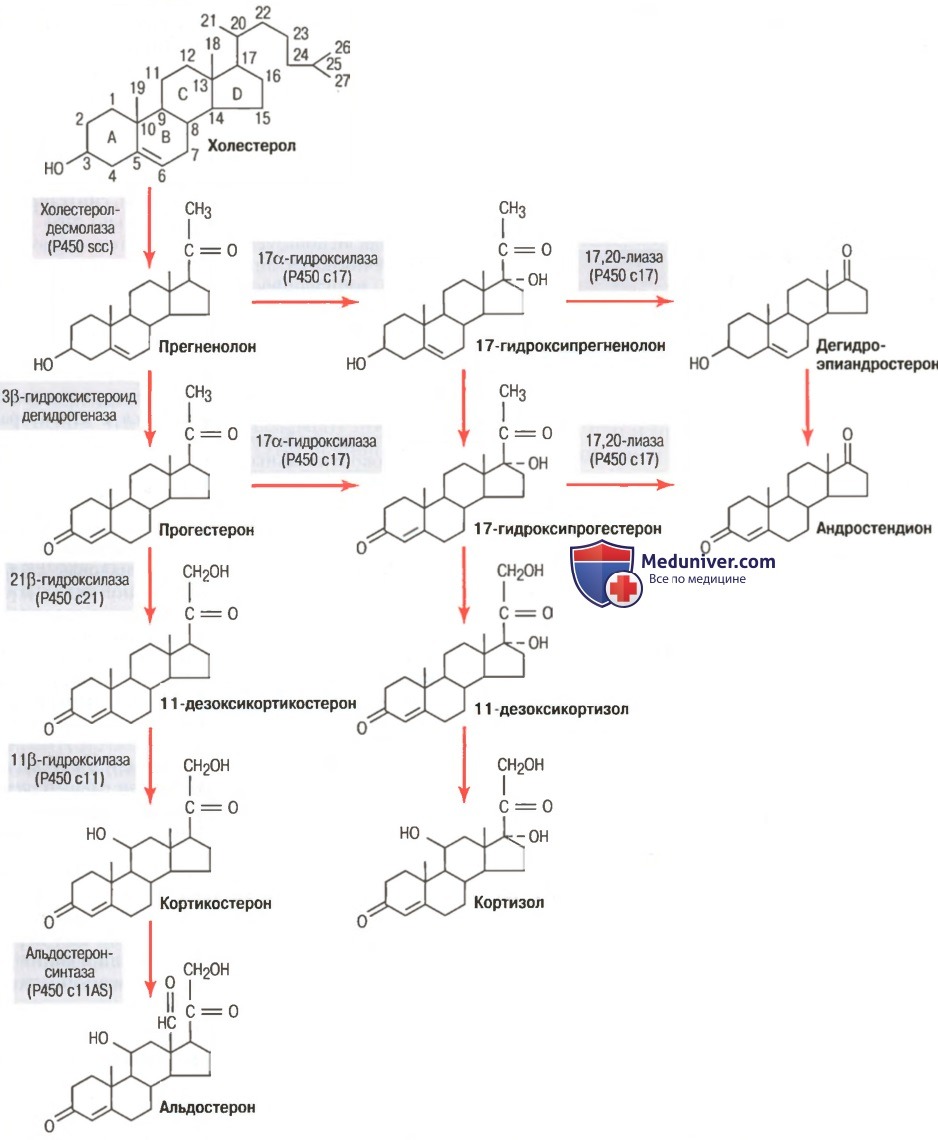 Пути синтеза стероидных гормонов коры надпочечников. Ферменты выделены серым фоном
Пути синтеза стероидных гормонов коры надпочечников. Ферменты выделены серым фоном