Трансплантация костного мозга как происходит
Трансплантация костного мозга как происходит
Трансплантация костного мозга и стволовых клеток
Общие принципы
ОБЩАЯ ИНФОРМАЦИЯ О СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТКАХ
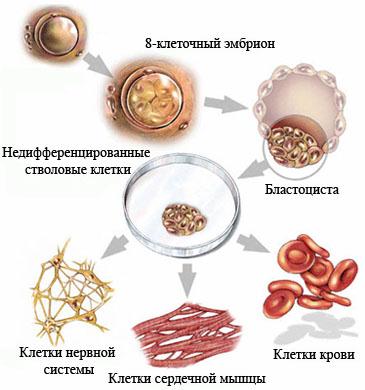
Недифференцированная стволовая клетка, происходящая из бластоцисты, является родоначальницей всех клеток организма, в том числе и стволовой кроветворной клетки (СКК).
Основными свойствами стволовой кроветворной клетки являются возможность дифференцироваться в направлении любого из ростков кроветворения и способность к самоподдержанию.
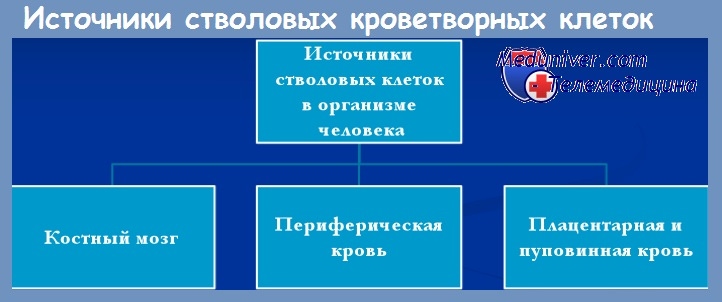
 Колонии стволовых кроветворных клеток (электронная микроскопия) |  Мононуклеарная фракция, обогащенная клетками CD34, окрашена по Маю-Грюнвальду с докраской по Гимзе. Стволовые клетки, несущие маркер CD34, внешне напоминают малые и средние лимфоциты. |
ИСТОРИЧЕСКАЯ СПРАВКА
Первые работы, посвященные терапевтическому использованию костного мозга, были выполнены в последней декаде XIX века, независимо друг от друга Brown-Sequard, d»Arsonval, Fraser, Billings и Hamilton, которые применяли экстракт костного мозга животных для лечения больных различными видами анемий. Несмотря на положительный эффект, отмеченный всеми авторами, в течение последующих пятидесяти лет использование данной методики носило спорадический характер и не выходило за рамки клинического эксперимента до 1937 года когда Schretzenmayr впервые произвел парентеральное (внутримышечное) введение костного мозга, а в 1939 году Osgood выполнил первое внутривенное введение костного мозга.
Результаты экспериментальных исследований привели клиницистов к идее использования ТКМ при заболеваниях, связанных с поражением костного мозга (лейкозы, апластическая анемия), а также при радиационных воздействиях и проведении химиотерапии, однако основные теоретические и практические проблемы проведения ТКМ удалось преодолеть в 60-е годы. С этого времени ТКМ является одним из методов лечения различных заболеваний крови и иммунной системы.
ВИДЫ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
Разновидностью АллоТКМ является сингенная ТКМ (трансплантация от однояйцевого близнеца).
ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
С развитием появлением колониестимулирующих факторов и развитием технологий клеточной сепарации с 70-х годов для получения гемопоэтических клеток крови вмести костного мозга стали использовать стволовые клетки периферической крови.
Применение клеточных сепараторов значительно упростило проведение процедуры получения стволовых клеток крови, уменьшило число осложнений связанных с дачей наркоза и травматическим повреждения костной ткани.
Еще одним потенциальным источником СКК является пуповинная кровь, основным преимуществом которой является меньшая иммуногенность, однако малое количество стволовых клеток в материале ограничивает ее применение и используется преимущественно в педиатрии или у пациентов с массой тела до 50 кг.
Методика проведения миелотрансплантации различается в зависимости от ее вида (аллогенная или аутологичная), нозологической формы заболевания и ряда других факторов.
ПРАКТИЧЕСКИЕ АСПЕКТЫ МИЕЛОТРАНСПЛАНТАЦИИ
ОПРЕДЕЛЕНИЕ ПОКАЗАНИЙ И ПРОТИВОПОКАЗАНИЙ
Наиболее частыми показаниями к ТКМ/ТСКК являются онкогематологические и гематологические заболевания (лейкозы, злокачественные лимфомы, апластическая анемия, врожденные иммунодефициты и нарушения метаболизма).
Чаше всего ТКМ или ТСКК проводится во время полной ремиссии (ПР), частичной ремиссии (ЧР) или при рецидиве опухоли, чувствительном к химиотерапии. При первичной резистентности к цитостатической терапии результаты ТКМ резко ухудшаются, поэтому в этих случаях операция выполняется относительно редко.
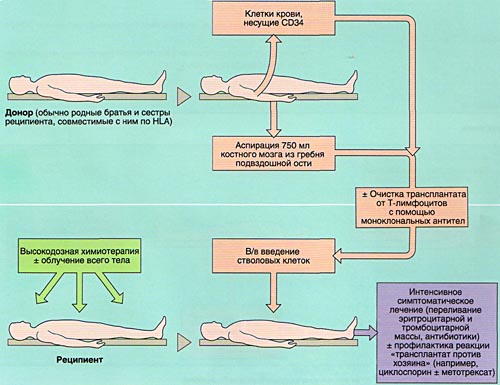
ВЫБОР ДОНОРА
Совместимость костного мозга определяет результаты АллоТКМ. Родственными донорами считаются совместимые по системе HLA братья или сестры реципиента (сибсы). Родители и дети гаплоидентичны (имеют одну общую хромосому из каждой пары, т. е. совпадают между собой на 50%) и не могут быть донорами аллогенного костного мозга. Совместимые сибсы имеются лишь у 20-25% больных, в связи с чем в последние 10 лет активно внедряется АллоТКМ от неродственных HLA-идентичных доноров или частично совместимых родственных доноров.
МОБИЛИЗАЦИЯ, ОБРАБОТКА И ИНФУЗИЯ СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТОК
 А) |  Б) |
А) специальный сосуд (дюар) с жидким азотом для транспортировки контейнеров с костным мозгом
Б) извлеченный из сосуда контейнер с костным мозгом
Инфузия аллогенного, размороженного аутологичного костного мозга или СКК периферической крови проводится внутривенно, капельно после предварительного введения антигистаминных препаратов для предотвращения аллергических реакций.
ИММУНОСУПРЕССИВНАЯ ТЕРАПИЯ (КОНДИЦИОНИРОВАНИЕ)
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ПЕРИОДА ЦИТОПЕНИИ
Вскоре после окончания кондиционирования и введения СКК у больного развивается аплазия костного мозга (период отсутствия костного мозгового кроветворения), которая проявляется практически полным отсутствием клеток крови (панцитопенией) и продолжается в среднем 4 недели. Этот период опасен развитием тяжелых осложнений (инфекции, кровоточивость и т.д.).
Основную опасность в периоде цитопении представляют инфекционные осложнения, поэтому их профилактика, своевременное и адекватное лечение являются необходимым условием успешной ТКМ.
Также по показаниям проводится переливание компонентов крови (эритроцитарная масса, тромбомасса, плазма).
Трансплантация костного мозга и стволовых клеток периферической крови
Основные положения
Что такое костный мозг и гемопоэтические стволовые клетки?
Костный мозг – это мягкое губчатое вещество, находящееся внутри костей. Костный мозг содержит незрелые клетки, которые называются гемопоэтическими или кровеобразующими стволовыми клетками. Гемопоэтические стволовые клетки отличаются от эмбриональных стволовых клеток. Эмбриональные стволовые клетки могут давать начало любым клеткам организма, а гемопоэтические стволовые клетки – только клеткам крови.
Гемопоэтические стволовые клетки способны делиться или дифференцироваться в один из трех видов клеток крови: лейкоциты, защищающие организм от инфекций; эритроциты, доставляющие клеткам организма кислород; или тромбоциты, принимающие участие в свертывании крови. Основная часть гемопоэтических стволовых клеток находится в костном мозге, но некоторые клетки, которые называются стволовыми клетками периферической крови, находятся в кровяном русле. Кроме того, гемопоэтические стволовые клетки содержатся в пуповинной крови. Для трансплантации можно использовать клетки из всех этих источников.
Что такое трансплантация костного мозга и трансплантация стволовых клеток периферической крови?
Трансплантация костного мозга и трансплантация стволовых клеток периферической крови – это процедуры, с помощью которых в организме пациента восстанавливают стволовые клетки, разрушенные высокими дозами химиотерапии и/или лучевой терапии. Существует три вида трансплантации:
Зачем при лечении рака применяется трансплантация костного мозга и трансплантация стволовых клеток периферической крови?
Трансплантация костного мозга и трансплантация стволовых клеток периферической крови применяются в лечении рака, потому что это дает возможность использовать высокие дозы химиотерапии и/или лучевой терапии. Чтобы лучше понять, зачем при лечении рака используют трансплантацию костного мозга и трансплантацию стволовых клеток периферической крови, нужно иметь представление о том, как действуют химиотерапия и лучевая терапия.
Химиотерапия и лучевая терапия в основном воздействуют на клетки, которые быстро делятся. Эти методы используются для лечения рака, потому что раковые клетки делятся чаще, чем большинство здоровых клеток. Но так как клетки костного мозга тоже часто делятся, высокие дозы химиопрепаратов и лучевой терапии могут серьезно повредить или вообще разрушить костный мозг пациента. А без здорового костного мозга организм не способен вырабатывать клетки крови, необходимые для доставки кислорода, защиты от инфекций и предотвращения кровотечений. При трансплантации костного мозга и трансплантации стволовых клеток периферической крови стволовые клетки крови пациента, разрушенные в процессе лечения, замещаются здоровыми. Таким образом, пересадка здоровых стволовых клеток позволяет восстановить способность костного мозга вырабатывать клетки крови, необходимые пациенту.
При некоторых формах лейкоза основным фактором, определяющим эффективность лечения, становится реакция «трансплантат против опухоли», которая развивается после аллогенной трансплантации костного мозга и стволовых клеток периферической крови. Это осложнение возникает, когда лейкоциты донора (трансплантат) признают раковые клетки, которые остаются в организме пациента после химиотерапии и/или лучевой терапии (опухоль) чужими и начинают их атаковать. (Это осложнение аллогенной трансплантации, которое называется «трансплантат против хозяина»).
При каких видах рака применяется трансплантация костного мозга и трансплантация стволовых клеток периферической крови?
Трансплантация костного мозга и трансплантация стволовых клеток периферической крови чаще всего применяются для лечения лейкоза и лимфомы. Причем, они наиболее эффективны, когда лейкоз или лимфома находятся в стадии ремиссии (симптомы рака отсутствуют). Кроме того, трансплантация костного мозга и трансплантация стволовых клеток периферической крови применяются при лечении других видов рака, таких как нейробластома (этот вид рак возникает в незрелых нервных клетках и чаще всего поражает младенцев и детей) и множественная миелома. Проводятся клинические исследования для изучения эффективности трансплантации костного мозга и трансплантации стволовых клеток периферической крови при лечении других типов рака.
Как подбираются донорские стволовые клетки при аллогенной и сингенной трансплантации?
Чтобы свести к минимуму возможные побочные эффекты, врачи стремятся использовать для трансплантации стволовые клетки, как можно более совместимые с собственными стволовыми клетками пациента. У каждого человека на поверхности клеток имеется индивидуальный набор белков – антигены тканевой совместимости (синоним – антигены главного комплекса гистосовместимости, или HLA-антигены). Этот набор белков можно определить с помощью специального анализа крови.
В большинстве случаев успех аллогенной трансплантации зависит от того, насколько HLA-антигены стволовых клеток донора совместимы с HLA-антигенами стволовых клеток пациента. Чем больше совместимых HLA-антигенов, тем больше вероятность, что организм пациента не отторгнет пересаженные стволовые клетки донора. Если стволовые клетки пациента и донора хорошо совместимы, у пациентов реже развивается осложнение, известное как реакция «трансплантат против хозяина».
Вероятность совместимости с пациентом по HLA-антигенам гораздо выше у близких родственников, особенно у братьев и сестер. Но HLA-совместимые брат или сестра имеются только у 25 – 35% пациентов. Шанс получить HLA-совместимые стволовые клетки от неродственного донора несколько выше и составляет около 50%. Среди неродственных доноров HLA-совместимость значительно лучше, когда донор и пациент принадлежат к одной и той же расе и этнической группе. Хотя в целом количество доноров увеличивается, у людей из некоторых этнических и расовых групп меньше шансов найти совместимого донора. Чтобы облегчить поиск подходящего неродственного донора, создаются реестры доноров-добровольцев.
Так как однояйцовые близнецы имеют одинаковые гены, у них одинаковый набор HLA-антигенов. Поэтому организм пациента не отторгнет трансплантат от однояйцового близнеца. Однако однояйцевые близнецы рождаются нечасто, и сингенная трансплантация проводится редко.
Как получают костный мозг для трансплантации?
Стволовые клетки, используемые для трансплантации, берутся из костного мозга (губчатой ткани, которая находится внутри крупных костей). Процедура получения костного мозга, которая называется «забор костного мозга», одинакова для всех типов трансплантации (аутогенной, сингенной и алогенной). Она проводится в операционной под общей анестезией (т.е. донор во время процедуры спит). Возможно использование спинномозговой (перидуральной) анестезии, которая вызывает потерю чувствительности ниже пояса. Игла прокалывает кожу и вводится в тазобедренную кость, (в редких случаях – в грудину), и костный мозг всасывается в шприц. Вся процедура занимает около часа.
Затем полученный костный мозг обрабатывают, чтобы удалить кровь и фрагменты кости. Если трансплантация не проводится немедленно, в полученный костный мозг добавляется консервант, и он замораживается, чтобы сохранить стволовые клетки до тех пор, пока они понадобятся. Эта методика называется криоконсервированием. Стволовые клетки могут храниться замороженными в течение многих лет.
Как получают стволовые клетки периферической крови для трансплантации?
Стволовые клетки периферической крови, используемые для трансплантации, получают из кровяного русла. Эта процедура называется аферез или лейкаферез. За 4 – 5 дней до афереза донору дают препарат, который увеличивает количество стволовых клеток, выделяемых в кровяное русло. При аферезе кровь забирают из вены на руке или через центральный венозный катетер. Кровь проходит через аппарат, который отбирает стволовые клетки. Затем кровь возвращается к донору, а отобранные стволовые клетки сохраняются. Аферез обычно продолжается 4 – 6 часов. Затем стволовые клетки замораживаются, пока их не введут пациенту.
Как получают стволовые клетки из пуповины для трансплантации?
Стволовые клетки также можно получить из пуповинной крови. Для этого мать должна до рождения ребенка связаться с банком пуповинной крови. Банк пуповинной крови может запросить, чтобы она заполнила анкету и предоставила пробу крови.
Банки пуповинной крови бывают общественные и коммерческие. Общественные банки пуповинной крови принимают пуповинную кровь и предоставляют стволовые клетки другим совместимым лицам в своей сети. В отличие от них, коммерческие банки пуповинной крови хранят пуповинную кровь только для данной семьи до того, как она понадобится ребенку или другому члену семьи.
После рождения ребенка и разрезания пуповины кровь со стволовыми клетками извлекается из пуповины и плаценты. Эта процедура не опасна для матери и ребенка. Если мать согласна, пуповинная кровь обрабатывается и замораживается для хранения в банке пуповинной крови. Из пуповины и плаценты можно получить только небольшое количество крови, поэтому полученные стволовые клетки обычно используются для детей и взрослых некрупного телосложения.
Существует ли риск, связанный со сдачей костного мозга?
Забор костного мозга не представляет проблем для донора, поскольку берется лишь небольшое количество костного мозга. Наибольший риск, связанный с донорством костного мозга – это использование во время процедуры анестезии. В течение нескольких дней возможны болезненные ощущения в месте, из которого забирался костный мозг. Кроме того, донор может ощущать усталость. Через несколько недель организм донора полностью восстанавливает костный мозг. Однако время, необходимое донору для восстановления, индивидуально. Некоторые люди возвращаются к нормальной жизни через 2 – 3 дня, а другим может понадобиться до 3 – 4 недель, чтобы полностью восстановиться.
Существует ли риск, связанный со сдачей стволовых клеток периферической крови?
Аферез доставляет минимальный дискомфорт. Во время проведения афереза человек может почувствовать головокружение, озноб, потерю чувствительности в области губ, судороги в руках. В отличие от забора костного мозга, при сдаче стволовых клеток периферической крови анестезия не требуется. Препарат, который дается донору, чтобы стимулировать выделение стволовых клеток из костного мозга в кровеносное русло, может вызвать боль в костях и мышцах, головную боль, утомляемость, тошноту, рвоту и/или бессонницу. Эти побочные эффекты обычно прекращаются через 2 – 3 дня после приема последней дозы препарата.
Как проходит процедура трансплантации стволовых клеток?
После курса лечения с применением высоких доз химиотерапии и/или лучевой терапии пациент получает стволовые клетки через внутривенный катетер, как при обычном переливании крови. Процедура трансплантации стволовых клеток длится от 1 до 5 часов.
Принимаются ли какие-либо особые меры, если пациент одновременно является донором (аутогенная трансплантация)?
Желательно, чтобы стволовые клетки, используемые для аутогенной трансплантации, содержали минимальное количество раковых клеток. Поэтому перед трансплантацией полученные стволовые клетки иногда очищают, чтобы избавиться от раковых клеток. Процедура очистки сводит к минимуму вероятность возвращения рака. Поскольку очистка может повредить некоторые здоровые стволовые клетки, у пациента забирается большее количество клеток для трансплантации, чтобы после очистки осталось достаточно здоровых клеток.
Что происходит после пересадки стволовых клеток пациенту?
После попадания в кровяное русло стволовые клетки перемещаются в костный мозг и начинают вырабатывать лейкоциты, эритроциты и тромбоциты. Этот процесс называется «приживление». Приживление обычно происходит в течение 2 – 4 недель после трансплантации. Врачи контролируют этот процесс с помощью регулярных анализов крови. Полное восстановление функций иммунной системы занимает намного больше времени – до нескольких месяцев при аутогенной трансплантации и до 1 – 2 лет при аллогенной и сингенной трансплантации. Врачи проводят различные анализы крови, чтобы подтвердить, что новые клетки крови вырабатываются и рак не вернулся. Понять, насколько хорошо работает новый костный мозг, помогает аспирация костного мозга (забор небольшого образца костного мозга для исследования под микроскопом).
Каковы возможные побочные эффекты трансплантации костного мозга и трансплантации стволовых клеток периферической крови?
В обоих случаях основной риск – это повышенная восприимчивость к инфекциям и кровотечения (вследствие предыдущего лечения с применением высоких доз химиотерапии и/или лучевой терапии). Иногда для предотвращения или лечения инфекций назначаются антибиотики. Также возможно переливание тромбоцитарной массы (для профилактики кровотечений) и эритроцитарной массы (для лечения анемии). Кроме того, после трансплантации костного мозга или стволовых клеток периферической крови пациенты в течение непродолжительного времени могут ощущать такие побочные эффекты, как тошнота, рвота, утомляемость, отсутствие аппетита, стоматит, выпадение волос, кожные реакции.
Возможные долгосрочные побочные эффекты включают осложнения от химиотерапии и лучевой терапии, предшествующих трансплантации: бесплодие, катаракта (помутнение хрусталика глаза, приводящее к потере зрения), вторичный рак (метастазы), повреждение печени, почек, легких и/или сердца.
При аллогенной трансплантации иногда развивается осложнение, известное как реакция «трансплантат против хозяина». Это происходит, если лейкоциты донора (трансплантат) принимают клетки пациента (хозяин) как чужие и атакуют их. При этом чаще всего поражается кожа, печень и кишечник. Это осложнение может развиться в течение нескольких недель после трансплантации (острая реакция «трансплантат против хозяина») или намного позже (хроническая реакция «трансплантат против хозяина»). Чтобы предотвратить это осложнение, пациентам могут назначаться препараты, подавляющие иммунную систему. Кроме того, стволовые клетки донора могут подвергнуть специальной обработке, чтобы удалить лейкоциты, которые вызывают реакцию «трансплантат против хозяина». Такая процедура называется «очищение от Т-клеток костного мозга».
Реакция «трансплантат против хозяина» может протекать очень тяжело. В этом случае назначают стероиды и другие препараты, подавляющие иммунитет. Однако некоторые исследования показывают, что если при лейкозе развивается реакция «трансплантат против хозяина», то вероятность того, что рак вернется, низка. В настоящее время проводятся клинические исследования, чтобы найти способы предотвращать и лечить реакцию «трансплантат против хозяина».
Вероятность возникновения и тяжесть осложнений очень индивидуальны и зависят от лечения, назначенного пациенту. Такие вопросы нужно в каждом конкретном случае обсуждать с лечащим врачом.
Что такое «мини-трансплантация»?
Мини-трансплантация, или трансплантация после миелоаблативных (не разрушающих костномозговое кроветворение) режимов – это вид алогенной трансплантации. При мини-трансплантации используют меньшие, не такие токсичные дозы химиотерапии и/или лучевой терапии, чтобы подготовить пациента к аллогенной трансплантации. Такие дозы химиопрепаратов и облучения уничтожают не весь костный мозг пациента, а только некоторую его часть. Кроме того, они уменьшают количество раковых клеток и подавляют иммунную систему пациента, предотвращая отторжение трансплантата.
В отличие от обычной трансплантации костного мозга и трансплантации стволовых клеток периферической крови, после мини-трансплантации в организме пациента некоторое время могут существовать и клетки донора, и клетки пациента. Когда клетки донора начинают приживаться, они могут вызвать реакцию «трансплантат против опухоли» и начать разрушать раковые клетки, которые не были уничтожены с помощью противораковых препаратов и/или лучевой терапии. Чтобы усилить реакцию «трансплантат против опухоли», иногда пациенту делают инъекции лейкоцитов донора. Эта процедура называется «инфузия донорских лейкоцитов».
Что такое «тандемная трансплантация»?
Тандемная трансплантация – это вид аутогенной трансплантации. В настоящее время проводятся клинические исследования для изучения и использования этого метода при лечении некоторых видов рака, включая множественную миелому и герминогенные опухоли. При тандемной трансплантации пациент проходит два последовательных курса высокодозированной химиотерапии с трансплантацией стволовых клеток. Обычно перерыв между двумя курсами составляет несколько недель или месяцев. Исследователи надеются, что этот метод поможет предотвратить рецидивы рака в будущем.
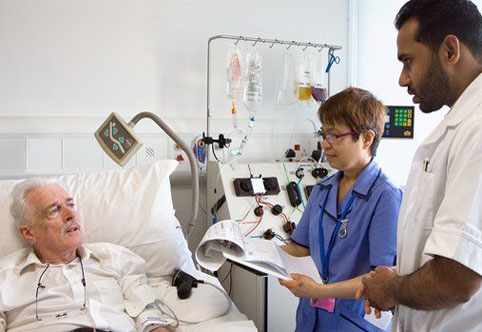
Как проходит трансплантация стволовых клеток
Заведующая онкологическим отделением в клинике Ихилов.
Процесс пересадки стволовых клеток состоит из нескольких этапов. Сущность и последовательность этапов практически не зависят от того, какой тип трансплантации вам назначили.
Обследование и подготовка к трансплантации
Вначале вас обследуют для того, чтобы выяснить, нет ли у вас противопоказаний к трансплантации стволовых клеток. Эта процедура – настоящее испытание для организма. Несмотря на то, что многим людям она помогает победить болезнь, проблемы в ходе процедуры могут привести к тяжелым осложнениям и даже к летальному исходу. Перед началом лечения необходимо взвесить все плюсы и минусы пересадки стволовых клеток.
Трансплантация тяжело переносится и в психологическом плане. Пациенту приходится лежать в больнице в изоляции. Кроме того, вероятность возникновения побочных эффектов очень высока. И, хотя многие из таких побочных эффектов вскоре проходят, некоторые сохраняются на несколько лет. Это значит, что людям приходится менять привычный образ жизни. Иногда такие изменения носят временный характер. В ряде случаев, впрочем, они сохраняются на всю оставшуюся жизнь.
Перед трансплантацией необходимо обсудить весь процесс и все потенциальные побочные эффекты с лечащим врачом. Возможно, вы также захотите пообщаться с теми пациентами, кто уже перенес процедуру по пересадке стволовых клеток. Эффект трансплантации может проявиться спустя недели и месяцы после процедуры. Тяжело жить, не зная о том, как на вас в итоге подействует пройденное лечение. Ожидание отнимает у пациента, его близких и лиц, осуществляющих уход, время и эмоциональные ресурсы. Важно получать поддержку от близких людей. К примеру, вам понадобится помощь ответственного взрослого человека, готового следить за графиком приема лекарств, проверять, не появились ли у вас осложнения, и оставаться на связи со специалистами даже после вашей выписки. Специалисты расскажут вам и человеку, осуществляющему уход за вами, обо всех нюансах лечения и выздоровления. Они также помогут вам преодолеть все трудности и препятствия, возникающие как во время подготовки к лечению, так и во время трансплантации.
Вам назначат различные диагностические процедуры. Врач также задаст вам ряд вопросов для того, чтобы определить, сможете ли вы перенести трансплантацию стволовых клеток. Процесс подготовки обычно состоит из следующих этапов:
Возможно, вам поставят центральный венозный катетер (ЦВК). Он устанавливается в крупную вену в грудной клетке. Катетер ставят в ходе амбулаторной операции, под местной анестезией (врач обезболивает только тот участок, куда вводят катетер). Медсестры используют катетер для того, чтобы брать образцы крови и вводить лекарственные препараты. Если вам предстоит аутологичная трансплантация, вам поставят особый катетер, предназначенный для забора стволовых клеток (афереза). ЦВК остается на месте до тех пор, пока пересаженные стволовые клетки не приживутся, а уровни форменных элементов крови не начнут стабильно подниматься до нормы.
Пригодность к трансплантации
Лучше всего трансплантацию стволовых клеток переносят люди более молодого возраста и пациенты, едва начавшие лечиться. Некоторые трансплантационные центры устанавливают возрастные лимиты. К примеру, традиционную аллогенную трансплантацию (есть несколько видов этой процедуры) нередко предлагают только пациентам младше 50 лет, а аутологичную – пациентам младше 65 лет. Трансплантация стволовых клеток может быть противопоказана при тяжелых заболеваниях сердца, легких, печени или почек. Некоторым из таких пациентов назначают так называемую мини-трансплантацию.
Госпитализация или амбулаторное лечение
Специалисты определят, где вам предстоит лечиться – в стационарном отделении или в амбулаторном центре. Возможно, вам посоветуют ложиться в стационар только на определенные процедуры. Если нужно лечь в стационарное отделение, в больницу следует прийти за день до назначенной трансплантации. Перед так называемым кондиционированием (см. ниже) бригада специалистов должна убедиться в том, что вы и ваши близкие понимаете процесс лечения и согласны на все рекомендуемые процедуры.
Если трансплантация полностью или частично проводится на амбулаторной основе, необходимо подыскать жилье рядом с трансплантационным центром на весь начальный период лечения. Вам потребуется помощь родственника или близкого человека, имеющего возможность круглосуточно находиться рядом с вами. Кроме того, вам обоим понадобится надежный транспорт для того, чтобы посещать клинику. Специалисты трансплантационной бригады будут внимательно следить за вашим состоянием и проверять, не возникли ли у вас осложнения. Соответственно, вам придется посещать клинику каждый день на протяжении нескольких недель. Возможно, вас все-таки положат в стационар в том случае, если ситуация изменится или если у вас возникнут осложнения.
Чтобы снизить риск инфицирования во время лечения, стационарных пациентов кладут в одноместные палаты с особыми воздушными фильтрами. Некоторые палаты оборудованы защитными барьерами, отделяющими их от остальных палат и коридоров. Специальные системы очистки препятствуют проникновению в помещение загрязненного воздуха. Если вы планируете лечиться на амбулаторной основе, вам подробно расскажут о том, как защититься от инфекций.
Вы и ваши близкие должны понимать, чего следует ожидать от лечения. Дело в том, что как только начнется кондиционирование, пути назад не будет. Прерывание трансплантации на любом из ее этапов грозит серьезными осложнениями.
Кондиционирование (химио- и/или лучевая терапия)
Кондиционирование, также известное под названием “подготовка костного мозга” или “миелоабляция”, – это лечение высокими дозами химиотерапевтических препаратов или радиации. Это первый этап трансплантации, который обычно длится 1-2 недели. Кондиционирование преследует одну или несколько целей:
Особенности кондиционирования зависят от ситуации. При планировании лечения специалисты учитывают, каким онкологическим заболеванием вы страдаете, какая трансплантация вам предстоит и какими методами (химиотерапия, облучение) вы лечились в прошлом.
Если план лечения включает химиотерапию, препараты выдадут в форме таблеток и/или введут через центральный венозный катетер. Если планируется лучевая терапия, это значит, что облучать будут все тело (тотальное облучение тела, или ТОТ). ТОТ проводится либо в виде единственной процедуры, либо в виде нескольких сеансов, назначенных на разные дни.
Некоторые побочные эффекты проходят лишь спустя несколько месяцев после начала лечения. Многие пациенты жалуются на то, что у них появились ранки в ротовой полости. При таких побочных эффектах принимают мощные обезболивающие препараты. Некоторые люди также жалуются на тошноту, рвоту, неспособность принимать пищу, выпадение волос и проблемы с легкими или дыханием.
У женщин кондиционирование может вызвать преждевременную менопаузу. Кроме того, многие женщины и мужчины после такого лечения становятся бесплодными (теряют способность иметь детей).
Важнейший день: инфузия стволовых клеток
Пациенту, перенесшему кондиционирование, дают несколько дней на отдых. После этого производится пересадка стволовых клеток. Клетки вводят через центральный венозный катетер. Процедура во многом напоминает переливание крови. Если стволовые клетки замораживались, вам вначале введут дополнительные лекарственные препараты. Эти препараты снизят риск нежелательной реакции вашего организма на консерванты, используемые при заморозке клеток.
Замороженные стволовые клетки вначале размораживают в теплой воде, а затем сразу же вводят в вену пациента. Иногда используют более одного пакета стволовых клеток. В ходе аллогенной или изогенной трансплантации забор донорских клеток производится в операционной, а обработка – в лаборатории сразу же после их извлечения. Стволовые клетки, прошедшие обработку, сразу же вводят в вену пациента – их не замораживают. Длительность пересадки зависит от объема жидкости, в которой находятся стволовые клетки.
Во время процедуры пациент пребывает в сознании. Анестезия не требуется. Это большой шаг, имеющий огромное значение для реципиентов и их близких. Многие люди воспринимают эту процедуру как перерождение или получение шанса на новую жизнь. Иногда день пересадки стволовых клеток празднуют как второй день рождения.
Побочные эффекты инфузии
Побочные эффекты инфузии наблюдаются редко и обычно не представляют опасности. Многие из таких побочных эффектов вызывает консервант, используемый при заморозке стволовых клеток (диметилсульфоксид, или ДМСО). К примеру, во рту может появиться сильный вкус чеснока или кукурузы в сливочном соусе. Справиться с ним помогут сладкие леденцы или ароматизированные напитки, которые можно употреблять как во время инфузии, так и после нее. Специфический запах может окутать все тело. Он нередко доставляет дискомфорт окружающим, однако сами пациенты его, как правило, даже не замечают. Запах и вкус сохраняются на несколько дней, после чего постепенно исчезают. Если помещение пропахло чесноком или кукурузой, можно разложить в нем порезанные апельсины. Пациенты, получившие стволовые клетки, не подвергавшиеся заморозке, не жалуются на эту проблему, так как при обработке стволовые клетки не смешивают с консервантом.
Известны и другие побочные эффекты, которые появляются у некоторых пациентов как во время, так и сразу после трансплантации стволовых клеток. К таким побочным эффектам относятся:
И снова: вышеперечисленные побочные эффекты наблюдаются редко и носят незначительный характер. При появлении любых побочных эффектов пациенту назначают соответствующее лечение. Инфузия стволовых клеток в любом случае должна быть доведена до конца.
Выздоровление после инфузии стволовых клеток
Этап выздоровления начинается сразу же после инфузии стволовых клеток. В этот период пациент и его близкие ждут, пока клетки приживутся. После приживления стволовые клетки начинают делиться и вырабатывать новые кровяные тельца. Длительность периода между трансплантацией и началом стабильного повышения уровней форменных элементов крови зависит от индивидуальных особенностей организма и вида процедуры. Чаще всего, впрочем, пациенты и врачи начинают отмечать изменения через 2-6 недель после пересадки стволовых клеток. Пациенту предстоит либо провести это время в больнице, либо ежедневно посещать трансплантационный центр.
В течение первых двух недель после трансплантации уровни эритроцитов, лейкоцитов и тромбоцитов остаются низкими. Сразу же после процедуры (когда уровни форменных элементов крови достигают крайне низких отметок) пациенту колют антибиотики в целях предотвращения инфекций. Такая антибактериальная терапия называется профилактической. Возможно, вам назначат комбинацию антибактериальных, противогрибковых и антивирусных препаратов. Лекарства следует принимать до тех пор, пока уровень белых кровяных телец не достигнет определенной отметки. Тем не менее, даже несмотря на терапию, у вас могут возникнуть такие осложнения, как инфекция в результате нейтропении (недостатка лейкоцитов) или кровотечение вследствие тромбоцитопении (нехватки тромбоцитов). У многих пациентов сильно повышается температура тела. При тяжелых инфекциях назначают капельницы с антибиотиками. Пока костный мозг не начал функционировать, а пересаженные клетки – вырабатывать новые кровяные тельца, пациентам делают переливания эритроцитов и тромбоцитов.
Не считая болезни “трансплантат против хозяина”, характерной только для аллогенной трансплантации, побочные эффекты аутологичной, аллогенной и изогенной трансплантаций можно считать приблизительно одинаковыми. В число потенциальных проблем входят нарушения со стороны желудка, сердца, легких, печени и почек. Пациенты переживают душевные потрясения, тревогу, уныние, радость и гнев. Людям приходится тяжело не только в физическом, но и в эмоциональном плане, ведь они долгое время чувствуют себя плохо и общаются с минимальным кругом лиц.
Выписка из больницы
Подготовка к возвращению домой
Процесс выписки по факту начинается за несколько недель до пересадки стволовых клеток. Вначале специалисты рассказывают пациенту и лицу, осуществляющему уход, о следующих нюансах:
Какие существуют критерии выписки из больницы
В большинстве случаев трансплантационные центры не выписывают пациентов домой до тех пор, пока они не будут отвечать следующим критериям:
Реабилитация
Процесс трансплантации стволовых клеток не заканчивается на вашей выписке. Многие пациенты жалуются на чувство усталости. Некоторым людям в период реабилитации приходится решать проблемы, связанные с физическим или психическим здоровьем. В связи с этим пациенты по-прежнему принимают много лекарств. После выписки все потребности больного должны удовлетворяться дома, поэтому поддержка со стороны опекуна и друзей/родственников в этот период приобретает особое значение.
Врачи продолжают тщательно следить за состоянием пациентов, перенесших трансплантацию стволовых клеток, даже после их выписки из больницы. Вероятно, вам назначат ежедневные или еженедельные обследования со сдачей анализов крови. Некоторым пациентам требуются дополнительные диагностические процедуры. В начале реабилитации вам, возможно, потребуется переливание крови и тромбоцитов, терапия антибиотиками или лечение иными средствами. Ежедневные посещения специалистов постепенно сменятся более редкими визитами в клинику. Может пройти 6-12 месяцев перед тем, как уровни форменных элементов крови приблизятся к норме, а иммунная система заработает как положено. В этот период врачи все еще будут следить за вашим состоянием.
Некоторые проблемы возникают примерно через год после инфузии стволовых клеток (и даже позже). К таким проблемам относятся:
К прочим потенциальным проблемам относятся:
В период реабилитации вы по-прежнему можете адресовать любые вопросы специалистам из вашей трансплантационной бригады. Они обеспечат необходимую поддержку и помогут вам справиться с любыми трудностями на пути к выздоровлению. Кроме того, специалисты сообщат, насколько ваши проблемы серьезны. Вполне вероятно, что трудности, с которыми вы столкнулись, представляют собой неотъемлемую часть процесса реабилитации.
Трансплантация костного мозга как происходит
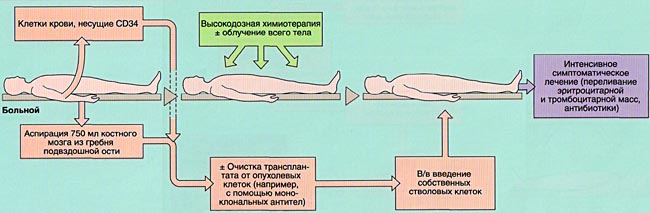
Метод также называют аутотрансплантацией стволовых клеток крови, высокодозной химиотерапией с поддержкой собственными столовыми клетками.
Химиотерапия – лечение препаратами, угнетающими рост опухолевых клеток. При этом очевидно, что чем выше доза препарата, тем лучше эффект, но и риск осложнений тоже значительно выше, т.к. под воздействие химиопрепарата попадают и нормальные клетки. Помимо противоопухолевого эффекта развивается снижение иммунитета, а это риск развития инфекционных осложнений. Решение этой проблемы особенно важно для пациентов с миеломной болезнью и рецидивами лимфом, где за счет повышения дозы лекарства можно вылечить пациента.
Но как сохранить иммунитет?
Ученые знают, что на иммунитет работают много групп клеток, у которых только один предшественник – материнская клетка, или стволовая клетка крови. Стволовые клетки в большинстве своем находятся внутри костей вместе с другими клетками костного мозга. Они живут там как в доме, где их защищают, питают и ухаживают за ними. Немного стволовых клеток циркулируют в крови.
Ученые быстро поняли, что бесполезно переносить в организм отдельные группы иммунных клеток, потому что их некому будет заменить, когда они проживут и проработают свой срок. А вот если ввести в организм стволовые клетки, то это даст возможность иммунитету быстрее прийти в норму и, следовательно, позволит уменьшить число инфекционных осложнений химиотерапии.
Нашли решение в конце 60-х годов, когда научились забирать и хранить стволовые клетки.
Как это делалось и делается? Расскажем об этом в самом общем виде.
Поначалу клетки забирали только напрямую из костного мозга под общим наркозом, делая несколько проколов в подвздошных костях на границе ягодицы и поясницы, отступив от позвоночника в сторону 10-15 см. В этом месте кость очень толстая, отсутствуют крупные нервные волокна, поэтому риск осложнений практически отсутствует. Сама процедура занимает около часа. После нее в течение нескольких дней пациента немного беспокоят умеренные боли, но они позволяют ему жить обычной жизнью. Позже научились брать клетки из крови, когда пациенту ставят в вену гибкую иглу (катетер), подключают специальный аппарат и в течение трех-четырех часов особый прибор «фильтрует» кровь, забирая и тут же возвращая ее. Пациент в это время чувствует себя нормально и может, например, смотреть телевизор, говорить по телефону. Правда, аппарат довольно громоздкий, поэтому трудно, к примеру, дойти до туалета. Процедура безопасна, а взятые из крови стволовые клетки быстро восстанавливаются.
Когда были опубликованы первые результаты нового метода лечения, во многих странах стали открываться трансплантационные центры, и сейчас в мире ежегодно выполняется более 130000 аутоТКМ. Сотни тысяч людей по всему миру полностью вылечились и вернулись к нормальной жизни.
Напомним, что при аутоТКМ основным методом лечения является химиотерапия, а заготовленные заранее стволовые клетки помогают только уменьшить осложнения.
Кого же лечат с помощью аутоТКМ? На решение влияет вид заболевания и состояние пациента. При миеломной болезни, при некоторых лимфомах аутоТКМ делается сразу, чтобы закрепить результат первичной химиотерапии. При агрессивных лимфомах аутоТКМ является основным способом лечения рецидивов. Понятно, что такое лечение может быть опасно, поэтому после 65 лет аутоТКМ, обычно, не назначают. Но важен в данном случае всё-таки не возраст, а общее состояние пациента, и в более старшем возрасте аутоТКМ тоже иногда проводится.
Вероятность полного излечения при лимфомах зависит от того, какая это лимфома, и в общем составляет около 65%. При миеломной болезни выполнение аутоТКМ после первой успешной химиотерапии увеличивает длительность ремиссии вдвое.
Как долго пациент лежит в больнице?
Обычно около трех-четырех недель, из которых две-три недели – это период, когда восстанавливается иммунитет. После аутоТКМ пациенты могут быстро вернуться к повседневной жизни и вести привычный образ жизни.
Проводят ли аутоТКМ в Санкт-Петербурге?
Для жителей Санкт-Петербурга возможно проведение аутоТКМ в городской клинической больнице № 31.
Для всех граждан Российской Федерации возможно проведение аутоКТМ в НИИ детской онкологии, гематологии и трансплантологии им.Р.М.Горбачевой Первого Санкт-Петербургского Государственного медицинского университета им. акад. И.П.Павлова, НИИ онкологии им. Н.Н.Петрова, Северо-Западном медицинском исследовательском центре им. В.А. Алмазова.
НИИ ДОГиТ им. Р.М. Горбачевой ПСПбГМУ им.ак. И.П.Павлова по количеству трансплантаций является ведущим центром в России и входит в первую пятерку в Европе.
Донорство костного мозга: кто, что, где и сколько стоит
Кому и зачем нужна трансплантация костного мозга? Кто может стать донором и чем это обернется для него?
Что такое костный мозг и какой он бывает
Костный мозг – это ткань, которая есть в полых костях скелета. Больше всего костного мозга – 40% – в костях таза, также костный мозг есть в позвонках, костях черепа и немного в ребрах.
Костный мозг бывает красный и желтый. Желтый костный мозг – это просто жировая ткань. Правда, в особых случаях – при ранениях и сильной анемии часть желтого костного мозга может превратиться в красный, чтобы быстрее восполнить кровопотерю. Красный костный мозг – это орган кроветворения: из особых гемопоэтических стволовых клеток, которые находятся в красном костном мозге, образуются разные клетки крови – эритроциты, лимфоциты и тромбоциты.
Когда нужна трансплантация костного мозга
Трансплантация костного мозга (ТКМ) используется, прежде всего, при лечении онкологических заболеваний, таких как лейкозы, поражения лимфатической системы, нейробластома, а также при апластической анемии и ряде наследственных дефектов крови.
Не следует думать, что больному «меняют» его костный мозг на чей-то еще. На самом деле пациент получает внутривенно гемопоэтические стволовые клетки здорового человека, которые восстанавливают способность организма к кроветворению. Эти клетки могут развиваться, превращаясь в эритроциты, лейкоциты и тромбоциты.
В России применять ТКМ начали в 1990-х годах. Введение здоровых гемопоэтических стволовых клеток бывает необходимо, когда онкологический больной получает высокие дозы лекарств, иногда в сочетании с лучевой терапией, в результате чего кроветворение подавляется и не может восстановиться самостоятельно.
Иногда это единственный способ спасти человека, но он несет в себе и серьезные риски. Возможны острые иммунные реакции, когда клетки донора распознаются клетками реципиента как чужеродные и наоборот. В этом случае может произойти отторжение донорских стволовых клеток организмом больного или иммунная атака донорских клеток на его ткани.
Врачи могут не решиться проводить трансплантацию до наступления у пациента прочной ремиссии, как в случае с Евгенией Герасимовой, героиней программы «Пусть говорят».
Опасно также проводить эту процедуру при тяжелых сопутствующих заболеваниях, например инфекционных.
Кто может стать донором костного мозга
Донором для пересадки костного мозга может быть и сам пациент. Это наиболее простой способ, поскольку иммунологические проблемы при нем не возникают. Если у онкологического больного не поражен костный мозг, у него могут заранее взять некоторое количество кроветворных стволовых клеток, а потом, после проведения интенсивной терапии, ввести ему их обратно.
Добровольные доноры требуются для так называемой аллогенной трансплантации, когда клетки берутся у другого человека. Чтобы проверить, подходит ли костный мозг для пересадки, у потенциального донора берется на анализ кровь и проводится типирование – определение HLA-фенотипа, то есть набора генов, отвечающих за совместимость тканей.
Большая вероятность такой совместимости есть у родственников, причем отец или мать обычно реже подходят на роль донора, чем брат или сестра. Однако идеальным донором – с таким же HLA-типом, как у больного, – может оказаться и совершенно незнакомый человек, живущий в другом полушарии. Найти такого человека возможно только с помощью специальных регистров.
Регистры доноров
Регистры для поиска потенциальных доноров костного мозга начали создаваться в Европе и США еще в 1980-х годах. Одними из первых возникли Фонд Энтони Нолана в Англии и Фонд Стефана Морша в Германии. В настоящее время в некоторых странах существуют национальные регистры, в которых объединены данные различных специализированных организаций. Так, национальный регистр NMDP в США содержит сведения о 9 млн доноров, DKMS в Германии – о 5 млн. Международный регистр IBMTR объединяет информацию о 20 млн доноров из всех мировых регистров.
В России в 2013 году «Русфонд» совместно с Первым Санкт-Петербургским медицинским университетом и рядом других организаций создал Национальный регистр доноров костного мозга имени Васи Перевощикова. Сейчас в нем зарегистрировано почти 65 000 потенциальных доноров.
Кроме того, в России есть 16 донорских баз, созданных государственными учреждениями. Общее число потенциальных доноров костного мозга в стране – около 175 000.
Поиск и привлечение российских доноров в десять с лишним раз дешевле, чем те же действия с использованием международных регистров и доноров-иностранцев. А главное, поиск в национальном регистре экономит время, важное для успешного лечения.
При этом доноров в российских регистрах недостаточно, чтобы найти подходящего донора для всех заболевших. По данным на июнь 2022 года, из 65 000 потенциальных доноров в Национальном регистре имени Васи Перевощикова реально донорами стали 64 человека.
Для того чтобы реже обращаться в зарубежные регистры, России необходим хотя бы миллион зарегистрированных доноров.
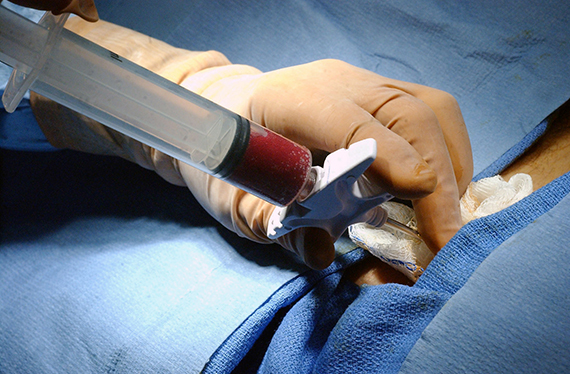
Как сдают костный мозг
Врачи считают, что процедура забора костного мозга у донора намного проще, чем обычное хирургическое вмешательство. Под общим или эпидуральным наркозом с помощью полой иглы в шприц закачивается небольшая часть костного мозга (это жидкость) из верхнего края тазовых костей. Обычно приходится делать несколько проколов, чтобы набрать необходимое количество этой жидкости. После этого донор проводит в стационаре около двух дней.
Самым неприятным моментом во всей процедуре забора костного мозга является анестезия, считают врачи. Уровень гемоглобина снижается незначительно. Костный мозг восстанавливается приблизительно месяц. Болезненные ощущения в спине проходят через несколько дней.
Второй способ – получение кроветворных клеток из периферической крови. Предварительно донору дают препарат, выгоняющий нужные клетки из костного мозга. Затем из вены берут кровь, она проходит через прибор, разделяющий ее на компоненты, гемопоэтические стволовые клетки собираются, а остальная кровь возвращается в организм через вену на другой руке. Для отбора нужного количества клеток вся кровь человека должна несколько раз пройти через сепаратор. Процедура продолжается пять-шесть часов. После нее донор может испытывать симптомы, похожие на недомогание при гриппе: боли в костях и суставах, головные боли, иногда повышение температуры.
Как стать донором костного мозга
Донором может стать любой человек в возрасте от 18 до 50 лет, если у него не было гепатитов В и С, туберкулеза, малярии, ВИЧ, нет онкологического заболевания или диабета.
Если вы решили стать потенциальным донором костного мозга, то сначала надо сдать 9 мл крови на типирование и подписать соглашение о вступлении в регистр. В случае, если ваш HLA-тип подойдет какому-нибудь больному, нуждающемуся в ТКМ, вам предложат пройти дополнительные обследования. Безусловно, вы должны будете подтвердить свое согласие выступить в роли донора.
На сайте «Русфонда» опубликован список лабораторий, где можно сдать кровь, чтобы оказаться в Национальном регистре доноров.
Сколько получают доноры
Донорство костного мозга безвозмездно, это общемировая практика. Но у тех, кто реально стал донором (то есть прошел через забор костного мозга, а не просто сдал кровь на типирование), в России есть льготы – пожизненный налоговый вычет 500 рублей в месяц и страхование жизни сроком на один год.
Где в России проводят ТКМ
В нескольких медицинских учреждениях Москвы, Санкт-Петербурга и Екатеринбурга:
ФНКЦ «Детская гематология, онкология и иммунология» им. Дмитрия Рогачева Миндзрава РФ,
НМИЦ онкологии имени Н. Н. Блохина,
Российская детская клиническая больница,
Морозовская детская больница в Москве,
ГКБ № 52 в Москве,
Институт детской гематологии и трансплантологии им. Р. М. Горбачевой в Санкт-Петербурге,
Свердловская областная детская клиническая больница № 1.
В каждой больнице надо уточнять, какой именно вид ТКМ они делают (аутотрансплантация, родственная, неродственная ТКМ), на ТКМ при каких диагнозах специализируются (после пересадки человеку может понадобиться борьба с побочными эффектами) и можно ли получить лечение по квоте.
Что такое квоты на ТКМ
На каждый финансовый год каждый медицинский центр получает от государства квоты (теперь правильно говорить «государственное задание») на определенное количество операций. Эти пересадки для пациентов – граждан России будут бесплатными.
В квоту на бесплатную трансплантацию не входят дополнительные расходы на поиск неродственного донора в зарубежном регистре и некоторые препараты. Но самая большая проблема в том, что, по опыту прошлых лет, госзадания всегда не хватает.
Обычно квоты на бесплатные операции на текущий год заканчиваются примерно к сентябрю и все дальнейшие операции проходят платно или за средства благотворителей – ведь ждать несколько месяцев до наступления нового года пациент не может.
Если лечиться за свои деньги, то оплата одного только койко-дня в отделении трансплантации гемопоэтических стволовых клеток института им. Рогачева обойдется как минимум в 38 500 рублей. В целом же стоимость ТКМ может доходить от 2,2 млн до 3,3 млн рублей.
За лечение в Германии приходится платить до 260 000 евро, а в Израиле – до 240 000 долларов. И все это без учета поиска донора в Международном регистре, который выльется еще в 21 000 евро. В России этот поиск оплачивают, как правило, благотворительные фонды – такие как «Русфонд», «Подари жизнь», AdVita. Большинство российских фондов при этом не оплачивает саму операцию ТКМ за рубежом, подобранный и оплаченный трансплантат привозится в Россию, и пересадка происходит уже здесь.
Возможен ли поиск донора в Европе, когда на Россию наложены санкции
Несмотря на санкции, которые были наложены на Россию в 2022 году, возможность поиска доноров костного мозга для российских пациентов в зарубежных регистрах сохраняется.
Как сообщили «Милосердию» в благотворительном фонде «Подари жизнь», у них нет информации, что какие-то европейские регистры отказались работать с российскими пациентами. Доноров для своих подопечных «Подари жизнь» чаще всего находит в немецком регистре Стефана Морша.
При этом, если подходящий для пересадки донор нашелся в Европе, это не значит, что российскому реципиенту придется ехать туда на операцию. Забор костного мозга сделают в Европе, а дальше его привезут в Россию в специальном контейнере.
С марта 2022 года для доставки костного мозга «Подари жизнь» использует маршрут через Стамбул, который фонд разработал еще во времена пандемии: в Стамбул летит кто-то из российских врачей, а контейнер с материалом для пересадки туда привозит представитель регистра.
Более того, несмотря на санкции, в начале июня костный мозг донора из российского регистра был пересажен реципиенту в Австралии.
Проблема в другом: пересадка спинного мозга возможна в течение 48 часов после его забора. Сейчас, когда часть аэропортов на юге России не работает, а часть российских авиакомпаний не летает за границу, приходится особенно тщательно составлять маршрут и сама доставка обходится дороже.
Мы просим подписаться на небольшой, но регулярный платеж в пользу нашего сайта. Милосердие.ru работает благодаря добровольным пожертвованиям наших читателей. На командировки, съемки, зарплаты редакторов, журналистов и техническую поддержку сайта нужны средства.
благотворительный фонд
Алексей Масчан провел свою первую трансплантацию костного мозга в 1992 году. Спустя 26 лет клиника имени Дмитрия Рогачева, где работает Алексей Александрович, является крупнейшим центром ТКМ в мире.
В клинике проводится 180 пересадок костного мозга в год. И до сих пор каждый день Алексей Александрович приходит в отделение как врач и продолжает вести пациентов. Как изменился за прошедшие годы подход к трансплантации, когда и при каких диагнозах эта процедура необходима и какие технологии позволяют снизить риск побочных эффектов.
Алексей Масчан, директор Института гематологии, иммунологии и клеточных технологий
За последние 11-15 лет произошли кардинальные изменения в использовании ТКМ для лечения онкологических и тяжелых гематологических заболеваний. Расскажите, пожалуйста, с чего все начиналось.
Когда я пришел работать в трансплантологию, пересадки (если отбросить в сторону аутологичные трансплантации), то есть переливание собственных клеток пациента) выполнялись практически исключительно от родственных доноров — генетически совместимых братьев и сестер. Тогда мы часто говорили родителям пациентов с хроническими заболеваниями, требующими ТКМ: вы можете попробовать родить еще одного ребенка, и вероятность того, что он сможет стать донором, 25%. И действительно, были такие случаи, что родители решались на очередного ребенка, он оказывался подходящим донором, и мы использовали для пересадки, например, пуповинную кровь.
Конечно, когда мы разговаривали с родителями, мы объясняли: вы рожаете не донора, у вас появится еще один ребенок, который точно так же будет нуждаться в любви и заботе. Только он еще может спасти своего брата или сестру. И все же это было очень сложным решением для родителей. К счастью, технологии пересадок за последние 20 лет развились настолько, что сейчас нет необходимости подбирать полностью совместимого родственного донора. А значит, и все этические дилеммы, с этим связанные, остались в прошлом.
Первая неродственная пересадка была сделана в России в 1997 году. Трансплантация прошла успешно, сейчас Антон — студент третьего курса в Орловском мединституте. Мы поддерживаем с ним связь и ждем к нам в ординатуру через пару лет. С 1997 по 2013 годы технология трансплантации от неродственных доноров пережила расцвет, результаты этих пересадок резко улучшились. Благодаря поддержке фонда «Подари жизнь» мы смогли развернуть программу неродственных трансплантаций сначала на базе Российской детской клинической больницы, затем в Центре гематологии имени Димы Рогачева. Огромные усилия прилагались к тому, чтобы оплатить поиск доноров, их активацию и транспортировку трансплантационного материала — костного мозга или гемопоэтических стволовых клеток.
Сейчас в Центре детской гематологии активно развивается программа пересадок гемопоэтических стволовых клеток от не полностью совместимых родственных доноров — гаплотрансплантаций. Но еще несколько лет назад такие трансплантации проводились только в крайних случаях. Расскажите об основных изменениях, которые произошли в подходе к трансплантации гемопоэтических стволовых клеток.
Да, гаплотрансплантация — это трансплантация от родственного донора, который не полностью совместим с пациентом. Например, ровно наполовину, как мама или папа. Мы начали разрабатывать эту программу под руководством моего брата Михаила Александровича Масчана и стали использовать в ней современные технологические новшества. В последние несколько лет ученые проникли в саму суть сложного биологического процесса пересадки костного мозга. Сегодня пересадки от гаплоидентичных доноров и от совместимых неродственных доноров дают практически одинаковые результаты. Более того: оказалось, что при миелоидных лейкозах пересадки от гаплоидентичного донора дают результаты лучше, чем при использовании неродственного донора. Именно с этим было связано наше решение о полном переходе на гаплоидентичные пересадки у больных миелолейкозами, и шире — у больных лейкозами.
Теперь во многих случаях мы даже не приступаем к поиску совместимого неродственного донора, а сразу планируем гаплоидентичную пересадку. Процедура дает результаты не хуже, при этом нам не нужно заниматься сложной логистикой подбора донора: пересылкой образца крови пациента в зарубежные регистры, дорогостоящим типированием, перевозкой трансплантационного материала. То есть гаплотрансплантация оказывается гораздо проще и дешевле. Кроме того, как уже было сказано, в случаях некоторых заболеваний эффективность гаплоидентичной трансплантации может быть и выше, поскольку при ней присутствует ряд эффектов, которые трансплантация от совместимого донора дать не может. Об этом врачи догадывались давно, только этого никто не мог доказать. Сегодня, кажется, мы наконец видим, что это действительно так.
Кто из родственников пациентов лучше всего подходит для гаплоидентичной трансплантации?
Лучше всего подходят доноры, которые могут подвергнуться процедуре мобилизации (то есть вывода нужных клеток в кровь) и последующего забора материала (то есть собственно взятия этих клеток). Для этого донор должен быть здоров и в то же время должен уже иметь опыт контакта с теми вирусами, которые могут активироваться после пересадки. Поэтому для гаплоидентичной трансплантации мы редко приглашаем стать донорами детей младше 14 лет. Обычно доноры — это родители, и мы не можем сказать, что папа лучше, чем мама, или наоборот. Это многомерная, многопараметрическая история.
Развитию гаплоидентичной трансплантации помогло возникновение новых технологий очистки трансплантационного материала — клеток, взятых из крови. Расскажите, пожалуйста, об этом подробнее.
Совершенно верно. Эта технологическая платформа была усовершенствована компанией Milteniy Biotec. Такая совершенно частная компания, основанная гением. Штефан Милтени создал высокотехнологичный медицинский бизнес с оборотом уже, наверное, в сотни миллионов. Мы с ним знакомы, и он производит впечатление совершенно невероятное. Это капиталист и при этом скромный и доступный человек, он ходит пешком, ест гамбургеры, абсолютно бескорыстен. Всю прибыль от продаж технологий Милтени вкладывает в новые разработки. К исследованиям он привлек уникальную команду ученых, в маленьком городке под Франкфуртом работает целый научный институт.
На ваш взгляд, какие условия необходимы, чтобы технология, разработанная компанией Miltenyi, была использована правильно и лечение дало ожидаемый результат? Насколько важна команда врачей, их опыт?
Сейчас процедура пересадки гемопоэтических стволовых клеток стала гораздо безопасней, мы можем справляться с подавляющим большинством осложнений. Но по-прежнему это очень сложная и рискованная процедура. Она не заработает, как утюг, в руках любого. Для этого нужна команда, которая способна на всех этапах обеспечивать ее безупречное функционирование. Именно благодаря тому, что у нас есть эта команда врачей и технология пересадок отработана за многие годы, сейчас эта процедура сопряжена с гораздо меньшим количеством осложнений.
Поэтому мы смогли увеличить количество пересадок, проводимых в Центре детской гематологии. Для сравнения: когда мы работали на нашей предыдущей базе в РДКБ, мы делали 70 пересадок в год. Это было очень хорошо, это был один из крупнейших европейских центров ТКМ. Сейчас в Центре Димы Рогачева мы делаем не меньше 180 пересадок в год. И это делает нас, наверное, самым крупным центром в мире.
Каких осложнений, которые раньше часто возникали при трансплантациях, сейчас получается избежать?
Во время трансплантации гемопоэтических стволовых клеток полностью перезапускаются кроветворная и иммунная системы пациента. Самое главное осложнение любой пересадки — это реакция «трансплантат против хозяина» (РТПХ), в ходе которой иммунные клетки трансплантата атакуют множество органов и тканей пациента. В прежние годы смертность от этого осложнения составляла 20-25%. И еще 20% пациентов оставались инвалидами в результате долгосрочных последствий РТПХ. Сейчас картина изменилась, осложнения возникают в три раза реже.
Это произошло благодаря тому, что мы используем современную технологию очистки трансплантата — парциальную Т-клеточную деплецию. Во время очистки мы убираем не все иммунные клетки, а только те, которые ответственны за развитие осложнений после трансплантации, за РТПХ. Риск осложнений уменьшился, но он, к сожалению, не нулевой. Трансплантация костного мозга никогда не будет элементарной процедурой, поскольку мы вмешиваемся в самую основу функционирования иммунной системы.
Решение о трансплантации костного мозга всегда непростое, и его должен принять родитель пациента. Каждый раз вы разговариваете с родителями и объясняете все риски. Чего родители боятся больше всего?
Конечно, больше всего родители боятся осложнений. Потому что перед трансплантацией они лежат в отделении, через которое проходит большое количество пациентов с осложнениями после пересадок. И получается, что родители и пациенты не видят удачных случаев — видят только своих соседей по отделению, которые возвращаются в Центр с РТПХ, отторжением трансплантата или с рецидивом. Поэтому возникает естественный страх, что именно это случится и с их ребенком.
С другой стороны, мы не можем гарантировать родителям, что все будет в порядке. Ведь речь идет об очень непростой процедуре. Мы всегда предупреждаем об осложнениях, которые могут возникнуть. За годы работы я понял, что в разговоре с родителями надо быть максимально откровенным, ни в коем случае не запугивать, а стараться дать наиболее полную информацию.
Вам удалось в три раза увеличить число трансплантаций в Центре детской гематологии имени Димы Рогачева. Получают ли сейчас трансплантацию костного мозга все российские дети, которые в них нуждаются?
Мы посчитали, что в России ежегодная потребность в ТКМ у детей составляет примерно 850-900 пересадок, а проводится около 500-550. Сейчас увеличить число пересадок можно только при условии строительства новых центров в регионах и адекватного обеспечения этих центров необходимым оборудованием и лекарствами. Также нужны, безусловно, квалифицированные специалисты, умеющие работать с современными технологиями и оборудованием. Но даже самая выдающаяся команда врачей не сможет лечить, если у нее не будет того, чем лечить: нормальных расходников, нормальных антибиотиков и так далее.
Какова сейчас роль фонда «Подари жизнь» в развитии программы ТКМ в Центре детской гематологии? Почему наша помощь по-прежнему нужна?
Первое, в чем нужна помощь фонда и в чем она всегда будет нужна, — это оплата поиска и активации неродственных доноров. Мы сократили применение неродственных трансплантаций, но все равно очень широко ими пользуемся. Государство не оплачивает поиск и активацию неродственного донора в зарубежных регистрах.
Второе, с чем нам помогает фонд, — это оплата незарегистрированных лекарственных препаратов, которые мы ввозим только с помощью фонда. И без этой помощи мы бы никогда не выжили.
Третье — и, пожалуй, с этого и надо было начать — стоимость самой процедуры трансплантации. То есть не процедуры, а препаратов, необходимых для ее успешного проведения. Сейчас существенная ее часть, она колеблется от пациента к пациенту, оплачивается благотворителями. Существующее государственное финансирование обеспечивает процедуру трансплантации костного мозга в лучшем случае на 50%.
Квота составляет немногим более трех миллионов рублей, а истинная стоимость трансплантации — 6,5-7 миллионов, иногда доходит и до десяти миллионов. В квоту укладывается только процесс лечения, а истинные затраты могут быть в три раза выше, чем это декларировано на бумаге. И вот эта разница между тем, что дают, и тем, что нужно врачам, в большой мере финансируется благотворителями фонда «Подари жизнь».
Кроме того, не будем забывать, что, когда мы выписываем больных по месту жительства, они уезжают с большим списком лекарств, зачастую дорогостоящих, которых им по месту жительства никто не даст. И фонд помогает с этим тоже. Так что программа трансплантации костного мозга в Центре Димы Рогачева не могла бы существовать и развиваться без «Подари жизнь».
В каких случаях пациентам все же необходима неродственная трансплантация костного мозга?
Неродственных пересадок мы по-прежнему делаем много, не меньше 30 в год. Неродственные трансплантации мы резервируем для некоторых иммунодефицитов и иногда для лимфобластных лейкозов — диагнозов, для которых положительные эффекты гаплоидентичной трансплантации выражены в меньшей степени. Также неродственная трансплантация необходима детям-сиротам, у которых нет биологических родственников. У меня в практике были такие случаи были. К счастью, нам удавалось найти неродственных доноров для сирот.
Насколько часты случаи отказов среди родственных доноров?
Большинство детей и взрослых родственников, которые могут стать донорами, страстно хотят этого. У детей отказов от донорства практически не бывает, среди взрослых родственников это иногда случается. Кандидаты боятся или просто не ощущают никакого родства.
Неродственному донору обеспечивают полную анонимность в течение двух лет для того, чтобы снизить риск психологической травмы в случае неудачи лечения. Но родственные доноры моментально узнают, если что-то идет не так.
Вы абсолютно правы. Если пациент не выживает, особенно если это происходит из-за реакции «трансплантат против хозяина», то донор может ощущать чувство вины из-за того, что не спас, из-за того, что причинил страдания.
Насколько сложно подготовить донора к трансплантации?
Гораздо проще, чем подготовить космонавта. В процедуре есть ряд неприятных моментов, но в целом это не больно. Если берется костный мозг, то он берется под наркозом, небольшая боль развивается только после процедуры. Эти боли не интенсивные, мы даем обезболивание. Если речь идет о гемопоэтических стволовых клетках, взятых из периферической крови, то у донора возникает недомогание, когда мы вводим вещества, которые выгоняют костномозговые клетки в кровь. Может развиться ломота в костях, иногда поднимается температура. Но это все переносимо, и с помощью очень простых лекарств осложнения сводятся к минимуму.
Считается, что после трансплантации костного мозга донор и реципиент становятся похожи. Правда ли это?
У пациента меняется группа крови на группу крови донора. И это, пожалуй, все сходство. Байка пошла с репортажа Валеры Панюшкина, который посетил вместе с нами первую встречу доноров и реципиентов в Биркенфельде. Тогда Валера написал, что, когда доноры и реципиенты встречаются, они оказываются очень похожими друг на друга. На самом деле это не совсем так – после трансплантации схожести не появляется. Но поскольку мы трансплантируем от доноров, которые генетически близки нашим пациентам, какое-то сходство быть может. Степень этой похожести зависит от впечатлительности наблюдателя.
Почему неродственных доноров для российских пациентов часто находят в немецких регистрах доноров костного мозга?
Пока точную цифру сложно назвать, поскольку больших популяционных исследований не проводилось. Но, по-моему, каждая пятая неродственная пересадка уже производится от доноров из российского регистра. Однако, к сожалению, даже с увеличением российских регистров вероятность нахождения донора для представителей национальных меньшинств не увеличивается. В России живет много народов-изолятов, особенно на Севере: ненцы, долганы. Для них практически невозможно найти неродственного донора. В этом случае пациента может спасти только гаплотрансплантация.
Трансплантация костного мозга как происходит
Множественная миелома (ММ) характеризуется выраженной вариабельностью течения, прогноза и результатов терапии. До недавнего времени применение мелфалана в комбинации с преднизолоном (схема МП) было наиболее распространенным методом лечения. Однако у многих больных на фоне этой терапии не удается достичь состояния полной клини-ко-гематологической ремиссии в течение длительного периода.
В настоящее время наметилась тенденция к увеличению частоты и длительности ремиссии, общей продолжительности жизни на фоне интенсивной химиотерапии при множественной миеломе. В последние годы альтернативным методом лечения является использование различных протоколов полихимиотерапии и прежде всего схем VAD (винкристин, адриамицин, дексаметазон), комбинации идарубицина с дексаметазоном, VMCP (винкристин, мелфалан, циклофосфан, преднизолон), BVAP (кармустин, винкристин, адриамицин, преднизон), Dexa-BEAM (BCNU, этопозид, цитозар, мелфалан, дексаметазон) или первичной высокодозной терапии мелфаланом (60—100 мг/м2).
Особый интерес представляет моно- или комбинированная терапия принципиально новыми классами препаратов: ингибиторами диацетилазы гистонов, ангиогенеза (талидомид, леналидомид), протеасом (велькейд), индукторами апоптоза (триоксид арсения).
Положительное влияние этих программ уже доказано. Полученные многими авторами данные воспринимаются как достаточно убедительные для более широкого применения не только химиотерапии, но и трансплантации гемопоэтических стволовых клеток у больных множественной миеломой. В связи с этим рассматривается использование следующиих видов трансплантации гемопоэтических стволовых клеток : аутологичной, аллогенной от родственного и неродственного доноров, сингенной.
К настоящему времени ауто-трансплантации гемопоэтических стволовых клеток более распространена по сравнению с алло-трансплантации гемопоэтических стволовых клеток. Использование ауто-трансплантации гемопоэтических стволовых клеток представляется оправданным при отсутствии противопоказаний и наличии активной формы болезни («неиндолентной» множественной миеломой) независимо от стадии (по Durie, Salmon). Ауто-ТПСКК при множественной миеломе имеет преимущество по сравнению с ауто-ТКМ.
Это связано с более легкой доступностью гемопоэтических стволовых клеток из крови больных множественной миеломе, меньшей примесью злокачественных клеток и травматичностью при сборе трансплантата. Однако для получения аутотрансплантата ГСК важно добиться редукции количества плазматических клеток в костный мозг по крайней мере до 20 % от исходного уровня. При уровне плазматических клеток в костный мозг не более 20 % ауто-трансплантации гемопоэтических стволовых клеток может быть выполнена больным множественной миеломой на любом этапе лечения.
Больные с множественной миеломой наиболее часто являются кандидатами на проведение двойных (тандем) трансплантаций. Это связано с отсутствием данных о преимуществе однократной ауто-трансплантации гемопоэтических стволовых клеток по сравнению со стандартной химиотерапией при множественной миеломе.
При этом могут использоваться следующие комбинации: две последовательные ауто-трансплантации гемопоэтических стволовых клеток, ауто-трансплантации гемопоэтических стволовых клеток и алло-трансплантации гемопоэтических стволовых клеток от родственного или неродственного донора с «миелоаблативным» режимом или режимом кондиционирования с уменьшенной интенсивностью дозы. Обсуждается возможность применения различных видов трансплантации гемопоэтических стволовых клеток при множественной миеломе в качестве одного из этапов первичной линии терапии (например, 1—2 курса химиотерапии в момент постановки диагноза и далее трансплантации гемопоэтических стволовых клеток).
Сравнивали эффективность стандартной и высокодозной цитостатической терапии с ауто-трансплантацией гемопоэтических стволовых клеток. Были получены следующие отдаленные результаты — достижение ПР и ПР + ЧР (частичная ремиссия) соответственно: после VAD — у 5 и 34 % больных, после однократной ауто-трансплантации гемопоэтических стволовых клеток — у 26 и 75 % больных, после тандема ауто-трансплантации гемопоэтических стволовых клеток —у 41 и 83 % больных.
Медиана общей и безрецидивной выживаемости после тандема ауто-трансплантации гемопоэтических стволовых клеток составила 68 и 43 мес, а 5-летняя общая и безрецидивная выживаемость были равны соответственно 58 и 42 %.
Общеизвестных критериев, определяющих показания к трансплантации гемопоэтических стволовых клеток при множественной миеломе, не существует. Принятие решения в пользу выполнения трансплантации гемопоэтических стволовых клеток во многом зависит от индивидуальных взглядов авторов, их опыта в этой области и наличия необходимых условий для проведения трансплантации гемопоэтических стволовых клеток.
Наиболее часто используемым режимом кондиционирования при ауто-трансплантации гемопоэтических стволовых клеток у больных с множественной миеломой является мелфалан в дозе 180—220 мг/м2, назначение которого предпочтительнее по сравнению с режимом кондиционирования тотальное облучение тела (ТОТ) + мелфалан.
По данным CIBMTR, 3-летняя общая выживаемость у больных с множественной миеломой при проведении ауто-трансплантации гемопоэтических стволовых клеток в первые 18 мес с момента постановки диагноза составила 55 %, в то время как после 18 мес — 43 %, однако эти показатели не имеют статистически достоверного различия.
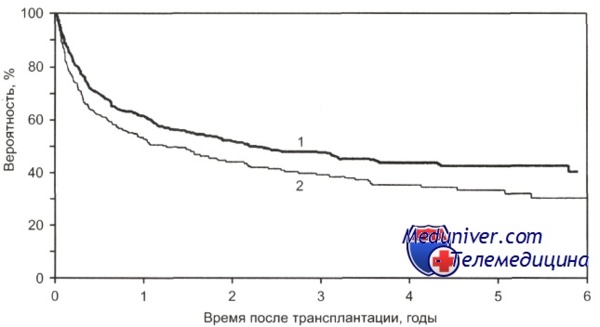
1 — 18 мес и менее (n = 642);
2 — более 18 мес (n = 258); р = 0,0035.
При выполнении ауто-трансплантации гемопоэтических стволовых клеток больным с множественной миеломой оценивали влияние «очистки» трансплантата ex vivo от примеси злокачественных клеток на отдаленные результаты. Предварительная «очистка» трансплантата ex vivo при множественной миеломе не имела преимуществ по сравнению с ауто-трансплантацией гемопоэтических стволовых клеток без «очистки». При сравнении ауто-трансплантации гемопоэтических стволовых клеток у больных ММ, выполненной с позитивной селекцией CD34+ или без нее, значимого влияния этого фактора также не было установлено.
Таким образом, несмотря на имеющиеся успехи в лечении больных множественной миеломой, достижение ПР при множественной миеломе до сих пор остается трудноразрешимой задачей. С этим связано стремление к совершенствованию методов терапии в первую очередь путем внедрения алло-ТГСК, несмотря на отсутствие в прошлом данных о преимуществе алло-ТГСК по сравнению с ауто-ТГСК у больных с множественной миеломой.
По результатам CIBMTR, после алло-ТГСК с режимом кондиционирования в миелоаблативных дозах 3-летняя общая выживаемость больных с множественной миеломой составляет 39 %, что связано с большим влиянием развития тяжелых осложнений (токсические, инфекционные, острая реакция «трансплантат против хозяина»).
Несмотря на это, в настоящее время доля алло-трансплантаций гемопоэтических стволовых клеток больным с множественной миеломой моложе 60 лет при наличии совместимого по HLA-системе донора, в том числе неродственного, постепенно увеличивается. Это обусловлено возможностью использования режимов кондиционирования с уменьшенной интенсивностью дозы и доказанным существованием иммунологического эффекта «трансплантат против миеломы».
Вероятность достижения полной ремиссии может быть увеличена с 18 % после однократной ауто-трансплантации гемопоэтических стволовых клеток до 70 % у больных, получивших тандем ауто-трансплантации гемопоэтических стволовых клеток и алло-трансплантации гемопоэтических стволовых клеток с режимом кондиционирования с уменьшенной интенсивностью дозы от неродственного донора.
Для наиболее эффективного применения алло-трансплантации гемопоэтических стволовых клеток при множественной миеломе анализируют следующие факторы: миелоаблативные режимы кондиционирования против режимов кондиционирования с уменьшенной интенсивностью дозы, сроки проведения трансплантации (терапия первой линии или отсроченное выполнение).
Для профилактики развития рецидива после ауто-трансплантации гемопоэтических стволовых клеток возможно назначение иммуномодулирующей терапии: интерферон, талидомид, велькейд. В качестве адоптивной иммунотерапии больным множественной миеломой после алло-трансплантации гемопоэтических стволовых клеток вводят донорские лимфоциты, при этом достижение длительной ремиссии у значительного количества больных, вероятно, связано с инфузией CD4+-клеток.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Как устроено донорство костного мозга: мифы, страхи, побочные эффекты
Олеся Остапчук СПИД.ЦЕНТР
Костный мозг достают из спины? Донор рискует своим здоровьем? Врачи относятся к донору хуже, чем к пациенту? По данным ВЦИОМ, 61 % россиян ничего не слышали о донорстве костного мозга, а каждый второй респондент считает процедуру опасной. И тем не менее трансплантация устойчивого к вирусу косного мозга остается самой перспективной технологией полной элиминации ВИЧ. СПИД.ЦЕНТР подготовил подробный разбор мифов о донорстве косного мозга, поговорив с онкологом-гематологом, консультантом «Фонда борьбы с лейкемией» Сергеем Семочкиным и донором костного мозга Ириной.
Что такое костный мозг и где он вообще расположен?
Это кроветворная ткань, которая находится в крупных костях человека. В костном мозге есть гемопоэтические (кроветворные) стволовые клетки (ГСК), когда они делятся и созревают — образуются все виды клеток крови: эритроциты, лейкоциты, тромбоциты. ГСК — отправная точка для процесса кроветворения в организме. Процесс их деления практически ничем не ограничен: из небольшого числа ГСК может появиться множество «дочерних» клеток, они будут делиться дальше, созревать, а из них образовываться другие клетки крови.
Из-за такой способности ГСК к делению, они чувствительны к цитостатической химиотерапии и облучению. Поэтому процесс кроветворения может нарушиться во время лечения онкологических заболеваний (у людей, проходящих высокодозную химиотерапию, как правило, этот процесс останавливается). Если ввести такому пациенту подходящие ГСК, они смогут заселить костный мозг пациента своими «дочерними» клетками и восстановить кроветворение. Соответственно, цель врачей — собрать достаточное количество ГСК у здорового человека (донора) и пересадить их больному (реципиенту).
А как его достают? Большим шприцем из позвоночника?
Костный мозг — не спинной, поэтому никто не будет выкачивать у доноров стволовых клеток жидкость из позвоночника. Собрать клетки можно двумя способами. Первый и самый распространенный — взять их из крови. В таком случае донору предварительно на протяжении нескольких дней вводят подкожно препарат — стволовые факторы роста, что стимулирует выход ГСК из костного мозга в кровь.
Сам забор клеток из крови очень похож на обычное донорство компонентов крови, например, тромбоцитов. Человека сажают в кресло, из вены берут кровь, она фильтруется в аппарате. Дальше машина забирает себе стволовые клетки, а все остальное возвращает обратно донору. Процесс длится несколько часов.
Во втором случае берут не кровь, а сам костный мозг. Для этого донору делают общую анестезию, шприцем прокалывают тазовую кость и берут литр смеси костного мозга и крови (это не более 5 % всего костного мозга). После из взятой смеси выделяют стволовые клетки. Операция длится примерно полчаса, а донор в этом случае около двух дней проводит в стационаре. После процедуры могут быть болезненные ощущения, которые снимаются обезболивающими.
Второй вариант используется существенно реже, когда врачам не удается собрать периферические, то есть циркулирующие в крови, ГСК. Поскольку он сложнее, соглашаются на него в основном родственники нуждающегося в трансплантации. Впрочем, донор сам может выбрать способ забора клеток.
По данным американской компании Be The Match, которая курирует самый большой регистр (банк) доноров костного мозга в мире, хирургическое вмешательство для забора стволовых клеток требуется в 23 % случаев. По другим цифрам — американского Института юстиции — хирургическая процедура делается в 30 %, а в 70 % — стволовые клетки забирают через кровь.
Любой ли костный мозг подойдет больному или он чем-то отличается?
Нет, костный мозг у каждого свой. Найти себе донора с подходящими стволовыми клетками сложнее, чем с кровью. Иногда среди родственников пациента может оказаться потенциальный донор костного мозга, но так бывает только в 50 % случаев. Если среди родных нет никого подходящего, нужно искать человека с таким же HLA-генотипом (это цифровой показатель генов, он отвечает за тканевую совместимость).
Найти донора можно через регистры (банки) доноров костного мозга. В них содержатся данные людей, прошедших фенотипирование — исследование клеток и генотипа — и согласившихся стать донорами ГСК.
А как выглядят банки костного мозга?
Это не огромные больницы с генетическими материалами, а электронные базы, компьютерная сеть, в которой хранится информация о генотипе потенциальных доноров и больных. Система определяет, насколько совместимы донор и реципиент.
Совместимость у всех разная. У каждой клетки человека есть свой набор рецепторов — главный комплекс гистосовместимости. Рецепторы находятся на поверхности клетки, и по ним можно определить информацию о белках, которые находятся внутри. Так клетки собственной иммунной системы могут вовремя определять нарушения среды внутри клетки и устранять их или сигнализировать о них. До какого-то момента иммунная система способна таким образом распознавать наличие опухоли.
по теме
Лечение
Зафиксирован второй случай излечения от ВИЧ. На самом деле он третий
Для трансплантации необязательна совместимость групп и резус-факторов крови, важнее именно генетическая совместимость. Среди идеально подходящего неродственного донора и родственного донора, совпадающего не по всем пунктам, врачи выберут, скорее всего, последнего, потому что с ним ниже вероятность отказа от донации.
Порой больному подходят сразу 50-70 доноров, но бывает, что «генетический близнец» в регистре вовсе не находится. В последнем случае можно попробовать организовать донорские акции, чтобы больше людей прошли типирование, но в любом случае, если подходящего донора нет в банке, помочь пациенту не получится. Каждый год не менее трех тысяч людей умирают, потому что не смогли найти себе подходящего донора.
Пациент и донор с одним и тем же этническим происхождением вероятнее подойдут друг другу. Чем больше людей проходит типирование, тем больше в регистрах разных генетических данных, а значит, выше вероятность совместимости пациента и донора.
По данным американской компании Be The Match, больше всего проблем с поиском донора костного мозга у темнокожих людей, индейцев, уроженцев Аляски, азиатов, коренных гавайцев и других жителей островов Тихого океана, латиноамериканцев и метисов. Американский Институт юстиции сообщает, что афроамериканцы, у которых нет родственного донора, находят себе подходящего только в 25 % случаев, при этом, если донора нашли, в 80 % случаев это единственный вариант в реестре. Для азиатов этот показатель равен 40 %, для латиноамериканцев — 45 %, для европейцев — 75 %. Конкретный процент для метисов в статистике не приводится, но институт уточняет, что для них ситуация гораздо хуже.
Зачем нужны доноры костного мозга?
Трансплантация костного мозга ежегодно требуется более чем 5 тысячам россиян, из них 4214 пересадок нужны взрослым и 900 — детям. В России нет общего регистра данных для доноров, каждый банк считает своих доноров сам. По словам онколога-гематолога Сергея Семочкина, самый большой банк стволовых клеток в России находится в Кирове в центре «Росплазма». В нем зарегистрировано 35 787 человек.
Еще один большой реестр доноров костного мозга в нашей стране находится в ведении «Русфонда» — Национальный регистр доноров костного мозга имени Васи Перевощикова. Он существует с 2013 года и объединяет 12 региональных российских регистров и один казахский. На 31 октября 2019 года в нем состояли 29 178 доноров костного мозга.
Во всемирном банке костного мозга (Bone Marrow Donors Worldwide) зарегистрировано 35,6 миллиона человек. Однако найти там совместимого с россиянином донора сложно — в нашей стране много национальностей и генетических сочетаний, которых нет больше нигде в мире. Вероятность, что русский человек найдет подходящего донора в отечественном регистре, выше, чем в зарубежных.
Семочкин приводит пример, что зачастую кавказцы не могут найти своего «генетического двойника» в европейской базе. Но у них больше детей в семье, поэтому выше вероятность найти родственного донора. Огромная проблема с поиском доноров и у малочисленных этносов, например, жителей Крайнего Севера. Как правило, найти донора им не удается.
Единственное решение проблемы — вступление в национальный регистр как можно большего количества людей разных национальностей. Как объясняет Семочкин, затраты на трансплантацию клеток и все остальные процедуры российского пациента с российским же донором не превышают 160 000 рублей. В то же время процедуры и трансплантация с донором из европейского банка требуют порядка 20 000 евро. Государство не может выделить такие деньги, у пациентов их тоже, как правило, нет — финансирование ложится на благотворительные фонды.
Как стать донором?
В России стать донором может любой здоровый гражданин РФ без хронических заболеваний в возрасте от 18 до 45 лет, в некоторых случаях — до 50 лет. Возраст имеет значение: чем моложе донор, тем выше концентрация клеток в трансплантате и их «качество».
Студентка магистратуры МГИМО Ирина стала донором костного мозга в конце октября этого года. До этого она с 18 лет регулярно сдавала кровь и тромбоциты в донорских организациях. Три года назад она прочитала колонку Валерия Панюшкина «Встреча» о том, как познакомились донор и реципиент, и окончательно решила сдать костный мозг.
Первый шаг — сдача крови на типирование. Это можно сделать в любой из крупных частных медицинских лабораторий или в лабораториях некоторых медицинских центров или регистров. Посмотреть полный список центров, позволяющих попасть в банк «Русфонда», можно здесь.
Ирина выбрала Национальный медицинский исследовательский центр гематологии. Там она сдала около 10 миллилитров крови на типирование и подписала соглашение о вступлении в регистр. Оно ни к чему не обязывает донора — можно отказаться в любой момент. Но это важно для реципиента — за 10 дней до пересадки стволовых клеток проводится высокодозная химиотерапия, которая полностью уничтожает кроветворную и иммунную системы. Поэтому отказ в последнюю минуту может быть губителен для того, кто ждет трансплантации.
Через полтора месяца после типирования на электронную почту Ирины пришло сообщение, что с анализами все в порядке и ее занесли в регистр.
по теме
Лечение
«В поисках исцеления». Что нового было на конференции CROI-2019?
«Я тогда почувствовала большую ответственность. Стояла на перекрестке и думала: а вдруг меня сейчас собьет машина, и я не смогу сдать. Меня это не то чтобы особо напрягало, но я стала отвечать на все звонки с незнакомых номеров, мало ли», — вспоминает она.
Через два года Ирине в мессенджер с неизвестного номера написали, что она подошла пациенту (из России), позвали на расширенное типирование, а также сдать анализы на ВИЧ и гепатит. Результаты анализов она ждала еще пять дней, параллельно врачи обследовали остальных подходящих доноров. Ответ прислали также в мессенджере: совместимость Ирины с пациентом 9 из 10, а у другого донора 10 из 10, врачи выбрали его.
Спустя полгода ей снова позвонили, оказалось, что пересадка так и не состоялась, а донор все еще был нужен. Она приехала в центр гематологии, поговорила с врачом, сдала кровь на биохимию, ВИЧ, сифилис, сделала флюорографию и ЭКГ. Через несколько дней позвали на уколы. Количество уколов зависит от веса донора, в среднем, делают 1-2 укола в день на протяжении трех дней. Ирине назначили дважды в день. Родителям она не стала говорить про свое донорство — не поняли бы. Поэтому приходилось прятать шприцы с лекарством в упаковках от зубной пасты в холодильнике.
По словам девушки, побочные эффекты были незначительные: на второй день появилась небольшая ломота в костях, «будто провела ночь в неудобной кровати», на третий — ощущение «тяжелой головы». Все это время врачи были на связи. Медицинские организации одинаково заботятся и о доноре, и о реципиенте: с момента прохождения необходимых для сдачи процедур донор формально числится как пациент при госпитализации, даже если не лежит в больнице, а сидит дома, как Ирина.
Можно ли донору знакомиться с реципиентом?
Да, но через два года и только если обе стороны согласны. За два года станет понятно, смог ли костный мозг донора прижиться у реципиента. В некоторых европейских странах и США этот срок составляет один год. А в Испании донорам и реципиентам запрещено видеться на протяжении всей жизни. Анонимность обеспечивает безопасность. Если они познакомятся сразу после донации, а через месяц костный мозг не приживется, то родственники больного могут «отомстить» донору, обвинить его в чем-то, в чем он не виноват. Анонимность позволяет избежать этого. С другой стороны такая мера позволяет избегать шантажирования родственников реципиента и вымогательства у них денег.
Донорство костного мозга проводится безвозмездно, можно узнать лишь пол и возраст больного, а также передать что-то анонимное в знак поддержки. Ирина передала открытку, на которой изображены руки, держащие кофейную чашку, на фоне гор. «Я там написала: поправляйся, я в тебя верю. Никакую информацию о себе нельзя указывать, мне даже сказали писать в настоящем времени, чтобы не было окончаний прошедшего времени, по которым можно определить род», — рассказывает Ирина.
Потенциальную встречу с реципиентом девушка не представляет. По количеству взятых у нее стволовых клеток и предполагаемой массе тела, она считает, что ее реципиент — мужчина средних лет. «Я не хочу, чтобы он чувствовал себя обязанным, да и о чем мы будем разговаривать? Я бы хотела, чтобы эта встреча произошла на каком-то мероприятии, в медицинском центре, например. Так мне было бы легче».
Трудно ли восстановиться после донорства костного мозга?
Пообщаться с корреспондентом Ирина смогла уже через пару дней после донации: «Мне важно, чтобы мои друзья и другие люди видели, что я сдала костный мозг и со мной все нормально. Я не лежу после этого в реанимации».
Донор отдает малую часть своего костного мозга — 5 % стволовых клеток здорового человека достаточно для восстановления кроветворения у больного. Потеря части стволовых клеток никак не ощущается, а их объем полностью восстанавливается в течение семи-десяти дней. Оставшиеся в крови донора ГСК самостоятельно обратно всасываются в костный мозг. Повторное донорство возможно уже через три месяца после забора клеток, то есть сдать костный мозг можно несколько раз за жизнь.
На каком уровне находится трансплантация стволовых клеток в России?
По словам Сергея Семочкина, сама российская система пересадки костного мозга очень хорошая, но проблема в нехватке учреждений, делающих трансплантацию, в России их — единицы. Недостаточно учреждений, квалифицированных сотрудников, нет государственного финансирования. После трансплантации реципиент должен еще несколько лет — минимум два года — получать терапию на подавление иммунных реакций. Например, если пациент из региона, а костный мозг ему пересаживали в Санкт-Петербурге, то дальнейшее ведение пациента должно проходить в его регионе. Но это сложно, объясняет Семочкин, врачей в регионах к этому не готовят, они не понимают, что делать. В итоге люди вынуждены постоянно обращаться в федеральный центр, а это тормозит трансплантацию следующих пациентов.
Трансплантация костного мозга как происходит
Выделяют следующие виды миелотрансплантации:
1) аллогенную трансплантацию, при которой больному вводятся СКК костного мозга (АлТКМ) или периферической крови (АлТСКК) от родственного или неродственного донора, совместимого по системе HLA;
2) аутологичную трансплантацию, когда пациент получает предварительно заготовленный собственный костный мозг (АТКМ) или стволовых кроветворных клеток периферической крови (АТСКК).
Разновидностью аллогенной трансплантации является сингенная трансплантация (трансплантация костного мозга или стволовых кроветворных клеток периферической крови от однояйцового близнеца). Кроме того, у детей все шире применяется аллогенная или аутологичная трансплантация СКК пупо-винной крови.
Биологические основы трансплантации гемопоэтических стволовых клеток
Для успешной трансплантации гемопоэтических стволовых клеток требуется:
1) обеспечить глубокую депрессию иммунной системы реципиента для успешного приживления аутологичного или аллогенного трансплантата;
2) ввести реципиенту аллогенные или аутологичные СКК в количестве, достаточном для восстановления гемопоэза;
3) при АлТКМ/АлТСКК — проводить иммуносупрессивную терапию с целью профилактики:
а) РТПХ;
б) реакции «хозяин против трансплантата» (РХПТ), которая может привести к отторжению гемопоэтических стволовых клеток донора.
После трансплантации аллогенных стволовых кроветворных клеток в организме реципиента возникает гемопоэтическая химера (одновременно имеются собственные клетки и клетки донора), существующая в течение нескольких месяцев, до полного восстановления иммунной и кроветворной систем за счет клеток трансплантата. Взаимодействие иммунных клеток донора и реципиента во время химеризма приводит к развитию двух реакций — РТПХ и РХПТ.
При онкологических заболеваниях возникает еще одна иммунологическая реакция, являющаяся частным видом РТПХ — реакция «трансплантат против опухоли» (РТПО): воздействие иммунных клеток аллогенного костного мозга (в основном Т-лимфоцитов) на опухолевые клетки, что приводит к их более полной эрадикации.
Реакция «хозяин против трансплантата». Отторжение трансплантата стволовых кроветворных клеток может происходить в результате иммунных и неиммунных механизмов. В первом случае донор и реципиент иммунологически различаются по локусам гистосовместимости. Риск иммунологически опосредованного отторжения трансплантата увеличивается при недостаточных дозах иммуносупрессивных препаратов в режимах кондиционирования и после проведения Т-клеточной деплеции.
Неиммунная реакция «хозяин против трансплантата» обусловлена недостаточным количеством трансплантированных стволовых кроветворных клеток.
Реакция «трансплантат против хозяина». Развитие РТПХ инициируется Т-лимфоцитами, которые способствуют выработке цитокинов (интерлейкин-2, фактор некроза опухоли-а, интерферон-у и др.). Совместное воздействие Т-лимфоцитов (прежде всего CD4+) и цитокинов приводит к повреждению тканей. Основными органами-мишенями при РТПХ являются кожа, печень и кишечник.
Реакция «трансплантат против опухоли». Возникновение РТПХ имеет не только отрицательные стороны. У больных со злокачественными новообразованиями РТПХ сопровождается развитием реакции «трансплантат против опухоли», приводящей к более полному уничтожению резидуальных опухолевых клеток.
Реакция «трансплантат против опухоли» используется в клинической практике при рецидиве после трансплантации аллогенных стволовых кроветворных клеток: введение таким пациентам дополнительного количества лимфоцитов от донора СКК приводит к улучшению результатов лечения.
Восстановление иммунной системы после трансплантации стволовых кроветворных клеток. После проведения миелотрансплантации в течение длительного времени у реципиента сохраняется выраженный иммунодефицит. Полное восстановление иммунной системы после трансплантации аллогенных СКК происходит в среднем через год.
Преимущества и недостатки различных видов миелотрансплантации
В целом АлТКМ/АлТСКК характеризуется лучшими отдаленными результатами и является методом выбора при заболеваниях с поражением костного мозга (лейкозы, апластическая анемия). Проведение АТКМ/АТСКК целесообразно прежде всего при отсутствии поражения костного мозга (лимфогранулематоз, неходжкинские лимфомы).
Трансплантация стволовых кроветворных клеток периферической крови. Установлено, что СКК в ряде случаев (назначение КСФ, «выход» из постцитостатического агранулоцитоза) появляются в периферической крови. С помощью МКА можно идентифицировать популяцию СКК (CD34+), а автоматический сепаратор клеток крови позволяет получить их в необходимом количестве.
Основные преимущества АлТСКК/АТСКК:
1) нет необходимости в общей анестезии;
2) меньшая длительность периода цитопении;
3) более быстрое восстановление иммунной системы;
4) возможность проведения при фиброзе костного мозга.
В настоящее время АТСКК практически полностью вытеснила из клинической практики АТКМ; при аллогенной трансплантации СКК костного мозга и периферической крови используются приблизительно с одинаковой частотой.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021