за счет каких функциональных групп белки обладают амфотерными свойствами
Амфотерность белков.
Амфотерность белков (наличие у молекул как кислотных, так и оснόвных свойств) обусловлена присутствием в их молекулах свободных карбоксильных групп (кислотные группы) и аминогрупп (оснόвные группы). Эти группы входят в состав радикалов аминокислот и, как было выше указано, не участвуют в образовании пептидных связей. Проявление белками кислотных или осноόвных свойств зависит от кислотности среды.







Таким образом, белки в кислой среде проявляют оснóвные (щелочные) и находятся в катионной форме (их молекулы заряжены положительно).
 |  |



Поэтому в щелочной среде белки обладают кислотными свойствами и находятся в анионной форме (их молекулы заряжены отрицательно).
 |

Значение рН, при котором молекулы белка нейтральны, называется изоэлектрической точкой белка и обозначается рI или рНиэт.. Для каждого белка изоэлектрическая точка имеет строго определенную величину. Значение рI зависит от соотношения в молекуле белка между аминокислотами, содержащими в радикале карбоксильную группу (моноаминодикарбоновые кислоты), и аминокислотами, содержащими в радикале аминогруппу (диаминомонокарбоновые кислоты). Если в белке преобладают аминокислоты с дополнительной карбоксильной группой, то значение изоэлектрической точки находится в кислой среде (рI
Дата добавления: 2015-03-11 ; просмотров: 13396 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
За счет каких функциональных групп белки обладают амфотерными свойствами
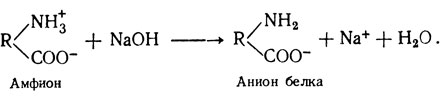
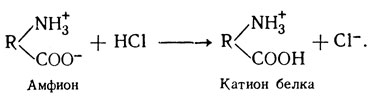
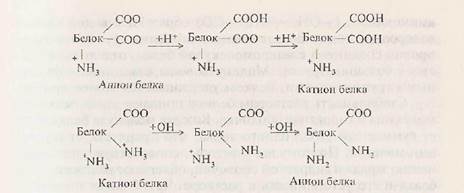
При изучении химического состава белка было установлено, что в его молекуле имеются свободные аминные (NH2) и карбоксильные (СООН) группы, которые в растворе находятся в виде NH3 и СООН. Следовательно, белки в растворе обладают амфотерными свойствами (амфолит, амфион). При пропускании электрического тока белки будут передвигаться в зависимости от заряда белковой молекулы к катоду или аноду (рис. 10).
В щелочных растворах белок играет роль аниона: например, при действии едкого натра происходит потеря Н + из NH + 3:
В кислых растворах, наоборот, белок играет роль катиона, как в случае с соляной кислотой:
Однако при определенных значениях рН число положительных зарядов белка будет равно числу отрицательных и заряд молекулы в целом будет практически равен нулю. Белковая молекула не будет перемещаться в электрическом поле. При этих условиях белок находится в изоэлектрическом состоянии; рН раствора, при котором белок находится в изоэлектрическом состоянии, называется изоэлектрической точкой. Изоэлектрическая точка большинства природных белков лежит в слабокислой среде (рН 4,8-5,4). Молекула таких белков содержит больше карбоксильных групп, чем аминных. Это свидетельствует о том, что в их составе содержится больше дикарбоновых аминокислот (см. Аминокислоты). В изоэлектрической точке белок находится в наименее устойчивом состоянии и при незначительных изменениях рН среды в кислую или щелочную сторону он легко выпадает в осадок.
Амфотерность белков лежит в основе белковой буферной системы, которая участвует в поддержании определенной реакции среды крови. Амфотерные свойства белков используются для разделения их на отдельные фракции (метод электрофореза) с целью диагностики различных заболеваний и контроля за состоянием больного.
Белок как амфотерный коллоид. Заряд белковой молекулы.
Белки обладают свойством амфотерности, то есть в зависимости от условий проявляют как кислотные, так и осно́вные свойства. В белках присутствуют несколько типов химических группировок, способных к ионизации в водном растворе: карбоксильные остатки боковых цепей кислых аминокислот (аспарагиновая и глутаминовая кислоты) и азотсодержащие группы боковых цепей основных аминокислот (в первую очередь, ε-аминогруппа лизина и амидиновый остаток CNH(NH2) аргинина).
Каждый белок характеризуется изоэлектрической точкой (pI) — кислотностью среды (pH), при которой суммарный электрический заряд молекул данного белка равен нулю и, соответственно, они не перемещаются в электрическом поле (например, при электрофорезе). В изоэлектрической точке гидратация и растворимость белка минимальны. Величина pI зависит от соотношения кислых и основных аминокислотных остатков в белке: у белков, содержащих много кислых аминокислотных остатков, изоэлектрические точки лежат в кислой области (такие белки называют кислыми), а у белков, содержащих больше основных остатков, — в щелочной (основные белки). Значение pI данного белка также может меняться в зависимости от ионной силы и типа буферного раствора, в котором он находится, так как нейтральные соли влияют на степень ионизации химических группировок белка. pI белка можно определить, например, из кривой титрования или с помощью изоэлектрофокусирования.
Амфотерность белков определяется не только присутствием свободных карбоксильных или аминогрупп в белке, но и наличием других функциональных группировок. Слабо выраженными кислотными свойствами обладают SH-группа цистеина и ОН-группа тирозина.
Электрические свойства белков определяются присутствием на их поверхности положительно и отрицательно заряженных аминокислотных остатков. Наличие заряженных группировок белка определяет суммарный заряд белковой молекулы. Если в белках преобладают отрицательно заряженные аминокислоты, то его молекула в нейтральном растворе будет иметь отрицательный заряд, если преобладают положительно заряженные – молекула будет иметь положительный заряд. Суммарный заряд белковой молекулы зависит и от кислотности (рН) среды. При увеличении концентрации ионов водорода (увеличении кислотности) происходит подавление диссоциации карбоксильных групп:
и в то же время увеличивается число протонированных амино-групп;
Таким образом, при увеличении кислотности среды происходит уменьшение на поверхности молекулы белка числа отрицательно заряженных и увеличение числа положительно заряженных групп. Совсем другая картина наблюдается при снижении концентрации ионов водорода и увеличении концентрации гидроксид-ионов. Число диссоциированных карбоксильных групп возрастает
и снижается число протонированных аминогрупп
Итак, изменяя кислотность среды, можно изменить и заряд молекулы белка. При увеличении кислотности среды в молекуле белка снижается число отрицательно заряженных группировок и увеличивается число положительно заряженных, молекула постепенно теряет отрицательный и приобретает положительный заряд. При снижении кислотности раствора наблюдается противоположная картина.
7) Изоэлектрическая точка (pI)— кислотность среды (pH), при которой определённая молекула или поверхность не несёт электрического заряда.
В изоэлектрической точке суммарный заряд белков, обладающих амфотерными свойствами, равен нулю и белки не перемещаются в электрическом поле. Зная аминокислотный состав белка, можно приближенно определить изоэлектрическую точку (pI); pI является характерной константой белков. Изоэлектрическая точка большинства белков животных тканей лежит в пределах от 5,5 до 7,0, что свидетельствует о частичном преобладании кислых аминокислот. Однако в природе имеются белки, у которых значения изоэлектрических точек лежат в крайних значениях рН среды.
В изоэлектрической точке белки наименее устойчивы в растворе и легко выпадают в осадок. Изоэлектрическая точка белка в сильной степени зависит от присутствия в растворе ионов солей; в то же время на ее величину не влияет концентрация белка. В химии белков существует понятие «изоионная точка белка». Раствор белка называется изоионным, если он не содержит никаких других ионов, кроме ионизированных остатков аминокислот белковой молекулы и ионов, образующихся при диссоциации воды. Для освобождения белка от посторонних ионов обычно его раствор пропускают через колонку, наполненную смесью анионо- и катионообменников. Изоионной точкой данного белка принято называть значение рН изоионного раствора этого белка:
где [Р] – молярная концентрация белка; Z – средний заряд молекулы. Согласно этому уравнению, изоионная точка белка зависит от его концентрации. Очевидно, поэтому белок, за исключением случая, когда рI равно 7, не может быть одновременно изоэлектрическим и изоионным.
8) для белков характерна сложная структурная организация молекулы. Различают первичную,вторичную,третичную структуры. Ряд белков обладает и четвертичной структурой.
Первичная структура-это последовательность аминокислот в полипептидной цепи, связанных ковалентной кислото-амидной(пептидной связью). 20 аминокислот, формирующих первичную структуру белков, называются протеиногенными (протеин-белок). Поскольку в образовании пептидной связи участвуют только А-амино и А-карбоксильные группы аминокислот, первичная структура всегда линейна. Зная первичную структуру, местоположение каждого остатка аминокислоты, можно точно написать структурную формулу белковой молекулы, если она представлена одной полипептидной цепью. Она отвечает за последующие уровни организации белков, определяет большинство физико-химических свойств, видовую и тканевую специфичность, а также и функции белков.
9)аминокислотные остатки в пептидной цепи белков чередуются не случайным образом, а расположены в определенном порядке. линейная последовательность аминокислотных остатков в полипептидной цепи называют «первичной структурой белка».
Каждый из 50 000 индивидуальных белков организма человека имеет уникальную для данного белка первичную структуру. Все молекулы данного индивидуального белка имеют одинаковое чередование аминокислотных остатков в белке, что в первую очередь отличает данный индивидуальный белок от любого другого.
10)Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
9) из известных 20 аминокислот, каждая имеет помимо аминной и карбоксильной групп свой радикал, отличающий ее от других аминокислот. В зависимости от наличия какого-либо радикала, аминокислоты образуют различные белки третичной и четвертичной структур. Образованные домены участвуют в строении четвертичных структур белка. Они связываются между собой благодаря особой последовательности радикалов, которые как бы подходят друг к другу, как «ключ к замку». Таким образом последовательность и положение радикалов обуславливают четвертичную структуру белка. Так же они способствуют образованию активного центра на глобулах, с помощью которого белки могут соединяться с лигандами органического и неорганического строения. От этого зависит их функция. Например, гемоглобин.
11) первичная структура белка представляет собой цепь последовательно расположенных аминокислотных остатков связанных между собой пептидными связями( СО-NH). Полимерные цепи обуславливают структуру и функцию белка. Замена или нехватка одной или нескольких аминокислот ведет и изменение структуры белка и его функции. В этом и заключается специфичность первичной структуры, так как она определяет строение белка. Примером образований из первичной структуры являются нуклеиновые кислоты, биополимеры, образованные остатками нуклеотидов. Нуклеиновые кислоты ДНК и РНК присутствуют в клетках
12.Первичная структура белка.
В настоящее время расшифрована первичная структура около 2500 белков, а в природе имеется 10 в12степени разнообразных белков.
Первичная структура – это последовательность (порядок) соединения аминокислотных остатков с помощью пептидной связи.
Пептидная связь образуется за счет карбоксильной группы одной аминокислоты и аминогруппы другой аминокислоты.
Пептидная связь образует остов полипептидной цепи, она является повторяющимся фрагментом:-CH-CO-NH-
Определение первичной структуры белков сводится к выяснению порядка расположения аминокислот в полипептидной цепочке. Эту задачу решают с помощью метода секвенирования (от англ. sequence последовательность).
секвенирование на его сегодняшнем уровне позволяет определить аминокислотную последовательность а полипептидах, размер которых не превышает несколько десятков аминокислотных остатков. В то же время исследуемые полипептидные фрагменты значительно короче тех природных белков, с которыми приходится иметь дело. Поэтому необходимо предварительное разрезание исходного полипептида на короткие фрагменты. После секвенирования полученных фрагментов их необходимо снова сшить в первоначальной последовательности.
определение первичной последовательности белка сводится к следующим основным этапам:
1) Расщепление белка на несколько фрагментов длиной, доступной для секвенирования.
2) Секвенирование каждого из полученных фрагментов.
3) Сборка полной структуры белка из установленных структур его фрагментов.
Химические методы:
Затем определяют какой перед нами олигопептид,с N-илиC-концевой аминокислотой.
Если с N-концевой,то используется либо метод Сенгера,либо метод Эдмана.
Метод Сенгера:основан на реакции арелирования полипептида1-фтор-2,4-динитробензола(ФДНБ),что приводит к образованию окрашенного в жёлтый цвет2,4-динитрофенильного производного N-концевой аминокислоты.N-аминокислоту идентифицируют хроматографией.
Метод Эмана:получил большее распространение благодаря большей чувствительности и возможности многократного применения в одной и той же пробе.фенилизотиоцианат реагирует со свободнойNH с образованием фенилтиокарбамоилпептида.затем природу аминлокислоты устанавливают хроматографически.метод эдмана используется в качестве химической основы для определения первичной структуры белков и пептидов;реализован в специальном приборе секвенаторе.
Если с C-концевой,то используется метод Акабори.
Метод Акабори :основан на гидразинолизе полипептида.гидразин,вызывая распад чувствительных к нему пептидных связей полипептида,реагирут со всеми аминокислотами за исключением С-концевой аминокислоты.образуется смесь аминоацилгидрозинов и свободной С-концевой аминокислоты.
Определяется чередование аминокислот в каждом индивидуальном пептиде. воссоздаётся первичная структура.
Современные методы определения первичной структуры белка:
данные о нуклеотидной последовательности кодонов РНК,позволяющие определить последовательность аминокислот в белковой молекуле.
Зная первичную структуру,можно написать стуктурную формулу белковой молекулы,а начит снтезировать этот белок искусственным путём и знать его свойства.
13.Вторичная структура белка-конфигурация полипептидной цепи,т.е.способ свёртывания,скручиванияполипептидной цепи в спиральную или какую-либо другую конформацию.процесс этот протекает не хаотично,а в соответствии с программой заложенной в первичной структуре.
14.третичная структура белка-трёхмерная пространственная структура, образующаяся за счет взаимодействия между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи. Различают две основные формы конформаций: Т-форму (от англ. tensed – напряженная) и R-форму (от англ. relaxed – расслабленная). Между этими формами осуществляются переходы, соответственно отражающиеся в биологических свойствах.
В соответствии с формой белковой молекулы, обусловленной третичной структурой, выделяют следующие группы белков:
15.связи,участвующие в формировании третичной структуры белка:
гидрофобные взаимодействия и силы ванн дер Ваальса между близко прилегающими друг к другу атомами. в результате белковой глобулы формируется гидрофобное ядро.
Ионные связивозникают между заряженными(анионными)карбоксильными группами радикалов и положительно заряженными (катионными )группами радикалов.
Водородные связи возникают между гидрофильными незаряженными группами (-ОН,,SH-группы) и любыми другими гидрофильными группами.
ковалентные связи:к ним относятся дисульфидные связи,образовавшиеся за счет взаимодействия SH-групп двух остатков цистеина.большинство внутриклеточных белков лишены дисульфидных связей,но такие связи характерны для белков,секретируемых клеткой во внеклеточное пространство.к таким белкам относятся гормон инсулин и иммуноглобулин.
трехмерная структура белковой молекулы также содержит информацию, но уже совершенно нового типа, а именно функциональную, которую акад. В.А. Энгельгардт назвал интрамолекулярной информацией. Как будет показано далее, все биологические свойства белков (каталитические, гормональные, антигенные и др.) связаны с сохранностью их третичной структуры, которую принято называть нативной конформацией. Любые воздействия (термические, физические, химические), приводящие к нарушению этой конформацииHYPERLINK «http://www.xumuk.ru/encyklopedia/2111.html» молекулы (разрыв водородных и других нековалентных связей), сопровождаются частичной или полной потерей белком его биологических свойств.
16.фолдинг белков-процесс сворачивания полипептидной цепи в правильную пространственную структуру.для многих белков,имеющих высокую молекулярную массу и сложную пространственную структуру,фолдинг протекаетпри участии специальной группы белков,которые называют шапероны(няни).на вновь синтезированном полипептиде имеется множество гидрофобных радикалов,ещё не спрятанных внутрь молекулы,и поэтому эти пептиды склонны к агрегации.белки-шапероны на время формирования нативной конформации белка отделяют реакционно-способные аминокислотные остатки от таких же остатков других аминокислот,дабы не произошла агрегация.
Шаперо́ны (англ. chaperones) — класс белков, главная функция которых состоит в восстановлении правильной третичной структуры повреждённых белков, а также образование и диссоциация белковых комплексов. Термин «молекулярный шаперон» впервые был использован в работе Ласкей и других при описании ядерного белка нуклеоплазмина, способного предотвращатьагрегирование белков-гистонов с ДНК при образовании нуклеосом. Шапероны есть во всех живых организмах, и механизм их действия, нековалентное присоединение к белкам и их «расплетение» с использованием энергии гидролизаАТФ также консервативен.
Многие шапероны являются белками теплового шока, то есть белками, экспрессия которых начинается в ответ на рост температуры или другие клеточные стрессы. Тепло сильно влияет на фолдинг белка, а некоторые шапероны участвуют в исправлении потенциального вреда, который возникает из-за неправильного сворачивания белков.
Другие шапероны участвуют в фолдинге только что созданных белков в тот момент, когда они «вытягиваются» из рибосомы. И хотя большинство только что синтезированных белков могут сворачиваться и при отсутствии шаперонов, некоторому меньшинству обязательно требуется их присутствие.
Другие типы шаперонов участвуют в транспортировке веществ сквозь мембраны, например в митохондриях иэндоплазматическомHYPERLINK «http://ru.wikipedia.org/wiki/%D0%AD%D0%BD%D0%B4%D0%BE%D0%BF%D0%BB%D0%B0%D0%B7%D0%BC%D0%B0%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%80%D0%B5%D1%82%D0%B8%D0%BA%D1%83%D0%BB%D1%83%D0%BC» HYPERLINK «http://ru.wikipedia.org/wiki/%D0%AD%D0%BD%D0%B4%D0%BE%D0%BF%D0%BB%D0%B0%D0%B7%D0%BC%D0%B0%D1%82%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D1%80%D0%B5%D1%82%D0%B8%D0%BA%D1%83%D0%BB%D1%83%D0%BC»ретикулуме у эукариот.
Продолжают обнаруживаться новые функции шаперонов, например, участие в разрушении белка, деятельности бактериального адгезина и в реакциях на заболевания, связанные с агрегацией белков.
Амфотерные свойства белков
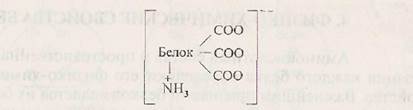
Природные белки в зависимости от состава аминокислот могут иметь кислый или основной характер. В кислых белках преобладают моноаминодикарбоновьге кислоты (Асп и Глу). Молекула такого белка в растворе заряжена отрицательно:
Большинство белков относится к кислым, например альбумины, глобулины, казеин, пепсин и др.
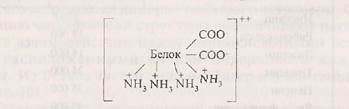
В молекулах белков основного характера преобладают ди-аминомонокарбоновые кислоты (Лиз, Арг, Гис). В растворе основные белки несут положительный заряд:
Среди этих белков — папаин, трипсин, лизоцим и др.
Суммарный заряд белковой молекулы, естественно, зависит от рН среды: в кислой среде он положителен, в щелочной — отрицателен. Распределение заряда на поверхности молекулы неравномерно, различные участки ее могут иметь противоположные заряды, стабилизированные диполями воды. Сдвиг рН среды приводит к изменению характера диссоциации группировок аминокислот, перераспределению зарядов на поверхности молекулы, что является причиной изменения пространственной структуры белка, следовательно, его биологической активности.
Наличие большого числа точек диссоциации определяет способность белка взаимодействовать с ионами металлов и другими заряженными макромолекулами, что очень важно для функционирования белков. Изменяя рН среды, можно влиять на константу диссоциации белковой молекулы как кислоты и как основания.
 |
Изоэлектрическая точка является характерной константой белка и зависит от аминокислотного состава белковой молекулы. Чем выше соотношение кислые/основные амино-кислоты в белке, тем ниже его рН. Для большинства внутриклеточных белков рН находится в области рН от 5,5 до 7,0, что свидетельствует об отрицательном заряде цитоплазмы в ценим. Избыток отрицательных зарядов внутри клетки урав-пшичмивается неорганическими катионами.
Значение изоэлектрической точки очень важно для понимания стабильности белков в растворах, так как в ней бельм нгледствие электронейтральности наименее устойчивы. Незаряженные частицы белка могут слипаться друг с другом и выпадать в осадок.
Растворимость белков
Белки — гидрофильные вещества, хорошо растворимые в воде. Под гидратацией понимают связывание диполей воды с ионными и полярными группами. Ионными группами в белках, несущими заряд, являются все —МН2— и — СООН-группы. В диссоциированном состоянии они притягивают молекулы воды за счет ион-диполъных взаимодействий. Неионные (незаряженные) полярные боковые группировки аминокислот (—ОН, — NН, —СО) образуют с водой слабые водородные связи. Вода, связанная ионными группами, очень прочно соединена с макромолекулой белка, отделить ее удается с большим трудом. Молекулы воды, связанные с неионными группировками, белком удерживаются менее прочно. Стабильность растворам белков придают заряд белковой молекулы и гидратная оболочка, Каждая молекула белка имеет суммарный заряд одного знака, что препятствует агрегации молекул. Поэтому все факторы, способствующие сохранению заряда и гидратной оболочки, облегчают растворимость белка и его устойчивость в растворе. Чем больше полярных аминокислот в белке, тем больше молекул воды связывается. Гидратная вода может составлять до 1/5 массы белка.
Растворимость белков в воде возрастает при небольших концентрациях нейтральных солей. Это объясняется следующим: ионы солей, взаимодействуя с противоположными зарядами в белке, экранируют заряженные группы белковых молекул и тем самым уменьшают белковое взаимодействие. Повышение концентрации нейтральных солей (увеличение ионной силы раствора) оказывает обратное действие. Процесс осаждения белков нейтральными солями называется высаливанием. При больших концентрациях ионов в растворе они оттягивают молекулы воды от полярных групп белка на себя. При этом гидратная оболочка белковой молекулы частично снимается, т. е нарушается один из факторов устойчивости белка в растворе. Возможно, одновременно происходит нейтрализация зарядов белка ионами солей, что приводит к изменению второго фактора устойчивости (изменению заряда белка в целом), а следовательно, осаждению белка из раствора. Характерной особенностью белков, полученных при высаливании, является сохранение ими своих природных свойств и функций после удаления соли.
Растворимость белков зависит и от растворителя: его рН, состава и температуры. Добавление к белковому раствору смешивающихся с водой органических растворителей (этанола, ацетона и др.) уменьшает растворимость белков. При высоких концентрациях растворителей наблюдается выпадение белка в осадок (в связи с уменьшением степени гидратации белка). В растворах белки обладают коллоидными свойствами: они медленно диффундируют, не способны проникать через полупроницаемые мембраны, рассеивают свет, характеризуются высокой вязкостью.
Образование коллоидных растворов белками обусловливает многие физико-химические явления, наблюдающиеся II биологических жидкостях и организмах в целом. При определенных условиях все коллоидные растворы могут терять текучесть и образовывать гели (студни). Они возникают в результате объединения молекул в виде сетки, внутреннее пространство которой заполнено большим количеством раст-иорителя, но при этом разделения на жидкую и твердую фазы не происходит, как в случае коагуляции. В клетках живых организмов белки находятся не только в виде растворов, но и гелей (в протоплазме, хрусталике глаза, соединительных тканях и др.). Гелеобразованию легче подвергаются фибриллярные белки. Так, пищевые студни готовят из продуктов, содержащим в большом количестве фибриллярные белки (кости, хрящи, мясо). Под действием ферментов микроорганизмов белковый раствор — молоко может переходить в гель с образованием кефира, простокваши.
Белковые гели имеют важное физиологическое значение к жизнедеятельности организма. Например, коллагеновые белки костей, сухожилий, кожи и т. п. обладают высокой прочностью, эластичностью и упругостью, так как находятся в гелеобразном состоянии. Отложение минеральных солей при старении снижает их упругость и эластичность, что приводит к ряду заболеваний.
Одним из свойств гелей является их способность к набуханию — увеличению объема за счет связывания большого количества воды. Такой процесс наблюдается при прорастании семян, при замачивании крупы, при изготовлении теста и т. д. Явление обратное набуханию (отделение воды от геля) называется синерезисом. Оно протекает, например, при дли-имп.пом хранении кефира.
Благодаря наличию гидрофильных и гидрофобных групп пгнки могут влиять на растворимость других веществ, высту-м.чи и роли эмульгаторов. Известно, что эмульгаторами явля-мнгн иещества, стабилизирующие эмульсии типа «вода — лито». В организме человека в эмульгированном состоянии млчодятся жиры в крови и лимфе. Белок образует на поверхности капелек жира (за счет гидрофобных взаимодействий) тонкую пленку, которая притягивает воду (за счет полярных групп) и препятствует слипанию жировых частиц. Казеин молока можно рассматривать как эмульгатор, стабилизирующий природную эмульсию — молоко.
Денатурация белков
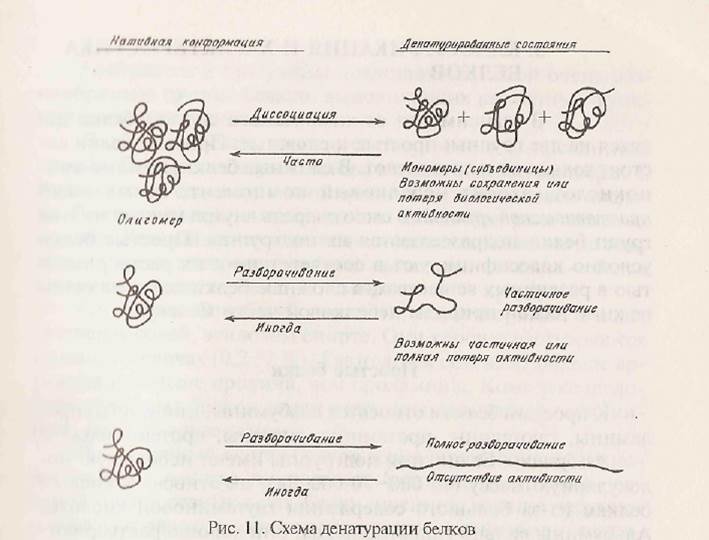
Под действием различных факторов нативная пространственная структура белковой молекулы может нарушаться: разрушаются четвертичная, третичная и вторичная структуры (изменения не затрагивают первичную структуру). Это явление называется денатурацией. Денатурация белка приводит к уменьшению или полной потере растворимости, утрате специфической биологической активности, изменению оптических свойств и вязкости и др. При денатурации разрываются связи, стабилизирующие структуру белковой молекулы: ионные, водородные и дисульфидные, нарушается гидрофобное взаимодействие. ГТолипептидная цепь раскручивается и находится в растворе в развернутом состоянии или в виде беспорядочного клубка. Степень денатурации белка может быть различной в зависимости от его физико-химических свойств, природы денатурирующего агента и времени его действия. Схематично процессы денатурации изображены на рисунке 11. Отметим, что для некоторых белков денатурация обратима (белки мышц). При этом и нативная конформация и биологическая активность белка могут быть восстановлены. Денатурирующие факторы можно разделить на физические и химические. К физическим агентам относится температура, давление, механическое воздействие, ультразвуковое и ионизирующее излучение. Наиболее общим фактором является нагревание. Тепловая денатурация белков — один из характерных их признаков. Усиление теплового движения атомов полипептидной цепи приводит к разрыву слабых нековалентных связей. Скорость тепловой денатурации существенно зависит от рН среды, ионной силы раствора. Тепловая денатурация сопровождается агрегацией белков, выпадением их в осадок. Наиболее полное и быстрое осаждение происходит в изоэлектрической точке.
Белки денатурируют при растирании сухих препаратов, энергичном встряхивании растворов, взбивании и т. д. При лиофилизации белков (высушивание в вакууме путем возгонки влаги из замороженного состояния) большинство их не денатурирует, что позволяет использовать этот способ сушки для длительного хранения белковых препаратов.
К химическим факторам, вызывающим денатурацию, относятся кислоты, щелочи, органические растворители, поверхностно-активные вещества, алкалоиды, тяжелые металлы и т. п.
Денатурация белков играет существенную роль в жизненных процессах. По мере старения организма происходит постепенная дена!урация белков и снижение их гидрофильности. Так, при старении семян денатурация белков приводит к потере их способности к прорастанию. Происходящее при денатурации превращение компактной молекулы в беспорядочный клубок облегчает доступ протеолитических ферментов к пептидным связям, которые они разрывают. Поэтому денатурированные белки легче расщепляются ферментами, чем нативные. Следовательно, денатурированные белки в желудочно-кишечном тракте человека будут лучше перевариваться. Этому способствует термическая обработка продуктов, содержащих белки (мясо, рыба). В желудке человека вырабатывается соляная кислота, которая, вызывая денатурацию белков, помогает расщеплению их ферментами и усвоению организмом.
Целый ряд технологических процессов получения пищевых продуктов (выпечка хлеба и кондитерских изделий, сушка макарон, овощей, молока, яичного порошка, изготовление консервов и т. д.) связан с частичной денатурацией белков, входящих в состав сырья.