железо имеет аллотропических формы
Аллотропические видоизменения чистого железа
Многие металлы в зависимости от температуры претерпевают структурные изменения кристаллической решетки.
Железо, олово, титан и другие металлы обладают свойствами аллотропии, т.е. способностью одного и того же элемента при различной температуре иметь разную кристаллическую структуру. Аллотропические превращения сопровождаются выделением или поглощением теплоты. Железо имеет четыре аллотропические формы: 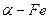
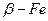


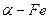

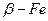

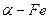
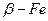
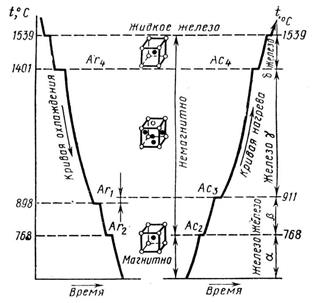
Температура, при которой, происходит переход металла из одного аллотропического вида в другой, называется критической. Величины этих температур видны на диаграмме охлаждения и нагревания чистого железа (рис. 2) в виде участков, свидетельствующих о том, что фазовые превращения происходят с выделением теплоты при нагревании. До точки Кюри ( 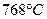
Рис. 2. Кривые охлаждения и нагревания железа
Все металлы находятся в твердом состоянии до определенной температуры. При нагреве металла амплитуда колебания атомов достигает некоторой критической величины, при которой происходят разрушение кристаллической решетки и переход металлов из твердого в жидкое состояние. Процесс кристаллизации заключается в росте кристаллов путем отложения новых кристаллических групп вокруг возникших зародышей. Рост кристаллических образований происходит в определенных направлениях. Вначале образуются главные оси кристалла путем роста в трех взаимно перпендикулярных направлениях, а затем от каждой из этих осей образуются новые и возникает не полностью завершенный кристалл, называемый дендритом. В дальнейшем все промежутки между осями дендрита заполняются упорядоченно расположенными атомами.
В условиях несвободной кристаллизации образующиеся кристаллы получают неправильные очертания и форму и называются кристаллитами, или зернами. Величина зерен оказывает существенное влияние на механические свойства металлов: чем мельче зерна, тем прочнее металл.
Технические металлы и сплавы представляют собой поликристаллические тела, состоящие из большого числа различно ориентированных кристаллических зерен (поперечные размеры зерен 0,001 – 0,1 мм). Поэтому в целом металлы принято считать условно изотропными телами.
Однако при одинаковой ориентации кристаллитов такой мнимой изотропности наблюдаться не будет. Кристаллическая решетка реальных металлов и сплавов далека от идеального строения.
Аллотропные формы железа



Железоуглеродистые и легированные сплавы
1. Стали – ковкие сплавы, содержащие до 2,14 % углерода.
Чугуны – хрупкие сплавы содержащие от 2,14 до 6, 67 % углерода
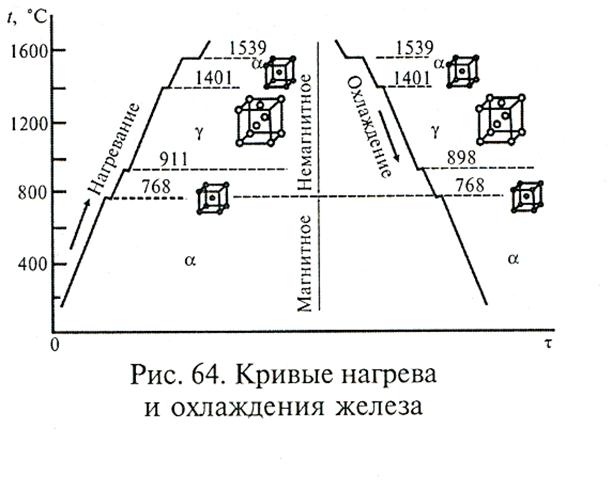
α- железо – кристаллическая решётка – центрированный куб, растворяет до 0,025 % углерода, магнитно.
β – имеет увеличенный параметр (размер) кристаллической решётки, теряет магнитные свойства.
γ – кристаллическая решётка гранецен-трированный куб, немагнитно, способно растворять до 2,14 % углерода.
δ – кристаллическая решётка – центрированный куб с увеличенным параметром.
Структурные составляющие сплавов Fe – C
2) Цементит (Ц) – химическое соединение Fe3С (карбид железа). Содержит 6,67 % углерода, самая прочная и твёрдая составляющая сплавов, магнитный и очень хрупкий.
3) Аустенит (А) – твёрдый раствор внедрения углерода в γ –железе. Содержит до 2,14 % углерода при 1147 0 С, прочный, немагнитный, имеет невысокую твёрдость, хорошую пластичность, стойкий против коррозии ( существует при t >727 0 С ).
4) Перлит (П) – механическая смесь (эвтектоид) феррита и цементита, образуется при распаде аустенита в результате охлаждения. Содержит 0,83 % углерода, обладает высокой прочностью и упругостью, маловязкий.
5) Ледебурит (Л) – механическая смесь (эвтектика) состоящая из аустенита и цементита, а после охлаждения из перлита и цементита. Содержит 4,3 % углерода, твёрдый и хрупкий.
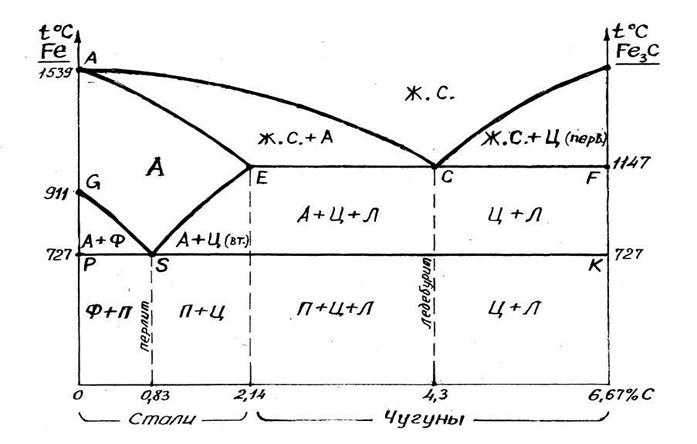
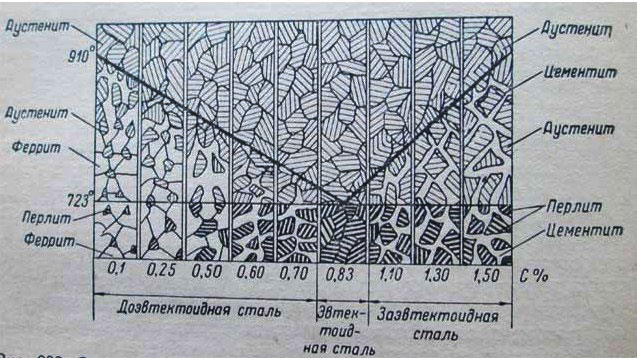
ACD – линия ликвидуса – начало первичной кристаллизации сплавов.
По AC – выпадают кристаллы аустенита, по CD – первичного цементита.
AECF – линия солидуса – заканчивается первичная кристаллизация сплавов.
По ES – аустенит начинает распадаться выделяя избыточный углерод в виде вторичного цементита.
В точке S – из аустенита одновременно кристаллизуются феррит и цементит, образуя эвтектоид – перлит.
Доэвтектоидные стали содержат феррит и перлит.
Заэвтектоидные ( > 0,83 % С) содержат перлит и цементит.
ECF – линия ледебуритного превращения – заканчивается первичная кристаллизация чугунов. В точке С (4,3 % С) при 1147 0 С одновременно кристаллизуются аустенит и цементит, образуя механическую смесь (эвтектику) – ледебурит.
По EC – образуются доэвтектические чугуны (2,14…4,3 % С). Они состоят из кристаллов аустенита и ледебурита. При охлаждении растворимость углерода в железе снижается и он выделяется из аустенита в виде вторичного цементита.
По CF – образуется заэвтектические чугуны (4,3…6,67 % С), которые состоят из ледебурита и первичного цементита (белые чугуны).
PSK – линия перлитного превращения. Ниже неё происходит окончательный распад аустенита, связанный с γ – α превращением в железе и образованием перлита.
Доэвтектические чугуны содержат перлит, цементит и ледебурит, заэвтектические – ледебурит и цементит.
Железо имеет аллотропических формы
Ярким примером аллотропии является железо, образующее в зависимости от температуры четыре основных аллотропических видоизменения, которые называют: α-Fе, β-Fe, γ-Fe, δ-Fe.
Фото кристаллических решеток железа
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
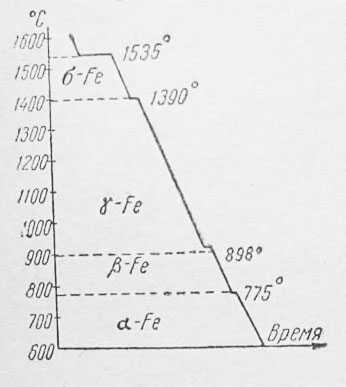
Ha этой кривой при переходах одной аллотропической формы в другую наблюдаются площадки постоянных температур, а именно:
при t=1535°— затвердевание железа с образованием δ-Fe;
фото кристаллических решеток железа
Рис. 2 Кривая охлаждения железа
Кроме твердых растворов углерода в железе, в железоуглеродистых сплавах встречается химическое соединение железа с углеродом — карбид железа Fe3C, который называется цементитом. Цементит содержит С — 6,67 %.
Аустенит и феррит отличаются пластичностью, феррит, кроме того, — мягкостью. Цементит чрезвычайно тверд и хрупок.
Что такое перлит и эвтектоид
В точке S кривая GS пересекается с ES — кривой предельной растворимости углерода в аустените. Поэтому дальнейшее насыщение остаточного аустенита углеродом становится уже невозможным, и последующее охлаждение вызывает окончательный распад аустенита, который совершается при постоянной температуре t=723°.
При этом распаде завершается переход γ- Fe->α-Fe, а выделившийся из кристаллической решетки железа углерод образует частицы цементита F3C. Распад аустенита происходит в стесненном объеме в пределах каждого зерна, поэтому продукты распада (феррит и цементит) образуются в виде тесно перемешанных частиц, обычно в виде чередующихся пластинок феррита и цементита.
Схема изменений структуры сталей при переходе через критические точки
Этот продукт распада аустенита называется перлитом; так как перлит имеет строение, подобное эвтектике, то он называется эвтектоидом. Разница между эвтектикой и эвтектоидом заключается в том, что эвтектика образуется из жидкого раствора, а эвтектоид — из твердого.
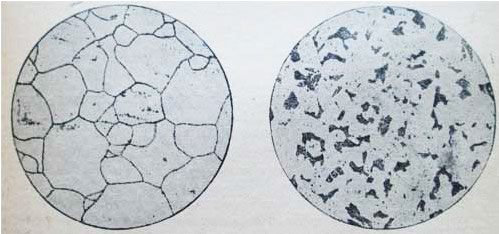
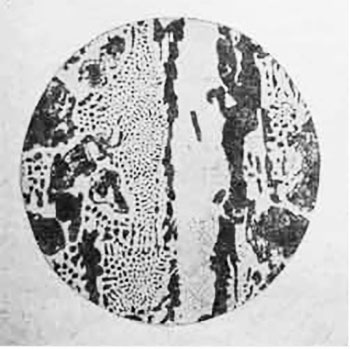
Образование перлита начинается и заканчивается при постоянной t=723°. Так ппявляется феррито-перлитовая структура сталей, которая при дальнейшем охлаждении от t=723° не претерпевает больше никаких структурных изменений. На рисунке представлены микроструктуры чистого железа и стали при С =0,15% и при С=0,6% (увеличение 100) после травления по-шрованной поверхности микрошлифа 4% раствором HNO3 в этиловом спирте.
Рис. 1. — феррит в чистом железе. Рис. 2 Доэвтектоидная сталь с содержанием С=0,15%
На рис. 1, где показана микроструктура чистого железа, четко выявились границы между светлыми зернами феррита. На рис. 2 представлена микроструктура строительной стали (С=0,15%); светлые поля — это феррит, темные участки — перлит.
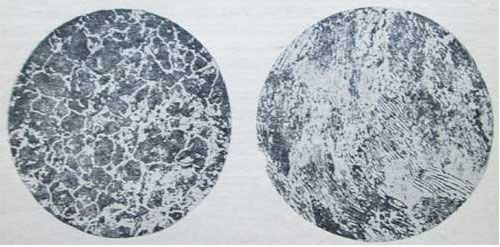
На рис. 3 приведена микроструктура машиностроительной стали (С=0,6%), из которой изготовляют оси, валы, шатуны и т. п.; большая часть шлифа занята перлитом, а феррит наблюдается только в виде тонкой сетки.
Чем больше углерода, тем больше в структуре стали перлита, состав перлита одинаков (С=0,83%). Строение перлита обычно пластинчатое (рис. 4).
Рис. 3 Доэвтектоидная сталь с содержанием С=0,6%. Рис. 4 Эвтектоидная сталь (пластинчатый перлит).
Феррит, как было указано выше, представляет собой наиболее мягкую пластичную составляющую железоуглеродистых сплавов; цементит, входящий в состав перлита, наиболее твердую и хрупкую, поэтому с увеличением содержания углерода увеличивается прочность и твердость стали, но пластичность и вязкость уменьшаются
Чтобы строительная сталь была достаточно пластичной, количество перлита в ней не должно превосходить 25%, что соответствует содержанию углерода до 0,2%.
В. тех деталях, от которых требуется большая прочность и твердость, но допустимы меньшая пластичность и вязкость (детали машин), применяются стали с большим количеством перлита, с содержанием С до 0,6%. В строительном деле такие стали применяются, например, для изготовления лопат, опорных частей мостовых ферм.
Возникновение цементно-перлитовой структуры
В сплавах, содержащих больше 0,83% углерода, структурные изменения при переходе через линии АС и А1Е протекают так же. Поэтому ниже линии А1Е структура затвердевшего сплава представляет собой аустенит. При дальнейшем охлаждении структурные изменения наступают тогда, когда достигнута SE —линия предельной растворимости углерода в аустените.
Так как при снижении температуры ниже линии SE растворимость углерода в аустените снижается, то из аустенита выделяется вторичный цементит, который выпадает обычном в виде сетки, окружающей аустенитовые зерна. Благодаря этому содержание углерода в аустените уменьшается и при t=723° доходит до С=0,83%, что соответствует эвтектоидному составу. Дальнейшее охлаждение вызывает распад аустенита, который постоянной температуре t=723° переходит в перлит. Таким образом возникает цементно-перлитовая структура, которая при дальнейшем охлаждении уже не претерпевает изменений.
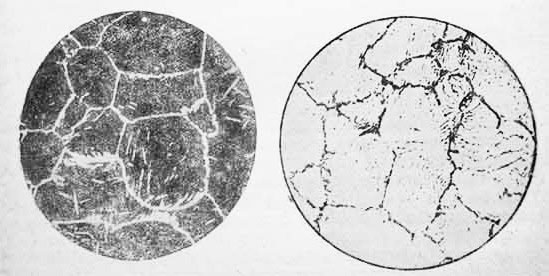
На рис. 1 цементит заметен в виде тонкой светлой сети окаймляющей темные зерна перлита, а на рис. 2 в виде темпе сетки. Стали с цементито-перлитовой структурой вследствие слишком малых пластичности и вязкости неприменимы для изготовления строительных конструкций и деталей машин. Из них делают инструменты, которым термической обработкой придают необходимую высокую твердость.
Рис.1 Заэвтектоидная сталь (после травления 4% раствором HNO3 в этиловом спирте. Рис.2 Заэвтектоидная сталь ( после травления пикратом натрия)
Несколько иначе протекают структурные изменения в сплавах при содержании С>1,7%. Например, из жидкого сплава с содержанием С в пределах 1,7—4,3%, превышающим предельную растворимость углерода в аустените (С=1,7%), по достижении температур линии АС начинают выделяться дендриты аустенита.
Этот процесс продолжается до тех пор, пока не будет достигнута температура линии ЕС. Концентрация углерода в выпадающих дендритах аустенита постепенно изменяется по линии А1Е. Концентрация углерода в жидком растворе увеличивается по линии АС и при t=1130° достигает С=4,3%, т. е. эвтектической концентрации. Дальнейшее охлаждение вызывает полный переход жидкого раствора, достигшего эвтектической концентрации, в твердое состояние.
Этот переход происходит при постоянной температуре t= 1130°; в результате образуется эвтектика, представляюшая собой смесь частиц аустенита и цементита—ледебурит. Таким образом, рассматриваемый сплав непосредственно после затвердевания будет состоять из аустенита и ледебурита. Дальнейшее охлаждение ниже t=1130° вызывает (вследствие уменьшения растворимости углерода по линии ES) выделение вторичного цементита из дендритов аустенита и из аустенита, входящего в состав ледебурита.
Выделение вторичного цементита наблюдается при падении температуры в интервале 1130—723°, причем при снижении температуры до t=723° концентрация углерода в остаточном аустените снижается до эвтектоидной концентрации, т. е. до С=0,83%. Дальнейшее охлаждение вызывает окончательный распад остаточного аустенита.
Этот распад происходит при постоянной температуре t=723°, причем весь аустенит (и выпавший в виде дендритов и входящий в состав ледебурита) переходит в перлит. Таким образом, ниже t=723° в структуре рассматриваемого сплава (рис. 3) содержится перлит, вторичный цеменит и видоизмененный ледебурит, состоящий из цеменита (основная масса) и перлита (округлые вкрапления).
Обычно и первоначальный ледебурит и видоизмененный объединяют общим названием ледебурит. Дальнейшее охлаждение не вызывает изменений в структуре сплава.
Железо имеет аллотропических формы
3658 дн. с момента
как существует сайт
Владельцы сайта
Железо.Свойства железа.
Удивительные факты о железе.
1.В 1813 году во время войны с Наполеоном прусская принцесса Марианна придумала способ пополнения казны. Немецким женщинам предложили обменивать золотые украшения на аналогичные ювелирные предметы из железа, на которых был надпись «Gold gab ich für Eisen» («Золотом отдам я за Железо»). Ношение таких украшений быстро вошло в моду и подчёркивало патриотизм обладательницы. Похожая идея способствовала созданию в том же 1813 году одной из самых знаменитых немецких наград, Железного креста. В отличие от других существующих медалей, Железный крест из драгоценного имел только скромную серебряную оправу.
2.Ледник Тейлора в Антарктиде знаменит Кровавым водопадом. Содержащееся в нем в двухвалентное железо, окисляясь кислородом воздуха, образует красного цвета окись железа, которое придаёт водопаду кроваво-рыжий оттенок. Производят двухвалентное железо бактерии, живущие на глубине под толщей льда.
3.На дне Индийского океана в области гидротермальных источников существуют улитки, раковина которых состоит из трех слоев: арагонита (материала обычного для моллюска), мягкого среднего слоя из органического наполнителя и внешнего из минерала железа. Кроме того, минералы железа входят в состав чешуек, покрывающих ногу улитки.
4.Атомиум — это гигантская молекула железа построенная в Брюсселе в 1958 году. Имеет девять круглых сфер диаметром 18 м, и является увеличенной копией молекулы железа в 165 миллиардов. Высота 102 метра, а суммарный вес этой конструкции превышает 2400 тонн. Туристы могут передвигаться от сферы к сфере по трубам длинна которых составляет 23 метра.
5.В Дели есть колонна, сделанная из железа, в котором есть немного примесей. Фактически это чистое железо. За много веков часть, которая находится на воздухе, практически не окислилась (вероятно, из-за сухости воздуха и наличию в составе фосфора), часть колонны, которая находится в земле, покрыта сантиметровым слоем ржавчины. Так что ничего сверхъестественного в том, что колона не ржавеет нет. Колонна изготовлена методом ковки отдельных криц, о чем говорят следы ковки и сварки (сварка также была сделана методом ковки).
Железо – химический элемент
Положение железа в периодической таблице химических элементов и строение его атома
Схема строения атома:
Электронная формула: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2
Металл средней активности, восстановитель:
Основные степени окисления: +2, +3
Железные руды довольно широко распространены на Земле. Названия гор на Урале говорят сами за себя: Высокая, Магнитная, Железная. Агрохимики в почвах находят соединения железа. Железо входит в состав большинства горных пород. Для получения железа используют железные руды с содержанием железа 30-70% и более.
Основными железными рудами являются :
Р оль железа в жизни человека и растений
Биохимики открыли важную роль железа в жизни растений, животных и человека. Входя в состав чрезвычайно сложно построенного органического соединения, называемого гемоглобином, железо обусловливает красную окраску этого вещества, от которого в свою очередь, зависит цвет крови человека и животных. В организме взрослого человека содержится 3 г чистого железа, 75% которого входит в состав гемоглобина. Основная роль гемоглобина – перенос кислорода из легких к тканям, а в обратном направлении – CO2.
Железо необходимо и растениям. Оно входит в состав цитоплазмы, участвует в процессе фотосинтеза. Растения, выращенные на субстрате, не содержащем железа, имеют белые листья. Маленькая добавка железа к субстрату – и они приобретают зеленый цвет. Больше того, стоит белый лист смазать раствором соли, содержащей железо, и вскоре смазанное место зеленеет. Так от одной и той же причины – наличия железа в соках и тканях – весело зеленеют листья растений и ярко румянятся щеки человека.
Физические свойства железа
Особенно важным свойством железа является его аллотропия, т.е. наличие нескольких кристаллических модификаций, что дает возможность упрочнять сплавы на основе железа.
Восстановлением из оксидов углём или оксидом углерода (II), а также водородом:
Алюминий используется для получения некоторых металлов. Этот метод называется алюминотермией. Метод основан на том, что порошкообразный алюминий при воспламенении восстанавливает оксиды многих металлов. При этом образуется очень чистый, свободный от углерода металл. Получим железо способом алюминотермии. Смесь порошкообразного алюминия и оксидов железа называется термитом. Приготовим термит и подожжем его. При горении термита алюминий восстанавливает железо из его оксида.
Получение железа.wmv
Химические свойства железа
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
4Fe + 3O 2 + 6H 2 O = 4Fe(OH) 3
3Fe + 2O 2 = Fe 3 O 4
Взаимодействие железа с кислородом
горение железа.wmv
3) При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H 2 O t˚C → Fe 3 O 4 + 4H 2
4) Железо реагирует с неметаллами при нагревании:
2Fe + 3Br 2 t˚C → 2FeBr 3
5) Железо легко растворяется в соляной и разбавленной серной кислотах при обычных условиях:
Fe + 2HCl = FeCl 2 + H 2
6) В концентрированных кислотах – окислителях железо растворяется только при нагревании. На холоде концентрированные азотная и серная кислоты пассивируют железо!
Взаимодействие железа с концентрированными кислотами
Безводная серная и азотная кисло ты пассивируют железо, не реагируют с ним. Однако концентрированные растворы этих кислот растворяют железо.
Концентрированная азотная кислота бурно реагирует с железом. Продукты реакции – нитрат железа ( III ) и бурый газ – диоксид азота ( IV ).
Концентрированная серная кислота тоже реагирует с железом. Выделяется сернистый газ.
7) Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Fe + CuSO 4 = FeSO 4 + Cu
Железо и его соединения.mp4
Кроссенс – это ассоциативная головоломка.
Название «кроссенс» переводится с английского языка как «пересечение смыслов»
и придумано по аналогии с словом «кроссворд», что означает «пересечение слов»…
Рассмотрите изображения. Как они связаны с темой этого урока?
Найдите ассоциации с изображениями и темой урока.