за счет каких клеток происходит регенерация
Процессы регенерации в слизистой оболочке желудка и канцерогенез
В клинической практике гастроэнтерологов нередко возникает необходимость воздействовать на процессы регенерации в гастродуоденальной зоне. В последние годы в связи с успехами молекулярной биологии существенно изменились представления о механизмах регуляции репаративных процессов. Воздействие на эти процессы требует осторожного подхода и глубокого понимания основных закономерностей.
Следует осознать, что вычленение отдельных компонентов этих процессов и воздействий регуляторных факторов носит условный характер, так как в организме они тесно связаны и переплетены между собой. После ознакомления с современными взглядами на общие закономерности регенераторных процессов мы конкретизируем их в отношении слизистой оболочки желудка, в частности в условиях геликобактерной инфекции.
Регенерацией (возрождением) называют процесс восстановления разрушенных или утраченных тканей, органов и отдельных частей тела живых существ.
Различают физиологическую и репаративную регенерацию.
В многоклеточном организме физиологической регенерацией называют процесс постоянного обновления клеток различных тканей. Биологический смысл процесса регенерации у многоклеточного организма заключается в восстановлении структуры, способной к выполнению специализированной функции. Достигается это либо восстановлением клеточной массы органа за счет гиперплазии клеток (клеточный тип регенерации), либо путем гиперплазии клеточных ультраструктур (внутриклеточный тип регенерации).
В ходе репаративной регенерации при восстановлении клеток, поврежденных патологическим процессом, включаются дополнительные механизмы, способствующие ускорению клеточного обновления. Репаративная регенерация может быть полной (реституция) при замещении дефекта тканью идентичной предсуществовавшей ткани и неполной (субституция), когда дефект ткани замещается тканью с более низким уровнем организации, например рубцом. В последние годы установлено, что при репаративной регенерации в органах формируются принципиально новые клеточные линии с новыми функциональными свойствами.
Основными компонентами регенераторного процесса являются: клеточная пролиферация и дифференцировка, миграция клеток, а также реструктуризация стромы и ангиогенез.
Реструктуризация стромы заключается в изменении клеточного состава и компонентов межклеточного матрикса собственной пластинки слизистой оболочки.
Процессы пролиферации и дифференцировки клеток в нормальных тканях организма теснейшим образом связываются понятием «клеточный путь».
Процессы пролиферации и дифференцировки клеток в ходе клеточного цикла идут параллельно и относительно автономно. Судьба клетки зависит от того, какой из этих процессов протекает быстрее.
Если подготовка к митозу произойдет быстрее, то клетка переходит в G1 фазу, и ее деление будет неизбежным. В противном случае клетка успеет продвинуться по пути дифференцировки настолько, что перейдет в фазу G0 следующего цикла (G0′). Длительность последней больше, чем фаза G0 предыдущего цикла, но теперь и времени для формирования механизмов митоза требуется больше. Время генерации клетки приближается ко времени ее жизни. Вероятность вступления в митоз уменьшается.
Английский эмбриолог Уодингтон предложил для описания представления о дифференцировке модель наклонной плоскости, по которой катится шарик. Недетерминированная клетка проходит при этом определенные дифференцировочные уровни, порог которых при нормальных условиях преодолим лишь в одном направлении.
На определенных этапах пути шарик попадает в дифференцировочные ямы, отражающие состояние относительной стабильности. Выйти из этого состояния клетка может в трех направлениях:
Схематически низший уровень на такой плоскости соответствует максимальной дифференцировке, то есть клетке с легко верифицируемым фенотипом, а схематически высший уровень соответствует идеальной зародышевой клетке, из которой может быть получен любой клеточный тип, входящий в организм данного вида.
В генетическом отношении дифференцировка клеток не является следствием коренных изменений генома, а определяется физико-химическими факторами, влияющими на геном. Разобщенные клетки не способны к дифференцировке. Дифференцировка одной клетки или клеток, изолированных друг от друга, невозможна.
Эксперименты с пересадкой ядер показали, что дифференцировка не связана с утратой или добавлением генетической информации. Ядро клетки любой ткани организма содержит одну и ту же генетическую информацию, но в большинстве дифференцированных клеток эта информация надежно заблокирована.
По теории открытого генома генетическая информация в недифференцированной клетке полностью открыта. Открытыми называются участки ДНК, доступные для молекул РНК-полимеразы, и, следовательно, для транскрипции с последующим синтезом белка.
Допускается, что в идеальной зародышевой клетке могут синтезироваться (хотя и в минимальных количествах) все белки, возможные для данного организма.
По мере дифференцировки происходит открытие одних генов и закрытие других. На разных стадиях развития и у клеток различных типов различны и зоны открытой ДНК. Закрытие генов осуществляется путем связывания нитей ДНК с основными белками гистонового типа. При этом блокированные участки ДНК приобретают компактную конфигурацию и становятся недоступными для транскрипции.
Исходя из положений этой теории легко понять молекулярную суть процесса детерминации, которая заключается в предварительном синтезе информационной РНК и накоплении ее в цитоплазме частично детерминированной клетки. Специфических белков в клетке еще нет, фенотип клетки еще не проявился, но иРНК для его синтеза уже готова. При получении очередных регуляторных стимулов синтез белка начинается, и клетка приобретет соответствующий фенотип.
По мере дальнейшей дифференцировки весь синтетический потенциал клетки переключается на продукцию специфических белков, что приводит к формированию фенотипа клетки, дифференцированной в определенном направлении. Подтверждением такому ходу событий является обнаружение в различных органах клеток-микстов, то есть клеток, сочетающих в себе фенотипические признаки нескольких видов клеток.
В желудке методами гибридизации in situ были выявлены клетки, экспрессирующие мРНК одновременно к гастрину и соматостатину, то есть эта частично детерминированная клетка «определилась» с направлением дифференцировки в сторону эндокринных клеток, но «не решила» стать гастриновой G-клеткой или соматостатиновой D-клеткой.
Таким образом, именно процесс поэтапного блокирования одних генов и разблокирования других является основой механизмов дифференцировки. Осуществляется этот процесс путем индукции, то есть влияния внешних факторов и клеток друг на друга.
Регенерация тканей взрослого организма представляет собой каскад индукций. В результате сбоя этих регулировочных механизмов возможно формирование клеточных линий, утрачивающих способность к дифференцировке или с преобладанием пролиферативного компонента. Это одно из основных патогенетических звеньев канцерогенеза.
Начало изучению гуморальных механизмов клеточного обновления в желудке было положено открытием трофического действия гастрина и «антитрофического» действия соматостатина.
Действие соматостатина на слизистую оболочку желудка можно назвать «антитрофическим» лишь условно, так как непосредственного влияния на пролиферативные процессы этот гормон не оказывает. Однако он обладает свойством подавлять секрецию гастрина, а также разнообразных биологически активных веществ, усиливающих пролиферативные процессы.
Блокирование пролиферативных и моторных стимулов соматостатином приводит к удлинению фазы покоя (G0) клеточного цикла и тем самым создает благоприятные условия для процессов клеточной дифференцировки. Секретируется соматостатин D-клетками антрального отдела желудка. В меньшем количестве и более равномерно D-клетки распределены и по другим отделам желудочно-кишечного тракта.
Факторы роста представляют собой самую многочисленную группу индукторов пролиферации и дифференцировки клеток. Эпидермальный фактор роста (EGF), который продуцируется клетками слюнных желез и выделяется со слюной, а также трансформирующий фактор роста a (TGF-a) и инсулиноподобный фактор роста (IGF) усиливают клеточную пролиферацию и угнетают процессы дифференцировки.
Трансформирующий фактор роста b (TGF-b) обладает прямо противоположным действием. Он ингибирует клеточную пролиферацию и способствует дифференцировке клеток.
Фактор роста кератиноцитов (KGF) стимулирует как пролиферацию, так и дифференцировку клеток.
TGF-a цитохимически выявляется на мембранах тубуловезикул париетальных клеток и в цитомембранах главных клеток. Он способствует подавлению кислой желудочной секреции и является сильным митогеном, то есть способствует заживлению язвенного дефекта.
EGF и TGF-a обладают вазодилатирующими свойствами, способствуя ангиогенезу в области язвенного дефекта и усиливая репаративные процессы. Однако увеличение экспрессии рецепторов к EGF, что наблюдается во всех случаях рака желудка независимо от гистологического типа, повышает восприимчивость опухолевых клеток к стимулам, усиливающим пролиферацию.
К недавно открытым регуляторам клеточного цикла относится и семейство трефоиловых пептидов, получившие название по своеобразной трехлопастной структуре своих молекул.
Пространственная структура трефоиловых пептидов представляет собой три петли, состоящие из полипептидных цепей, соединенных дисульфидными мостиками. Они продуцируются слизеобразующими клетками слизистой оболочки желудка и кишки в норме, но их продукция многократно возрастает при образовании дефекта эпителиального пласта.
По данным электронно-микроскопической иммуноцитохимии, Ps2 и hSp локализуются на цитомембранах, включая мембраны комплекса Гольджи слизеобразующих клеток. Они включаются в состав слизистых гранул, вместе с которыми и высвобождаются в просвет.
Все трефоиловые пептиды существенно замедляют рост опухолевых клеток. Эти вещества чрезвычайно устойчивы к действию пищеварительных ферментов и оказывают регуляторные воздействия, находясь в просвете желудочно-кишечного тракта. Интересно, что они присутствуют и в цитомембранах эндокринных клеток желудочно-кишечного тракта, включаются в состав их эндокринных гранул, вместе с которыми секретируются в собственную пластинку слизистой оболочки. Значение этого регуляторного механизма пока не изучено.
Комбинированное воздействие факторов роста и трефоиловых пептидов позволяет оптимизировать процессы регенерации за счет уменьшения пролиферативного компонента.
Для реализации своих функций р53 нуждается в генах семейства bcl, белковые продукты которых оказывают порой диаметрально противоположное действие на апоптоз и пролиферацию. Так, белок bcl-2 подавляет апоптоз через блокаду кальциевых каналов клеточных мембран, усиливает пролиферацию и способствует дифференцировке клеток.
Местом локализации bcl-2 в клетке являются внутренние мембраны митохондрий и ядро клетки. Другие гены этого семейства (Bax, bclXS), наоборот, синнергически взаимодействуют с р53, подавляя пролиферацию и усиливая апоптоз.
Таким образом, баланс между белковыми продуктами этих генов определяет равновесие между пролиферацией и апоптозом.
Такие составные компоненты межклеточного вещества, как Е-кадгерин и коллаген IV, подавляют миграцию клеток вне генеративных зон, создавая условия для их дифференцировки, не воздействуя на процессы пролиферации. Е-кадгерин используется для построения плотных межклеточных контактов. Роль его в норме мало изучена. Он препятствует обратной диффузии кислот (но не щелочей) из просвета желудка.
Мутациям генов, кодирующих синтез молекул адгезии, придается большое значение в механизмах инфильтративного роста и метастазирования опухолей. За последние 3 года резко возросло количество публикаций, посвященных этому вопросу. Основной их смысл сводится к тому, что рост опухоли (как пролиферация) и инвазия регулируются различными механизмами. При этом главным в механизмах инвазивного роста является снижение экспрессии или мутация генов адгезивных молекул, в частности Е-кадгерина.
Мутации в генах, кодирующих синтез Е-кадгерина, приводят к развитию диффузного рака желудка с ранним метастазированием и плохим прогнозом. Заболевание это имеет семейный характер. Такие мутации не встречаются при раке желудка кишечного типа. Тест на выявление растворимых фрагментов Е-кадгерина в крови рекомендуется для использования в качестве маркера диффузного рака желудка.
Линии эндокринных, главных и париетальных клеток в области шеечных отделов желез проходят стадию клеток-предшественников. Процессы дифференцировки различных клеточных линий могут регулироваться автономно под влиянием различных гуморальных факторов клеточного микроокружения.
Согласно данным, полученным в последнее время на трансгенных мышах, париетальные клетки играют решающую роль в механизмах дифференцировки шеечных клеток в главные клетки. Репаративная регенерация при острых повреждениях слизистой оболочки желудка осуществляется по типу реституции с полным восстановлением структуры и функции.
Однако при хронических патологических процессах часто возникают сбои в работе регуляторных механизмов клеточной пролиферации и дифференцировки, что приводит к субституции (атрофия главных желез при атрофическом гастрите, образование рубца на месте хронической язвы) либо к патологической регенерации (кишечная метаплазия). После гастрэктомии или частичной резекции у взрослого организма полного восстановления желудка как анатомо-физиологического образования не происходит.
Однако исследованиями Н. Райта с использованием современных морфологичесаких, иммуногистохимических методик и методов гибридизации in situ установлено, что эта группа клеток представляет собой отдельную дифференцировочную ветвь, происходящую из стволовых клеток. Эти клетки характеризуются определенным фенотипом: они продуцируют нейтральные мукополисахариды, выявляемые ШИК-реакцией (в отличие от окружающих слизистых клеток, продуцирующих кислые муцины).
Кроме того, они секретируют большое количество регуляторных пептидов и других индукторов пролиферации или дифференцировки окружающих клеток: EGF, TGF-a, FGF, некоторые из трефоиловых пептидов и лизоцим, обладающий бактерицидным действием.
Большой объем информации накоплен по влиянию Helicobacter pylori на процессы пролиферации и дифференцировки клеток в слизистой оболочке желудка. Развитие этой инфекции приводит к усилению пролиферативных процессов в слизистой оболочке желудка. Однако установлено, что эффект этот обусловлен не прямым действием H. pylori, а опосредован повышением уровня гастрина в крови.
Следствием прямого непосредственного действия H. pylori на эпителиальные клетки желудка является усиление апоптоза. Действие это проявляется как при геликобактерном гастрите, когда задействованы все механизмы воспалительных реакций, так и in vitro на культуре эпителиальных клеток желудка, когда участие факторов воспалительной реакции исключается. При этом не только усиливается апоптоз, но и наблюдается фрагментация ДНК.
Известно также, что в условиях геликобактерной инфекции уровень образования активных форм кислорода в слизистой оболочке желудка всегда выше, чем в отсутствие H. pylori, даже при одинаковой степени инфильтрированности ее нейтрофилами и макрофагами. Исходя из этих данных следует подчеркнуть, что весьма важным фактором профилактики рака желудка являются антиоксидантные ферменты и витамины (Е), существенно снижающие риск развития этого заболевания.
Регенерация на кончиках пальцев
Статья подана на конкурс портала Биомолекула — «Био/мол/текст»-2020/2021
Регенерация похожа на божественное искусство. В ней задействованы самые разные гены, но точная координация их работы творит чудеса. Прямо как работа мазками разных цветов: под умелой рукой они складываются в картину.
Почти у всех нас есть конечности. Мы настолько привыкли к ним, что воспринимаем как нечто само собой разумеющееся. Часто ли мы задумываемся об их важности? Вспоминается грустная пословица «Что имеем не храним, потерявши плачем». Авторы статьи искренне желают читателю никогда не познать ее в жизни. Во всяком случае, в таком контексте. Но все же — обязательно ли «плакать» в случае потери конечности, и нет ли способа вернуть ее в случае несчастья? А, может, такой способ появится в будущем? Большие вещи начинаются с малого. Понимание регенерации целой руки и ноги кроется в осознании процессов, происходящих на самых кончиках пальцев. О них и пойдет речь дальше.
Важность конечностей неоспорима. Недаром даже поговорки составлены: «С руками нигде не пропадешь», «Волка ноги кормят». Их потеря или необратимые повреждения могут оставить человека инвалидом на всю жизнь. С помощью современных медицинских подходов можно, конечно, поставить человека «на ноги». Возможны реплантация ампутированной конечности (ее обратное приживление), или закрытие раны участками кожи для формирования культи с последующим применением протезирующих устройств. Несмотря на стремительно развивающееся протезирование и появление киберпротезов, которые (как пророчат книги, игры и фильмы) уже в недалеком будущем будут почти идентичны утраченной части тела и легко и дешево заменимы, уж очень привлекательна перспектива полного структурного и функционального восстановления ампутированной конечности собственными силами организма (или с помощью небольшой дополнительной стимуляции).
Рисунок 1 | В настоящем 2077 протезы уже не будут нужны.
Известно, что многие рыбы и амфибии способны к регенерации утраченной конечности. Но способен ли на это человеческий организм? Оказывается, и да, и нет. Все зависит от правильного взаимодействия различных факторов: от активности генов и иммунной системы до морфологического строения поврежденной конечности и концентрации кислорода в ране. Попытаемся подробнее изучить основные эволюционные изменения процессов регенерации, рассмотреть все тонкости регенерации конечностей, а также порассуждать, насколько хорошо проходит регенерация у млекопитающих.
Регенерация — от прошлого к настоящему
Еще в древних мифах описывалось необычное свойство некоторых существ восстанавливать любую отрубленную часть тела. Так, Лернейская гидра в битве с Гераклом могла отращивать новые головы на месте отрубленной. При этом для победы Геракл использовал вполне оригинальный и логичный способ: он прижег горящими головнями места, где вырастали новые головы, что воспрепятствовало бесконечной регенерации. Можно вспомнить и другой пример из древнегреческой мифологии — каждый день печень Прометея, который похитил для людей божественный огонь, склевывал орел, а каждую ночь она отрастала заново. Однако древние греки едва ли могли объяснить описываемые явления с биологической точки зрения. Так чем же обусловлены эти процессы у существующих организмов?
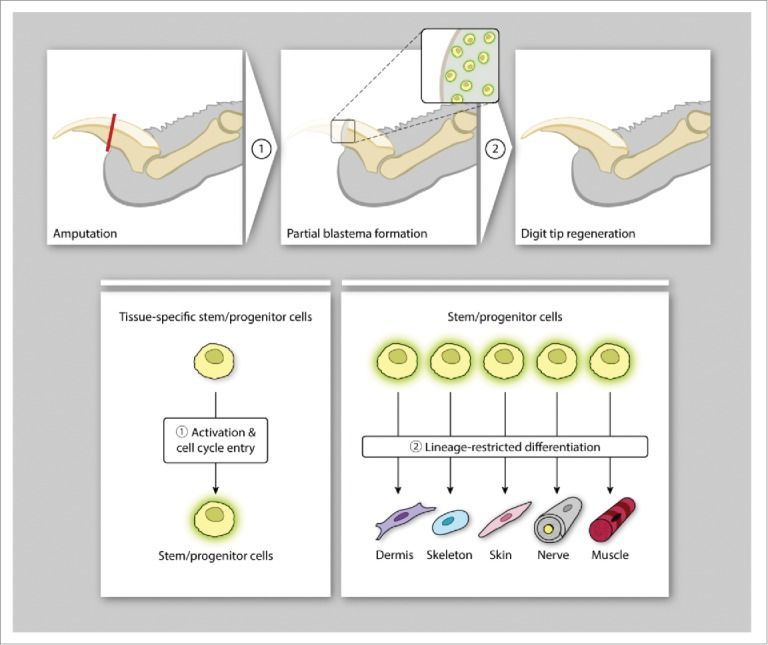
Наши передние и задние конечности состоят из различных типов клеток: остеоцитов (клеток скелета), миоцитов (клеток мышц), адипоцитов (клеток жировой ткани), нейронов (клеток нервной ткани), кератиноцитов (клеток эпидермиса). Каждая клетка имеет свой генетический профиль и историю его реализации, называемую дифференцировкой. Клетки сохраняют свои приобретенные в результате специализации особенности, так как хранят запись биохимических сигналов своих клеточных предков, полученных еще на эмбриональной стадии. По сути, регенерация конечности — процесс прохождения клеточной специализации заново. И пройти ее должны все названные выше типы клеток. Восстановить группу клеток одного типа — уже непростая задача, что уж говорить о регенерации более сложноорганизованных структур. В организме для этого формируется бластема — неоднородная популяция клеток, которая временно образуется на раневой поверхности после ампутации как результат миграции и компенсаторной пролиферации клеток, а затем подвергается морфогенезу и замещает поврежденную часть органа. Бластема становится источником стволовых клеток — недифференцированных (незрелых) клеток, из которых впоследствии формируются ткани. Именно они затем специализируются и восстанавливают первоначальный размер и форму утраченной конечности.
Рисунок 2 | Мыши для регенерации поврежденного кончика пальца используют клеточные механизмы, единые для всех позвоночных, которые активируют при повреждении стволовые клетки для образования бластемы. Затем стволовые клетки на основе своей уникальной программы, заложенной в геноме, дифференцируются в соответствующий тип клеток (кожи, мышц, костей и др.) и восстанавливают исходный размер и форму кончика пальца [1].
Заметка. Пролиферация — это процесс размножения клеток, приумножающий объем тканей. Интенсивно протекает в период эмбрионального развития, когда клетки развивающегося эмбриона активно и непрерывно делятся. Данный процесс тесно связан с репаративной (от лат. reparatio — «восстановление») регенерацией, которую подразделяют по процессу восстановления функциональности органов:
Рисунок 3 | Нас интересует первый из данных типов — эпиморфоз, или эпиморфная регенерация, так как именно этот тип регенерации эволюционно ближе к млекопитающим и, следовательно, человеку.
Изменение способности к регенерации в течение эволюции
Среди млекопитающих не найти столь впечатляющих примеров регенерации, как среди хвостатых амфибий. Но сравнение эпиморфной регенерации у классических моделей (земноводных и рыб) и млекопитающих приближает нас к пониманию того, что конкретно препятствует столь же эффективной регенерации у последних, и как это можно преодолеть. Сложно поверить, но механизмы регенерации, как и механизмы развития, схожи не только у всех позвоночных, но также и среди основных типов беспозвоночных. Информацию о механизмах регенерации содержит геном. Геном во всех клетках почти идентичен. Клетки тканей отличаются друг от друга потому, что экспрессируют разные наборы генов, а не содержат разные гены. Избирательная экспрессия генов обусловливает такие необходимые процессы, происходящие во время регенерации, как: пролиферация клеток, дающая множество клеток из одной, специализация клеток, создающая клетки с разной пространственной ориентацией и биологическими характеристиками, связь клеток, согласующая поведение одной клетки по отношению к соседям, перемещение, или миграция, клеток, при которой клетки группируются, чтобы сформировать ткани и органы заданной структуры. В этих процессах осуществляется последовательная программа перехода из недифференцированного состояния начальной (столовой) клетки в следующее, более специализированное. Возможен и альтернативный путь: клетка может уже пройти частично путь специализации, но перейти на другой под воздействием особых сигналов среды. Ее роль и играет бластема. Но почему же примитивные беспозвоночные и низшие позвоночные, или анамнии, способны к регенерации, а высшие, или амниоты, утратили эту особенность?
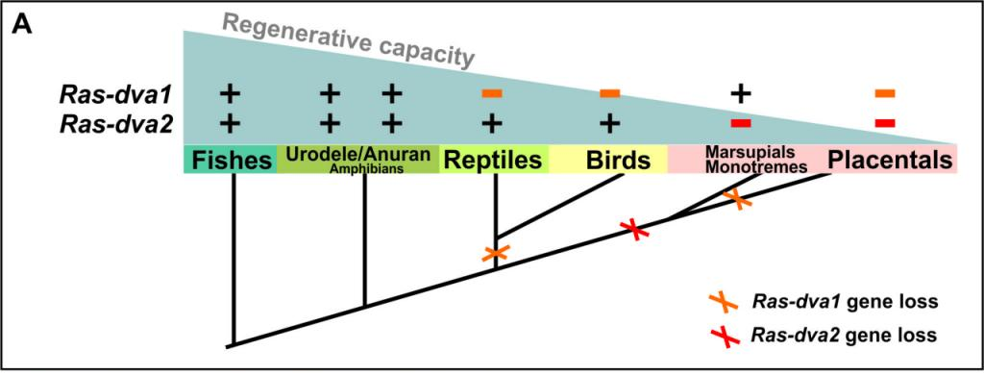
В течение эволюции у всех животных, от низших до высших, вплоть до человека, набор генов не изменялся. Для согласования построения организованной многоклеточной структуры разные организмы используют лишь несколько довольно консервативных путей передачи межклеточных сигналов. Однако, по мере усложнения организмов дар регенерации постепенно угасал. В результате амниоты (рептилии, птицы, млекопитающие) почти утратили способность формировать бластему. Почему? Различия в общем плане строения организма возникают во многом из-за различий в генах регуляторных и сигнальных белков, которые отвечают за то, когда и где другие гены, кодирующие структурные белки, должны быть активированы или ингибированы. Ученые из ИБХ РАН выдвинули гипотезу о том, что изменения в регуляторных участках и некоторых генах коррелирует с потерей регенерации. Чтобы проверить данную гипотезу, они поочередно ингибировали и активировали гены, которые могли быть причастны к формированию раневого эпителия и бластемы. Выяснилось, что гены транскрипционных факторов Ag1 и сигнальных белков Ras-dva встречаются только в геномах низших позвоночных, рыб и амфибий, но отсутствуют у высших — рептилий, птиц и млекопитающих [2]. При этом эти гены одновременно и стимулируют регенерацию конечностей, и подавляют развитие конечного мозга. Именно с их потерей у высших позвоночных появился на этапе эмбриогенеза конечный мозг.
Рисунок 4 | Видно, что с усложнением организации высших позвоночных происходила потеря генов семейства Ras-dva, а вместе с этим и способности к регенерации [3].
Произошел обмен регенерации конечностей на эволюцию мозга. Видимо, раз мы смогли написать для вас эту статью, то он оказался полезным.
На данный момент регенерацию изучают на тех животных, для которых она в большей степени характерна. Это амфибии и рыбы: саламандры, тритоны, рыбки данио-рерио (зебрафиш) и др. Как известно, хвостатые амфибии при необходимости способны восстанавливать конечность, хвост, хрусталик глаза и часть нижней челюсти. Исследования проводят и на млекопитающих, хотя их потенциал далеко не так впечатляет. Ампутированные кончики пальцев у грызунов, повреждения ушной раковины у иглистых мышей и кроликов – распространенные экспериментальные модельные системы для изучения эпиморфной регенерации. Эти исследования позволяют связать регенеративную биологию и регенеративную медицину. В статье мы будем использовать информацию, полученную из исследований как на амниотах, так и анамниях, ибо, несмотря на потерю транскрипционных факторов Ag1 и сигнальных белков Ras-dva, консервативные пути передачи регенеративного сигнала в клетках в течение эволюции сохранились, и общий план строения конечностей у анамний и амниот схож.
Разбираем бластему: этап за этапом, клетка за клеткой, ген за геном
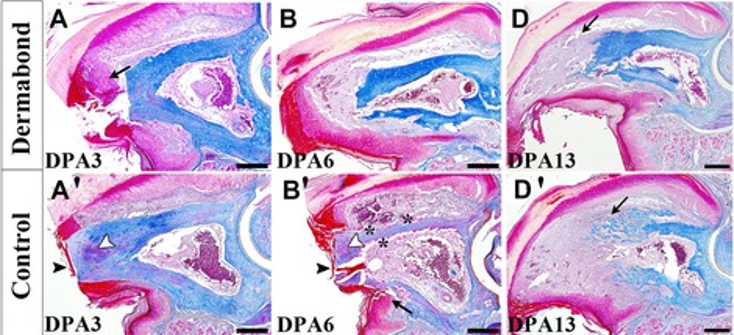
Сначала необходимо понять, какие внешние воздействия могут способствовать или мешать формированию бластемы. Для этого лучше изучить регенерацию «на практике». Вот мы ампутировали конечность. А дальше? Что мы можем сделать для стимуляции регенеративных процессов? Оказывается, не так много. Конечно, можно использовать разные шовные материалы и медицинские клеи для остановки кровотечения. Однако может получиться так, что регенерация остановится уже на первых этапах и не успеет достигнуть стадии бластемы. В исследовании, проведенном на мышах, ученые пробовали покрывать рану медицинским клеем [4]. Это привело к следующему результату — раневая поверхность покрылась беспорядочной богатой коллагеном соединительной тканью, называемой фиброзной, которая составила основу культи и мало чем напоминала нормальную конечность.
Рисунок 5 | Представлена хронология процессов при обработке медицинским клеем (фирма Dermabond; A, B и D) и без обработки (Control; A’, B’ и D’) в течение 13 дней после ампутации (DPA — days post-amputation) кончика пальца у мыши. Можно заметить, что закрытие раны эпидермисом у пальца, обработанного клеем, на 3 день после ампутации (A) началось преждевременно (черная стрелка) по сравнению с контрольной группой (A’), где наблюдалось лишь образование сгустка крови в полости костного мозга (белая стрелка). Впоследствии структурные изменения становились все более заметными, в результате чего на 13 день после ампутации у пальца, не обработанного клеем, бластема была больше по объему и числу клеток (черная стрелка на срезе D’ указывает на клетки разрушенной костной ткани, которые впоследствии будут вовлечены в процесс регенерации), чем у пальца, обработанного клеем (срез D) [4].
Оказалось, локальное изменение концентрации кислорода играет значительную роль на разных этапах восстановления конечности [5]. Примечательно, что в норме на начальных этапах регенерации концентрация кислорода должна быть повышена (при использовании медицинского клея выходит наоборот), а впоследствии падать из-за образования раневого эпидермиса на поверхности раны и активировать сигнальные пути регенерации. Если же изначально закрыть рану, то не происходит образования стабильного микроокружения из клеток и сигнальных молекул для формирования бластемы.
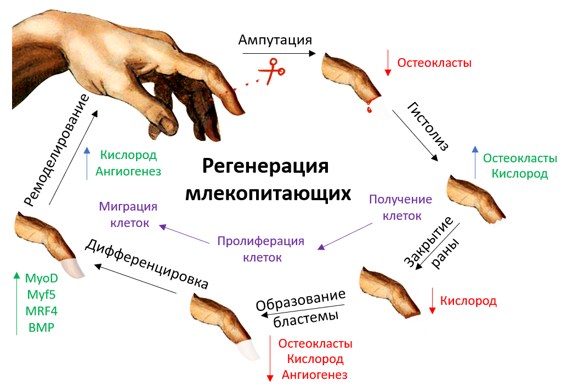
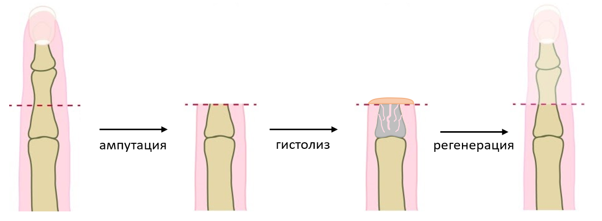
Процесс регенерации конечности можно проиллюстрировать следующей схемой.
Рисунок 6 | Цикл регенерации кончика пальца у млекопитающих состоит из следующих стадий: ампутации, гистолиза, закрытия раны, образования бластемы, дифференцировки, ремоделирования. Для каждого этапа характерны свои особенностями и нюансы, о которых речь пойдет дальше.
Рассмотрим каждый этап подробнее и опишем процессы, которые при этом происходят.
1. Ампутация
Прежде всего организму необходимо осуществить заживление раны и создать условия для образования бластемы. Сразу после травмы включается иммунная реакция, останавливается кровотечение, происходит вазоконстрикция (сужение сосудов) и коагуляция тромбоцитов. Они формируют сгусток фибрина, который составляет основу тромба [6], [7]. Вместе с этим в рану мигрируют воспалительные клетки – нейтрофилы и моноциты. Моноциты после миграции в место повреждения превращаются в макрофагов, в то время как нейтрофилы начинают подвергаться апоптозу после поглощения и переваривания патогенных микроорганизмов. Они являются наиболее важными компонентами системы врожденного иммунитета, которые в первую очередь вовлекаются в иммунные процессы и обусловливают пусковые механизмы развития воспаления. Данный этап длится первые несколько часов после травмы.
Как упоминалось ранее у заживления возможны два исхода: образование рубца из фиброзной ткани или эпиморфная регенерация. Ключевое различие заключается в следующей фазе.
2. Гистолиз
Разрушение тканей путем их «растворения» протеолитическими ферментами перед заживлением раны. Можно сказать, что организм действует по принципу «вред во благо». Эта одна из ключевых стадий эпиморфной регенерации, так как именно в результате гистолиза формируется микроокружение, стимулирующее дедифференцировку клеток в стволовые, благодаря чему и формируется бластема. Происходит необходимое разрушение кости и уменьшение ее в объеме (до 60–75 %) для того, чтобы ее компоненты (в том числе мезенхимальные и гемопоэтические, или кроветворные, стволовые клетки) могли принять участие в регенерации. Параллельно этому синтезируются протеазы (ферменты, расщепляющие белки) клетками иммунной системы, реорганизуются фрагменты внеклеточного матрикса и образуются факторы роста — специальные белки, контролирующие рост клеток и их вступление в клеточный цикл и усиливающие или ингибирующие регенеративные процессы.
Рисунок 7 | Гистолизу подвергается преимущественно костная ткань, которую разрушают предназначенные для этого клетки — остеокласты. Данный процесс может длиться вплоть до образования бластемы (12-14 дней после ампутации) [8].
Активная роль в разрушении тканей принадлежит ферментам матриксным металлопротеиназам (ММП). Матриксные металлопротеиназы — ферменты, расщепляющие белки внеклеточного матрикса, которые вовлечены в процесс заживления ран и контролируют процесс ремоделирования тканей.
Заметка. Внеклеточный матрикс — многокомпонентная субстанция, которая объединяет разрозненные клетки в единый многоклеточный организм, и в которую погружены все клетки организма [9]. Внеклеточный матрикс, который формируется при воздействии иммунных клеток, содержит гиалуроновую кислоту и специфические белки (гликопротеины и протеогликаны), а затем дополняется другими белками (коллагены типа I и III, эластин, фибронектин, тенасцин-C и др.), что делает матрикс более организованным и структурированным [10]. Примечательно, элементы внеклеточного матрикса легко окрашиваются, поэтому по их градиенту концентрации легко визуализировать и отслеживать по нему, с каким успехом проходят восстановительные процессы. Все перечисленные соединения синтезируются преимущественно фибробластами — клетками соединительной ткани, которые вносят основной вклад в образование бластемы и ремоделирование конечностей [11].
Раневые участки содержат множество типов ММП, которые поддерживают различные реакции, связанные с миграцией фибробластов, ангиогенезом (восстановлением сосудистой сети) и предотвращением синтеза мембраны между тканями конечности и раневым эпидермисом, называемой базальной, что и подавляет рубцевание. Ингибирование ММП приводит к замедлению заживления ран и нарушению миграции и дифференцировки стволовых клеток. Например, мыши с мутацией коллагена типа I, который устойчив к расщеплению ММП-1, демонстрируют нарушение ремоделирования и замедленное заживление тканей. Однако в ряде исследований многие ММП-дефицитные мутанты не демонстрируют таких аномалий, что может быть связано со сложной специфической ролью каждой ММП [10], [12]. При этом активность ММП не может продолжаться долго, она подавляется тканевыми ингибиторами металлопротеиназ, когда приходит время создавать новый каркас для клеток из внеклеточного матрикса на стадии ремоделирования.
3. Закрытие раны
На 7-10 день после ампутации происходит эпителизация поврежденного участка, что связано с ростом количества кератиноцитов. При этом продолжают работу иммунные клетки: макрофаги и нейтрофилы синтезируют активные формы кислорода, чтобы нейтрализовать инородные микроорганизмы и подвергнуть фагоцитозу поврежденную ткань [10]. Макрофаги — важный источник как воспалительных, так и противовоспалительных сигналов, поступающих в поврежденную область после травмы, где они участвуют в обмене компонентов внеклеточного матрикса, очищают ткани от инородных частиц и подвергают фагоцитозу апоптические клетки (останки клеток после программируемой гибели). Эти процессы опосредованы специальными белками, контролирующие рост клеток — цитокинами. Благодаря провоспалительным цитокинам, которые запускают механизм специфического иммунитета и действуют через свои рецепторы на клетки мишени на ранней стадии воспаления (интерлейкин-1 IL-1, IL-6, IL-8, фактор некроза опухоли-α TNF-α), фибробласты выделяют факторы роста кератиноцитов KGF-1, KGF-2, сигнализирующие кератиноцитам мигрировать и пролиферировать. Также клетками иммунной системы синтезируются хемокины (семейство цитокинов), необходимые для миграции фибробластов, а впоследствии и противовоспалительные цитокины (IL-4, IL-10, трансформирующий фактор роста TGFβ), которые ослабляют воспаление и стимулируют ангиогенез [13]. К примеру, сигнальная молекула TGFβ подавляет пролиферацию кератиноцитов, что способствует регенеративным процессам благодаря замедлению рубцевания. А у мышей с мутациями, нарушающими синтез TGFβ, наблюдалось более быстрое заживление ран и рубцевание. Поэтому неудивительно, что в исследованиях на мышах недостаток макрофагов и нейтрофилов или нарушение их регуляции после ампутации приводит к неполному восстановлению мышц и образованию рубцов [14].
Таким образом, уменьшение количества иммунных клеток вызывает снижение миграции фибробластов и кератиноцитов, так как снижается концентрация сигнализирующих белков. Однако и нормальное содержание макрофагов и нейтрофилов приводит к воспалению, а затем к образованию рубцовой ткани, что преимущественно и наблюдается у млекопитающих. Поэтому нельзя однозначно ответить, положительно или отрицательно клетки иммунной системы влияют на процессы регенерации. Стоит помнить, что иммунная система примитивных животных и низших позвоночных не так сложна, как у высших, что также может объяснять их лучшую способность к регенерации. Примечательно, что в ряде исследований, мутантные модели мышей, испытывающие дефицит макрофагов и нейтрофилов, все еще были способны заживлять небольшие раны без образования рубцовой ткани [14].
4. Образование бластемы
После заживления раны на 10-14 день после ампутации организму необходимо накопить достаточное число стволовых клеток для формирования бластемы. Обычно полученных на стадии гистолиза стволовых клеток взрослому организму бывает недостаточно, так как регенерация сложных структур конечности требует большого количества клеток-предшественников. Решение данной проблемы – дедифференцировка и трансдифференцировка уже детерминированных клеток соседних тканей. При этом анамнии справляются с дефицитом стволовых клеток путем свободного формирования клеток-предшественников из дифференцированных клеток в бластеме, а у амниот дедифференцировка совмещена с трансдифференцировкой [1]. Переход к более недифференцированному состоянию или смена клеткой своей специализации сопровождается реорганизацией цитоскелета (клеточного каркаса), перегруппировкой клеток, изменением взаимодействия между молекулами клеточной адгезии (преимущественно кадгерином и интегрином).
Заметка. Кадгерины и интегрины — кальций-зависимые и кальций-независимые соединения, соответственно, которые управляют перемещениями клеток, взаимодействуют с элементами внеклеточного матрикса и контролируют избирательное связывание клеток друг с другом в пункте назначения.
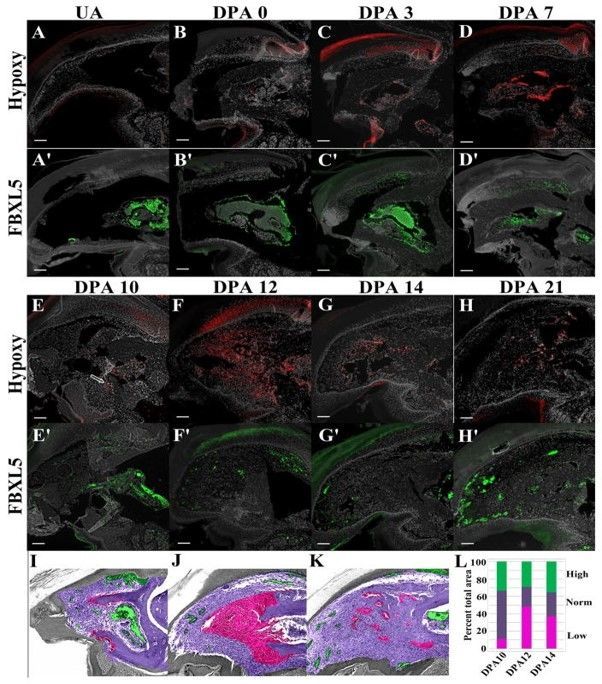
Синтез цитокинов, факторов роста, сигнальных молекул и молекул клеточной адгезии, от которых зависит потеря или смена клеточной специализации и пролиферация клеток в бластеме, коррелирует с кислородным голоданием — гипоксией. Если обратить внимание на хронологическую последовательность регенерации конечности у мыши, то можно заметить, что гипоксия наблюдается как раз к 12 дню после ампутации конечности [5].
Рисунок 8 | На кончике пальца мыши после ампутации можно заметить области гипоксии (A-H; красный цвет) и нормальной концентрации кислорода (A’-H’; зеленый цвет). Примечательно, в первые 7 дней после ампутации (DPA — days post-amputation) концентрация кислорода была по большей части повышена в тканях пальца, что связано с беспрепятственным проникновением кислорода через незакрытую эпидермисом рану, однако после ее закрытия можно наблюдать обширные области сниженной концентрации кислорода в тканях, что впоследствии приводит к формированию бластемы на 12 день после ампутации (F, J, L) [5].
На основе работ по изучению гипоксии во время регенерации можно предположить, что кислородное голодание является своеобразным стимулятором регенеративных процессов на стадии формирования бластемы. Однако как клеткам, которым обычно необходим кислород для нормального функционирования, приспособиться к таким непростым условиям? В это время в них синтезируются молекулы, призванные поддерживать их жизнеспособность — фактор, индуцируемый гипоксией, или HIF-1α [15]. Он побуждает клетки синтезировать те гены, которые адаптируют метаболизм под условия недостатка кислорода и участвуют в пролиферации и выживаемости клеток. Однако работа HIF-1α на данном этапе не закончена. Впоследствии он будет необходим уже для восстановления сосудистой сети.
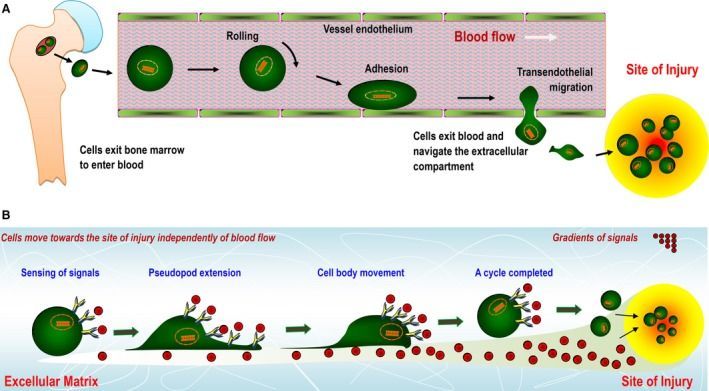
Клетки бластемы обладают сложным генетическим профилем. Какие же гены отвечают за перепрограммирование зрелых клеток в стволовые? Общий фон экспрессии генов бластемы схож с таковым у эмбриональных стволовых клеток уже после формирования зародышевых листков. Кажется, многие слышали о возможности превратить окончательно дифференцированные клетки в стволовые, которые называются индуцированными плюрипотентными стволовыми клетками: ученые Джон Гардон и Шинья Яманака на опыте продемонстрировали, как вектор из четырех генов (Myc, Oct3/4, Sox2 и Klf4; данный список продолжает пополняться), внедренный в клетки, может обратить вспять биологические часы [16]. По сути, такие же гены активны в стволовых клетках бластемы. К сожалению, было доказано, что клетки бластемы находятся не в плюрипотентном состоянии даже у анамний. Только четыре из шести ключевых генов транскрипционных факторов (Klf4, Sox2, Lin28, c‐Myc; без Nanog и Oct4), используемых для перепрограммирования взрослых специализированных клеток, активно экспрессируются [17]. Именно поэтому стволовые клетки бластемы относят к мультипотентным — клеткам, которые могут дифференцироваться только в определенного типа ткани. Наряду с обязательными генами в общий профиль бластемы может входить до 50 генов, в разной степени вовлеченных в процесс формирования и поддержания бластемы. Однако необходимо еще распределить такое разнообразие клеток в пространстве для последующих дифференцировки и ремоделирования. Для этого существуют так называемые направляющие воздействия. Активность небольшой группы соединений координирует миграцию большой популяции клеток, не только стволовых. Среди них, помимо градиента кислорода, важное место занимает комплекс из сигнальной молекулы и рецептора SDF1/CXCR4 [18]. Во время регенерации сигнальные молекулы SDF1 синтезируются преимущественно в фибробластах, которые, как говорилось ранее, необходимы для организации внеклеточного матрикса в бластеме. SDF1/CXCR4 примечателен тем, что его экспрессия повышается в ответ на повышение концентрации HIF-1α и механические повреждения, что приводит к усиленной миграции стволовых клеток посредством хемотаксиса в область ампутации [15], [18]. Таким образом, к концу стадии образования бластемы у организма уже есть резерв стволовых клеток и место для их дислокации для последующей дифференцировки.
Рисунок 9 | Схематично показана миграция стволовых клеток по градиенту сигнальных молекул (например, факторов роста и хемокинов), которые высвобождаются тканью в ответ на повреждение. Стволовые клетки мобилизуются из костной ткани и мигрируют по кровеносным сосудам (A) или непосредственно по внеклеточному матриксу (B) с помощью белков клеточной адгезии, достигая места повреждения [18].
5. Дифференцировка
После образования бластемы необходимо направить дифференцировку стволовых клеток в нужное русло для последующего ремоделирования поврежденной конечности. У каждой более специализированной группы клеток активны определенные гены, которые кодируют сигнальные молекулы, молекулы клеточной адгезии, структурные белки и другие соединения. Чтобы восстановить ткань, нужно направить стволовые клетки по пути переспециализации, которая, в свою очередь, достигается за счет смены экспрессируемых генов.
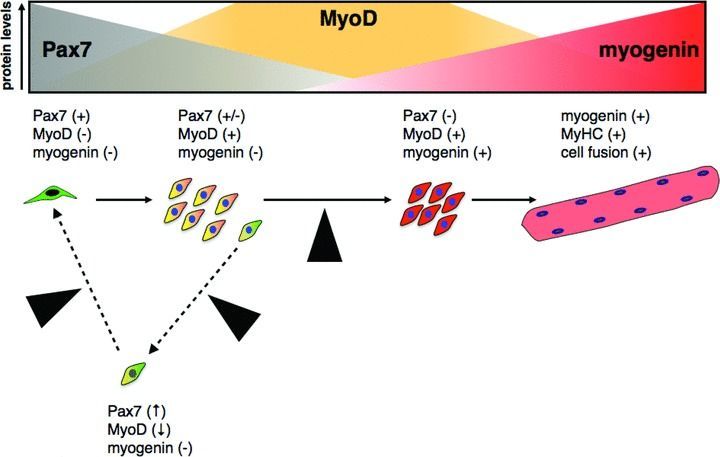
Рассмотрим в качестве примера активацию сателлитных стволовых клеток — предшественников миоцитов. Направление миогенной дифференцировки осуществляется при помощи различных факторов роста, к которым относятся фактор роста гепатоцитов (HGF), фактор роста фибробластов (FGF), трансформирующий фактор роста-β (TGFβ). Взаимодействуя со своими рецепторами, они активируют внутриклеточные сигнальные пути, что приводит к экспрессии специфических миогенных регуляторов. Среди них можно выделить белки и их семейства Pax (Pax3, Pax7), MyoD, Myf5, MRF4, миогенин [19]. Они заставляют клетки дифференцироваться и экспрессировать специфические для мышц актин и миозин, цитоскелетные, метаболические и мембранные белки, характерные именно для мышечной клетки. При регенерации происходит активация не всех регуляторов сразу, процесс последователен: сначала в клетках-предшественниках активен белок Pax7, затем начинает экспрессироваться MyoD, потом Myf5 и MRF4, а миогенин синтезируется позднее, одновременно с началом синтеза тяжелых цепей миозина. При этом порядок их экспрессии отличается от картины, характерной для миогенеза в ходе эмбрионального развития.
Рисунок 10 | При пролиферации и самообновления сателлитных клеток повышена экспрессия Pax7, затем под воздействием внешних стимулов происходит постепенная дифференцировка, за которую отвечает регулятор MyoD, в конце дифференцировки к общему фону экспрессии подключается ген транскрипционного фактора миогенина, который стимулирует синтез основных сократительных белков мышц (актин и миозин) и белков клеточной адгезии [19].
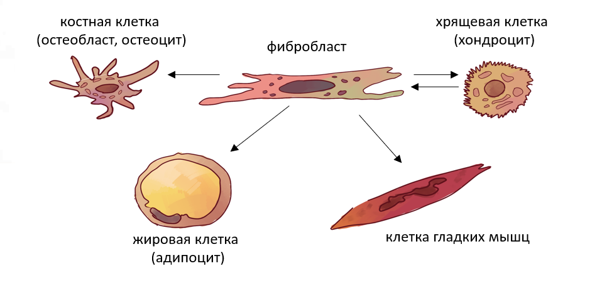
Особенное место при восстановлении конечности занимает дифференцировка клеток соединительной ткани. В основе этого процесса лежит активность преобладающих в бластеме фибробластов. В плане регенерации фибробласты являются уникальной группой клеток: после повреждения они мигрируют по градиенту сигнальных молекул, помогая восстанавливать как внеклеточный матрикс, так и почти все клетки соединительной ткани — костные клетки (остеобласты, остеоциты), хрящевые клетки (хондроциты), жировые клетки (адипоциты) и клетки гладких мышц (входят в состав сосудов) [20], [21]. Фибробласты в разных частях организма могут сильно отличаться друг от друга, даже в одной конечности между ними есть различия. Так, «зрелые» фибробласты, почти дифференцированные клетки с меньшей способностью к преобразованиям, могут существовать рядом с «незрелыми» фибробластами (часто называемыми мезенхимальными стволовыми клетками), которые способны развиваться в любой тип клеток соединительной ткани.
Рисунок 11 | Стрелками показаны взаимные превращения, происходящие между представителями семейства соединительной ткани [20].
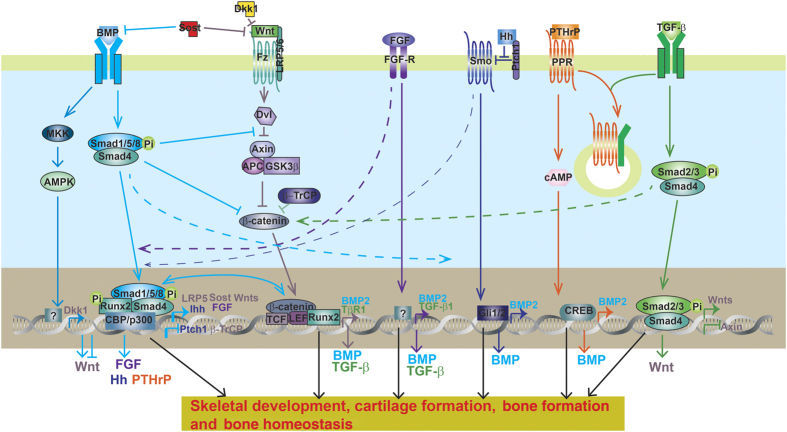
Поэтому грань между стволовыми клетками и фибробластами может быть довольно тонкой. Механизм этих взаимных превращений изучен не до конца, но можно выделить несколько наиболее важных участников сигнальных путей фибробластов: костные морфогенетические белки (BMP) и трансформирующий фактор роста-β (TGFβ) [22]. Они регулируют рост, дифференцировку клеток соединительной ткани, а также контролируют синтез внеклеточного матрикса.
Параллельно с процессами дифференцировки происходит развитие сосудистой сети. Под влиянием ряда факторов роста — фибробластов (FGF), тромбоцитарного (PDGF), эпидермального (EGF), трансформирующего (TGFβ), фактора некроза опухоли-альфа (TNF-α), IL-6, IL-1 — происходит повышение уровня экспрессии фактора роста эндотелия сосудов (VEGF). Он же является мощным стимулятором эндотелиоцитов, выстилающих выстилающих кровеносные сосуды [14], [23]. VEGF связывается с рецепторами на поверхности эндотелиоцитов, побуждая их разрастаться и проникать в испытывающую кислородное голодание ткань после образование бластемы, чтобы обеспечить ее новыми кровеносными сосудами. Чтобы эндотелиальные клетки бесконтрольно не разрастались, они взаимодействуют между собой и с краевыми клетками для своевременной приостановки ангиогенеза. Таким образом, если запустить нужную комбинацию работы генов, можно преобразовать стволовые клетки в определенный тип дифференцированных клеток.
Наиболее просто способ — обратиться к внешним стимулами, которые в норме поступают от соседних клеток. Общая схема дифференцировки основана на том, что сигнальные белки от окружающих бластему клеток направляют развитие группы клеток по определенному пути. Можно выделить шесть групп сигнальных путей, необходимых как для самообновления стволовых клеток в бластеме, так и для их дифференцировки: FGF, TGFβ, BMP, Hedgehog (Hh), Notch, Wnt. Все ранее упомянутые молекулы в той или иной степени являются их участниками. Пути могут пересекаться и иметь общие сигнальные молекулы.
Рисунок 12 | Общая схема и перекрестное взаимодействие некоторых сигнальных путей. Их активация связана со сложным каскадом взаимодействий между комплексами белков и ДНК, что в итоге приводит к синтезу белков, необходимых для регенерации поврежденных тканей [22].
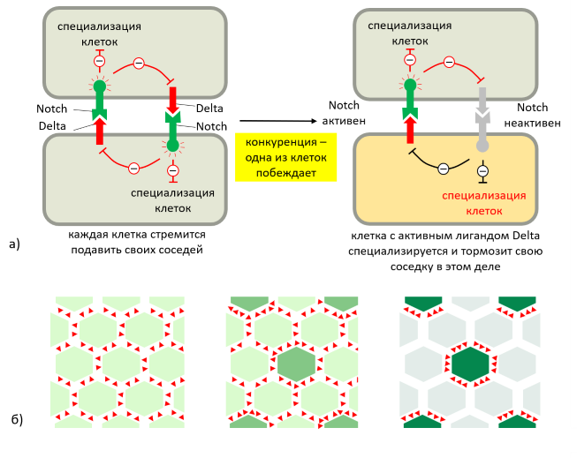
Наиболее изученным в плане регенерации являются белки семейства Wnt. Они способны активировать Wnt/β-катениноный путь (канонический Wnt-путь), который основан на протеолизе (расщеплении) β-катенина — белка-регулятора генов, что приводит к окончательному определению судьбы клеток и морфогенезу; и неканонические (β-катенин-независимые) пути, которые регулируют реорганизацию цитоскелета и метаболизм кальция в клетках [24]. При этом дифференцировка клеток не обязательно должна быть однородной. Существует механизм, обуславливающий чередование обычных эпидермальных клеток с сенсорными. За него преимущественно отвечает путь Notch. В основе лежит связывание сигнального белка Delta с рецептором Notch. Этот путь направляет сигнал клеткам вблизи предшественника сенсорной клетки не становиться на такой же путь дифференцировки. В результате они становятся эпидермальными.
Рисунок 13 | а) Механизм конкурентного ингибирования соседствующих клеток. Сначала все клетки в группе эквивалентны и экспрессируют и трансмембранный рецептор Notch, и его сигнальную молекулу Delta, что препятствует специализации (серый цвет клеток). Когда одна из клеток дифференцируется (оранжевый цвет клеток), она пытается предотвратить дифференцировку в том же направлении соседних клеток за счет более сильной экспрессии Delta (у неспециализированной клетки экспрессия Delta подавляется); б) Исход того же процесса в более многочисленной группе клеток. Выигрывающая клетка, по мере того, как становится все более и более дифференцированной, тормозит своих соседей все сильнее [25].
Таким образом, результатом активации или ингибирования перечисленных сигнальных путей является изменение транскрипции ДНК в отвечающей на сигнал клетке. Одни гены включаются, а другие выключаются. Разные сигнальные молекулы (факторы роста, гормоны, цитокины) активируют разные виды регулирующих гены белков, поэтому одни и те же клетки по-разному реагируют на один и тот же сигнал, посылаемый в разное время, а клетки разного типа по-разному реагируют на одинаковый сигнал. При этом молекулы сигнальных путей образуют группу сигнальных молекул — морфогенов, изменение концентрации которых приводит к изменению градиента концентрации сигнала, что побуждает клетки ступать на различные пути развития (высокая концентрация — один путь развития, низкая концентрация — другой). Когда клетка делает свой окончательный выбор в дифференцировке, она обязуется следовать сложной программе, предполагающей экспрессию строго определенного набора генов. В конечном счете это приводит к ремоделированию конечности, где каждая специализированная клетка занимает свое место.
Рисунок 14 | Иногда выбор пути клеточной специализации навевает воспоминания о дорожном камне из русских былин.
6. Ремоделирование
Вместе с процессами дифференцировки происходит ремоделирование — восстановление исходного размера и формы конечности. Эти процессы могут быть растянуты во времени и занимать от 14 до 40 дней после ампутации. Необходимо учесть факт, что к концу дифференцировки каждая клетка обладает своей пространственной ориентацией благодаря молекулам клеточной адгезии и запоминает положение по биохимическим реакциям соседей — возникает подобие позиционной памяти. Передние и задние конечности обладают одним и тем же набором дифференцированных тканей (кости, кожа, мышцы). Однако именно различие в пространственном положении тканей друг относительно друга отличает руку от ноги. И клеточная память хранит информацию об этом. Если перенести элемент бластемы с дистальной (дальше от туловища) части конечности к более проксимально (ближе к туловищу) расположенной бластеме той же конечности, то клетки будут формировать нормальную конечность [17]. Если же взять часть клеток бластемы, которая в норме должна образовывать заднюю конечность, и интегрировать в область бластемы передних конечностей, то нас ждет весьма интересный результат: из-за позиционной памяти часть клеток передних конечностей будет содержать морфологические признаки задних конечностей.
Рисунок 15 | Такие маленькие мелочи, как происхождение бластемы, могут иметь большое значение.
Как происходит регуляция положения клеток, приводящая к формированию нужной? Она осуществляется с помощью так называемых гомеозисных (консервативных генов, отвечающих за регуляцию развития и формирование органов и тканей). Различают несколько комплексов гомеозисных генов, которые объединены в кластеры на нескольких хромосомах. Общее число таких генов в течение эволюции достигло 48 у млекопитающих. При этом к наиболее важным семействам генов относится Hox-группа генов, которая участвует в определении формы конечностей и экспрессируется неоднородно в проксимальном и дистальном положении в бластеме. Так, в конечности позвоночных гены из пары комплексов Hох (НохА и НоxD) экспрессируются в виде регулярной системы, подчиняющейся обычным правилам последовательной экспрессии генов в этих комплексах (всего их четыре: НохА, HoxB, HoxC и НоxD). Они помогают в сочетании с другими факторами регулировать различия в поведения клеток по проксимально-дистальной оси конечности. В результате клетка запоминает свой «адрес» по оси конечности в пределах своего сегмента [26].
Но не все регуляторы относятся к группе гомеозисных белков. Например, группа морфогенов Wnt, Bmp, Sox9 [27]. Это трио лежит в основе реакционно-диффузионный механизма, открытого Аланом Тьюрингом в 1979 году. Благодаря взаимной активации и ингибированию при участии описанных выше факторов роста и гомеозисных белков происходит формирование в бластеме градиентного сигнала и паттерна из полос Sox9, в результате чего образуется необходимое число и приобретается правильная форма пальцев [28]. При этом любое нарушение одного из компонентов может нарушить нормальное строение конечности.
Нервная иннервация и бластема — «два сапога пара»
Следует учитывать, что на всех этапах регенерации, особенно на ранних стадиях, важную роль играет нервная иннервация места повреждения, которая является своеобразным связующим звеном в процессах регенерации. Можно сказать, что нейроны способствуют миграции и создают дополнительный стимул к дифференцировке стволовых клеток [10]. Еще в 2003 году было доказано, что факторы роста, среди которых можно выделить нейротрофический фактор мозга (BDNF) и глиальный нейротрофический фактор (GDNF), необходимые для нормального развития бластемы и дополнительного привлечения нервов к месту ампутации, образуются как раз при взаимодействии микроокружения бластемы с нервами [29]. К примеру, ампутированные конечности тритона без иннервации не регенерируют, а раны просто зарубцовываются. Даже была сформулирована нейротрофическая теория Маркуса Сингера на основе его работ 1942-1978 годов, согласно которой существует некий порог числа нервных волокон для успешного формирования бластемы в зависимости от места повреждения. Причем тип нервных волокон (чувствительные или двигательные), согласно ей, не влияет существенно на ход регенерации. Результаты исследований, проведенных на тритонах, подтверждают, что чем больше площадь поперечного сечения у конечности, тем большее число нервных волокон необходимо для регенерации (количество нервных волокон на единицу площади при этом оставалось постоянным) [30]. Эта теория работает и на млекопитающих, хотя роль иннервации в регенерации у них изучена не до конца: у мышей при удалении нервов задней конечности в области кончиков пальцев наблюдалось утолщение кожи и нарушение роста костей, однако стволовые клетки все же не утрачивали способность к дифференцировке [31].
«Через неделю пациент пришел со старым отрубленным пальцем в сумке и новым на руке» — Каковы реальные возможности регенеративной медицины настоящего и будущего?
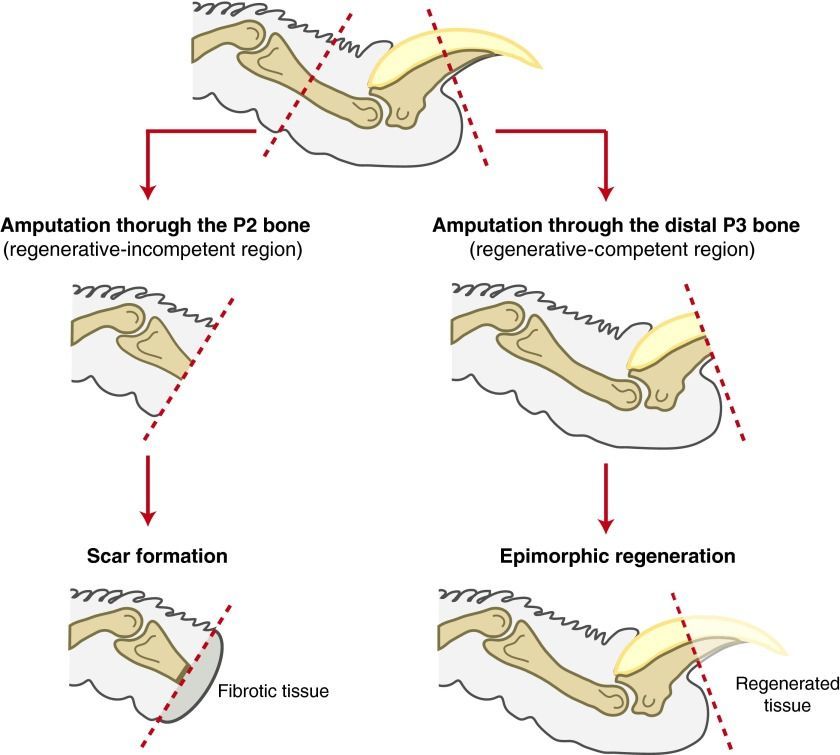
Мы постарались объяснить процессы, за счет которых происходит регенерация конечностей, но пока оставили без должного внимания самый важный вопрос — до какой степени возможна регенерация? Анамнии способны отращивать всю конечность заново, но у амниот все иначе. По названию статьи и примерам, приведенным по ходу, читатель уже мог догадаться, что у амниот, особенно у млекопитающих, регенерация возможна не для плеча, не для предплечья, даже не для кисти, а только лишь для фаланг пальцев (и то не всех)! В исследовании на мышах ученые ампутировали различные фаланги пальцев, а затем наблюдали за формированием бластемы. На 10 день после ампутации образование бластемы на уровне второй фаланги наблюдалось лишь в некоторых случаях. При этом даже попытка приживления бластемы из первой фаланги ко второй не увенчалась успехом ( наблюдалось менее 10% случаев успешного формирования бластемы) [32]. На успех регенерации может может влиять ногтевая пластина, вокруг которой о обнаружено скопление стволовых клеток, способных влиять на другие мультипотентные стволовые клетки. После ампутации кончика пальца в пределах ногтевой пластины стволовые клетки за счет активности уже известных генов группы Bmp и Wnt и перечисленных ранее в статье цитокинов, факторов роста, транскрипционных факторов и молекул клеточной адгезии оказались способны восстановить утраченный кончик пальца. Мыши после ампутации выше ногтевой пластины в пределах второй фаланги были почти лишены способности к регенерации [33].
Рисунок 16 | Если произвести срез в пределах первой фаланги (правый путь), то регенерация утраченной части конечности возможна. Если же ампутация произошла дальше, в пределах второй фаланги (левый путь), то образуется преимущественно фиброзная ткань [8].
У людей наблюдается похожая картина: пострадавший после несчастного случая может регенерировать 1-ую фалангу пальца, на которой осталась нетронутая ногтевая пластина. Может ли врач поспособствовать более эффективному процессу регенерации? В силу сложности хирургической работы с мелкими сосудами проводить операции по реплантации нецелесообразно. Лучший вариант — наложить окклюзионную повязку на место ампутации, тем самым предотвращая возможное заражение и предоставить организму самому справиться с проблемой, как это было ранее упомянуто в исследовании с медицинским клеем.
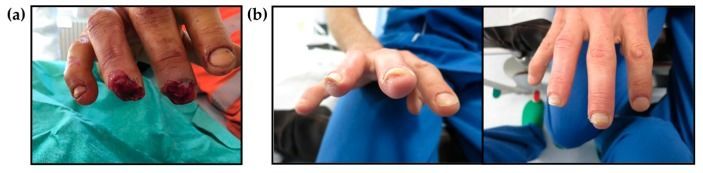
В журнале International Journal of Molecular Sciences ученые впервые описывают изменения, происходившие на раневой поверхности в течение недели после ампутации у людей. Выяснилось, что в экссудате, полученном с окклюзионных повязок, была повышена концентрация упомянутых ранее факторов роста, VEGF, EGF, FGF, BDNF, а также воспалительных цитокинов на первой неделе после ампутации. На второй — противовоспалительных цитокинов [34]. При этом неясной оставалась роль иммунитета, результаты действия которого связывали с образованием фиброзной ткани. Успешная регенерация в основном наблюдалась у детей. Примечательно, что после регенерации отпечаток пальца не восстанавливался. Тем не менее, в интернете можно найти немало сопровождающихся фотографиями рассказов о случаях успешной регенерации у взрослых. Вот еще один повод беречь свои ногти!
Рисунок 17 | Клинический случай регенерации: (a) перед наложением окклюзионной повязки; (b) через три месяца после травмы. Регенерированные пальцы по морфологическим и функциональным характеристикам аналогичны пальцам на другой руке [34].
Заметка. Стоит отметить, что ногти немного похожи на волосы: они продолжают расти на протяжении всей жизни. Каждый фолликул содержит группу стволовых клеток, которые способствуют росту нового волоса даже после выпадения предыдущего.
Может показаться, что в регенерации кончиков пальцев нет ничего важного. Слишком уж мелки они, что в физических размерах, что в значимости для организма по сравнению с другими органами. Однако ее изучение впоследствии позволит расширить знания о созревании стволовых клеток, и в будущем будет возможно спроецировать модель восстановления кончиков пальцев на более сложные структуры. Надеемся, развитие технологий регенеративной медицины позволит создать будущее, в котором протезы уже не будут нужны.